子宫内膜癌患者病灶组织中XPO4、STC2及L1CAM表达水平及对病情预后的预测价值
李娟,倪惠华
南通大学附属医院妇产科,江苏南通 226000
子宫内膜癌是女性常见的恶性肿瘤,属于一种原发于子宫内膜上的恶性肿瘤,主要起源于内膜腺体[1]。既往研究结果显示[2],子宫内膜癌占女性恶性肿瘤的20%左右,最近几年呈升高趋势。目前关于子宫内膜癌发生机制的研究尚未完全明确,与遗传、激素分泌、社会压力大等因素有关[3-4]。探析子宫内膜癌发生机制,有利于揭示其发展规律,便于临床判断病情,制订个性化治疗方案。随着分子学的发展,L1-细胞粘附分子(L1 cell adhesion molecular, L1CAM)、斯钙素(stanniocalcin 2, STC2)、输出蛋白4(exportin 4, XPO4)参与部分特定疾病发生和发展。其中XPO4是临床新发现的抑癌分子[5]。STC2是一种调控钙磷代谢的蛋白。L1CAM主要分布在细胞膜上,参与细胞粘附调节。本文选择南通大学附属医院2020年1月—2021年5月诊治的88例子宫内膜癌患者为研究对象,分析病灶组织中XPO4、STC2及L1CAM表达水平,探讨其作用,现报道如下。
1 资料与方法
1.1 一般资料
经本院医学伦理学会批准,选择本院妇产科诊治的88例子宫内膜癌患者为研究对象。年龄24~74岁,平均(45.69±3.58)岁;病程1~7年,平均(4.47±0.36)年;临床分期(TNM):Ⅰ~Ⅱ期58例、Ⅲ~Ⅳ期30例。
1.2 纳入与排除标准
纳入标准:①符合《2011年NCCN子宫内膜癌临床实践指南解读》中子宫内膜癌诊断标准者;②病理证实为子宫内膜癌者;③患者知情同意;④首次确诊患者;⑤经手术、化疗等治疗的患者。
排除标准:①合并其他恶性肿瘤的患者;②妊娠期、哺乳期患者;③严重癌因疲乏患者;④近6个月接受免疫抑制剂治疗的患者;⑤全身炎症反应患者;⑥精神疾病患者。
1.3 方法
①XPO4、STC2及L1CAM表达检查:细针获取患者癌组织及癌旁组织(近2 cm),经石蜡和脱水处理后,组成组织芯片,常规卵育20 min,PBS缓冲液冲洗,进行一抗和二抗处理,苏木染色后在生物显微镜下观察染色情况。根据细胞阳性分数将其分为5个等级。1分:5%~25%;2分:25%~50%;3分:50%~75%;4分:75%以上。染色强度标准是无染色,0分;淡黄色,1分;棕黄色,2分;棕褐色,3分。计算细胞阳性分数与染色强度评分,以5~12分作为阳性标准。
②复发情况:随访5个月,统计患者复发情况。
1.4 观察指标
比较癌组织和癌旁组织的XPO4、STC2及L1CAM表达情况,分析复发患者XPO4、STC2及L1CAM表达,探讨其预测价值。
1.5 统计方法
采用SPSS 19.0统计学软件处理数据,计数资料以频数及百分比(%)表示,组间差异比较进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 癌组织和癌旁组织XPO4、STC2及L1CAM阳性表达情况比较
癌组织的XPO4阳性率低于癌旁组织,差异有统计学意义(P<0.05),STC2及L1CAM阳性表达率高于癌旁组织,但差异无统计学意义(P>0.05),见表1。

表1 癌组织和癌旁组织XPO4、STC2及L1CAM阳性表达情况对比[n(%)]
2.2 复发患者癌组织中XPO4、STC2及L1CAM阳性表达情况比较
经随访发现共有24例患者复发,64例患者未复发。复发患者中XPO4阳性例数有3例,未复发患者4例。复发患者XPO4、L1CAM阳性率与未复发患者比较,差异无统计学意义(P>0.05)。复发患者STC2阳性率高于未复发患者,差异有统计学意义(P<0.05),见表2。
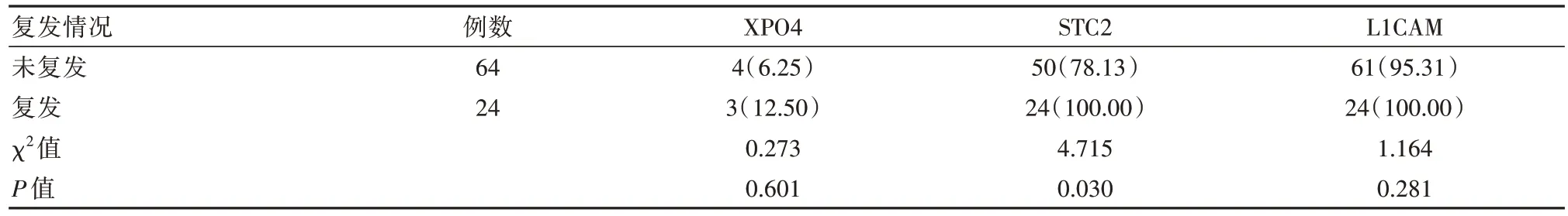
表2 复发患者癌组织中XPO4、STC2及L1CAM阳性表达情况对比[n(%)]
2.3 XPO4、STC2及L1CAM表达情况与病情复发价值分析
分析发现,检测XPO4表达预测子宫内膜癌病情复发价值最高(AUC=0.838),见表3、图1。

表3 XPO4、STC2及L1CAM表达情况与病情复发价值

图1 XPO4、STC2及L1CAM表达情况与病情复发价值图
3 讨论
子宫内膜癌病因尚未完全明确,但很多研究认为不良生活习惯、肥胖、不孕不育等是其发展的危险因素。根据临床统计,子宫内膜癌主要临床症状是阴道不规则流血、经期延长、疼痛及阴道排液。本病治疗效果较好,但极容易复发。因此对子宫内膜癌病情和预后的判断有利于临床制订个性化治疗方案。最近几年随着我国居民生活方式及饮食结构的改变,子宫内膜癌发生率显著增加,如果得不到及时治疗既会严重影响患者生育质量,又会影响患者生命健康。传统检查子宫内膜癌的方法主要是B超、宫腔镜与病理检查,但均有不同程度的局限性,故而较难大范围的推广使用。随着分子学的发展,诸多学者发现很多分子参与子宫内膜癌发生和发展。XPO4基因位于人类染色体13q,属于细胞核转运蛋白,能将Smad3从细胞核中输出。Timmerman S等[6]发现,Smad3参与多种病理生理过程。细胞核转运蛋白可以调节多种蛋白表达,并参与细胞增殖、分化及转移,影响恶性肿瘤发生和发展,这与本文研究结果一致。在一项肝癌组织研究中发现[8],XPO4在癌组织中低表达,在癌旁组中高表达,XPO4表达与淋巴结转移、FIGO分期、病理分级、肌层浸润深度显著相关(P<0.05);ROC分析显示XPO4 AUC为0.843,属于抑癌因子。而本文单纯XPO4预测子宫内膜癌复发价值中AUC为0.665,相对较低。分析可能是样本选择例数及范围不同而导致。STC2表达与多种恶性肿瘤发生和发展关系密切,包括宫颈癌、肝癌和乳腺癌[8-11]。STC2是一种通过调控钙磷代谢的蛋白,促使无机磷酸盐诱导的钙化,并抵制异位钙化,能够在低氧状态下促进肿瘤细胞增殖、浸润[12]。L1CAM是细胞内微管及微小丝组装的重要调节蛋白,参与细胞的有丝分裂,是一种促癌因子,与恶性肿瘤的分期、分化及转移关系密切[13-14]。在结肠癌组织中L1CAM阳性率为75.30%,显著高于癌旁组织的阳性率24.70%[15]。本文子宫内膜癌组织中L1CAM阳性率为96.59%,癌旁组织阳性率为11.36%,与结肠癌组织阳性率比较较低。
本研究子宫内膜癌组织中XPO4、STC2及L1CAM表达情况可知,癌组织中STC2及L1CAM阳性表达率较癌旁组织高,但差异无统计学意义(P>0.05),XPO4阳性率明显较低(P<0.05)。而且复发患者的癌组织中STC2及L1CAM阳性表达率较未复发患者高,XPO4阳性率低。以上结果说明,XPO4、STC2及L1CAM影响子宫内膜癌复发情况[16]。继续分析发现,联合检测XPO4、STC2、L1CAM表达预测子宫内膜癌病情复发价值最高(AUC=0.838)。XPO4是抑癌因子,在子宫内膜癌组织中低表达,而其高表达能抑制子宫内膜癌复发。STC2、L1CAM高表达会促使癌细胞增殖、分化[17-18],影响治疗,故而复发风险较高。基于以上3种分子的特征,联合检测能提升预测复发价值。但是目前对子宫内膜癌组织中XPO4、STC2及L1CAM之间调控机制仍然缺少了解,需要进一步研究。
综上所述,子宫内膜癌患者病灶组织中XPO4阳性表达率低,STC2及L1CAM阳性表达率高,联合检测3项指标能提升对病情复发预测价值。

