脑出血大鼠模型中Ho-1基因相关microRNAs的筛查
范学政,林超群,魏川江,胡志卿,曾振东(中国科学院大学深圳医院(光明)神经外科,广东 深圳 518106;通讯作者,E-mail:fxz12514@163.com)
脑出血是一种常见的致死性中风,由脑出血产生的脑实质血肿将引发一系列不良事件,可能导致神经血管单元的组成部分(灰质和白质)不可逆转的破坏,随后是血脑屏障破坏和脑水肿,最终导致大量脑细胞死亡[1,2]。脑细胞死亡或损伤时产生的局部炎症介质进一步增强脑出血(继发性损伤)造成的损害[3]。因此,迫切需要寻找可用于治疗脑出血损伤相关的继发性损伤的潜在分子靶点。
血红素加氧酶(HO)是一种参与血红素分解代谢的限速酶,可将血红素转化为胆绿素、一氧化碳和铁[4]。研究表明,HO有助于将血红素从脑实质细胞外间隙清除[5]。HO-1(也称为HSP32)是HO一种诱导形式,而脑出血后HO-1的表达主要诱导于内皮细胞和星形胶质细胞/巨噬细胞[6]。研究表明HO-1的低表达可以减少红细胞中游离铁的过度释放,从而限制脑出血[7]。此外,Zhang等[8]的研究发现在脑出血早期,HO-1高表达与脑出血模型小鼠治疗预后较差有关,同时HO-1的高表达也会增加脑水肿、白质损伤、神经元死亡和神经行为障碍的机率。Wang等[4]发现在HO-1敲除的脑出血小鼠中,脑出血24 h和72 h后脑损伤体积明显降低,对脑出血小鼠发挥治疗效用。因此,我们认为HO-1是恢复脑出血后神经功能有希望的治疗靶点。
microRNA(miRNA),作为基因的调控因子之一,可以使基因在转录后沉默,为治疗人类疾病开辟了新的策略[9]。临床前研究以及部分临床研究[10,11]已经证实,在脑出血的进程当中,血清或脑脊液中的miRNA表达已经发生了改变,某些miRNA可能参与了星形胶质细胞激活、神经元凋亡、血脑屏障保护[12]、炎症反应[13]以及血管再生[14],这也提示我们找到与关键基因相关的miRNA对于脑出血的治疗至关重要。
在这项研究中,我们筛选在脑出血疾病中与HO-1基因相关的15个miRNA,探讨其在脑出血大鼠的脑组织中的表达水平,并挑选差异性较大、并在脑出血后下调的3个miRNA,通过构建双荧光素酶系统确定了miR-877与HO-1具有靶向关系,为治疗脑出血损伤提供了潜在的分子靶点。
1 材料与方法
1.1 主要试剂及仪器
6周龄的雄性SD大鼠(常州卡文斯);苏木素(上海展云化工有限公司);伊红(上海展云化工有限公司);Trizol提取试剂盒(Invitrogen, USA);DEPC处理水(CTCC);氯仿、异丙醇、无水乙醇(上海国药);SYBRGreen PCR试剂盒(Thermo F-415XL,USA);逆转录试剂盒(Thermo #K1622,USA);第一链cDNA合成试剂盒(Invitrogen,USA);PCR引物(上海生工公司);点突变试剂盒(Stratagene, USA);miR-455-5p mimic、miR-877 mimic、miR-31a-5p mimic、mimic-NC(吉玛基因);双荧光检测试剂盒(promega E1910, USA);GFAP(Abcam ab53554, UK);DMEM、FBS(Thermo Fisher Scientific, USA)。
1.2 自体血栓的制备
16只SD大鼠在清洁的动物室内适应性喂养,室温22~25 ℃,昼夜循环,自由取食和饮水。1周后取SD大鼠称重后用无菌生理盐水配置3%戊巴比妥钠溶液,按1 ml/100 g剂量进行腹腔麻醉。对麻醉大鼠行眼眶采血,采血100 μl左右。待血液静置凝固后,用1 ml针筒充分抽吸血栓后备用。动物实验严格按照美国国立卫生研究院发布的《实验动物管理和使用指南》进行。动物实验规程经中国科学院大学深圳医院动物护理与使用委员会批准。
1.3 大鼠脑出血模型的构建
SD大鼠称重后用无菌生理盐水配置3%戊巴比妥钠溶液,按1 ml/100 g剂量进行腹腔麻醉,模型组和假手术组各8只。将大鼠固定在立体定向装置上,剔除头部毛发,剪开表皮,露出头骨,用手术钳将大鼠头部固定。于前囟0.5 mm,中线右侧3 mm处钻孔进针,钻孔深度为6 mm。按照24 mg/kg剂量缓慢注射备用血栓,注射完后留针10 min再缓慢退出针头,建模后根据神经行为学评分和病理染色结果评判。假手术组注射等量生理盐水。之后采用骨蜡封闭钻孔,逐层缝合表皮,碘酒消毒。建模7 d后取材。
1.4 大鼠神经行为学评价
大鼠麻醉苏醒后,进行神经行为学评分的具体评分标准是:无任何症状0分;提尾时对侧肢体屈曲内收为1分;抗侧方推力降低,并有1分时的症状,评定为2分;爬行时向对侧划圈,并有评分为2分时的症状,评定为3分;意识丧失,不能行走,评定为4分。各组动物于术后6 h和1,3,5 d分别进行神经行为学评分1次。
1.5 HE染色检测大鼠脑组织病理改变
行为学评分结束后断颈处死大鼠,分离出脑组织,以出血为中心,切取右脑组织,10%甲醛固定48 h,石蜡包埋,行5 μm冠状切片。石蜡切片在恒温烘箱中烘烤1 h后,加入二甲苯Ⅰ和二甲苯Ⅱ依次脱蜡30 min,之后用梯度浓度乙醇(100%乙醇3 min,95%乙醇2 min,85%乙醇2 min,75%乙醇3 min)依次水合。水合完成后将切片水洗2 min,然后用苏木素染色5 min。接着将切片蒸馏水洗至组织呈蓝紫色,滴加1%盐酸乙醇分化2 s,待组织变红。继续蒸馏水洗至组织呈蓝紫色,伊红染色2~8 s。蒸馏水冲洗切片后无水乙醇脱水,干燥后用中性胶封闭切片,光学显微镜观察拍照。
1.6 real-time PCR检测HO-1和相关miRNA的表达
取大鼠脑出血部分脑组织用无RNA酶的剪刀剪碎后,按照Trizol提取试剂盒步骤提取组织总RNA。采用第一链cDNA合成试剂盒合成cDNA,逆转录反应总体积为20.0 μl:5.0 μl总RNA,1.0 μl 0.2 μg/μl的Random Primer p(dN)6,5.0 μl Rnase-free ddH2O,4.0 μl 5×Reaction Buffer,2.0 μl 10 mmol/L的dNTP Mix,1.0 μl 20 U/μl的Rnase inhibitor,2.0 μl 10 U/μl的Reverse Transcriptase。逆转录条件为37 ℃温浴5 min,42 ℃温浴30 min,65 ℃温浴3 min。反应完成后将溶液保存于-20 ℃。以管家基因GAPDH为内参。GAPDH引物序列:Forward,ACAGCAACAGGGTGGTGGAC;Reverse,TTTGAGGGTGCAGCGAACT。HO-1引物序列:Forward,ACAGGGTGACAGAAGAGG;Reverse,GAAACT GAGTGTGAGGAC。根据real time-PCR反应体系配制反应液。在PCR反应管中分别加入7.0 μl ddH2O、10.0 μl 2×SybrGreen qPCR Master Mix、1.0 μl Forward primer、1.0 μl Reverse primer、1.0 μl cDNA模板。PCR扩增条件为94 ℃ 10 min,40个循环下94 ℃ 20 s,55 ℃ 20 s,72 ℃ 20 s。PCR扩增后,实时荧光定量PCR仪自动分析结果,根据阴性对照调整阈值和基线以确定各个标本的Ct值,并根据熔解曲线确定该Ct值是否有效。相关miRNA引物序列见表1。采用2-ΔΔCt法分析目的基因在对照组和各实验组之间的表达差异。

表1 相关miRNA引物序列
1.7 大鼠脑星形胶质细胞提取及鉴定
取大鼠脑组织至装有冷PBS的培养皿中,反复冲洗。使用手术器械去除脑表面的蛛网膜以及软脑膜,用PBS液冲洗,并置于D-Hank’s液中,镊子剥离剔除海马区后,将脑组织用眼科镊子撕碎至糜状,后加入混合酶(0.25%胰蛋白酶与0.1%胶原酶),反复吹打消化约20 min。加入含有20% FBS的DMEM完全培养基以终止消化,反复吹打制成单细胞悬液。悬浮液用70 μm的过滤器过滤后,1 000 r/min离心5 min。去除上清,用DMEM完全培养基重悬沉淀后,接种于培养瓶,在37 ℃,5% CO2的培养箱内培养。细胞培养3 d后,以340 r/min的速度摇动培养瓶2 h。采集漂浮细胞,置于培养皿中培养获得星形胶质细胞。
细胞培养过夜后,4%多聚甲醛固定30 min,PBS漂洗5 min,重复3次。0.1% Triton处理10 min以通透细胞膜,继续采用PBS漂洗。将PBS稀释的3% H2O2加入培养皿室温孵育15 min以灭活内源过氧化物酶,PBS漂洗。之后采用5% FBS封闭在37 ℃下30 min,与GFAP一抗4 ℃孵育过夜。PBS漂洗后加入CY3标记二抗,37 ℃下孵育1 h。PBS漂后加入Hoechst室温孵育15 min,继续漂洗并封片,荧光显微镜下观察拍照。
1.8 双荧光素酶报告实验分析
采用TargetScan生物信息学网站分别预测miR-455-5p与HO-1、miR-877与HO-1、miR-31a-5p与HO-1的结合位点。从NCBI中查阅获取HO-1的3′UTR序列,并在3'UTR中找出miR-455-5p、miR-877、miR-31a-5p与HO-1的结合位点,分别取结合位点上下(包含结合位点)约300 bp作为野生型HO-1(HO-1 WT);同时,采用点突变试剂盒突变其中的结合位点作为突变型HO-1。合成具有限制性酶切位点SacⅠ和XbaⅠ的片段,并利用基因克隆技术分别构建含miR-455-5p、miR-455-5p、miR-31a-5p野生结合位点的HO-1 mRNA 3′UTR区报告基因载体(HO-1 WT)以及含miR-455-5p、miR-455-5p、miR-31a-5p突变结合位点的HO-1 mRNA 3′UTR区报告基因载体(HO-1 MUT)的重组质粒。
构建双荧光素酶HO-1 WT和HO-1 MUT质粒过程:首先取正常大鼠的脑组织,并用TRIzol法提取RNA并定量,RT-PCR获得含有miR-455-5p、miR-877、miR-31a-5p野生及突变结合位点的目的片段;其次,采用限制性内切酶SacⅠ和XbaⅠ对目的片段PCR产物和pmirGLO质粒进行双酶切,酶切产物采用1%琼脂糖凝胶电泳,再UV投射光下将切胶回收,纯化DNA并测量浓度;将双酶切纯化后的pmirGLO载体和目的片段以1 ∶3的比例采用T4连接酶连接,16 ℃过夜;转化:取5 μl连接产物加入25 μl的DH5α感受态细胞中,并于25 min后,42 ℃热激90 s,后加500 μl LB(无抗性),37 ℃ 180 r/min条件下震荡1 h,之后离心涂板。
测序验证质粒:在LB平板上随机挑取3阳性克隆,加入100 μg/ml氨苄青霉素的LB液体培养基进行小摇。并取1 ml菌液测序,剩余菌液暂时4 ℃保存;测序经比对正确后,将剩余菌液大摇并按照质粒大提试剂盒的步骤提取各重组质粒,用于后续的转染操作等。
将大鼠星形胶质细胞在转染前一天按照5×105/孔种于六孔板中,第2天待约80%~90%融合度时,将miR-455-5p mimics、miR-877 mimics、miR-31a-5p mimics或其相应的阴性对照与HO-1 WT或HO-1 MUT质粒采用Lipofectamine 2000脂质体无血清体系共转染至星形胶质细胞中。转染6 h后,换新鲜培养基完全培养,继续培养24 h。之后,按照双荧光检测试剂盒裂解转染后的星形胶质细胞,并采用多功能酶标仪检测萤火虫荧光素酶(FLU)和海肾荧光素酶(RLU)活性,并通过计算用海肾荧光素酶校正的萤火虫荧光素酶活性(FLU/RLU)用于统计分析。
1.9 统计学分析
所有数据采用SPSS 21.0(SPSS,Inc,Chicago,IL,USA)统计软件进行数据统计分析,计量资料用均值±标准差表示,计量资料两组之间的比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 脑出血模型成功建立
脑出血模型在术后6 h和1,3,5 d四个时间点的神经行为学评分见表2。HE结果显示:假手术组中,大鼠脑组织的神经细胞饱满,核淡,未见神经细胞和胶质细胞坏死,无炎性细胞浸润;模型组神经元肿胀,有部分细胞水肿,血管扩张并伴有大量红细胞渗出,有炎性细胞浸润(见图1)。综合行为学和组织形态学结果,表明大鼠脑出血模型已成功建立。

表2 假手术组与模型组术后各时间点大鼠神经行为学评分/分
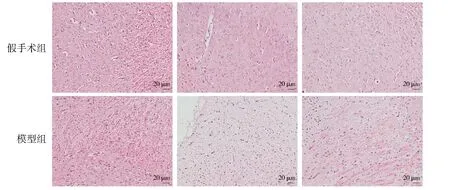
图1 脑出血大鼠脑组织的HE染色Figure 1 HE staining of brain tissues in rats with cerebral hemorrhage
2.2 HO-1与相关miRNA的表达水平
HO-1在脑出血模型组中大鼠脑组织中的表达水平与假手术组相比显著上升(见图2)。为了进一步确定脑出血过程中靶向性调控HO-1的miRNA,我们检测了15个相关的microRNA的表达水平。结果显示,与假手术组相比,miR-331-3p、miR-298-5p、miR-221-3p、miR-187-5p、miR-7a-5p、miR-3557-3p在脑出血模型组中表达水平上升;miR-673-5p、miR-330-5p、miR-6331、miR-29b-5p、miR-218a-5p、miR-3564-5p在脑出血模型组中表达水平变化无显著性差异;而miR-877,miR-31a-5p,miR-455-5p在脑出血模型组中表达下降(见图3),这提示miR-877,miR-31a-5p,miR-455-5p可能是调控HO-1基因转录后表达的关键因素。因此,我们选择miR-877,miR-31a-5p,miR-455-5p这3个miRNA进行后续的靶向验证实验。
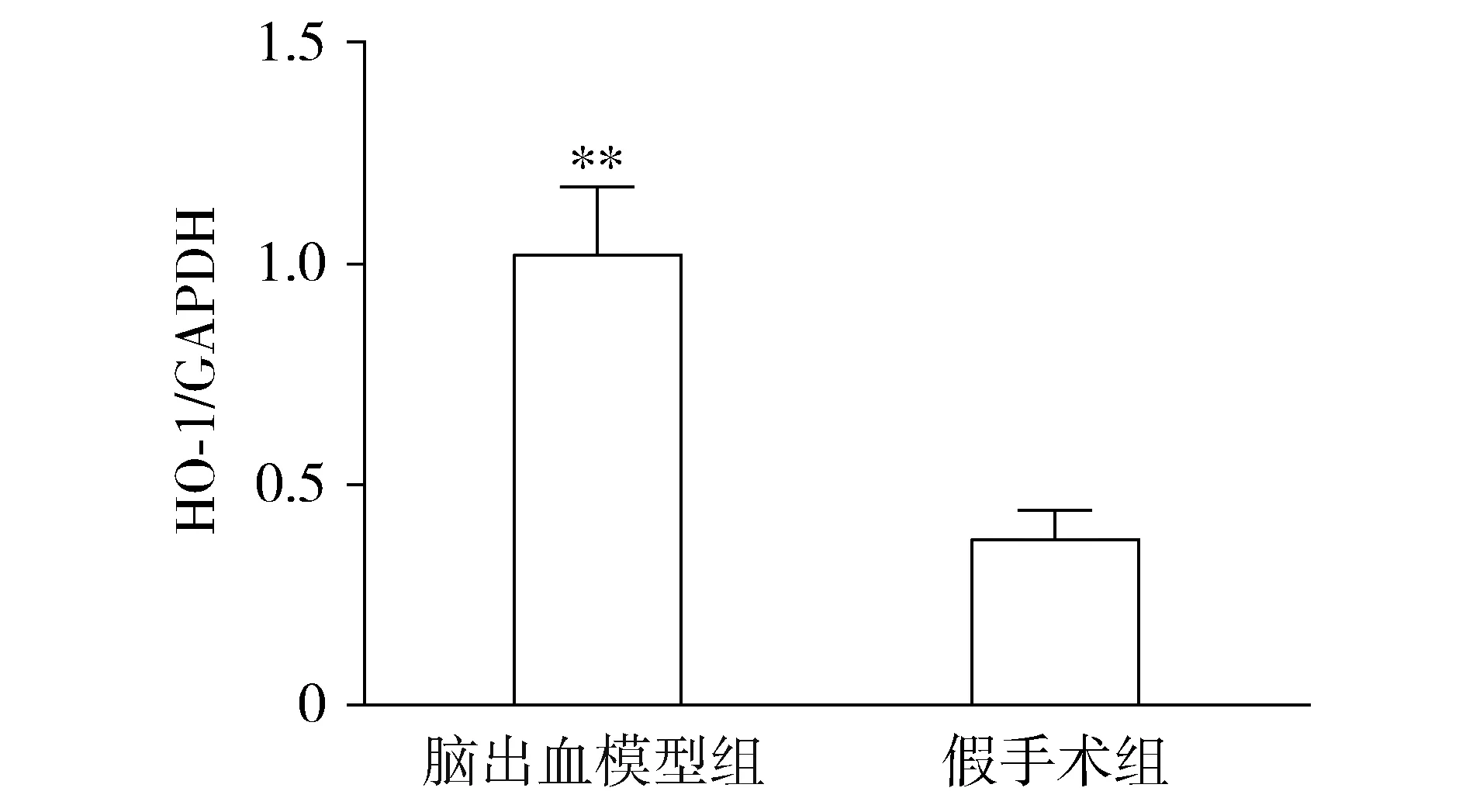
与假手术组相比,**P<0.01图2 RT-PCR法检测大鼠脑组织中HO-1基因的mRNA相对表达水平Figure 2 The expression level of HO-1 mRNA in rat brain tissue by RT-PCR
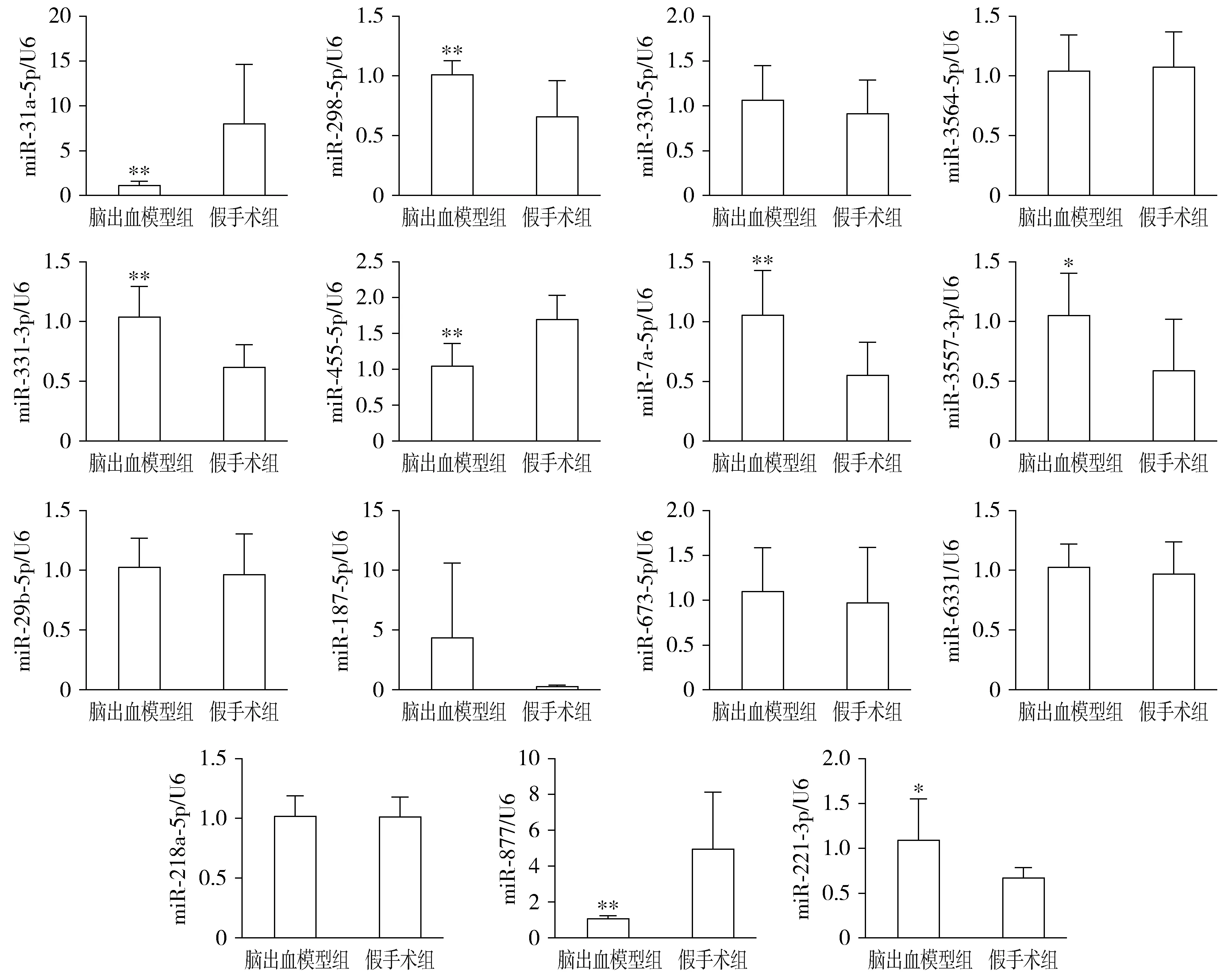
与假手术组相比,*P<0.05,**P<0.01图3 RT-PCR法检验大鼠脑组织中HO-1基因相关的miRNA的相对表达水平Figure 3 The expression levels of HO-1 and its related miRNAs in rat brain tissues by RT-PCR
2.3 大鼠脑星形胶质细胞分离及鉴定
为进一步探究HO-1在脑出血病理状态下受miRNA的调控作用,我们分离了脑出血后HO-1表达丰度较高的大鼠脑星形胶质细胞,并进行体外培养。在显微镜下可见细胞呈扁平,多角状,胞质丰富,胞核呈圆形或椭圆形(见图4)。应用GFAP进行免疫荧光染色,GFAP阳性的为星形胶质细胞,可见星形胶质细胞的纯化效率较高(见图4)。

图4 大鼠脑星形胶质细胞形态及鉴定Figure 4 Morphology and identification of rat brain astrocytes
2.4 miRNA与HO-1的靶向关系
利用TargetScan网站查找发现miR-877,miR-31a-5p,miR-455-5p与HO-1都存在潜在的结合位点(见图5A)。双荧光素酶切报告实验的结果显示,与HO-1 MUT+miR-455-5p mimics NC或HO-1 MUT+miR-31a-5p mimics NC相比,HO-1 MUT+miR-455-5p mimics或HO-1 MUT+miR-31a-5p mimics组的荧光素酶活性变化无显著性差异。与HO-1 WT+miR-877 mimics NC相比,HO-1 WT+miR-877 mimics组的荧光素酶活性下降(P<0.05)。说明miR-31a-5p,miR-455-5p与HO-1无靶向关系,而miR-877靶向HO-1 3′-UTR。因此,我们确定了miR-877为脑出血中HO-1的上游miRNA(见图5B)。
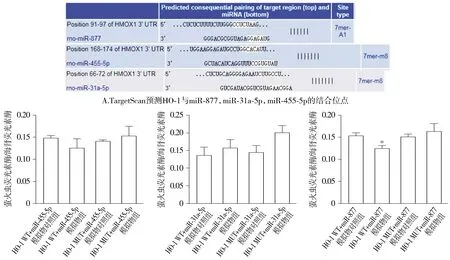
与HO-1 WT+miR-877模拟物对照组相比,*P<0.05 B.双荧光素酶切报告实验检测miR-455-5p,miR-31a-5p,miR-877与HO-1的靶向关系图5 HO-1与miR-877,miR-31a-5p,miR-455-5p的靶向关系Figure 5 The targeting relationships of HO-1 with miR-877, miR-31a-5p, miR-455-5p
3 讨论
脑出血具有较高的发病率和死亡率[15]。脑出血引起局部和全局性炎症,其中血细胞形成白细胞血小板聚集,黏附于脑内皮细胞,并浸润大脑,导致血脑屏障破坏,脑水肿和脑实质损伤,从而加重预后[16]。脑出血损伤是一个复杂的病理生理过程,受多种因素调节。
HO-1是一种可诱导的低分子量应激蛋白,在各种损伤和疾病模型中提供细胞和组织保护[17]。HO-1已经被发现具有神经保护作用,参与脑出血的后续进展[4,8]。然而,HO-1在脑出血中的作用机制及其调控尚未被深入研究。因此,我们构建了大鼠脑出血模型,研究HO-1在脑出血模型中的表达,并研究其上游调控机制。
近年来,miRNAs在脑出血引起的神经元死亡中起重要调节作用[18]。然而,对于参与脑出血分子机制的miRNA基因组学生物信息学以及这些miRNA如何发挥作用,我们知之甚少。在中枢神经系统中,miRNAs与多种疾病和病理过程的调节相关,如神经退行性疾病[19]、癌症[20]、脑卒中[21]和脑出血[22]。此外,越来越多的研究报道了脑出血动物模型中的miRNA表达谱[23,24]。然而,这些研究仅证明了miRNA的变化或关注单个miRNA在脑出血中的作用,缺乏对其生物学功能和下游信号转导通路的综合分析。在这项研究中,我们筛选在脑出血疾病中与HO-1基因相关的15个miRNA,探讨其在脑出血大鼠的脑组织中的表达水平,并挑选差异性较大、并在脑出血后下调的3个miRNA,通过构建双荧光素酶系统确定了miR-877与HO-1具有靶向关系,提示在脑出血后miR-877的下调会影响星形胶质细胞中HO-1基因的抑制,进而使HO-1的表达升高。而已有研究表明HO-1可控制多种生物学事件,如减少红细胞中游离铁的过度释放,进而限制脑出血的进程。这表明miR-877是HO-1上调的调控因素之一,为治疗脑出血损伤提供了潜在的分子靶点。
miR-877作为一种被广泛研究miRNA,在部分癌症中发挥抑癌因子的作用[25]。此外,Li等[26]的研究表明miR-877恶化心肌缺血再灌注损伤后。miR-877已经被证明在胶质母细胞瘤细胞的生长、迁移和侵袭和凋亡方面发挥关键作用[27]。可见,miR-877可能参与脑出血。而本研究发现miR-877作为在脑缺血中显著下调的miRNA,被证明参与调控HO-1的表达。
总而言之,脑出血疾病中miR-877下调,HO-1被上调。星形胶质细胞中的miR-877靶向于HO-1,miR-877/HO-1可能为脑出血患者的治疗提供新的靶点。

