HSF1通过抑制中性粒细胞浸润减轻LPS诱导的小鼠急性肺损伤*
肖 归, 陈广文, 李 涛, 张华莉, 王慷慨, 刘梅冬, 刘 可, 肖献忠△
(1中南大学湘雅医学院病理生理学系,湖南 长沙 410008;2海南医学院国际护理学院,海南 海口 571199;3嘉应学院医学院病理学与病理生理学教研室,广东 梅州 514000)
急性肺损伤(acute lung injury,ALI)是一种由病毒、细菌感染、外伤、中毒、脓毒症或者休克等非心源性因素造成的急性进行性缺氧性呼吸衰竭。如果得不到控制,ALI 将发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),最终导致死亡[1-3]。ALI 发病率和病死率高,且目前各种治疗方法效果不理想,因此在临床治疗和基础研究中都引起了高度的重视[4-5]。ALI 主要表现为进行性呼吸窘迫和低氧血症,其病理改变主要是微血管病变、肺泡通透性增加、大量炎症细胞浸润和炎症介质的产生增加。ALI 发病机制非常复杂,至今尚未完全阐明,但研究已经确定炎症反应是最主要的机制之一。
热休克因子1(heat shock factor 1,HSF1)是一种与热休克反应有关的转录因子,能够调节热休克蛋白(如Hsp27、Hsp60和Hsp70)的转录,在肺部炎症和损伤中发挥重要的细胞保护作用[6-10]。本课题组之前的研究表明,HSF1 对脂多糖(lipopolysaccharide,LPS)诱导的多器官功能障碍[11]和ALI[12]均具有抑制作用。此外,HSF1 能够减少肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1(interleukin-1,IL-1)等炎症介质的产生,减轻炎症反应[13-15]。然而,HSF1减轻ALI的潜在机制仍不明确,需要进一步探索。
中性粒细胞是ALI 发病机制中的重要效应细胞,其激活和迁移与ALI 的严重程度密切相关。活化的中性粒细胞能够产生许多细胞毒性物质,包括颗粒酶、活性氧、活性脂、各种促炎细胞因子和中性粒细胞胞外陷阱,它们可导致肺组织细胞损伤,对ALI 发展至关重要[16]。然而,HSF1 对ALI 中性粒细胞细胞的影响仍不明确。本研究旨在研究HSF1 对趋化因子调节作用和对中性粒细胞浸润的影响,探讨HSF1对LPS所致ALI的保护作用及其分子机制。
材料和方法
1 动物
SPF 级HSF1−/−和HSF1+/+小鼠由美国德克萨斯大学西南研究中心Dr.Ivor J.Benjamin惠赠,统一喂养在中南大学湘雅医学院实验动物中心,由专人负责小鼠基因型检测,获取雄性HSF1−/−和HSF1+/+小鼠,2~3 月龄,25 g 左右。小鼠分为HSF1+/++生理盐水(nor‑mal saline,NS)组、HSF1+/++LPS 组、HSF1−/−+NS 组和HSF1−/−+LPS 组,其中HSF1+/++LPS 组和HSF1−/−+LPS组按照5 mg/kg 的剂量从气管滴注LPS(浓度0.8 mg/mL),而HSF1+/++NS组和HSF1−/−+NS组从气管滴注同等体积的NS。
2 主要试剂
LPS(大肠杆菌055:B5)购自Sigma;Purified rat anti-mouse CD16/CD32(货号553142)、PerCP-Cy5.5 rat anti-mouse CD45(货号555483)、FITC anti-mouse Ly6G(货号551459)和70 μm cell strainer 购自BD;APC anti-mouse/rat XCR-1(货号372603)购自Bio‑Legend;XCL-1 ELISA 试剂盒购自Raybiotech;antimouse Ly6G antibody 和anti-goat XCR-1 antibody 购自Santa Cruz;4% 多聚甲醛购自北京鼎国公司;PBS 购自欧盟公司。
3 主要方法
3.1 小鼠ALI 模型的建立按照之前的方法构建小鼠ALI 模型[12]。用0.3% 戊巴比妥钠(0.01 mL/g体重)腹腔注射麻醉小鼠,暴露小鼠气管后,用1 mL注射器缓慢滴加LPS(5 mg/kg,浓度为0.8 mg/mL)入气管内,竖立起小鼠,旋转,使LPS 分布均匀,对照组给予NS 气管内滴注,滴注LPS 或NS 12、24 和36 h 后检测各项指标。
3.2 收集小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)分别于注射LPS 或NS 12、24 和36 h 后将小鼠用颈椎脱臼法安乐死,将小鼠固定在干净的泡沫板上,用消毒灭菌后的眼科剪剪切小鼠颈部皮肤,暴露气管,用镊子从下穿过气管,在靠近小鼠头部的气管切一小斜切口,将套管针轻柔插进气管,拔出硬针,确保套管针固定在气管内。用1 mL注射器抽1 mL PBS 缓慢注入支气管,用手指轻轻震荡小鼠胸廓1 min,用1 mL 注射器回抽液体,保存在EP 管中(冰上),接着再用1 mL PBS 灌洗支气管肺泡,重复3次,第1管回抽率为60%~70%,第2管和第3 管回抽率为80%~90%。 将存有BALF 的EP 管4 ℃、1 500 r/min 离心5 min。第1 管BALF 的上清用于XCL-1 检测,所有EP 管中的细胞收集起来用于中性粒细胞和XCR-1流式细胞术检测。
3.3 流式细胞术用上述收集的细胞进行流式细胞术检测,将BALF中所有的细胞悬浮在1 mL 1×红细胞裂解缓冲液(BD Biosciences)中5 min,然后250×g离心5 min。将含有BALF 细胞的上清液重悬于100 μL PBS 中,用0.5 μL 纯化的大鼠抗小鼠CD16/CD32抗体在4 ℃下封闭10 min。BALF细胞用荧光偶联抗体(PerCP-Cy™5.5 大鼠抗小鼠CD45 抗体0.5 μL、FITC 抗小鼠Ly6G 抗体0.5 μL 和APC 抗小鼠XCR-1抗体0.5 μL)在4 ℃下避光20 min,然后以250×g离心5 min。上清液用100 μL 2% 多聚甲醛4 ℃避光固定10 min,上流式细胞仪(BD Biosciences,LSRⅡ)检测,使用FlowJo软件分析数据。
3.4 ELISA使用ELISA 试剂盒(RD),根据说明书操作,检测肺组织匀浆、BALF和血清中XCL-1水平。
3.5 免疫荧光染色滴注LPS 或NS 12、24 和36 h后,将小鼠用颈椎脱臼法安乐死,并立即取出左肺放于4% 多聚甲醛中固定24 h。石蜡包埋后,将肺组织切成4 μm 厚的切片。将切片置于柠檬酸钠缓冲液中并在100 ℃的微波中加热15 min,然后与PBS 中的10% 牛血清白蛋白在室温下孵育2 h 以封闭非特异性结合位点。随后,切片与鼠中性粒细胞单克隆抗体(抗Ly6G 抗体;1∶200)和抗XCR-1 抗体(1∶100)在4 ℃下过夜,然后与辣根过氧化物酶标记的Ⅱ抗(1∶50;ABclonal)在37 ℃下避光孵育1 h。用PBS 洗涤4次后,用密封液处理样品。使用Panoramic 250/MIDI(Hungary)拍片。
4 统计学处理
使用GraphPad Prism 7.0 和SPSS 21.0 分析所有数据。计量资料以均数±标准差(mean±SD)表示。两组样本之间比较选用独立样本t检验,多组比较使用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 HSF1对LPS 所致的ALI小鼠BALF 中性粒细胞百分率的影响
本研究使用CD45+LY6G 标记中性粒细胞,采用流式细胞术检测各组小鼠不同时点BALF 中性粒细胞百分率的变化。如图1 所示,在12、24 及36 h,HSF1−/−+LPS 组小鼠BALF中性粒细胞比例均高于HSF1+/++LPS 组小鼠(P<0.01),24 h 时BALF 中性粒细胞含量最高,这与炎症状态下经典炎症细胞迁移的过程相符。以上结果表明,HSF1 能减轻LPS 所致的ALI肺泡中性粒细胞的浸润。
2 HSF1对LPS所致ALI小鼠肺组织中性粒细胞浸润的影响
采用免疫荧光方法分别检测小鼠肺组织中性粒细胞数目,结果见图2。12 h、24 h 时和36 h 时,与HSF1+/++LPS 组相比,HSF1−/−+LPS 组肺组织中的中性粒细胞浸润更多(红色箭头),表明HSF1 能减轻LPS所致急性肺损伤小鼠肺组织中的炎症细胞的浸润。
3 HSF1 对LPS 所致ALI 小鼠血清、肺组织和BALF中趋化因子XCL-1浓度的影响
3.1 血清中XCL-1 的浓度LPS 处理12、24 和36 h后,HSF1−/−+LPS 组小鼠血清中XCL-1 水平显著高于HSF1+/++LPS 组(P<0.05),且在24 h 达到高峰(P<0.01),见图3。以上结果表明,HSF1 可能通过抑制血清中XCL-1 的表达水平来抑制中性粒细胞浸润,从而发挥保护作用。
3.2 肺组织中XCL-1 的浓度LPS 处理12、24 和36 h 后,HSF1−/−+LPS 组小鼠肺组织中XCL-1 水平显著高于HSF1+/++LPS 组(P<0.05),且在24 h 达到高峰(P<0.01),这与血清的结果相一致,见图4。以上结果表明,HSF1 可能通过抑制肺组织中XCL-1 的表达水平来抑制中性粒细胞浸润,从而发挥保护作用。
3.3 BALF 中XCL-1 的浓度与HSF1+/++LPS 组相比,12 和24 h 时,HSF1−/−+LPS 组BALF 的XCL-1 水平显著高于HSF1+/++LPS 组(P<0.01),且在24 h 达到高峰;36 h 时,HSF1−/−+LPS 组BALF 的XCL-1 水平略高于HSF1+/++LPS 组(P<0.05),见图5。以上结果表明,HSF1 可能通过抑制肺泡中XCL-1 的表达水平来抑制中性粒细胞浸润,从而发挥保护作用。
4 HSF1对LPS 所致ALI小鼠BALF 中性粒细胞表面XCR-1表达的影响
LPS处理12 h后,HSF1−/−+LPS组小鼠BALF 的中性粒细胞表面XCR-1 比例高于HSF1+/++LPS 组(P<0.01);24 h 时,HSF1−/−+LPS 组 和HSF1+/++LPS 组BALF 的中性粒细胞表面XCR-1 均有增加,HSF1−/−+LPS 组小鼠BALF 的中性粒细胞表面XCR-1 比例仍高于HSF1+/++LPS 组(P<0.01);36 h 时,HSF1−/−+LPS组小鼠BALF 的中性粒细胞表面XCR-1 水平仍高于HSF1+/++LPS 组,见图6。以上结果表明,在LPS 所致的ALI模型中,HSF1能通过抑制中性粒细胞上XCR-1表达而发挥对中性粒细胞浸润的抑制作用。
讨 论
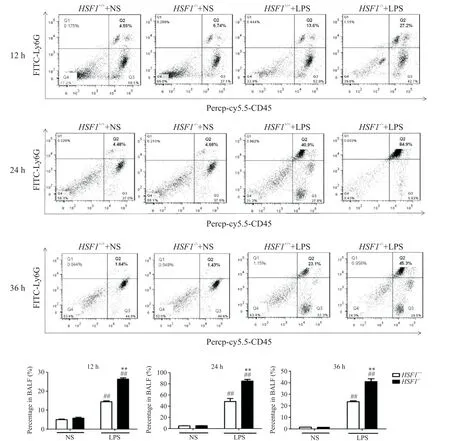
Figure 1.The effect of HSF1 on percentage of neutrophils in BALF of ALI mice induced by LPS.Mean±SD. n=6.##P<0.01 vs HSF1+/++NS group;**P<0.01 vs HSF1+/++LPS group.图1 HSF1对LPS所致ALI小鼠BALF中性粒细胞百分率变化的影响
肺组织因为独特的解剖结构非常容易遭受外界有害物质的损伤,不少研究者发现,当肺脏受到LPS等刺激时,大量中性粒细胞会从血管游出聚集到肺部,并释放大量的细胞因子,引起体内促炎和抗炎系统失衡,从而进一步激活炎症细胞,导致ALI/ARDS的发生[17]。HSF1是必不可少的热休克基因,HSF1−/−动物的细胞在遭受高温等刺激时,相比于野生型动物更容易凋亡,这证明了HSF1能够提高细胞的存活率[18-20]。HSF1能够提高存活率这一现象在很多动物中也有证实。 本课题组在前期研究中也发现,HSF1−/−小鼠对LPS 的敏感性显著增强,并且其生存率显著降低,且HSF1 能够有效减少内毒素血症中TNF-α、IL-1β 和IL-6 等炎症因子的表达水平,表明HSF1 对LPS 所导致的内毒素血症具有明显的抑制作用[21]。本课题前期采用HSF1−/−小鼠经气管内滴注LPS 制备了小鼠ALI 模型,并通过检测肺湿/干重、肺组织病理学改变、BALF 蛋白定量、BALF 和肺组织中VEGF 的含量等确认小鼠ALI 模型建立成功,且发现HSF1 明显减轻LPS 所致的ALI,但其作用机制仍不明确[12]。因此,本研究中我们继续使用上述小鼠ALI模型,采用流式细胞术检测了LPS 处理12、24 和36 h后各组小鼠BALF中性粒细胞含量,并采用免疫荧光法检测了不同组别小鼠肺组织中性粒细胞含量。结果发现,HSF1−/−+LPS 组的中性粒细胞含量均高于HSF1+/++LPS 组,说明在LPS 诱导的ALI 时,HSF1 能够抑制中性粒细胞在肺部的浸润。
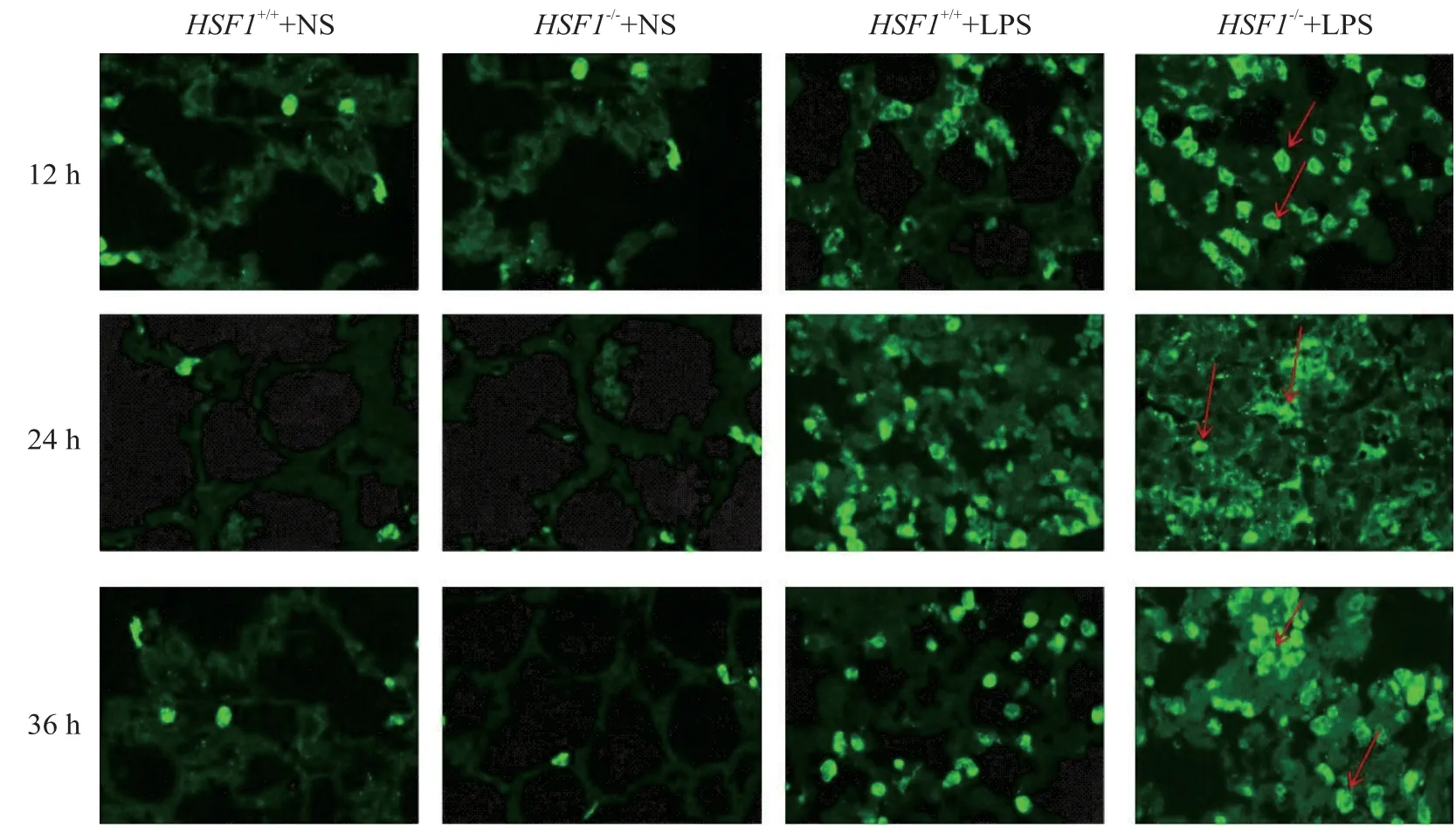
Figure 2.The effect of HSF1 on infiltration of neutrophils in the lung tissues of ALI mice induced by LPS(immunoflurorescence,×40).图2 HSF1对LPS所致ALI小鼠肺组织中性粒细胞浸润的影响
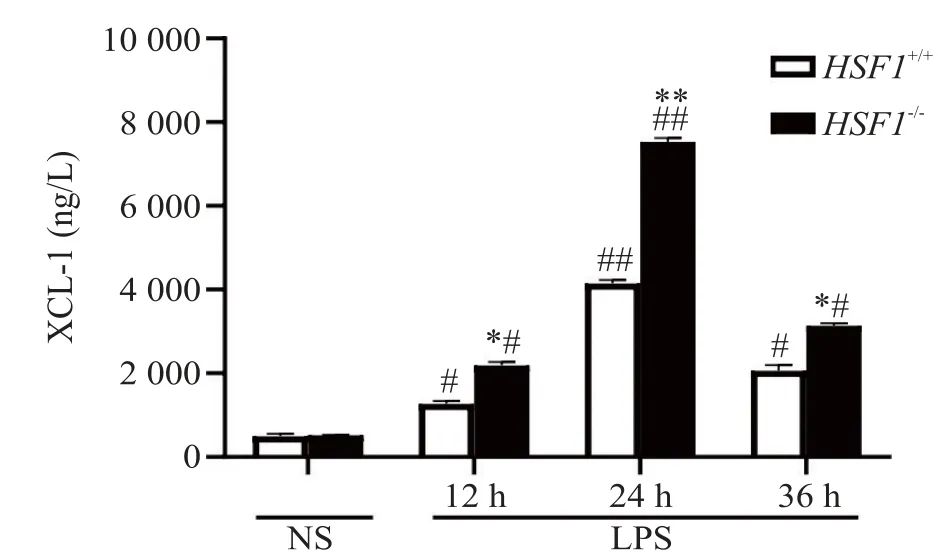
Figure 3.The effect of HSF1 on the serum concentration of XCL-1 in ALI mice induced by LPS.Mean±SD. n=6.#P<0.05,##P<0.01 vs HSF1+/++NS group;*P<0.05,**P<0.01 vs HSF1+/++LPS group.图3 HSF1对LPS所致ALI小鼠血清中XCL-1浓度的影响
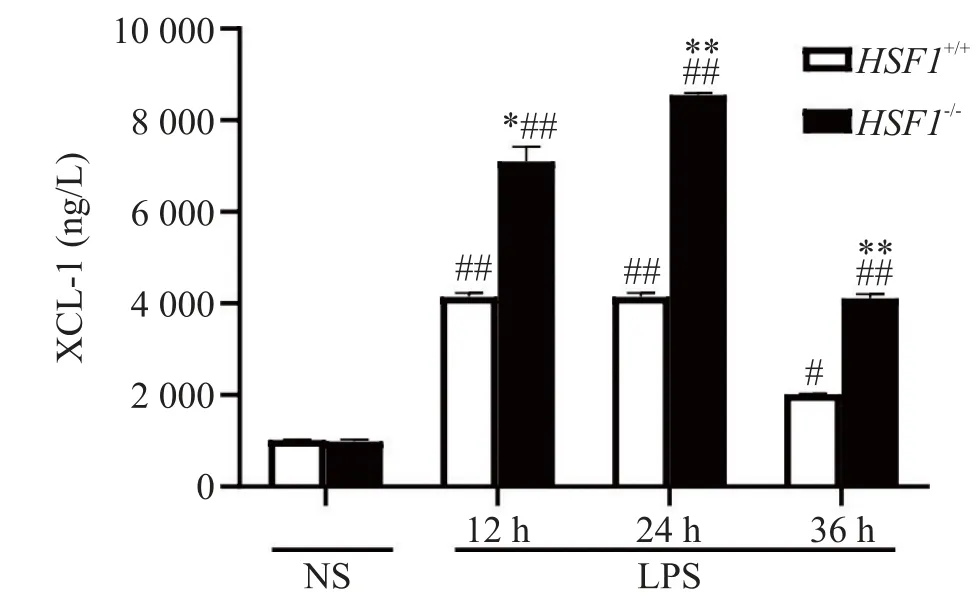
Figure 4.The effect of HSF1 on the concentration of XCL-1 in the lung tissues of ALI mice induced by LPS.Mean±SD. n=6.#P<0.05,##P<0.01 vs HSF1+/++NS group;*P<0.05,**P<0.01 vs HSF1+/++LPS group.图4 HSF1对LPS所致ALI小鼠肺组织中XCL-1浓度的影响
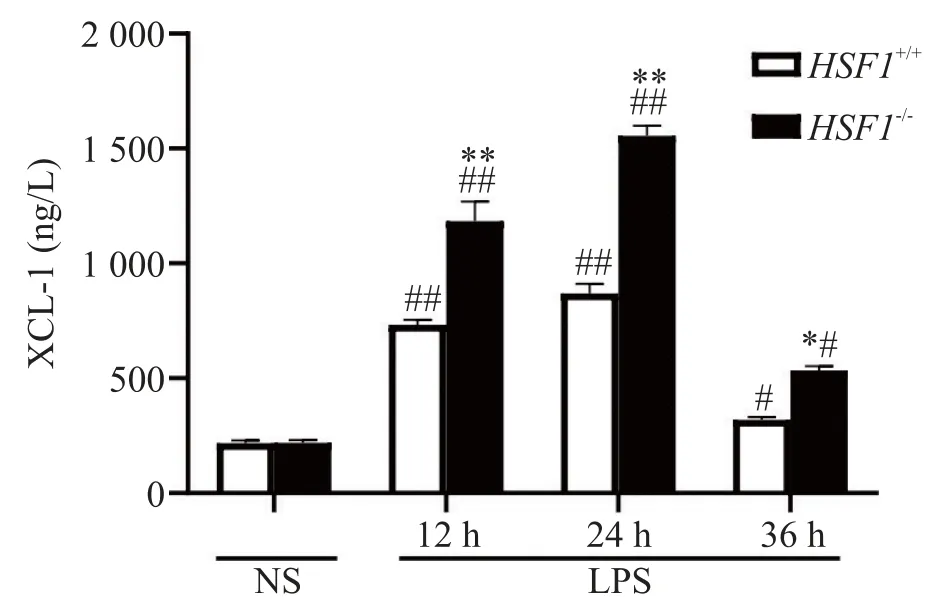
Figure 5.The effect of HSF1 on the concentration of XCL-1 in the BALF of ALI mice induced by LPS.Mean±SD.n=6.#P<0.05,##P<0.01 vs HSF1+/++NS group;*P<0.05,**P<0.01 vs HSF1+/++LPS group.图5 HSF1对LPS所致ALI小鼠BALF中XCL-1浓度的影响
HSF1 究竟通过何种分子机制抑制中性粒细胞在ALI 小鼠肺部的浸润呢?在肺部炎症时,最开始中性粒细胞趋化到肺血管的能力比较弱,随着中性粒细胞和肺血管内皮细胞变得活化,并释放趋化分子和黏附分子,中性粒细胞进入肺循环的能力变强,并且能够穿过肺血管内皮细胞、肺泡上皮细胞和肺间质渗出到肺泡腔中。研究证明,XCL-1 是其中非常关键的趋化分子[22]。XCL1 是C 族趋化因子家族的一员。XCR-1 是其特异性受体,主要表达在在中性粒细胞、T 细胞、NK 细胞和B 细胞表面。XCL-1 通过与XCR-1 相互作用,产生趋化效应[23]。在本科室前期工作中,采用含有384 个炎症因子基因的微阵列,利用HSF1−/−和HSF1+/+小鼠制备了内毒素血症模型,采用该模型小鼠的肺组织,筛选出了HSF1 调控的相关炎症基因,发现HSF1 可能抑制XCR-1 的表达[24]。进一步生物信息学分析发现,在XCR-1转录起始位点上游,存在HSF1 结合位点;通过进一步生物信息学分析,我们发现XCL-1的启动子区也含有HSF1 的结合位点。因此,我们推测HSF1 对LPS 所致ALI 小鼠肺组织中性粒细胞浸润的抑制作用可能是通过调节XCL-1/XCR-1 这一对趋化因子配体/受体的表达来实现的。据此,我们通过ELISA 检测了小鼠血清、肺组织及BALF 中XCL-1 的表达水平,并采用流式细胞术检测了BALF 中性粒细胞表面XCR-1 的表达水平。结果发现,小鼠敲除HSF1后,在LPS所致的ALI模型中,血清、肺组织和BALF中的XCL-1水平以及BALF 中性粒细胞表面的XCR-1 水平均高于野生型小鼠。因此,HSF1 可能是通过抑制XCL-1及中性粒细胞表面XCR-1 的表达,从而发挥对中性粒细胞浸润的抑制作用。但HSF1 是否是在转录水平直接调节XCR-1的表达尚需要进一步研究。
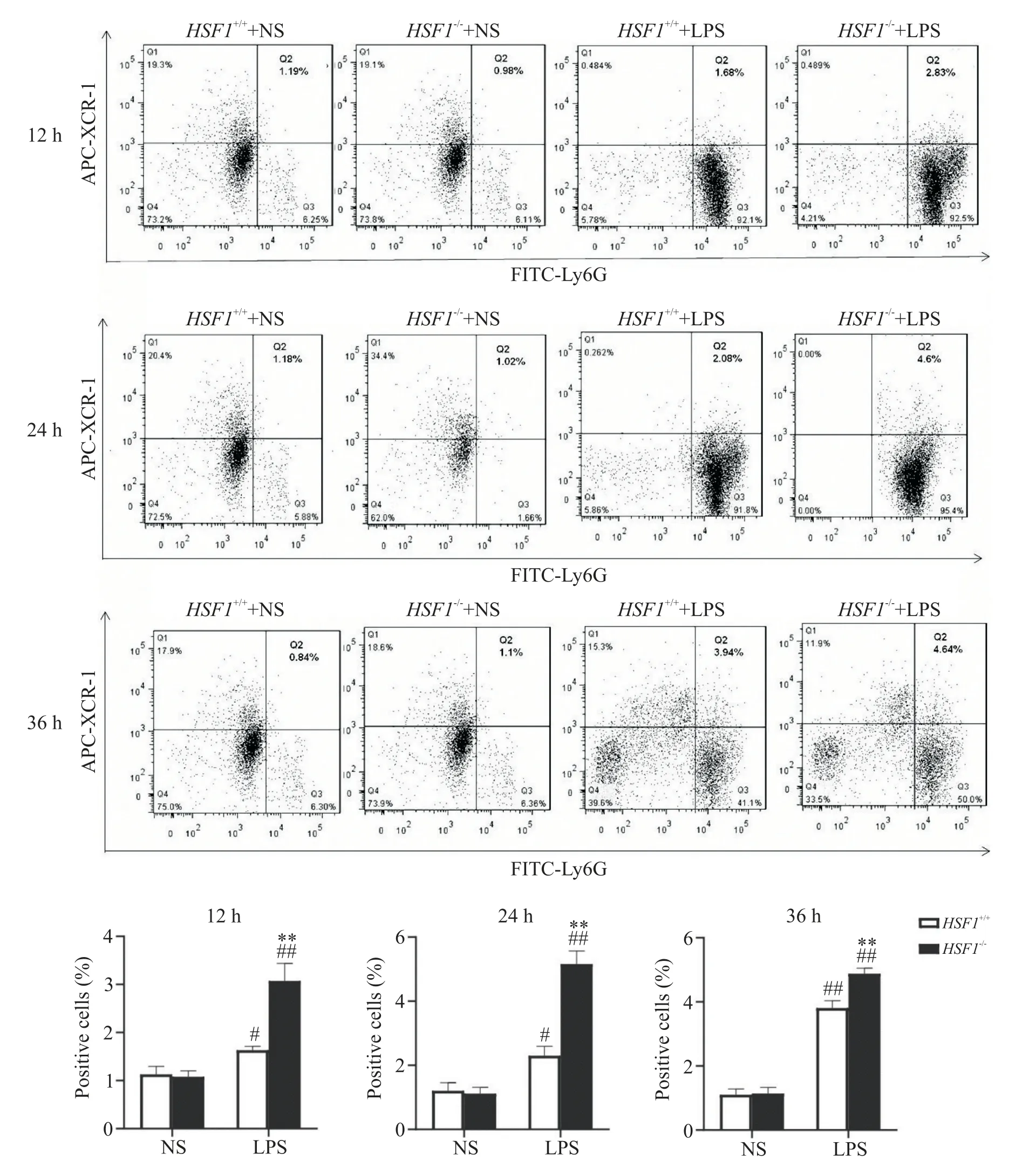
Figure 6.The effect of HSF1 on the expression of XCR-1 on the nuetrophils in BALF of ALI mice induced by LPS.Mean±SD. n=6.#P<0.05,##P<0.01 vs HSF1+/++NS group;*P<0.05,**P<0.01 vs HSF1+/++LPS group.图6 HSF1对LPS所致ALI小鼠BALF的中性粒细胞表面XCR-1表达的影响
总之,本研究证明了HSF1 通过抑制XCL-1/XCR-1 这一对趋化因子配体/受体的表达,抑制了中性粒细胞在肺组织的迁移和浸润,从而减轻了LPS所致的肺损伤,这对进一步揭示ALI/ARDS 的潜在防治靶点有着重要意义。

