阿卡替尼增强利妥昔单抗生物类似药HLX01对非GCB型DLBCL耐药细胞株的杀伤效果*
申 晗, 高冠论, 许艳丽, 张 星, 杜庆华, 李庆山,△
(1华南理工大学医学院,广东 广州 510006;2暨南大学附属广州红十字会医院血液科,广东 广州 510220;3华南理工大学附属第二医院血液科,广东 广州 510180)
弥漫大B 细胞淋巴瘤(diffuse large B-cell lym‑phoma,DLBCL)是最常见的非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL),占发达国家成人NHL 的25%~35%,其按照细胞起源分为生发中心B 细胞样(germinal center B-cell-like,GCB)亚型和非GCB 亚型[1-2]。R-CHOP[利妥昔单抗(rituximab,RTX)、环磷酰胺、多柔比星、长春新碱和泼尼松]方案是DLBCL的一线标准治疗方案,大大改善了DLBCL 的治疗效果[3],但对非GCB 型DLBCL 的疗效和整体预后仍差于GCB 型DLBCL[4]。在非GCB 型DLBCL 中,治疗后总体复发率超过30%。一些难治/复发病例对RTX产生了耐药性,这使得治疗更加困难[5-6]。所以在RCHOP 方案的基础上联合其他治疗策略(即RCHOP+X)而增强RTX 敏感性是目前研究的热点,这些策略包括联合Bruton 酪氨酸激酶(Bruton tyrosine kinase,BTK)抑制剂、抗CD30药物偶联剂、免疫调节剂、免疫检查点阻断剂和表观遗传学抑制剂等。
BTK 抑制剂伊布替尼是近10年来治疗B 细胞淋巴瘤包括DLBCL 的重要新药[7],伊布替尼是第1 个小分子BTK 抑制剂,它抑制BTK 磷酸化,从而阻断B细胞激活,在自身免疫性疾病和B 细胞恶性肿瘤模型中有效[8]。在DLBCL 患者中,二期临床试验发现,伊布替尼对非GCB 型DLBCL 比GCB 型患者更有效。可能的 机制是非GCB 型DLBCL 比GCB 型DLBCL 更能持续激活B 细胞受体信号通路,从而使得伊布替尼发挥更大的作用[9]。但同时,伊布替尼还与其他激酶,例如表皮生长因子受体(epidermal growth fac‑tor receptor,EGFR)、肝细胞癌中表达的酪氨酸激酶、白细胞介素2诱导型T细胞激酶(interleukin-2-in‑ducible T-cell kinase,ITK)和TXK 酪氨酸激酶不可逆地结合[10],从而给其与RTX 的联用带来了负面效果。RTX 主要通过3 种途径杀伤肿瘤细胞:(1)补体依赖的细胞毒性(complement-dependent cytotoxicity,CDC),即与抗原结合的抗体激发补体形成膜攻复合物使细胞溶解,补体调节蛋白如CD55、CD59 的表达上调可抑制补体激活,从而导致CDC 作用减弱;(2)抗体依赖的细胞介导的细胞毒性(antibody-depen‑dent cell-mediated cytotoxicity,ADCC),即是一种由抗原抗体结合后,携带Fcγ 受体的细胞(如NK 细胞、粒细胞、单核细胞和T 细胞等)识别IgG 抗体的Fc 片段而引起的免疫杀伤效应;(3)直接效应,即RTX 诱导肿瘤细胞内部信号的激活引起抗增殖作用或者细胞死亡[11]。而伊布替尼对ITK 的脱靶抑制会拮抗NK 细胞介导的抗CD20 抗体依赖的ADCC[12]。同时一项三期临床研究也发现,对于未经治疗的非GCB型DLBCL 患者,在R-CHOP 中加入伊布替尼并没有改善疗效[13]。
而阿卡替尼(acalabrutinib,Aca)是第二代、选择性、不可逆的BTK 抑制剂,与伊布替尼最大的不同就是对靶点的选择性,Aca 显著减少了BTK 以外的脱靶效应,例如EGFR、TEC 和ITK 等[14],因而有可能会消除伊布替尼与RTX联用时的不足。近期通过分析发现,作为RTX 原研药美罗华(MabThera®)的生物类似药,汉利康®(HLX01)在理化性质和生物活性方面与其高度相似[15],因此需要进一步探索Aca 与RTX(HLX01)联用对非GCB 型DLBCL 的效果。基于此,我们希望进行体外实验,对Aca 联用RTX(HLX01)是否会增加对RTX(HLX01)耐药的非GCB型DLBCL细胞株的杀伤效果及其相关机制进行探讨,为Aca逆转DLBCL 对靶向药物的耐药性提供更多的实验和理论依据。
材料和方法
1 细胞
人非GCB 型DLBCL 细胞株NU-DUL-1 购自上海中乔新舟生物科技有限公司,其耐药株NU-DUL-1-R自行构建,构建方法见下文。所有实验均使用处于对数生长期状态的细胞;NU-DUL-1-R 是停药1 周后恢复到对数生长期状态的细胞。
2 主要试剂
Aca 购自Selleck;RTX(HLX01,汉利康®)购自上海复宏汉霖生物制药有限公司;FITC 标记的抗人CD20、CD55 及CD59 抗体购自BioLegend;羧基荧光素琥珀酰亚胺酯(carboxyfluorescein succinimidyl es‑ter,CFSE)、PE-Cy7 标记的抗人CD3 单抗和Percp-Cy5.5 标记的抗人CD8 单抗购自Tonbo Biosciences;APC-eFluor780 标记的抗人白细胞介素17(interleu‑kin-17,IL-17)单抗购自Invitrogen;Cell Counting Kit-8(CCK-8)购自Dojindo。ELISA 试剂盒购自武汉华美生物工程有限公司。
3 方法
3.1 耐药株的构建和培养补体来源为从健康志愿者身上采集的新鲜外周血血清,通过RTX 的CDC作用诱导耐药细胞。耐药细胞是将处于对数生长期内的亲本细胞体外培养于含20% 正常人新鲜血清(normal human serum,NHS)的RPMI-1640 培养基中,从低浓度逐渐递增加入RTX(1、2、4、8、16、32、64和128 mg/L)诱导构建而成。
3.2 耐药细胞株NU-DUL-1-R的生物学特性
3.2.1 生长曲线收集对数生长期的细胞计数并稀释成5×107/L 的细胞悬液。在96 孔板中每孔加入100 μL 细胞悬液,每种细胞(NU-DUL-1 和NU-DUL-1-R)各设定3 复孔,接种7 块96 孔板。每天于相同时点向每孔中加入10 μL CCK-8 溶液,避光孵育4 h左右,并检测吸光度(A)值,连续7 d,绘制出生长曲线,以培养时间为横坐标,每天的A值/0 h 的A值为纵坐标。
3.2.2 细胞周期制备NU-DUL-1 或NU-DUL-1-R单细胞悬液,调整细胞浓度为1×109/L。加入1 mL DNA staining solution 和10 μL permeabilization solu‑tion 混匀后室温下避光染色30 min。流式检测时选择最低上样速度。用FlowJo 进行细胞周期分析可以自动识别出G1期、S 期和G2期各期细胞的占比。通过增殖指数(proliferation index,PI)表示细胞增殖状况,公式为PI=(S+G2M)/(G0G1+S+G2M)。
3.2.3 死活染料7-氨基放线菌素D(7-aminoactino‑mycin D,7-AAD)流式染色检测耐药株与亲本株CDC 效应的差异分别将NU-DUL-1和NU-DUL-1-R细胞重悬于含20% NHS 的RPMI-1640 培养基中,以每孔1×106铺在6 孔板中,根据加入RTX 的浓度不同分为3 组:0 mg/L、4 mg/L 和100 mg/L,处理2~4 h 后收集各组细胞,采用7-AAD 染色及流式细胞术检测NU-DUL-1 和NU-DUL-1-R 细胞对RTX 诱导的CDC作用的差异。
3.2.4 CFSE/7-AAD 流式细胞术检测耐药株与亲本株的ADCC 效应用CFSE 标记肿瘤细胞,再将人外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)和肿瘤细胞以1∶1、5∶1、10∶1 和20∶1 的比例共培养于6孔板中,并加入RTX(终浓度为100 mg/L)处理24 h,采用7-AAD 染色及流式细胞术检测ADCC效应对肿瘤细胞的杀伤。
3.2.5 流式细胞术检测耐药株和亲本株表面抗原CD20、CD55 及CD59 表达的变化收集生长对数期的细胞,PBS 洗涤重悬后向细胞悬液中分别加入5 μL 的表面抗原CD20、CD55 及CD59 流式抗体,轻轻震荡混匀,在室温或者4 ℃下避光孵育20~30 min,洗涤重悬,然后流式上机检测。
3.3 CCK-8法测定Aca对细胞增殖的影响将细胞按照每孔2×104个接种于96孔培养板中,并分为对照组和实验组。实验组分别加入不同浓度的Aca 处理48 h,然后每孔加入10 μL CCK-8 溶液,避光孵育4 h后,在酶标仪上于波长450 nm处测定各孔A值。
3.4 7-AAD 流式染色检测CDC 效应将NU-DUL-1-R 细胞重悬于含20% NHS 的RPMI-1640 培养基中,以每孔1×106铺在6 孔板中,分为6 组:对照(con‑trol)组(加入相同体积的完全培养基)、单药Aca(6 μmol/L)组、单药Aca(12 μmol/L)组、单药RTX 组、RTX+Aca(6 μmol/L)组和RTX+Aca(12 μmol/L)组。其中Aca 的浓度依据CCK-8 实验确定,RTX 的浓度是100 mg/L。Aca 处理48 h 后对每孔细胞进行换液处理,分别将每孔细胞重悬于含20% NHS 的RPMI-1640 培养基中,按照不同分组加入RTX。RTX 处理细胞2~4 h 后对各组细胞进行7-AAD 染色及流式细胞术检测。
3.5 CFSE/7-AAD 流式细胞术检测ADCC 效应将NU-DUL-1-R 用CFSE 标记后加入PBMCs 共培养,效靶比为5∶1。将NU-DUL-1-R+PBMCs 共培养的细胞重悬于完全培养基中,以每孔2×106铺在6孔板中,按照不同的处理方式分为6 组:control 组(加入相同体积的完全培养基)、单药Aca(6 μmol/L)组、单药Aca(12 μmol/L)组、单药RTX 组、RTX+Aca(6 μmol/L)组和RTX+Aca(12 μmol/L)组。RTX 的浓度是100 mg/L。处理完成后对各组细胞进行7-AAD 染色及流式细胞术检测。
3.6 流式细胞术检测Aca 联合RTX 对Th17 细胞分化的影响将PBMCs 与NU-DUL-1-R 以5∶1 的比例共培养,并按照3.5 中分为6 组,处理完成后在培养基中加入50 μg/L 的佛波酯、1 mg/L 的离子霉素和10 mg/L 的Brefeldin A,刺激细胞5 h。然后按说明书要求加入PE-Cy5 标记的抗人CD3 单抗和FITC 标记的抗人CD8 单抗,室温下避光孵育20 min,以标记CD4+T细胞(CD3+CD8−T细胞)。用PBS洗涤,固定、破膜后,加入PE 标记的抗人IL-17 单抗,室温下避光孵育30 min。PBS 洗涤、重悬细胞,用流式细胞仪对细胞进行分析。
3.7 ELISA法检测Aca联合RTX处理后培养上清液中IL-17 的浓度按上述方案进行分组,处理完成后收集各组培养上清液,然后按照IL-17 ELISA 试剂盒说明书进行测定,用多功能微孔板分析仪测出各血清A值,通过绘制标准曲线计算出标本中各IL-17 的浓度。
4 统计学处理
所有体外实验均进行了至少3 次独立重复实验,代表性结果显示在图中。GraphPad Prism 8 软件绘图,运用SPSS 22.0进行统计学处理。正态分布的计量资料以均数±标准差(mean±SD)表示。两组之间比较采用t检验;多组资料之间的比较采用单因素方差分析(one-way ANOVA)。以P<0.05时表示差异有统计学意义。
结 果
1 NU-DUL-1-R细胞耐药性检测
1.1 RTX 对耐药株与亲本株CDC 及ADCC 效应的差异对于CDC 作用,通过对RTX 对耐药株和亲本株的杀伤作用进行流式细胞术分析,检测结果显示4 mg/L 和100 mg/L 的RTX 对NU-DUL-1-R 细 胞 的CDC 作用均比对NU-DUL-1 细胞弱(P<0.05),见图1A。
同时对于ADCC 作用而言,流式细胞术检测结果显示,不论在何种效靶比之下,RTX 对NU-DUL-1-R 细 胞的ADCC 作用 都 比NU-DUL-1 细 胞 弱(P<0.05);同时,效靶比为5∶1时的ADCC 作用与效靶比10∶1 及20∶1 时的差异无统计学显著性,故后续实验选择效靶比5∶1,见图1B。
1.2 细胞生长曲线、细胞周期和表面抗原表达的变化采用CCK-8 法检测NU-DUL-1 和NU-DUL-1-R细胞每天的A值并绘制出生长曲线,可以看出与亲本细胞株NU-DUL-1 相比,耐药细胞株NU-DUL-1-R生长速度较慢,见图2A。同时,对NU-DUL-1 和NUDUL-1-R 细胞采用流式细胞周期分析显示,相较于亲本细胞株,耐药细胞株在G1期的细胞比例升高,在S 期和G2期的细胞比例略少,PI 显著减小(P<0.05),见图2B。
采用流式细胞术检测上述细胞株CD20、CD55及CD59 抗原表达情况,结果显示耐药株NU-DUL-1-R 与亲本细胞株相比CD20 表达显著下调(P<0.05),但CD55 和CD59 表达的差异无统计学显著性(P>0.05),见图2C。
2 不同浓度的Aca 对NU-DUL-1-R 细胞活力的影响
通过CCK-8 实验检测不同浓度的Aca 对NUDUL-1-R 细胞活力的影响,与对照组相比,实验组给予Aca(2.5、5、10、20、40 和80 μmol/L)处理后,NUDUL-1-R 细胞活力均受到显著抑制,且呈剂量依赖性,IC50=12.51 μmol/L,见图3。在后续实验中选取IC50和1/2 IC50的近似值作为Aca 的处理浓度,即12 μmol/L和6 μmol/L。
3 Aca 联合RTX 的CDC 效应对NU-DUL-1-R 细胞杀伤的影响
流式细胞术检测Aca 联合RTX 的CDC 效应下NU-DUL-1-R 细胞的死亡率,结果显示,与单药组相比,Aca 与RTX 联用组细胞死亡率均更高(P<0.01),说明两药联用诱导的杀伤效果更强;同时,联合作用组中杀伤效果也呈剂量依赖性,Aca 浓度增大,杀伤效果增强,差异有统计学意义(P<0.05),见图4A。
4 Aca 联合RTX 的ADCC 效 应对NU-DUL-1-R 细胞杀伤的影响
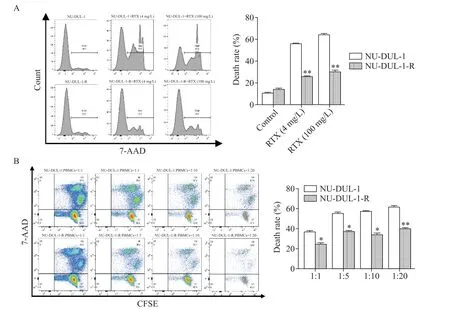
Figure 1.Death rates of NU-DUL-1 and NU-DUL-1-R cells induced by rituximab(RTX).A:the complement-dependent cytotoxicity(CDC)of RTX detected by flow cytometry;B:the antibody-dependent cell-mediated cytotoxicity(ADCC)of RTX detected by flow cytometry.Mean±SD. n=3.*P<0.05,**P<0.01 vs NU-DUL-1 group.图1 利妥昔单抗诱导的NU-DUL-1和NU-DUL-1-R细胞死亡率
流式细胞术检测Aca 联合RTX 的ADCC 效应下NU-DUL-1-R 细胞的死亡率,结果显示,与单药组相比,联用组比单药组细胞死亡率更高,差异有统计学意义(P<0.05),说明两药物联用诱导的ADCC 效果更强,见图4B。
5 Aca 联合RTX 对Th17 细胞分化及IL-17 分 泌的影响
流式细胞术结果显示,CD4+T 淋巴细胞中Th17细胞所占比例约为2.5%,与对照组相比,Aca处理后Th17 细胞占CD4+T 淋巴细胞的比例降低,差异有统计学意义(P<0.05);同时,RTX 处理后Th17 细胞占CD4+T 淋巴细胞的比例升高,而Aca 联用RTX 处理后Th17 细胞比例比单药RTX 组下降,差异有统计学意义(P<0.05),见图5A。
ELISA 结果同样显示,相较于对照组,单药Aca组的IL-17 分泌更少,差异有统计学意义(P<0.05);而单药RTX 组的IL-17分泌最多,与之相比两药联用组的IL-17分泌显著减少(P<0.05),见图5B。
讨 论
RTX 是抗CD20 单克隆抗体,在DLBCL 治疗中发挥着基石作用。一项三期、多中心、随机、平行、双盲研究证实了汉利康(HLX01)与美罗华之间的治疗等效性[16]。同时,由于价格相对于美罗华来说更低,国产的仿制药物如汉利康(HLX01)等在临床上得到了广泛应用,从而使得更多DLBCL 患者受益,但是对于RTX所产生的耐药性是阻碍患者长期生存的重要因素[17],因此研究RTX(HLX01)的耐药机制以及寻找增加RTX 的敏感性方法是目前急需解决的问题。
目前在R-CHOP 方案基础上加上其他的策略(R-CHOP+X)为目前研究的热点,其中BTK 抑制剂联合R-CHOP 是新的研究热点。BTK 抑制剂伊布替尼联合RTX 本有望增强非GCB 型DLBCL 的治疗效果,但是临床研究未显示出患者获益,主要是由于伊布替尼对ITK 的脱靶抑制,从而拮抗了抗CD20 单抗介导的ADCC[12]。因此,Aca 作为第二代、选择性更高的BTK 抑制剂[14],成为了我们研究的新方向。而NU-DUL-1 细胞株作为来源于人的非GCB 型DLBCL细胞株,与GCB 型DLBCL 相比,其对RTX 的反应和效果较差[18],是进行RTX 耐药性相关研究的理想细胞模型。
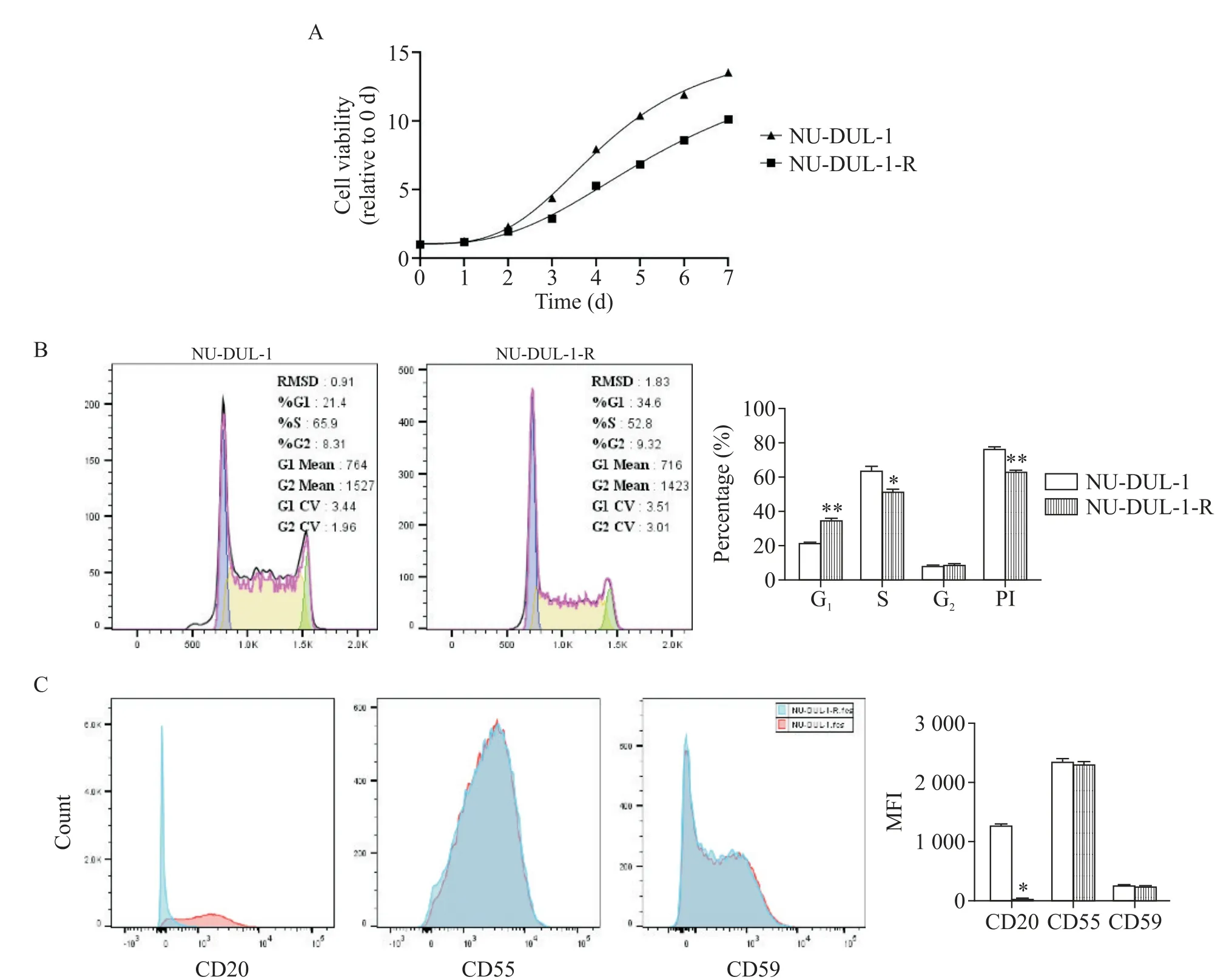
Figure 2.The diversity in biological characteristics between NU-DUL-1 and NU-DUL-1-R cell lines.A:growth curve of the two cell lines;B:comparison of cell cycle between the two cell lines;C:cell surface antigen expression of the two cell lines.Mean±SD. n=3.*P<0.05,**P<0.01 vs NU-DUL-1 group.图2 NU-DUL-1和NU-DUL-1-R细胞株生物学特性差异
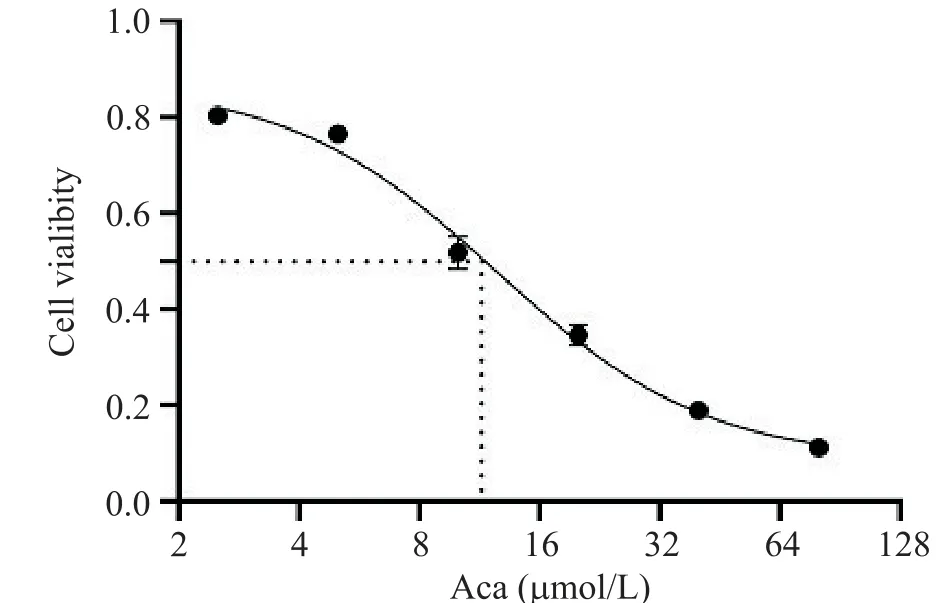
Figure 3.The viability of NU-DUL-1-R cells after treated with different concentrations of acalabrutinib (Aca) de‑tected by CCK-8 method.Mean±SD. n=3.图3 CCK-8 法检测不同浓度阿卡替尼处理后NU-DUL-1-R细胞的活力
恶性B细胞对RTX 耐药的机制主要包括CDC效应减弱、ADCC 作用减弱、直接凋亡作用减弱、CD20表达降低、CD20 构象变化、肿瘤微环境的调节作用等[19]。其中,肿瘤细胞表面CD20 表达下调是其抗CD20 单克隆抗体抵抗最直接和常见的原因之一[20]。同时临床也观察到复发/难治型DLBCL 患者肿瘤细胞表面CD20表达下调[21]。基于以上发现,我们参考相关文献的耐药株构建方法[18,22],诱导出了可耐受128 mg/L RTX 的耐药细胞株NU-DUL-1-R,然后通过流式细胞术检测出RTX 对NU-DUL-1-R 细胞的CDC作用和ADCC 作用均比亲本株明显减弱,且CD20 流式染色显示其相对表达量显著下降。但与王文廉等[23]的研究结果不同的是,NU-DUL-1 与NU-DUL-1-R 细胞表面的CD55 和CD59 表达无显著差异,这可能与DLBCL的高度异质性有关[24]。
除此之外,我们观察到相较于亲本株,耐药株的生长速度较慢,这与徐宗斌[25]等的研究结果相似,表明细胞在耐药后倍增时间延长,对药物敏感性降低。流式细胞术结果也显示,耐药株G0/G1期细胞增加,S期细胞减少,增殖指数减小。有研究表明,当细胞主要分布于对药物相对不敏感的时期如G0/G1期时,会表现出耐药性[26]。
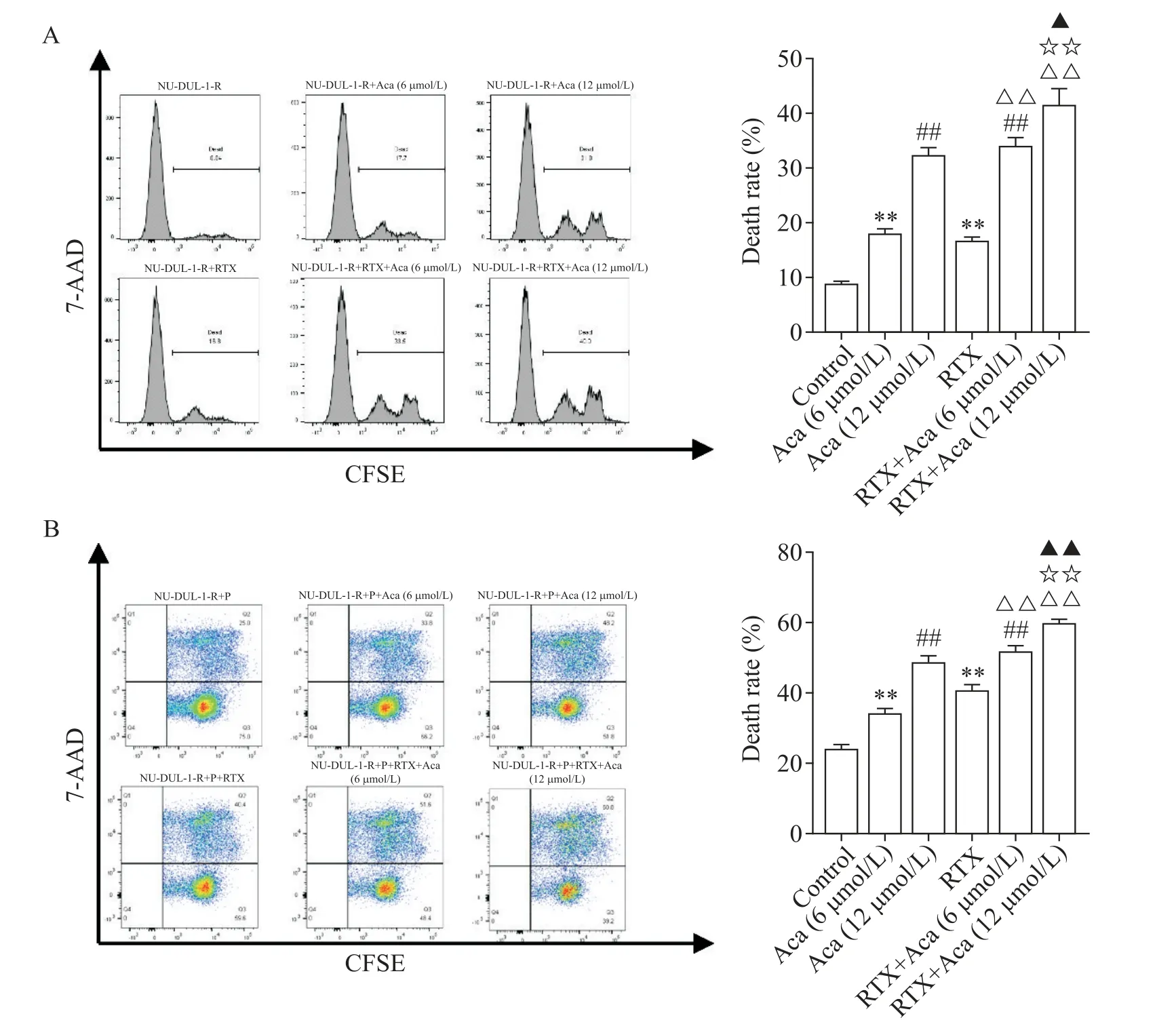
Figure 4.Death rates of NU-DUL-1-R cells induced by combination of acalabrutinib (Aca) and rituximab (RTX).A:the complement-dependent cytotoxicity(CDC)of Aca and RTX detected by flow cytometry;B:the antibody-dependent cellmediated cytotoxicity(ADCC)of Aca and RTX detected by flow cytometry.P:PBMCs.Mean±SD. n=3.**P<0.01 vs con‑trol group;##P<0.01 vs Aca(6 μmol/L)group;△△P<0.01 vs RTX group;☆☆P<0.01 vs Aca(12 μmol/L)group;▲P<0.05,▲▲P<0.01 vs RTX+Aca(6 μmol/L)group.图4 阿卡替尼联合利妥昔单抗诱导的NU-DUL-1-R细胞死亡率
在此基础上,通过采用不同浓度的Aca处理NUDUL-1-R 细胞,我们发现NU-DUL-1-R 细胞的增殖均受到显著抑制,且呈剂量依赖性,因此为了明确不同浓度的Aca 是否都对RTX 有增敏效果,我们选取了IC50与1/2 IC50这两个有代表性的浓度来进行后续实验。同时对于RTX,为了保证后续实验中RTX 在不同靶细胞数量下一定是足量的,且更能代表患者治疗过程中体内血药浓度,我们将实验中RTX 的终浓度 设置 为100 mg/L[27]。在本实验中,对于CDC 和ADCC 效应来说,联用组NU-DUL-1-R 细胞比单药组死亡率更高,证明Aca 加强了RTX 诱导的CDC 作用和ADCC作用。
DLBCL 的发生发展与肿瘤免疫微环境密切相关[28],结合我们之前的研究及相关文献报道,发现无论是GCB 型还是非GCB 型DLBCL,IL-17 均可以通过下调p53 来抑制淋巴瘤的凋亡,从而促进肿瘤的生长,而RTX 会上调IL-17 的分泌,这也与其耐药有关[29-31]。因此我们体外实验探讨了Aca 对IL-17 分泌的影响,结果发现Aca 处理后IL-17 分泌显著减少。而RTX 单药组Th17 细胞比例增加,IL-17 的分泌增加,结合我们前期的结果,我们认为,Aca 和RTX 联用时其Th17 细胞的比例显著降低,分泌的IL-17 减少,抑制p53的表达,促进淋巴瘤细胞的凋亡[30]。
综上所述,我们通过体外实验证明了Aca 能通过降低Th17细胞比例,恢复RTX作用之后Th17/Treg比例的失衡,减少IL-17 的分泌,来增强RTX 对耐药细胞的杀伤作用。但这一作用尚需在动物体内进行验证,从而为两药联合、增强RTX疗效来治疗耐RTX的非GCB型DLBCL提供更多理论依据。
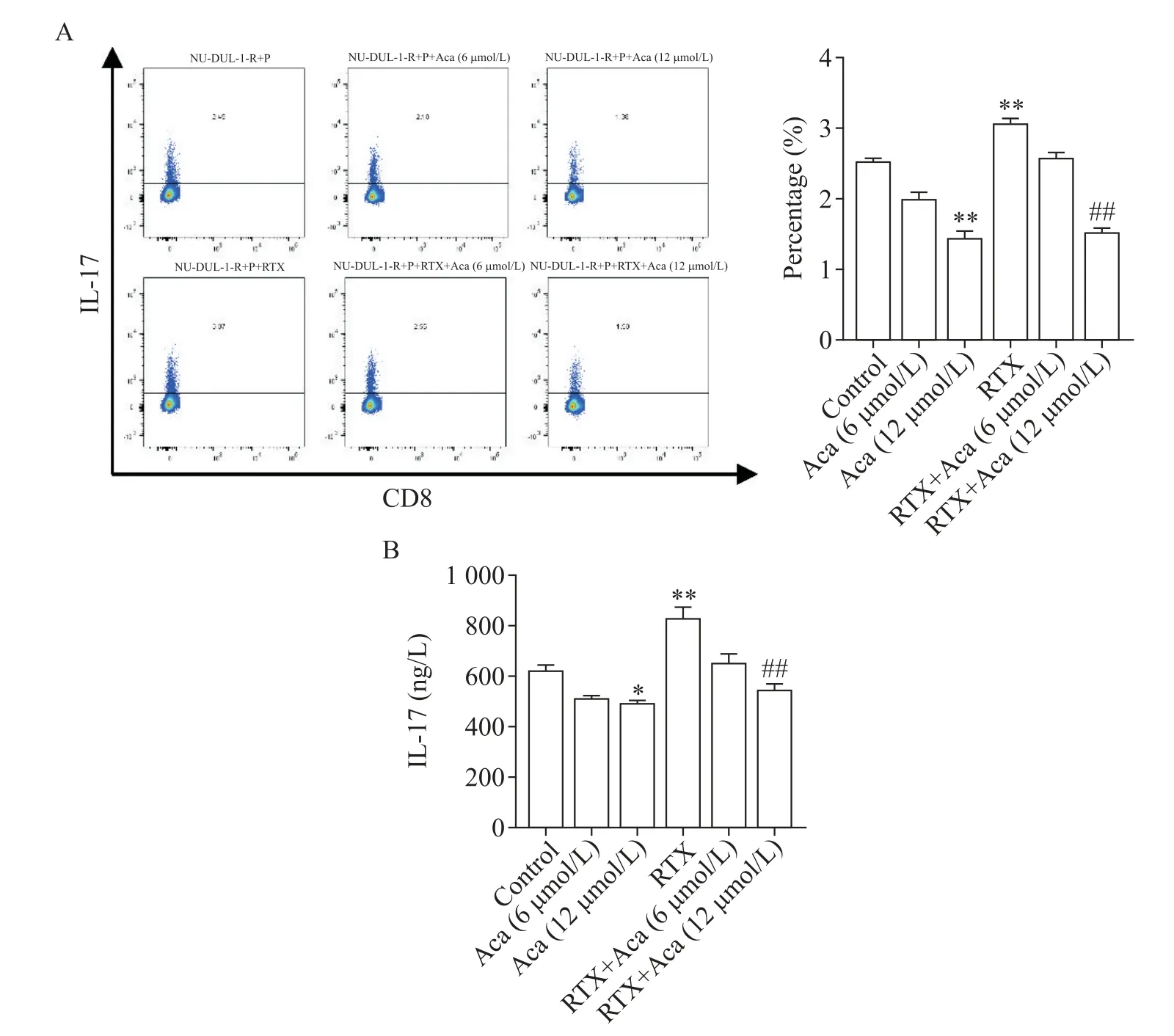
Figure 5.Effect of acalabrutinib(Aca)combined with rituximab(RTX)on the proportion of Th17 cells and the level of IL-17.A:the proportion of Th17 cell detected by flow cytometry;B:the level of IL-17 detected by ELISA.Mean ± SD. n=3.*P<0.05,**P<0.01 vs control group;##P<0.01 vs RTX group.图5 阿卡替尼和利妥昔单抗对Th17细胞比例及IL-17水平的影响

