肾乳头状腺瘤1 例报道并文献复习
张乐飞 易发现 闫 诺
内蒙古医科大学附属医院泌尿外科,内蒙古呼和浩特 010030
肾乳头状腺瘤(renal papillary adenoma,RPA)是肾脏良性肿瘤中比较少见的一种肾原发肿瘤。首先,肾乳头状腺瘤与乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)以及其他在病理形态学上具有乳头状结构的肿瘤具有一些相似性;其次,此类肿瘤临床早期多无症状,容易漏诊。关于RPA 的文章较少,有必要对此类肿瘤的临床表现以及病理学特征进行梳理总结并加以分析,以期提高临床医生对该类肿瘤的认识[1]。内蒙古医科大学附属医院(以下简称“我院”)收治1 例该病患者,行腹腔镜右肾部分切除术,术后恢复好。现结合以往相关文献探讨并复习该肿瘤在病理学、影像学、诊断及鉴别诊断等方面特征。
1 病例资料
患者,女,78 岁,因“体检发现右肾占位性病变40 余天”于2018 年10 月8 日收入我院。查体:患者一般情况好,双侧肾区无隆起、无压痛及叩击痛,腹部未触及包块,浅表淋巴结不大,心肺未见异常,肝脾不大。患者自发病以来无发烧、血尿、体重减轻及腰背部疼痛等。各项化验结果报告无明显异常。既往有高血压病史10 年,糖尿病病史10 余年。PET/CT 提示:右肾中级类圆形结节影伴代谢增高,直径约13.7 mm,CT值为29~58 Hu;考虑右肾中级良性病变可能性大,不完全除外高分化恶性病变(见图1)。腹部增强MRI 提示:右肾下极偏前可见结节状短T1、混杂T2 信号,病变边界清,大小为13 mm×11 mm,DWI 呈稍高信号,增强扫描呈花环状强化,考虑右肾恶性肿瘤。入院初步诊断为:右肾占位性病变。于2018 年10 月11 日行腹腔镜右肾部分切除术。术中可见右肾中下极一类圆形肿物,肿瘤位于肾皮质内并突出于肾表面。完整切除后肿瘤大小为15 mm×10 mm,肿瘤边界清楚。剖开瘤体,观察瘤体切面呈灰褐色,质地均匀,未见囊腔、出血、坏死。病理报告:肿瘤体积较小,瘤组织呈乳头状结构,细胞浆由小的嗜酸性细胞组成,细胞分化好,无异型性。术后病理报告:根据免疫组织化学染色结果,(右肾肿物)支持RPA(肿物体积1.3 cm×1.0 cm×0.6 cm)。免疫组织化学染色诊断为:CK7(+)、P504S(+)、CD10(-)、CD117(-)(图2)。术后随访18 个月,各项检查结果报告未见局部肿物复发与远处转移,右肾部分切除术术后肾功能良好。
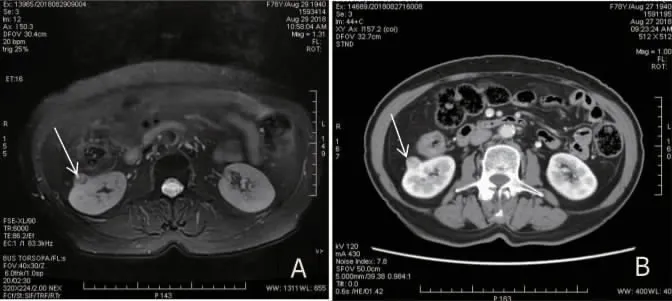
图1 右肾肿瘤增强CT 图像
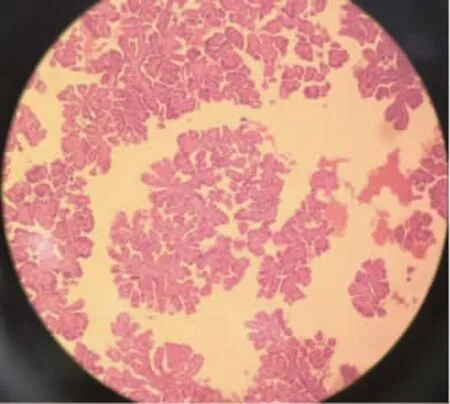
图2 术后病理显微镜下表现(HE 染色,100×)
2 讨论
RPA 是一种比较罕见的肾脏良性肿瘤。国外有研究发现,成人的发病率可达20%以上[2],但在国内较少报道。1950 年有研究[3]报道,把直径<3 cm 的肾肿瘤称之为腺瘤,直径>3 cm 称之为腺癌。1975 年Bennington 等提出腺瘤实际上都是早期的腺癌,也有人认为二者是同一肿瘤的不同发展阶段,二者以肿瘤直径<1.0 cm 为鉴别标准。2016 年WHO 分类对肿瘤直径降低了标准,定义RPA 为一种直径≤1.5 cm、具有管状或乳头状结构的WHO/ISUP 低级别(1~2 级)无包膜肿瘤[4]。RPA 在临床病理诊断中较少见,而在尸检中相对较多见,21~40 岁人群尸检发现率可达10%,同时可伴发嫌色细胞癌、嗜酸细胞腺瘤、血管平滑肌脂肪瘤、肾间质肿瘤等[5]。
2.1 临床特点
RPA 是一种起源于近曲小管上皮细胞的良性肿瘤。好发于老年人,年龄70 岁以上的人群中发病率超过40%,男女发病率无明显差异[6]。该病发生与硬化性血管疾病密切相关[7]。RPA 因其属于良性肿瘤所以肿瘤生长相对缓慢,在上早期常无明显临床表现,偶有腰部胀痛,当肿块较大时可在腹部触及包块,当侵犯到肾盂时可出现血尿。临床中该病多数是在体检中偶然发现[8],本例患者无任何症状,体检发现肿瘤,行手术治疗。
2.2 病理学特征
肾脏良性肿瘤病理学特征常为可有新生血管形成,但形成速度缓慢,新生血管数量少,形态相对单一,分支较少,血流不丰富,所以肿瘤生长缓慢[9]。而此肿瘤病理学特点为瘤体较小,呈小管状、乳头状或小管乳头状结构,有的肿瘤有薄的纤维性假包膜[10]。本研究中以乳头状生长为主,与以往文献报告大致相符。但与以往报道不同的是,管状结构中可见嗜酸性分泌物,细胞浆嗜酸性,由小的“嗜碱性细胞”或“嗜酸性细胞”组成,多数细胞胞浆稀少,细胞核未发现核分裂象,核呈椭圆形或圆形,核仁不明显,细胞分化良好,无异型性。组织学上乳头状腺瘤与1 型和2 型肾乳头状腺癌相似[11]。因此RPA 与分化好的PRCC 无论在细胞学还是结构上均不宜鉴别。但从临床上看,这两种疾病可能是两种不同性质的病变或者同一种肿瘤的不同发展阶段[12]。病理学鉴别两种疾病时应注意PRCC 缺乏水肿样间质,细胞核仁明显,细胞有异型,常伴有明显出血坏死,间质和乳头核心内常见较多泡沫细胞沉积[13]等特点。研究认为RPA 与分化好的肾乳头状腺癌在病理诊断时,不能以肿瘤直径大小来定性,一旦病理发现透明细胞、核分裂象、多形性核等现象,即以乳头状肾癌对待[14]。
2.3 影像学表现
RPA 的影像学特征多不典型,术前常不容易诊断。RPA 在超声上表现为边界清晰的实性肿块,呈强回声;彩色多普勒表现为缺乏血供病变[15]。CT 多表现为突出肾脏外的高密度或等密度肾实性肿块,肿瘤内部可有低密度纤维瘢痕,注射造影剂后,肾肿瘤与肾实质分界清楚,呈轻至中度强化,肿瘤内部常没有出血或坏死,一般不侵犯血管及周围邻近器官组织[16],与本例患者CT 表现大致相同。肾血管造影无动静脉瘘、肿瘤染色等恶性肿瘤征象[17]。MRI 表现为T1WI 呈等信号,T2WI 呈低信号[18]。对于肾脏良恶性肿瘤的鉴别,彩色多普勒超声是最便捷的一种检查方法。有研究显示,彩色多普勒超声检查肾脏恶性肿瘤时,表现为收缩峰值速度和舒张末期流速明显高于良性组,而阻力指数却低于良性组,而且这种差异均有显著性[19]。患侧肾动脉表现也与此一致。所以利用彩色多普勒超声诊断肾肿瘤的血流动力学改变特点,可以为临床提供很好的帮助[20]。
2.4 遗传学特点
RPA 的遗传学研究相对较少。有研究显示,RPA和PRCC 均来自近曲小管上皮细胞,细胞遗传学研究发现均表现有7 号及17 号染色体的扩增和Y 染色体的缺失[21]。但小体积的RPA 相比于PRCC 发生遗传学变异的细胞数量少得多[22]。
2.5 治疗方式及预后
目前对于术前肾脏肿瘤较小且影像学不能完全提示为恶性肿瘤的患者,考虑行保留肾单位的肿瘤切除术[23],术中行冰冻组织病理检查进一步确诊,根据病理结果再决定手术切除范围。RPA 虽为肾脏良性肿瘤,但也有研究发现肿瘤侵及肾周脂肪及周围淋巴结的报道[24]。所以对于RPA 术后的患者也应密切随诊。本例患者长期随访,预后良好,未发现局部复发及远处转移[25]。
RPA 的发病率较低,但随着人们体检意识的增强以及影像学技术的不断进步,其检出率在不断升高。目前,肾脏良性肿瘤的诊断主要依靠影像学检查,但有部分肾脏良性肿瘤缺乏典型的影像学表现,在肾癌术前鉴别时较难,容易出现误诊。肾部分切除术是肾脏良性肿瘤的理想治疗方式,对于有手术条件医院应首选肾部分切除术治疗。而对于术前肿瘤定性未明确者,术中可结合冰冻结果进一步确定肿瘤性质后再确定手术方式,以避免造成不必要的肾脏损伤。多数肾脏良性肿瘤术后远期预后良好。

