基于H6蛋白禽流感抗体间接ELISA检测方法建立与应用
王微,张霞,张人俊,胡安东,杨颖,温贵兰,文明







摘要:為临床H6亚型禽流感抗体检测提供技术支撑,通过克隆得到的H6亚型禽流感病毒H6基因并与原核表达载体pET32α连接,经PCR、酶切和测序鉴定后,转化大肠杆菌进行诱导表达和Western blotting鉴定,以纯化的表达产物为包被抗原,通过反应条件优化,建立检测禽流感病毒H6抗体的间接ELISA方法并对临床鸡血清样本检测评价。结果表明:该方法最佳反应条件是,包被抗原浓度为10 μg/mL,4 ℃过夜;5%脱脂奶粉37 ℃封闭 2 h;血清稀释度为 1∶20,37 ℃孵育30 min;酶标二抗稀释度为 1∶5000,37 ℃作用 30 min;显色时间为 37 ℃10 min。该ELISA方法可特异性检测 H6亚型禽流感抗体,阳性血清稀释至 1∶320 仍可检出,与其他禽病阳性血清均无交叉反应,检测变异系数均小于10%。以该ELISA方法检测2017年至2019年收集的1837份家禽临床血清样本,H6亚型禽流感抗体阳性率为10.45%。这些结果表明,建立的基于H6蛋白禽流感抗体间接ELISA检测方法,具有良好的特异性、敏感性、重复性和可靠性,能为H6亚型禽流感血清流行病学调查提供技术手段。
关键词:H6亚型禽流感;H6蛋白;间接ELISA方法;建立;应用
中图分类号:S852.65文献标识码:A
文章编号:1008-0457(2022)01-0021-007国际DOI编码:10.15958/j.cnki.sdnyswxb.2022.01.003
Establishment and Application of Indirect ELISA Detection Method for Avian Influenza Type H6 Antibody Based on H6 Protein
Wang Wei1,Zhang Xia2,Zhang Renjun2,Hu Andong3,Yang Ying1,4,Wen Guilan1,4,Wen Ming1,4*
(1.College of Animal Science,Guizhou University,Guiyang,Guizhou 550025,China;2.Guizhou Center of Animal Disease Prevention and Control,Guiyang,Guizhou 550008,China;3.Guizhou Vocational College of Agriculture,Qingzhen,Guizhou 551400,China;4.Guizhou Research Center of Engineering Technology for Animal Biological Products,Guiyang,Guizhou 550025,China)
Abstract:To provide technical support for clinical avian influenza subtype H6 antibody detection,the H6 gene of avian influenza virus was cloned and connected the prokaryotic expression vector pET32α.After identification by PCR,double enzyme digestion and sequencing,the positive recombinant plasmid was transformed into E.coli (DE3)for induction expression by IPTG and western blotting identification,with the purified expression product as the coating antigen,through optimization of reaction conditions,an indirect ELISA method for detecting avian influenza virus subtype H6 antibody was established and the clinical chicken serum samples were tested and evaluated.The results were showed as follows:the optimum reaction conditions of indirect ELISA,were 10μg/mL of coated antigen concentration and overnight at 4 ℃,5% skimmed milk powder sealed at 37 ℃ for 2 h,1∶20 of the serum dilution and 30 min of incubation at 37 ℃,1∶5000 of HRPIgG dilution and 30 min of the reaction time at 37 ℃,10 min of the TMB reaction time at 37 ℃.The ELISA method could specifically detect the AI H6 antibody but no cross reaction with other avian pathogen positive serum,and the positive serum was still positive after 1∶320 dilution.The variation coefficient of detection was less than 10%.The antibody positive rate was 10.45% against avian influenza subtype H6,which 1837 of serum samples were collected in poultry from 2017 to 2019.These results indicated that the indirect ELISA method based on H6 protein has good specificity,sensitivity,repeatability and reliability,which could provide technical means for serological investigation of avian influenza subtype H6.
Keywords:avian influenza type H6;H6 protein;indirect ELISA;establishment;application
禽流感是一种人兽共患传染病,由A型流感病毒引起,主要威胁和危害家禽养殖产业和人类健康安全。A型流感病毒属正黏病毒科成员,其基因组分节段、单股负链RNA。根据病毒囊膜蛋白即血凝素(HA)和神经氨酸酶(NA)抗原性不同,A型流感病毒可分为18个HA亚型和11个NA亚型,其中H5亚型和H7亚型属于高致病性禽流感病毒[12]。H6亚型虽属低致病性禽流感病毒,但在禽类中普遍存在,能跨越种间屏障进行传播,且容易与其他亚型禽流感病毒发生基因重组,形成新的高致病性禽流感病毒亚型如H5N1亚型、H5N6亚型禽流感病毒等,对家禽养殖产业和人类健康安全构成巨大的威胁[34]。目前检测禽流感抗体主要采用血凝与血凝抑制试验方法,也有H5亚型和H7亚型禽流感抗体ELISA检测方法,但尚未见到有关H6亚型禽流感抗体ELISA检测方法的研究报道。为此,本试验拟通过克隆H6亚型禽流感病毒H6基因并进行原核表达,以原核表达产物为包被抗原,建立检测H6亚型禽流感病毒抗体ELISA方法,以期为H6亚型禽流感流行病学调查和隐性感染监测提供有效的检测手段。
1材料与方法
1.1试验材料H6N6亚型禽流感病毒,由贵州省动物疫病与兽医公共卫生重点实验室保存;EcoliDH5α和pET32α(+),由贵州省动物疫病研究室保存;H6亚型AIV标准阳性血清(20191012)和阴性血清(20191020)、H5亚型AIV阳性血清(20190811)、H7亚型AIV阳性血清(20190618)和新城疫阳性血清(20191024),购自青岛立见诊断技术发展中心;待检鸡血清样本1837份,由省动物疫病预防控制中心采自全省9个市(州)养鸡场。
1.2主要试剂和仪器设备
DNA连接酶、限制性核酸内切酶、RNA提取试剂盒、RNA反转录试剂盒、BCA Protein Assay Kit、BSA、胎牛血清等,购自宝生物(大连)工程有限公司;PCRMix、DL2 000Marker、琼脂糖等,购自天根生化科技(北京)有限公司;纯化Ni柱,购自北京韦氏博慧色谱科技有限公司;脱脂奶粉、HRP标记山羊抗鸡IgG、Tween20、SDSPAGE凝胶配制试剂盒等,购自北京索莱宝科技有限公司;其他试剂,均为分析纯。
1.3目的蛋白表达、纯化与鉴定
1.3.1目的基因获取与表达质粒构建
参考GenBank上禽流感病毒H6基因序列(登录号KJ484613),利用Primer5.0软件设计H6基因特异性引物(H6F:5′GAATTCGAAGATGATTGCCATCATTATAATAACG3′[含EcoR I酶切位点]/H6R:5′CGGATCCTATACATCATACATTGCATTGA GC3′ [含Hind III酶切位点],预期扩增长度1714 bp,由上海英淮捷基有限公司合成)。鸡胚增殖病毒,收集尿囊液,以RNA提取试剂盒提取病毒RNA,反转录为cDNA,再以上述引物扩增目的基因,经琼脂糖凝胶电泳,回收目的基因,酶切并与同样处理的pET32α(+)连接,转化EcoliDH5α,提取重组质粒进行PCR、酶切和测定鉴定。
1.3.2目的蛋白表达、纯化与鉴定
取鉴定含H6基因的阳性重组质粒,转化BL21(DE3)大肠杆菌进行IPTG诱导表达,取4.5 h表达的细菌菌液,经超声波处理后收集离心沉淀物,适量PBS溶液悬浮,Ni柱纯化,收集纯化产物,透析袋反透析浓缩,以BCA Protein Assay Kit进行蛋白质含量测定和Western blotting鉴定。
1.4基于H6蛋白禽流感抗体间接ELISA检测方法的建立1.4.1间接ELISA操作步驟
以上述纯化并浓缩的表达蛋白溶液,以PBS稀释为10 μg/mL,取96孔酶标板,加入100 μL/孔,4 ℃孵育过夜,PBST液洗涤5次;加入5%脱脂奶粉200 μL/孔,37 ℃温箱封闭l h,洗涤5次;加入稀释待检血清100 μL/孔,37 ℃温箱孵育30 min,洗涤5次;加入HRP羊抗鸡抗体100 μL/孔,37 ℃温箱孵育30 min,加入显色液100 μL/孔,避光显色10 min,加入终止液50 μL/孔,酶标仪测定OD630值,判断和分析结果。
1.4.2间接ELISA反应条件优化
采用方阵滴定法,即取表达蛋白稀释成不同浓度后包被酶标板,以H6亚型标准阳性血清和阴性血清不同稀释度进行方阵滴定试验,测定OD630值,计算P/N值确定最佳抗原包被浓度和血清稀释度;以最佳抗原包被浓度进行包被,以不同温度和不同时间进行孵育,按照上述步骤进行ELISA检测,测定OD630值,计算P/N值确定最佳包被条件;以最佳抗原包被浓度和包被条件进行包被,以不同封闭液进行封闭2 h,按照上述步骤进行ELISA检测,测定OD630值,计算P/N值确定最佳封闭液;以上述最佳条件进行包被和封闭,开展酶标二抗浓度与最佳显色时间优化,确定间接ELISA检测方法的反应条件。
1.4.3间接ELISA临界值确定
按照上述优化的ELISA反应条件对已知H6亚型禽流感阴性血清15份进行检测,计算OD630值的平均值X和标准差SD,根据统计学计算方法,以OD630值≥X+3SD判为阳性,OD630值<X+3SD判为阴性。
1.4.4间接ELISA重复性、特异性和敏感性试验
取已知H6亚型禽流感阴性血清15份,每个样本作5个重复进行ELISA检测,测定其OD630值,计算其变异系数;取H6亚型AIV阳性血清和阴性血清、H5亚型AIV阳性血清、H7亚型AIV阳性血清和新城疫阳性血清进行适当稀释后进行ELISA检测,测定其OD630值,确定其反应特异性;以H6亚型AIV阳性血清作系列梯度稀释后进行ELISA检测,测定其OD630值,确定其反应灵敏度。
1.5基于H6蛋白禽流感抗体间接ELISA检测方法初步应用取本实验室近三年收集得到的全省各地部分规模养鸡场血清样本1837份(其中2017年505份、2018年608份和2019年724份),按照上述优化条件的ELISA进行禽流感H6亚型禽流感抗体检测,计算待检样本的H6亚型禽流感抗体阳性率。
2结果与分析
2.1重组H6亚型蛋白的表达与纯化鉴定
2.1.1重组H6亚型蛋白的表达
如图1所示,在预期位置出现明显的蛋白条带,重组目的蛋白分子量约为65 ku,说明目的蛋白能成功地得到表达,且表达产物主要存在于细菌的包涵体沉淀中。
2.1.2重组H6亚型蛋白的纯化鉴定
如图2所示,经镍柱纯化后Western blotting检测,重组蛋白能与His单抗产生特异性反应,说明表达的重组蛋白具有良好的抗体结合能力,可用于下一步间接ELISA检测方法的建立。
2.2基于H6蛋白禽流感抗体间接ELISA检测方法建立2.2.1间接ELISA反应条件优化
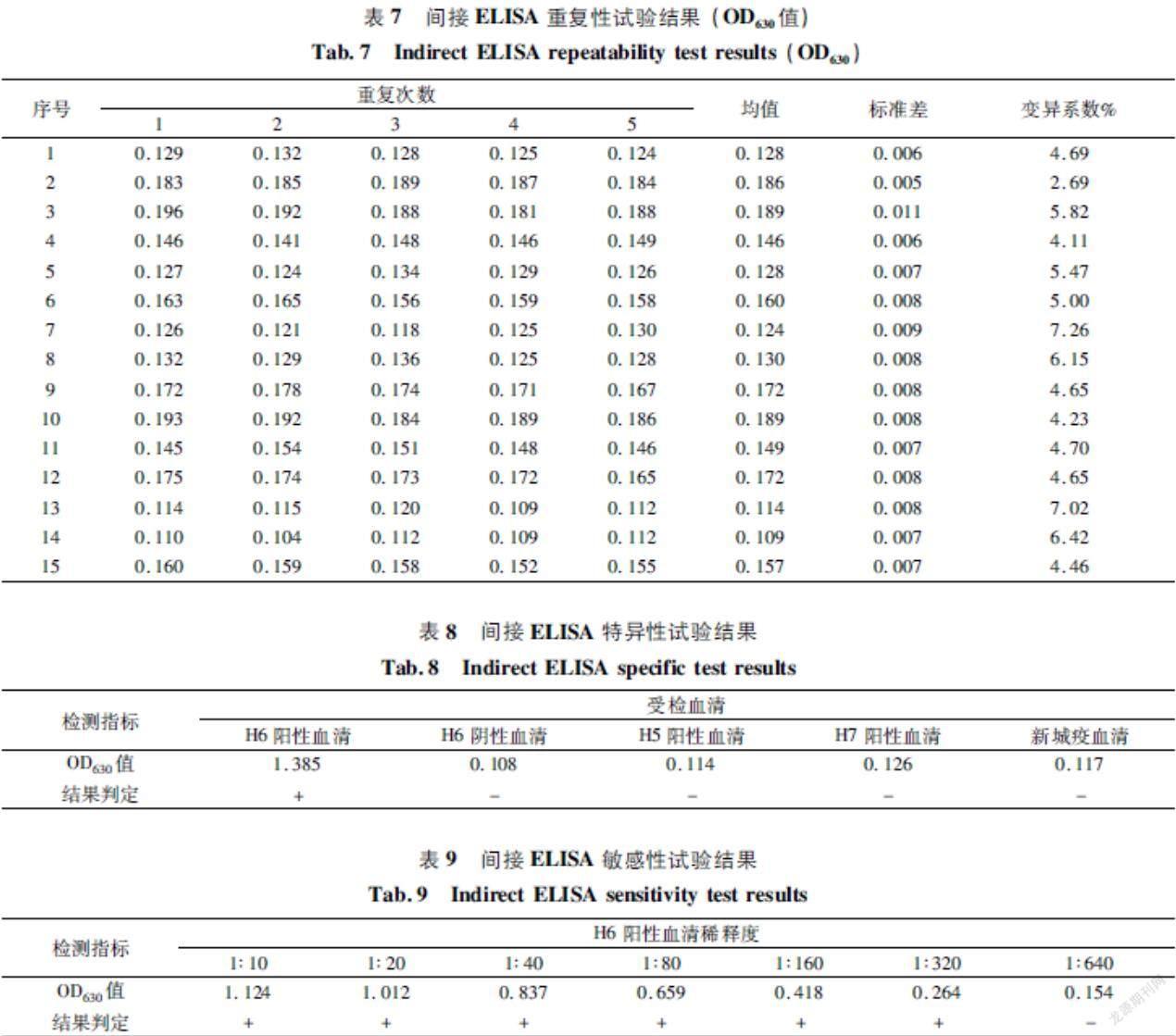
最佳包被抗原浓度与血清稀释度确定:如表1所示,当重组H6蛋白包被浓度为10.0 μg/mL、血清稀释度为 1∶20 时, P/N值为864最大。因此,确定最佳抗原包被浓度为100 μg/mL,血清稀释度为1∶20。
最佳抗原包被条件确定:如表2所示,当采用 4 ℃包被过夜时,P/N值为8.67最大。因此,确定最佳包被条件为 4 ℃过夜。
最佳封闭液确定:如表3所示,当采用 5%脱脂奶粉37 ℃封闭2 h时,P/N值为9.28最大。因此,确定最佳封闭液为5%脱脂奶粉。
最佳血清作用时间确定:如表4所示,当血清于37 ℃作用30 min 时,P/N值最大。因此,确定最佳血清作用时间为 37 ℃条件下30 min。
最佳酶标二抗浓度确定:如表5所示,当酶标二抗以 1∶5000稀释、37 ℃作用30 min时,P/N 值为9.11最大。因此,确定最佳酶标二抗稀释度为 1∶5000。
最佳显色时间确定:表6结果显示,当37 ℃避光显色10 min 时,P/N 值为8.81最大。因此,确定最佳显色时间为 37 ℃作用10 min。
2.2.2间接ELISA方法临界值确定
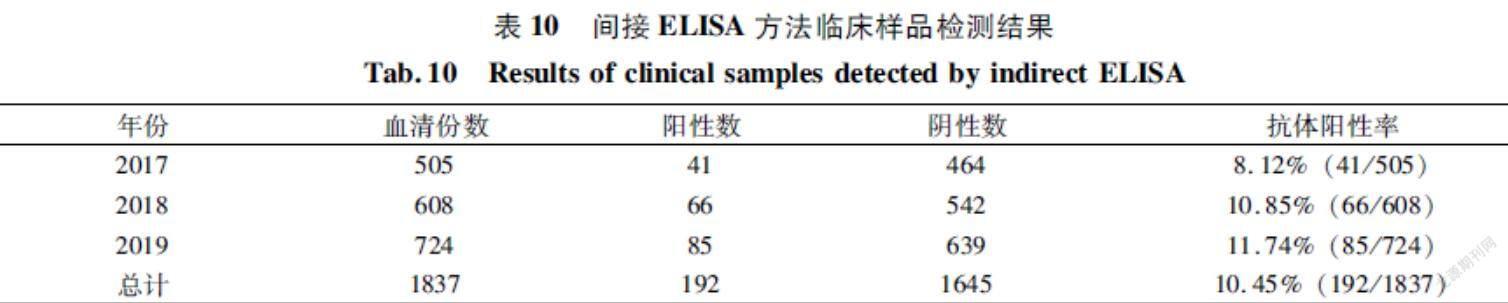
取已知H6亚型AIV阴性血清15份进行间接 ELISA检测,测定OD630值,计算得到平均值X和标准差SD分别为0.152和0.018,计算出基于H6蛋白间接ELISA方法的判定标准为:样本OD630值≥0.206判为阳性;样本OD630值<0.206判为阴性。2.2.3间接ELISA方法重复性、特异性和敏感性分析间接ELISA方法重复性分析:如表7所示,建立的间接 ELISA 方法对同一样本检测的变异系数均小于10%(2.69%~7.26%),说明建立的间接 ELISA 有良好的重复性。
间接ELISA方法特异性分析:表8结果显示,用建立的间接ELISA进行检测,H5亚型、H7亚型禽流感和新城疫阳性血清的OD630值均小于0206,且H6亚型禽流感阴性、阳性血清对照均成立,表明该ELISA方法与常见病原阳性血清无交叉反应,具有良好的特異性。
间接ELISA方法敏感性分析:如表9所示,建立的间接ELISA方法能检测到最高稀释度为 1∶320的 H6亚型禽流感阳性血清,说明建立的间接 ELISA 有良好的敏感性。
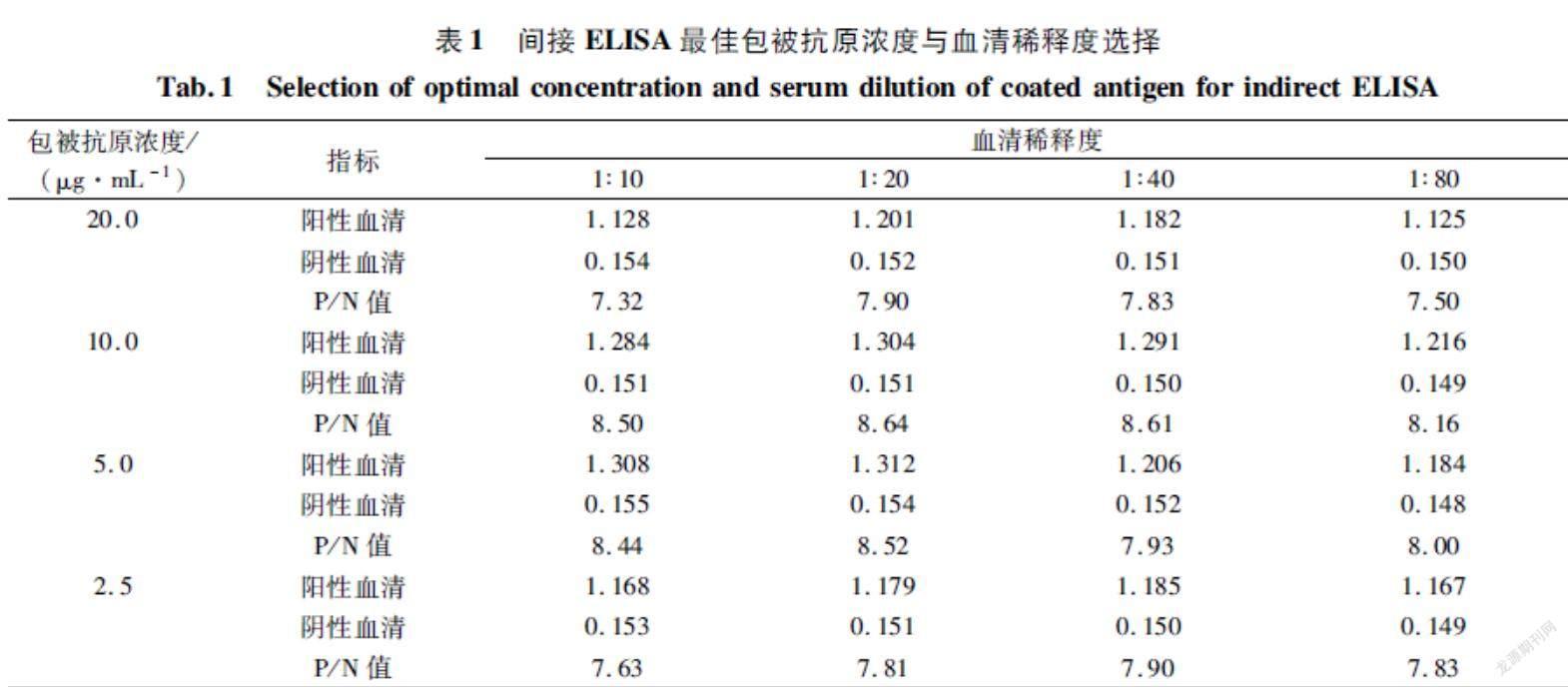
2.3基于H6蛋白禽流感抗体间接ELISA检测方法初步应用使用建立的间接 ELISA方法对2017-2019年采自贵州省部分地区家禽养殖场1837份临床血清样品进行H6亚型禽流感抗体检测(表10),样本阳性率平均为10.45%,说明本试验建立的间接 ELISA 方法能用于临床血清样本H6亚型禽流感抗体检测。
3结论与讨论
H6亚型禽流感病毒属于低致病性禽流感病毒,1965年首次在美国马萨诸塞州一个养殖场火鸡体内分离得到[5],随后在水禽、陆禽和家禽中发现[6]。H6亚型禽流感病毒在我国家禽中呈现快速增长趋势:1975-2000年,从我国香港地区家禽中先后分离得到H6N1、H6N2、H6N7和H6N9亚型禽流感病毒[7];2000-2010年,从我国南部和东部地区活禽交易市场家禽中分离出H6N1、H6N2和H6N6亚型禽流感病毒[89];2011年以后,在华南、华东和华中地区活禽交易市场先后分离到H6N6、H6N2和H6N6亚型禽流感病毒[1011]。这些调查结果说明,H6亚型禽流感病毒已在我国饲养家禽中普遍存在,因此必须加强H6亚型禽流感流行病学调查。
目前,动物疫病流行病学调查方法主要有描述流行病学调查方法、血清流行病学调查方法、分子流行病学调查方法等,其中血清流行病学调查方法具有敏感特异、简便经济、可靠安全等优点,广泛应用到兽医流行病学调查各个领域中[12]。在血清流行病学调查方法中,最常采用的是血凝抑制试验(HI)和酶联免疫吸附试验技术(ELISA),其中ELISA是目前运用最广泛的的一种病毒抗原与抗体检测技术,非常适合于大批量样品的血清学调查,结果易于分析,在禽流感的检疫、控制和扑灭中起着不可替代的作用,如针对H9亚型禽流感抗体[1314]、H7亚型抗体[1516]和H5亚型抗体[1718]建立的ELISA检测方法等,但目前尚未见到有关针对H6亚型禽流感抗体检测的ELISA方法。
本试验从H6N6亚型禽流感病毒毒株得到H6基因后,连接到原核表达载体pET32α并转化到大肠杆菌进行表达,经Westernblotting检测显示,表达的H6重组蛋白具有良好的反应原性,为建立检测H6亚型禽流感抗体的间接 ELISA 方法奠定了基础;以原核表达的H6重组蛋白为包被抗原,通过对抗原浓度、血清、酶标二抗稀释度与反应时间等条件进行优化,建立检测H6亚型禽流感抗体的间接 ELISA 方法;该方法能特异性检测禽流感H6亚型抗体,阳性血清稀释至 1∶320仍可检出,与其他病原阳性血清均无交叉反应,批内检测变异系数均小于10.00%,表明该方法具有敏感性高、特异性强、重复性好等优点,可应用于临床禽流感H6亚型抗体的检测。应用该ELISA方法对2017-2019年1837份鸡血清样本检测显示,H6亚型禽流感抗体阳性率从2017年的8.12%上升到2018年的10.85%,再上升至2019年的11.74%,说明H6亚型禽流感感染在饲养鸡群中呈现逐步上升趋势,应引起足够的重视。综上所述,本试验成功建立了可检测H6亚型禽流感抗体的间接ELISA方法,为临床H6亚型禽流感的血清流行病学调查提供了技术支撑。
参考文献:
[1]Fouchier R A,Munster V,Wallensten A,et al.Characterization of a novel influenza A virus hemaglutinin subtype (H16) obtained from blackheaded gulls[J].Journal of Virology,2005,79(5):28142822.
[2]Zhu X,Yu W,Mcbride R,et al.Hemagglutin inhomologue from H17N10 bat influenza virus exhibits divergent receptorbinding and pHdependent fusion activities[J].Proceedings of the National Academy of Sciences,2013,110(4):14581463.
[3]Shen Y Y,Ke C W,Li Q,et al.Novel reassortant avian influenza A (H5N6) viruses in Humans,Guangdong,China,2015[J].Emerging Infections Diseases,2016,22(8):15071509.
[4]Wei S H,Yang J R,Wu H S,et al.Human infection with avian influenza A H6N1 virus:an epidemiological analysis[J].The Lancet Respiratory Medicine,2013,1(10):771778.
[5]Downie J C,Laver W G.Isolation of a type A influenza virus from an Australian pelagic bird[J].Virology,1973,51(2):259269.
[6]Munster V J,Baas C,Lexmond P,et al.Spatial,temporal,and species variation in prevalence of influenza A viruses in wild migratory birds[J].PLoS Pathogens,2007,3(5):e61.
[7]Chin P S,Hoffmann E,Webby R,et al.Molecular evolution of H6 influenza viruses from poultry in Southeastern China:prevalence of H6N1 influenza viruses possessing seven A/Hong Kong/156/97 (H5N1)like genes in poultry[J].Journal of Virology,2002,76(2):507516.
[8]Huang K,Bahl J,Fan X H,et al.Establishment of an H6N2 influenza virus lineage in domestic ducks in southern China[J].Journal of Virology,2010,84(14):69786986.
[9]Zhao G,Lu X,Gu X,et al.Molecular evolution of the H6 subtype influenza A viruses from poultry in eastern China from 2002 to 2010[J].Virology Journal,2011,8(1):470478.
[10]Wang G,Deng G,Shi J,et al.H6 influenza viruses pose a potential threat to human health[J].Journal of Virology,2014,88(8):39533964.
[11]Li J,Quan C,Xie Y,et al.A sandwich ELISA for the detection of neuraminidase of avian influenza A(H7N9) virus[J].Journal of Virological Methods,2017,247:5860.
[12]劉秀梵.兽医流行病学[M].2版.北京:中国农业出版社,1999.
[13]Yang J M,Dai X G,Chen H J,et al.Development of blocking ELISA for detection of antibodies against H9N2 avian influenza viruses [J].Journal of Virological Methods,2016,229:4047.
[14]仉薇,侯力丹,宋洁,等.一种更灵敏的特异性检测H9亚型禽流感抗体的间接ELISA方法的建立[J].生物工程学报,2017,33(8):12531264.
[15]王洋,吴芷慧,薛春宜,等.应用跨膜区置换的血凝素蛋白建立H7N9禽流感病毒抗体间接ELISA检测方法[J].微生物学报,2017,44(12):28122821.
[16]Yu Y Y,Zhang X,Zhao B H,et al.A sandwich ELISA for the detection of neuraminidase of avian influenza A(H7N9) virus[J].Journal of Virological Methods,2017,247:5860.
[17]Pose A G,Rodríguez E R,Pieiro M J,et al.Quantitative ELISA sandwich for a new vaccine against avian influenza virus H5N1[J].Journal of Immunological Methods,2018,459:7075.
[18]黄璐,林一,王厚照,等.H5亚型禽流感病毒DASELISA检测方法的建立[J].泰山医学院学报,2020,41(1):913.

