睡眠调控与睡眠调节药物研究进展
崔素颖,秦 宇,张永鹤
(北京大学医学部学基础医学院药理学系,北京 100191)
从古希腊亚里士多德时代到20世纪初,大多数哲学家和医学家都认为睡眠只是外界感觉输入减少和大脑活动度降低的结果,即认为睡眠是觉醒的副产物,属于觉醒之后的被动过程。然而,随着研究人员在大脑中发现越来越多的“促睡眠神经元”和“促觉醒神经元”,这些神经元构成精密的睡眠-觉醒神经调控网络,并以此为基础调整机体新陈代谢、情绪重塑和认知体系时,人们逐渐意识到“睡眠被动学说”的不足,并开始接纳“睡眠主动学说”,即睡眠绝不仅仅是觉醒的附属物,而是维持人类生命不可或缺的、为了生存而演化的无意识的行为范式[1]。
随着人们生活节奏加快和工作压力激增,睡眠疾病已成为临床中最常见疾病,严重影响患者的身心健康,以及由此导致的意外伤害、工作效率低下也给社会带来了负面影响。但比较令人鼓舞的是,光遗传学实验技术、基因修饰动物模型以及人脑功能性成像技术的普及和应用,助推了睡眠医学研究的高速发展,使我们在时间和空间维度,更准确、更清晰、更精细地捕捉到“促睡眠神经元”和“促觉醒神经元”的生物学特性以及它们的运行模式,这也促进了睡眠疾病治疗药物的研发。近10年来,基于新机制、作用于新靶点的多种睡眠调节药物也陆续进入临床,用于治疗睡眠疾病。
本文基于近年来取得的睡眠医学研究进展,对睡眠-觉醒神经调控网络以及扰动该网络的昼夜节律机制、内稳态机制及睡眠调节药物的研究进展加以综述,旨在进一步了解“促睡眠神经元”和“促觉醒神经元”的生物学特性,以及这些神经元调控睡眠-觉醒行为的神经机制,并把握睡眠疾病治疗药物的研究动态,为睡眠疾病的病因学和治疗学研究提供可借鉴的资料。
1 睡眠-觉醒调控理论
1.1 睡眠-觉醒相位调节双过程模型
1982年,瑞士科学家 Alexander Borbély关于睡眠调控过程提出了“双过程理论模型”(twoprocess model)[2]。该理论模型认为,睡眠是昼夜节律系统(circadian rhythm,process C)与机体内稳态系统(sleep-wake homeostasis,process S)相互作用整合进而调控睡眠需求(sleep need)的结果。昼夜节律对睡眠-觉醒行为的调节反映外界环境因素对觉醒的需求,睡眠稳态调节反映机体内部因素对睡眠的需求。主要表现为睡眠和觉醒行为随昼夜变化而产生节律性振荡,而睡眠的时长和深度与先前的觉醒时间相关[3]。
1.1.1 睡眠-觉醒行为的昼夜节律调节
机体可根据外界环境灵活调节昼夜节律,如倒班、倒时差,这是机体适应外部环境的表现。Scammell等[4]发现,机体的睡眠-觉醒调节系统和生物钟系统之间存在广泛的、间接的神经纤维投射,并揭示了在外部环境诱因下,机体的睡眠-觉醒行为发生昼夜节律倒换的神经生物学机制。视交叉上核(suprachiasmatic nucleus,SCN)神经元被认为是中央生物钟核心脑区,这些神经元接受来自视网膜光敏细胞的兴奋性传入,其电活动呈现昼夜节律震荡。但是SCN的神经元和“促觉醒神经元”、“促睡眠神经元”之间的神经纤维联系较少,提示由SCN主导的生物钟信息可能并不直接传递给睡眠-觉醒调控系统[5]。研究人员在外部环境变化诱导的睡眠-觉醒昼夜节律倒换的实验动物中发现,SCN神经元的电活动始终与外界光刺激有关,而“促觉醒神经元”和“促睡眠神经元”的活动始终与动物的觉醒和睡眠状态有关[6]。这进一步提示SCN与睡眠-觉醒调控系统之间的联系并不是单突触连接。由此推论,在倒班、倒时差等睡眠-觉醒昼夜节律倒换过程中,机体需要一个“转换系统”重置昼夜节律对睡眠-觉醒行为的调节。后续的神经解剖学研究提示,下丘脑背内侧核(dorsal medial hypothalamus,DMH)的神经元可能是这个“转换系统”的一个中转站,因为DMH神经元接受来自SCN直接通路的抑制性调控和来自SCN间接通路的兴奋性调控。此外,DMH神经元还分别通过兴奋性输出和抑制性输出,对“促觉醒神经元”和“促睡眠神经元”进行差异化调控[7]。DMH神经元的损伤或功能缺失,可以引起实验动物睡眠-觉醒等多种生物功能的节律紊乱,同时伴有“促觉醒神经元”和“促睡眠神经元”的“失灵”[8]。
基于上述发现,研究人员提出睡眠-觉醒昼夜节律倒换的神经调控理论(图1)。该理论认为,对于夜行性动物(如鼠类),白天外界光照信息激活SCN神经元,SCN通过直接通路的抑制性纤维投射,抑制DMH神经元,此时觉醒发生系统功能下调,睡眠发生系统功能上调,机体处于睡眠状态;夜间,因SCN失去光信号的刺激作用,传递与日间相反的信息,机体进入觉醒状态。然而,对于昼行性动物,SCN对DMH的输出主要是通过途经室旁下核或SCN内部的间接通路完成,此时DMH最终接受兴奋性传入,动物表现出相反的睡眠-觉醒昼夜节律[9-10]。正是由于SCN的生物钟系统对睡眠-觉醒系统存在多种调控路径,才保证了机体根据外界环境的变化及时调整睡眠-觉醒节律。但该理论还存在尚未解释清楚的问题。例如,机体如何切换SCN至DMH的直接通路和间接通路?分别投射至“促睡眠神经元”和“促睡眠神经元”的DMH神经元的生物学特点是什么?以及光信号对睡眠-觉醒昼夜节律的调节是否还有其他调节通路呢?针对后面的问题,复旦大学黄志力课题组发现,皮质下视觉反射中枢上丘的γ-氨基丁酸(γ-aminobutyric acid,GABA)能神经元接受来自视网膜神经节细胞的信号,并传递给腹侧背盖区多巴胺能神经元,这条通路在小鼠急性黑暗暴露诱发的促觉醒效应中发挥了关键性作用[11],这有望为光照异常导致的昼夜节律紊乱性睡眠疾病的发病机制提供新见解。
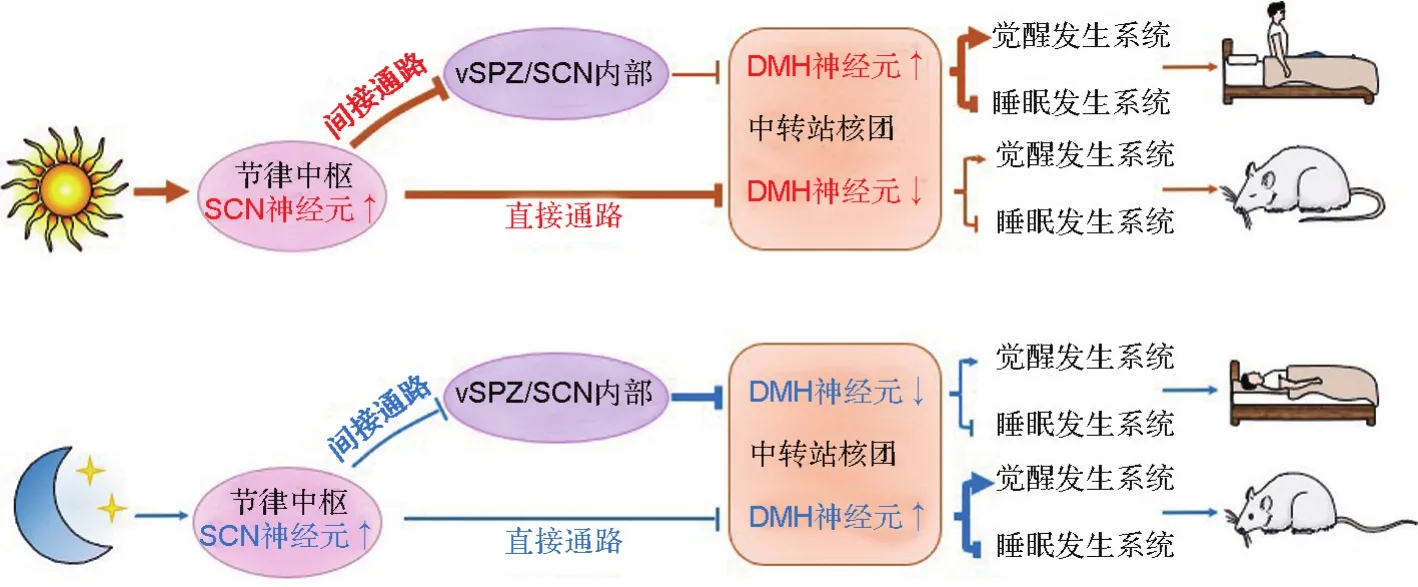
图1 睡眠-觉醒昼夜倒换神经调控示意图.SCN:视交叉上核;vSPZ:腹侧脑室下区;DMH:下丘脑背内侧核;:兴奋增强;:兴奋减弱;:抑制增强;:抑制减弱.
1.1.2 睡眠-觉醒行为的稳态调节
睡眠稳态过程是指随觉醒时间延长,睡眠压力逐渐增加成为“睡眠负荷”,而为了减轻“睡眠负荷”,机体会主动进入睡眠状态的调节过程。因觉醒时间延长(如睡眠剥夺)引起的睡眠负荷积聚,需通过后续睡眠时间的延长或睡眠深度的提高(慢波活动的强化)得以消除。“睡眠负荷”可能是一种化学物质,如腺苷、褪黑素(melatonin,MT)或前列腺素D2,也可能是一种生物学效应,如神经突触稳态、DNA损伤和蛋白质磷酸化水平等[12-14]。
虽然,学术界尚未诠释“睡眠负荷”的全貌,但是对“睡眠负荷”应有的特性达成了一定共识:①“睡眠负荷”在觉醒状态和睡眠状态下,发生动态变化的方向是相反的;②“睡眠负荷”需要有状态依赖性属性,即变化幅度随睡眠或觉醒维持时间的推移而增加;③“睡眠负荷”触发睡眠的生物学效应是“全或无”过程,即觉醒期间积攒的“睡眠负荷”并不是时时刻刻触发睡眠,而是需在特定的时间点,以非常强有力的作用方式让机体迅速进入睡眠状态。
腺苷作为ATP的最终代谢产物,是第一个被广泛认可的“睡眠负荷”。在20世纪90年代,McCarley团队发现,实验动物基底前脑(basal forebrain,BF)和大脑皮质中腺苷含量随觉醒时间的延长而增加,随睡眠时间的延长而减少,并证实腺苷通过腺苷A1受体抑制“促觉醒神经元”,通过A2受体兴奋“促睡眠神经元”[15-17]。在此基础上,中国科学院神经科学研究所徐敏研究团队利用新型遗传编码的腺苷探针,进一步发现BF脑区腺苷的释放主要依赖于谷氨酸能神经元的活动,若选择性损伤这些谷氨酸能神经元,睡眠的内稳态功能会严重受损[18]。上述研究解释了“睡眠负荷”腺苷在“特定时间”启动睡眠的可能性,提示谷氨酸能神经元接受某种信息(如生物钟信息),在“指定时间”活动度增加,引起大量腺苷的同步性释放,继而触发睡眠。但上述推论还有待于进一步验证。
1.2 睡眠-觉醒跷跷板开关模型
2005年,美国哈佛大学医学院Saper研究团队提出“睡眠-觉醒跷跷板开关理论模型”(简称“跷跷板模型”,flip-flop model)[19]。该理论模型的核心观点为睡眠和觉醒之间的更替是由体内睡眠发生系统和觉醒发生系统交替兴奋而引起的,这种交替兴奋的解剖学结构基础是这2个系统之间相互存在抑制性纤维投射。因此,当一个系统的活性被触发时,就会抑制另一个系统的活性并解除另一个系统对自身的抑制,继而进入正反馈循环,启动并维持某一种状态(睡眠或觉醒)。该模型下,睡眠和觉醒的转换需要依赖于特定的“开关”,该“开关”需要在“指定时间”触发睡眠发生系统或觉醒发生系统,以此实现状态转换。
在“跷跷板模型”提出之初,学术界对“睡眠发生系统”和“觉醒发生系统”以及“开关”的概念十分模糊,也较为局限。当时,Saper研究团队认为,在啮齿类哺乳动物中,睡眠发生系统可能是下丘脑腹外侧视前核(ventrolateral preoptic nucleus,VLPO)的甘丙肽和GABA神经元;觉醒发生系统可能是脑干网状上行激活系统,包括蓝斑核的去甲肾上腺素能神经元、中缝核的5-羟色胺能神经元、腹侧被盖区的多巴胺能神经元、脑桥被盖核和背侧被盖核的乙酰胆碱能神经元,此外还有下丘脑背侧被盖核的组胺能(histamine,H)神经元,BF的乙酰胆碱能神经元等;而“觉醒开关”是下丘脑穹隆周核的促食欲素能(orexin,OX)神经元。
随后睡眠医学研究工作者围绕“跷跷板模型”开展了深入细致的研究,不仅找到了支持该理论模型的实验室依据,还借助化学遗传、光遗传、钙成像实验技术,发现了全新的参与睡眠-觉醒调控的神经元和物质。美国加州伯克利大学Dan研究发现,腹侧巨细胞网状核中GABA能神经元和杏仁核中神经紧张素阳性的GABA能神经元通过抑制脑干的单胺系统,促进非快眼动(non-rapid eye movement,NREM)睡眠的发生[20-21]。美国杜克大学Wang课题组发现,下丘脑视上核团中分泌抗利尿激素的一组神经元可被麻醉剂激活,并促进NREM睡眠,该项研究支持了麻醉剂的药理作用依赖于内源性睡眠调节通路的假说[22]。陆军军医大学胡志安课题组于2018年在Science发表文章,提出丘脑室旁核的谷氨酸能神经元在觉醒控制中发挥重要作用[23]。复旦大学黄志力课题组发现了尾壳核、腹侧苍白球、伏隔核、吻内侧被盖核和嗅结节等参与睡眠与觉醒调控的新核团[24-25]。
此外,近几年的睡眠医学研究整合了睡眠“跷跷板模型”和“双过程理论模型”。笔者认为,“跷跷板模型”的“开关”对应“双过程理论模型”的“稳态调节”。“睡眠开关”是“睡眠负荷”,由此想到,体内可能还有对应“觉醒开关”的“觉醒负荷”,撬动机体从睡眠中快速苏醒,如饥饿感、焦虑感和求知欲等。此外,“跷跷板模型”中“开关”发挥作用的“指定时间”对应“双过程理论模型”的昼夜节律调节,因此“开关”必须接受来自体内生物钟的信息,使机体的功能同步于外界环境的变化(图2)。
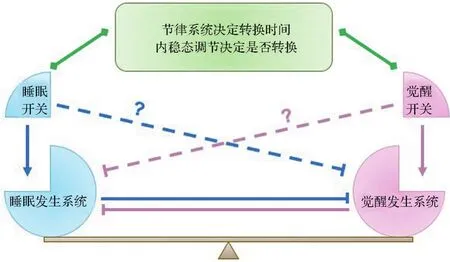
图2 睡眠-觉醒调控理论示意图.:调控作用;:兴奋作用;:抑制作用.
至今科学家已经发现20余个促觉醒相关脑区和近10个促睡眠相关脑区。但是对绝大多数这些脑区的“促觉醒神经元”和“促睡眠神经元”进行干预(损毁、药理学方法、光遗传学激活或抑制等)只影响觉醒或睡眠状态的水平(时间和程度),并不会诱发觉醒或睡眠状态的绝对缺失,提示这些睡眠-觉醒相关神经元发挥作用的方式极有可能是一组联动的、互补的协同效应。以觉醒为例,胡志安教授认为觉醒是觉醒发生系统及其支配的功能网络共同活动的结果。促觉醒神经元可进一步细分为觉醒发生的“核心组构”和“辅助组构”,“核心组构”决定觉醒的基础水平,为大脑核心功能网络提供持续的兴奋性输入,保证大脑不会宕机;而“辅助组构”主要协助大脑核心功能的合理有效运行[26]。睡眠是有别于觉醒状态的另一种大脑工作模式,因此睡眠发生系统也极有可能通过影响大脑核心功能网络,对大脑核心功能起不可忽视的关键作用,这主要体现在睡眠对记忆的分选作用和对情绪的安抚作用[27-28]。
近年来,随着神经科学相关研究技术的发展和进步,已经确认了多个可调控睡眠的重要核团,也发现了一些重要的睡眠-觉醒调控的分子生物学机制,但是,至今对“为什么睡觉?”这一问题仍知之甚少。
2 睡眠调节药物
临床常见的睡眠疾病包括失眠、睡眠呼吸暂停、日渐过度思睡和猝倒等。睡眠疾病的治疗药物分为促眠药和促醒药,主要作用于GABA系统、褪黑素系统、促食欲素系统、组胺系统和单胺系统发挥治疗作用。
2.1 作用于GABA系统的睡眠调节药物
自1958年GABA被认定为抑制性神经递质以来,科研人员已经发现在中枢神经系统中超过1/3的神经元通过GABA进行信号传递。GABA系统紊乱与多种神经系统疾病相关。GABAA受体是配体门控氯离子通道复合物,由α,β和δ等多个不同亚单位组装成五聚体,其中各亚单位又细分为不同亚型,例如α亚单位有α1~α6 6个亚型。这提示GABAA受体在不同脑区、不同神经元、同一神经元的不同部位以及不同刺激因素下可能呈现不同组装模式。
除了具有GABA结合位点外,GABAA受体还具有非常重要的苯二氮(benzodiazepine,BDZ)类催眠药的结合位点GABAA-ω1和GABAA-ω2。GABAA-ω1受体被激活可发挥催眠和抗焦虑作用,而GABAA-ω2受体被激活则出现肌松和认知记忆受损等效应。作为GABAA受体的正向调节剂,BDZ类药物作用于GABAA受体的BDZ结合位点,使GABA与GABAA受体的亲和力增强,更有效地触发氯离子通道开放,引起细胞膜超极化,产生中枢抑制作用,进而增强睡眠发生系统(如VLPO核团)对觉醒发生系统(如脑干网状系统)的GABA能抑制性输入,同时亦在皮质和丘脑等脑区增强GABA的作用,从而发挥催眠作用。然而,这些药物并不会精准打击睡眠-觉醒调节通路,而是广泛地作用于含有GABAA-ω1和GABAA-ω2结合位点的脑区,诱发许多不良反应。BDZ类催眠药对短期失眠效果较好,可缩短入睡潜伏期,减少觉醒次数,延长睡眠总时间,但缩短快眼动(rapid eye movement,REM)睡眠和慢波睡眠(slow wave sleep,SWS)睡眠,但长期使用可产生依赖性和成瘾性。
20世纪60年代以后,BDZ类催眠药作为常规首选药物应用于临床失眠症的治疗,但由于其对GABAA-ω1和GABAA-ω2受体亚基无选择性,导致不良反应时有发生,促使后续的药物研发更加注重于具有高选择性且不良反应更少的镇静催眠药。由此,便出现了新型非苯二氮类催眠药(Z-drug)。Z-drug选择性作用于GABAA-ω1结合位点,而对GABAA-ω2无影响(即无认知和记忆功能方面的不良反应)。临床上常用的Z-drug主要有唑吡坦、扎来普隆和佐匹克隆等,具有起效快、对循环和呼吸系统不良反应少等特点,同时不会引起认知和精神运动障碍,反跳现象轻微。但Z-drug依然具有药物成瘾风险,尤其在精神疾患和药物滥用人群中,其成瘾风险显著增加[29]。
自2018年开始,Nature相继报道研究结果解析了不同亚型GABA受体的三维空间结构[30-31]。研究人员采用低温电镜技术捕捉到地西泮结合至GABAA受体(α2β2δ和α1β3γ2亚型)后呈现的“活化态”面貌,并阐释了氟马西尼竞争性拮抗地西泮的分子动力学过程[32-33]。另有研究表明,呈现βαδββ排列的突触外GABAA受体中含有一个组胺结合位点,提示体内的组胺和GABA 2种递质可能共同调节GABAA受体[34]。正如作者提到“GABAA受体的差异化组装是调节GABAA受体的生理学和药理学的普遍机制”,当我们获悉睡眠-觉醒调节通路上的GABAA受体组装模式,并让药物精准打击具有该模式的受体时,可能会解决GABAA受体正向调节剂面临的多个临床痛点。上述研究有望为以GABAA受体为靶点的药物设计提供重要的理论依据,其中解码GABAA受体的不同组装模式与GABAA-ω1和GABAA-ω2药物结合位点之间对应关系,将会成为非常关键的问题。
GABAB受体激动剂用于治疗发作性睡病的夜间睡眠紊乱和猝倒。作为γ-羟丁酸的钠盐,羟丁酸钠作用于GABAB受体,通过抑制去甲肾上腺素能神经元、多巴胺能神经元和丘脑皮质神经元,产生中枢抑制作用。羟丁酸钠可显著延长深睡眠时间,提高睡眠质量,该效应确保机体在次日白天提高清醒度。羟丁酸钠在发作性睡病中的成功应用为基于睡眠内稳态调控理论治疗觉醒不足的临床实践奠定了可行性基础。在2021年,羟丁酸钙镁钾钠(JZP-258)和羟丁酸钠控释片(FT218)相继获得了美国食品药品监督管理局(FDA)的新药批复和临床试验申请。这些新药可改善羟丁酸钠的药动学特性,降低高钠引起的心血管风险。这些药物的成功上市提示,以GABAB受体为靶点的、增加深睡眠的药物可能对发作性睡病具有独特的治疗作用。近年来,对GABAB受体的结构解析也将有助于基于该靶点的新药研发[35-36]。
2.2 作用于褪黑素系统的睡眠调节药物
目前获批上市的MT受体激动剂有雷美替胺(ramelteon)、特斯美尔通(tasimelteon)和阿戈美拉汀(agomelatine),均属于促眠药。MT受体激动剂作用于SCN脑区神经元上的MT1和MT2受体(褪黑素受体),阻断光信号诱发的促觉醒作用,同时调整机体的生物钟使其同步于外界昼夜节律,在时差反应、倒班等特殊环境下,促使机体的睡眠-觉醒节律快速适应环境变化。在下午或晚上服用MT或MT受体激动剂可提前睡眠-觉醒时相,晨服则可推迟睡眠-觉醒时相。一项综合13个临床试验、涉及近6000例患者的荟萃分析评估了雷美替胺的效应和安全性,结果表明该药可显著缩短主观睡眠潜伏期,增加睡眠质量,但对主观总睡眠时间无显著作用,唯一显著的不良反应为思睡[37]。特斯美尔通是针对昼夜节律失调性睡眠觉醒障碍研制的药物。在特斯美尔通的Ⅱ期和Ⅲ期临床试验中,受试人员因接受提前5 h的睡眠-觉醒时间安排导致入睡困难,而睡前服用特斯美尔通可缩短睡眠潜伏期、改善睡眠效率和睡眠维持,且无明显的副作用[38]。阿戈美拉汀相较于前2种的独特之处在于其同时拮抗5-HT2受体,兼有抗抑郁的作用,因而临床上可用于治疗伴有昼夜节律紊乱的抑郁症。总体来看,MT受体激动剂对不同原因引起的睡眠疾病均有一定的调节作用,尤其是对睡眠节律障碍的改善,包括睡眠位相滞后障碍和时差反常、倒班作业引起的睡眠疾病。尽管这些药物的促眠作用比BDZ药物弱,但由于其不影响学习、记忆和精细运动功能,并且成瘾性低,可能更适用于失眠症的长期治疗。
最近研究提示,MT1和MT2受体在睡眠调节中可能具有不同的作用。MT1基因敲除小鼠的NREM睡眠增加,REM睡眠减少,而MT2敲除小鼠则表现为NREM睡眠减少。MT1和MT2受体在睡眠-觉醒相关脑区中的分布不同,MT1受体主要位于蓝斑核、下丘脑外侧等REM睡眠相关脑区,MT2受体则位于网状丘脑等NREM睡眠相关脑区。因此,MT1受体可能主要参与REM睡眠调节,而MT2受体主要参与NREM睡眠的调节[39]。由于目前使用的褪黑素受体激动剂对MT1和MT2并无选择性,因而这类药物可助于维持睡眠结构的稳定性。但从另一个角度来看,MT受体激动剂无法对REM睡眠和NREM睡眠进行差异化调节,这促使我们思考是否可以单独针对MT1或MT2受体研制药物,用于临床不同睡眠结构障碍的治疗。
近几年对MT1和MT2受体的结构解析加速了MT1或MT2选择性激动剂的研发工作。2019年,Cherezov研究团队采用X射线自由电子激光技术,揭示了人MT1和MT2受体的三维结构差异。他们发现MT1的“药物结合口袋”大于MT2,导致大分子化合物对MT1受体显示出更高的亲和力[40-41]。在此基础上,采用虚拟分子对接技术,成功找到了具有新颖拓扑结构的选择性MT1受体可逆激动剂UCSF7447和UCSF3384。在黄昏给予小鼠这些MT1选择性激动剂,可导致小鼠的昼夜节律时钟提前1.5 h,该作用在MT1敲除小鼠中被消除,但在MT2敲除小鼠中依然保留[42]。上述研究为选择性MT受体激动剂的研制工作提供了坚实的理论基础。
2.3 作用于促食欲素系统的睡眠调节药物
2022年9月,斯坦福大学的埃马纽埃尔·米格诺(Emmanuel Mignot)和日本筑波大学的柳沢正史(Masashi Yanagisawa)因发现发作性睡病的发病机制获得了“2023年科学突破奖”。自1998年这2位科学家独立发现促食欲素系统功能缺失在发作性睡病中的关键作用,到近年3个促食欲素受体拮抗剂苏沃雷生(suvorexant)、莱博雷生(lemborexant)和达利多雷生(daridorexant)的相继问世,促食欲素在睡眠-觉醒调节中的作用一直备受关注。
OX是由下丘脑外侧穹隆周核神经元分泌的神经肽,并作用于2个兴奋性G蛋白偶联受体——OX1型受体(orexin 1 receptor,OX1R)和OX2R。研究表明,OX2R在睡眠调节中起主导作用,而OX1R对睡眠诱导的贡献甚小,但其可与OX2R协同调节REM睡眠[43]。目前,获批上市的苏沃雷生、莱博雷生和达利多雷生均是OX1R/OX2R竞争性双重拮抗剂。失眠患者的循证医学研究也证实了在客观睡眠参数上OX1R/OX2R双重拮抗剂的有效性,包括睡眠效率、总睡眠时间和入睡后觉醒的相关指标。并且这些药物没有显示出对记忆和认知的副作用,最常见的不良反应是嗜睡、梦境异常、疲劳和口干[44]。
仅从睡眠-觉醒调节考虑,OX2R似乎是更为理想的干预靶点。事实上,选择性OX2R拮抗剂的研发已进入临床试验阶段[45-46]。结果显示,OX1R/OX2R双重拮抗剂和选择性OX2R拮抗剂均可以延长健康受试者的睡眠时间,但对失眠患者睡眠结构的影响不同。OX1R/OX2R双重拮抗剂主要延长失眠患者的REM睡眠时间,而OX2R选择性拮抗剂对NREM睡眠和REM睡眠时间均有延长作用[47]。陆林院士曾提出“促食欲素受体将会成为多种精神疾病的治疗靶点”,并陈述了促食欲素受体拮抗剂在失眠、抑郁症、焦虑症和药物成瘾中的应用进展[48]。促食欲素受体拮抗剂之间的细微差异以及这些药物在不同疾病中的应用,使我们更加谨慎对待患者睡眠结构的表型分析,并对精神疾患共病性睡眠疾病的诊治提出了更高的要求。
另一方面,促食欲素替代品和促食欲素受体激动剂的促觉醒作用也受到了广泛关注。在促食欲素替代治疗中,最棘手的问题是促食欲素替代品难以透过血脑屏障进入中枢分布。发作性睡病动物模型研究结果提示,口服或静脉注射促食欲素均无效,只有鞘内注射或吸入性给药方案才能缓解症状[43]。因此,基于小分子化合物的促食欲素受体激动剂逐渐成为研发重点。尽管第一款OX2R激动剂YNT-185在临床试验中夭折,但对该化合物的研究首次证实了OX2R激动剂在Ⅰ型发作性睡病中的治疗作用[49]。由武田制药研发的OX2R选择性激动剂TAK-925(静脉输注剂型)目前正在Ⅰb期临床试验中开展对特发性嗜睡患者的安全性和耐受性评价,其口服剂型TAK-994也已进入Ⅱ期临床研究并被美国FDA授予突破性疗法认定,预期用于治疗Ⅰ型发作性睡病和日间过度嗜睡[50-51]。这些药物的研制有望在发作性睡病和特发性过度睡眠治疗中提供新的解决方案。
2.4 作用于组胺系统的睡眠调节药物
第一代组胺H1受体阻断剂,如苯海拉明和多西拉敏具有明显的中枢镇静催眠作用,这些药物可以缩短入睡潜伏期,减少睡眠中觉醒次数。近几年,具有抗组胺作用的抗精神疾病药物也逐渐应用于失眠障碍的治疗,如多塞平、米氮平、曲唑酮和喹硫平等,小剂量服用该类药物可产生与阻断H1受体有关的镇静催眠作用。
哌托生特(pitolisant,替洛利生/Wakix)为H3受体拮抗/反向激动剂,是一种新型强效促觉醒剂。哌托生特可通过拮抗组胺H3受体的固有活性,减少组胺H3受体对组胺释放的负性调节,甚至促进组胺释放,增强脑部组胺能神经元的活性,表现出显著的促觉醒作用。哌托生特于2019年被美国FDA批准用于治疗发作性睡病成人患者的白天过度嗜睡和猝倒。此外,哌托生特还具有抗疲劳作用和改善认知功能的潜能,使得哌托生特在一些特殊活动如轮班、倒班以及部分军事活动中具有一定的应用潜力。另一种H3受体反向激动剂SUVN-G3031尚处于Ⅱ期临床试验阶段[52]。非临床研究表明,SUVNG3031具有促觉醒作用,且可增加实验动物大脑皮质的乙酰胆碱、组胺、多巴胺和去甲肾上腺素水平,但并不会升高纹状体及伏隔核中的多巴胺水平,提示该药物的成瘾风险较低[53]。这与以单胺转运体为靶点的传统促觉醒药(如苯丙胺类)有显著差别,也是这类药物的潜在优势。
2.5 作用于单胺系统的睡眠调节药物
此类促醒药多数作用于多巴胺和去甲肾上腺素转运体,通过抑制单胺类神经递质的再摄取发挥中枢兴奋作用。传统的单胺类促醒药为苯丙胺类似物,如苯丙胺、甲基苯丙胺和哌甲酯。近年,新获批的单胺类促醒药有莫达非尼(modafinil)、阿莫达非尼(armodafinil)和索安菲特(solriamfetol,JZP-110)。这些促醒药主要用于治疗中枢性过度睡眠,如发作性睡病、特发性过度睡眠、Kleine-Levin综合征以及药物或毒品引起的过度嗜睡等,并可有效缓解日间过度思睡。
莫达非尼与多巴胺转运体结合的亲和力较低,因此其药理作用较为温和且药物依赖及滥用的风险较低。阿莫达非尼是外消旋莫达非尼的R-对映体,具有更长的半衰期,最近也被美国FDA批准用于治疗发作性睡病相关的日间过度思睡,以及治疗经鼻持续气道内正压通气治疗者的残余嗜睡和轮班工作的嗜睡[54]。莫达非尼的促醒作用机制尚未完全阐释,可能与其调节多种神经递质和神经肽有关,如谷氨酸、GABA、5-羟色胺、H和OX等[55]。此外,莫达非尼也作为促认知剂在治疗认知缺陷相关疾病方面显示出积极的治疗效果,其中包括对工作记忆、情景记忆以及其他依赖于前额叶皮质和认知调控过程的改善[56]。索安菲特是一种多巴胺/去甲肾上腺素再摄取抑制剂,其促觉醒作用机制似乎与调节睡眠-觉醒的其他神经递质受体(如组胺或食欲素受体)无关,同时因其不释放单胺类物质而与苯丙胺类兴奋剂有所区别。索安菲特于2019年被美国FDA批准用于治疗伴有发作性睡病或阻塞性睡眠呼吸暂停的成人患者[57]。
此外,尚有几个基于该机制的药物已进入临床试验阶段。瑞波西汀(reboxetine,AXS-12)是高选择性、强效去甲肾上腺素再摄取抑制剂。瑞波西汀具有抗抑郁、促觉醒、维持肌张力和增强认知等药理作用,最初获批的适应证为抑郁症。研发人员基于瑞波西汀对去甲肾上腺素系统独有的强效作用,以“老药新用”思路,将研发重点切换至发作性睡病。2020年,瑞波西汀获得了美国FDA颁发的发作性睡病突破性疗法认定,但随后美国FDA又批准了哌托生特用于治疗发作性睡病患者的猝倒,因而取消了对瑞波西汀的突破性疗法认定。在促食欲素缺乏导致的发作性睡病小鼠模型中,瑞波西汀可以显著降低猝倒发生率[58]。纳入21例发作性睡病患者的多中心Ⅱ期临床试验结果表明,瑞波西汀与安慰剂相比显著降低了治疗期间(2周)平均每周的猝倒发作次数,显著改善患者日间过度思睡症状,同时改善了认知功能。该试验中,瑞波西汀的耐受性良好,最常见的不良反应是焦虑、便秘和失眠[59]。
THN102是另一个进入临床试验阶段的促醒药。THN102是莫达非尼和氟卡尼(flecainide)的组合制剂。氟卡尼是一种星形胶质细胞连接蛋白抑制剂。在临床前研究中,氟卡尼增强了莫达非尼对野生型小鼠的促醒和促认知作用,而莫达非尼和氟卡尼联合用药减少了OX敲除小鼠直接过渡到REM睡眠的次数和持续时间,提示联合用药方案可能会改善发作性睡病的睡眠结构异常[60]。但是,对发作性睡病伴或不伴猝倒的成年人开展的Ⅱ期临床试验结果表明,THN102与莫达非尼单独治疗相比,疗效并无差异,因此针对发作性睡病的THN102研发暂时被搁置[61-62]。尽管THN102的新药研发历程不尽人意,但是“促醒剂+星形胶质细胞连接蛋白抑制剂”的组合模式给科研工作者带来新的启发。考虑到星形胶质细胞和小胶质细胞可能在睡眠期间扮演“大脑清道夫”的角色[63-64],“睡眠调节药+胶质细胞调节剂”的独特组合模式有望为神经退行性疾病的治疗提供重要的参考意义,如帕金森综合征[65]。
3 结语
尽管目前学术界尚未完全清晰阐释“觉醒发生系统(促觉醒神经元)”和“睡眠发生系统(促睡眠神经元)”的神经网络调控机制,但是对该系统提出了基本的研究框架和理论假设,并达成了一定共识,即昼夜节律对睡眠-觉醒调控系统提供“定时服务”,而内稳态平衡对其提供“驱动力”。此外,近年来睡眠医学基础研究成果也在一定程度上推动了睡眠疾病治疗药物的研发,如MT系统药物、OX系统药物和H3受体反向激动剂,均为基于睡眠研究理论转化成功的实例。然而,睡眠疾病表型繁多,病因复杂,未来针对不同病因、不同表型的睡眠疾病治疗药物研发依然任重道远,尚需睡眠医学工作者的深耕探索。

