基于小胸鳖甲转录组的免疫相关基因发掘
李洁琼
(新疆农业职业技术学院生物科技分院,新疆 昌吉 831100)
昆虫不具备适应性免疫系统,依赖多种先天防御反应对抗入侵的病原体和寄生虫,这些反应包括使用物理屏障以及局部和全身的先天免疫反应[1,2]。同时昆虫体内存在的强大抗菌免疫系统可以作为第二道防线发挥作用,主要基于抗菌肽,但也包括丝氨酸蛋白酶、应激因子和参与调理和凝血的因子[3,4]。与其他生理过程一样,昆虫免疫反应涉及传感器(sensor)、效应器(effector)和信号转导器(signal transducer),将病原体识别与细胞免疫反应、体液免疫反应联系起来[5-7]。因此,昆虫细胞外和细胞内信号转导网络对于介导昆虫的免疫反应是非常重要的。受体介导的Toll、IMD、MAPK-JNK-p38、JAKSTAT 等免疫信号通路进化保守,作为体液和细胞免疫反应的调节剂和介质发挥着重要的作用[8-10]。
对果蝇(Drosophila melanogaster)的研究表明,真菌、革兰氏阳性细菌往往是借助果蝇体内的丝氨酸蛋白酶级联作用,水解活化细胞因子Spätzle 最终触发Toll 通路[11,12]。被激活的细胞因子Spätzle 能够高度结合Toll 受体,借助Dorsal、Dif 等NF-κB 转录激活因子,作用和调控体内的免疫效应物基因的表达水平,促进抗菌肽加速合成。在这一过程中还会逐步分化血细胞,从而产生具有包裹作用的层状细胞,可以杀灭寄生虫、病原体[13]。当发现或感知到革兰氏阴性细菌时,DAP 型肽聚糖可以快速通过信号传导介质、跨膜受体PGRP-LC 开启IMD 信号通路,活化的Relish(NF-κB 转录激活因子)也会转入细胞核内,启动另一组免疫相关基因的转录[14,15]。而且,果蝇体内有很多能够激发MAPK-JNK-p38 通路的物质,如应激信号、生长因子、细胞因子等,并对细胞凋亡、分化和IMD 通路起到调节作用[16,17]。此外,JAK-STAT 通路、RNA 干扰以及自噬同样也会介入抗病毒免疫反应[18]。根据现有信息,这些途径在模式昆虫和非模式昆虫中基本保守,但也存在明显的差异。报道显示,意蜂(Apis mellifera)的各类免疫基因并不是很多[19]。例如,果蝇中已发现9 个不同的Toll 基因,但是意蜂却仅为5 个[19]。相较于果蝇,豌豆蚜(Acyrthosiphon pisum)尚未找到完整、统一的IMD 途径[20]。在昆虫纲中,部分基因组已发现免疫相关基因在不同物种中是有区别的。因此,有必要分析在不同的昆虫中,是否存在完整的免疫信号传导通路以及免疫信号通路组分的进化是否保守。
昆虫生存的微环境丰富多样,对不同类别的昆虫来说,其响应低温、病原微生物等胁迫的分子机制有显著差异。鞘翅目拟步甲科昆虫小胸鳖甲(Microdera punctipennis),广泛地分布于新疆地区的古尔班通古特沙漠,是生存于北部荒漠的优势物种之一,也是新疆特有物种[21],在抵抗荒漠环境时具有自身的优势和特点[22]。小胸鳖甲这种对环境适应性的差异需要从基因整体表达的角度开展全面研究。所以,本研究以小胸鳖甲为试验对象,样本采集选择在越冬地点进行,并分别对越冬的成虫、实验室饲养的成虫和实验室低温胁迫的成虫进行转录组测序[23-25],最终建立低温响应相关的转录组数据库,获得小胸鳖甲基因整体表达的情况。
目前缺乏对小胸鳖甲分子免疫机制的研究。为观察小胸鳖甲自身的免疫功能在低温环境下发生哪些变化,人们先要了解它的免疫系统,对比、判断与其他模式昆虫是否存在不同之处。目前昆虫防御机制的基因组分析表明,病原体诱导免疫应答的中心是识别真菌、细菌和病毒所引发的信号通路,这些信号通路可导致效应分子的产生[8],因此,本研究利用小胸鳖甲的转录组数据首次注释和筛选了小胸鳖甲的免疫相关基因,包括编码模式识别受体、信号转导及调控因子、免疫效应因子等。分别对小胸鳖甲潜在的模式识别受体蛋白完成有序的筛选;对Toll、IMD、MAPK-JNK-p38 以及JAK-STAT 免疫通路,以及自噬、凋亡还有RNA 干扰等免疫相关的细胞过程进行全面的分析;并对溶菌酶、抗菌肽、几丁质酶、热休克蛋白、酚氧化酶以及谷胱甘肽S-转移酶等免疫效应物做出注释。结合筛选得到的免疫相关基因绘制小胸鳖甲免疫通路图,建立小胸鳖甲的免疫系统架构。此研究成果为进一步明确昆虫免疫调控与抗寒机制的内在联系奠定可靠的基础。
1 材料与方法
1.1 样品采集、处理及测序
小胸鳖甲成虫采自古尔班通古特沙漠南部,阜康市222 团(44°24′ N,87°51′ E,海拔444 m),于实验室(30 ℃)饲养。4 只越冬成虫于2016年1月11日采集(组名为Mp_W),置于液氮内保存。采样点土壤温度-8.8 ℃,湿度4.98%。在饲养得到的成虫中选取个体相似的3 只作为对照组试虫(组名为Mp_30)。此外,取3 只饲养的成虫于-4 ℃低温胁迫处理3 h(组名为Mp_4)。-4℃处理组、越冬组、对照组,全部通过Illumina HiSeq™4000 测序仪来完成转录组测序。
为补充低温处理的数据,再次将3 只饲养的成虫作为对照组试虫(组名为CK),另取3 只饲养的成虫于4 ℃低温胁迫处理3 h(组名为CD),通过测序仪完成转录组测序。
小胸鳖甲转录组测序数据已上载至生物技术信息中心(NCBI),利用BioProject 号PRJNA345299 即可完成下载。
1.2 原始序列拼接组装
基于Novogene 内部的Perl 脚本,进行测序raw reads 的预处理。将adapter、低质量reads(掺杂多聚-N)予以去除,留下clean reads。通过Trinity(r20140413p1)软件进行clean reads 的拼接得到contig,然后进行contig 聚类组装,从中选取最长的转录本作为unigene。除参数min_kmer_covfor 设为2 外,各参数均为0。
1.3 unigene 功能注释和分类
基于blastx 算法(E-value<10-5),将unigene 与Refseq Insect Protein、Refseq Insect RNA、NCBI Nr、NCBI Nt、Swiss-Prot、基因本位GO、京都基因与基因组百科全书KEGG 等多个数据库的已知序列做比较,根据序列相似性,可以对照注释转录组中unigene 的功能。若同个unigene 在不同的库中注释结果不一致,则参照最佳命中(best hit)结果来确定基因的生物学功能。使用软件Blast2go 预测各序列功能及其GO 分类,使用KAAS(KEGG auto annotation server)预测KEGG 代谢通路。
1.4 重要免疫相关基因的筛选和比较
基于基因比对注释的信息,并参照果蝇[9,11-14,16,17]、家蚕[26]、赤拟谷盗(Tribolium castaneum)[27]、烟草天蛾[5,28]等昆虫物种中已报道的相关知识,采用人工识别的方法从小胸鳖甲转录组序列中识别筛选出与免疫信号途径有关的基因序列,尤其MAPK、Toll、IMD、JAK-STAT、RNAi、凋亡和自噬等信号通路。利用Trinity 的CDS 软件来完成蛋白编码序列(Protein coding sequence,CDS)的预测。根据上述结果,筛选免疫相关基因,同时绘制小胸鳖甲的免疫通路图。
2 结果与分析
2.1 基于昆虫数据库的小胸鳖甲测序数据的组装及功能注释
为了充分获取小胸鳖甲低温转录组中潜在的昆虫免疫相关基因序列,本研究收集以小胸鳖甲为材料测序的所有RNA-Seq 数据(表1),包括来自冬季样本的4 组数据(Mp_W),30 ℃饲养成虫对照组样本的3 组数据(Mp_30),-4 ℃3 h 处理样本的3 组数据(Mp_4),4 ℃3 h 处理样本的1 组数据(3 只昆虫数据合并)(CD)和25 ℃饲养成虫的1 组数据(3 只昆虫数据合并)(CK)。

表1 小胸鳖甲转录组测序数据的统计
4 个越冬组样本、3 个-4 ℃组样本和3 个对照组均是利用De novo 组装、Trinity 拼接,得到的平均长度为635 bp,N50 为1 007 bp 的198 206 个小胸鳖甲unigene(表2)。4 ℃处理组与对照组样本总共得到79 725 244 个转录本,约为31 741 条unigene,其长度平均为1 019 bp,N50 为1 958 bp。
将小胸鳖甲unigene 与NCBI nr 库内的123 种昆虫基因数据进行序列同源性对比,共发现49 034 个unigene(占24.74%)与已知的其他昆虫蛋白具有不同程度的同源性(表3)。在小胸鳖甲已注释的序列中,有9 650 个(E-value = 0)unigene 是完全匹配的,占注释序列总数的19.68%(图1a)。分析对比同源性序列一致的物种,共9 522 个unigene(占19.42%)和模式昆虫赤拟谷盗存在高度同源性(图1b)。
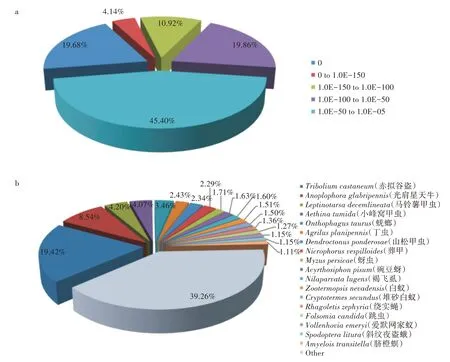
图1 小胸鳖甲转录组unigene 与NCBI的nr 库昆虫数据的比对结果

表3 小胸鳖甲转录组测序数据在公共数据库中的基因注释统计
2.2 小胸鳖甲免疫相关基因的筛选与分析
从转录组数据分析和功能注释的结果中,共筛选得到小胸鳖甲的107 个免疫相关基因及其同源unigene 1 750 个,分为识别、信号转导与调控、效应分子3 大类(表4)。
小胸鳖甲转录组中筛选出16 种模式识别受体,其中,vitellogenin最多,有75 个unigene;筛选出昆虫调制因子(Modulator)相关的352 个unigene,其中包括丝氨酸蛋白酶SP 基因的同源unigene 112 个(表4)。另外,有13 个丝氨酸蛋白酶抑制剂serpin 基因同源unigene。
昆虫Toll 信号通路的组分是高度保守的,与果蝇相比,小胸鳖甲的Toll 通路是完整的,具有编码胞外细胞因子spätzle、跨膜受体Toll、激酶pelle 和NFκB 转录因子dorsal等基因(表4,图2)。

图2 小胸鳖甲Toll免疫信号通路及其调控
图3 显示小胸鳖甲IMD 通路基因包含了TAK1、TAB2、Dredd、Ird5、Relish(Rel)、Effete等。与果蝇IMD 通路相比,小胸鳖甲缺失的IMD 通路基因包括IMD、kenny和FADD。IMD 通路也分支到JNK 通路和细胞凋亡通路,图3a 显示,JNK 通路是IMD 通路的一个分支,共享一些上游调控基因,包括TAK1、TAB2 和IRD5;图3b 显示,JNK 通路与p38MAPK 通路共同激活下游基因——核内转录因子Jra/Fos,增强特定基因的转录。此外,还有2 种血小板衍生和血管内皮生长因子PVF 及其受体PVR,可以和小GTP 酶Ras85D 共同作用激活JNK 通路(图3b)。同时MLK1 和MKK4 也参与到JNK 途径的激活。

图3 小胸鳖甲IMD-JNK 与MAPK-JNK-p38 免疫信号通路及其调控
图4 显示小胸鳖甲具有JAK-STAT 通路的核心基因,包括编码JAK 酪氨酸激酶(Hopscotch)和STAT 因子的基因,与果蝇相比,小胸鳖甲转录组中未找到与跨膜受体Dome(domeless)、配体Upd(unpaired)同源的基因(表4,图4a)。介入调节免疫的RNAi 途径有3 种,分别为piRNA、miRNA、siRNA。小胸鳖甲转录组中注释到dicer(Dcr)、Belle、argonaut(Ago)以及Vig基因,如siRNA 核心基因Dcr-2、Ago-2,以及miRNA 和piRNA 的核心基因Ago-1和Ago-3(表4,图4b)。在小胸鳖甲转录组中检测到参与调控整个自噬过程的自噬相关基因(Autophagy-related gene,Atg)的同源unigene,分别为Atg1、Atg2、Atg5、Atg8、Atg9、Atg13、Atg16,还有5 个磷脂酰肌醇3-激酶PI3K、6 个蛋白激酶AKT、8 个蛋白激酶TOR基因的同源unigene(表4,图4c)。同时,检测到细胞凋亡过程中重要的5 个基因,包括sickle、IAP1(Inhibitor of apoptosis)、Dronc(caspase-5)、Dredd(caspase-6)以及hid(编码IAP 拮抗剂)(表4,图4d)。

图4 小胸整甲JAK-STAT(a)、RNAi(b)、自噬(c)与凋亡(d)免疫信号通路及其调控
对免疫效应因子对应的基因进行初步注释、筛选后,发现小胸鳖甲转录组中共有558 个免疫效应因子基因的同源unigene(表4),包括抗菌肽、溶菌酶、几丁质酶、热休克蛋白、酚原氧化酶(PPO)以及酚氧化酶(PO)等。此外,还具有涉及调控自由基的多种抗氧化酶,包括过氧化物酶、过氧化氢酶、超氧化物歧化酶、谷胱甘肽S-转移酶、NADPH 氧化酶、一氧化氮合酶、硫氧还蛋白还原酶、硫醇抗氧化酶等(表4)。
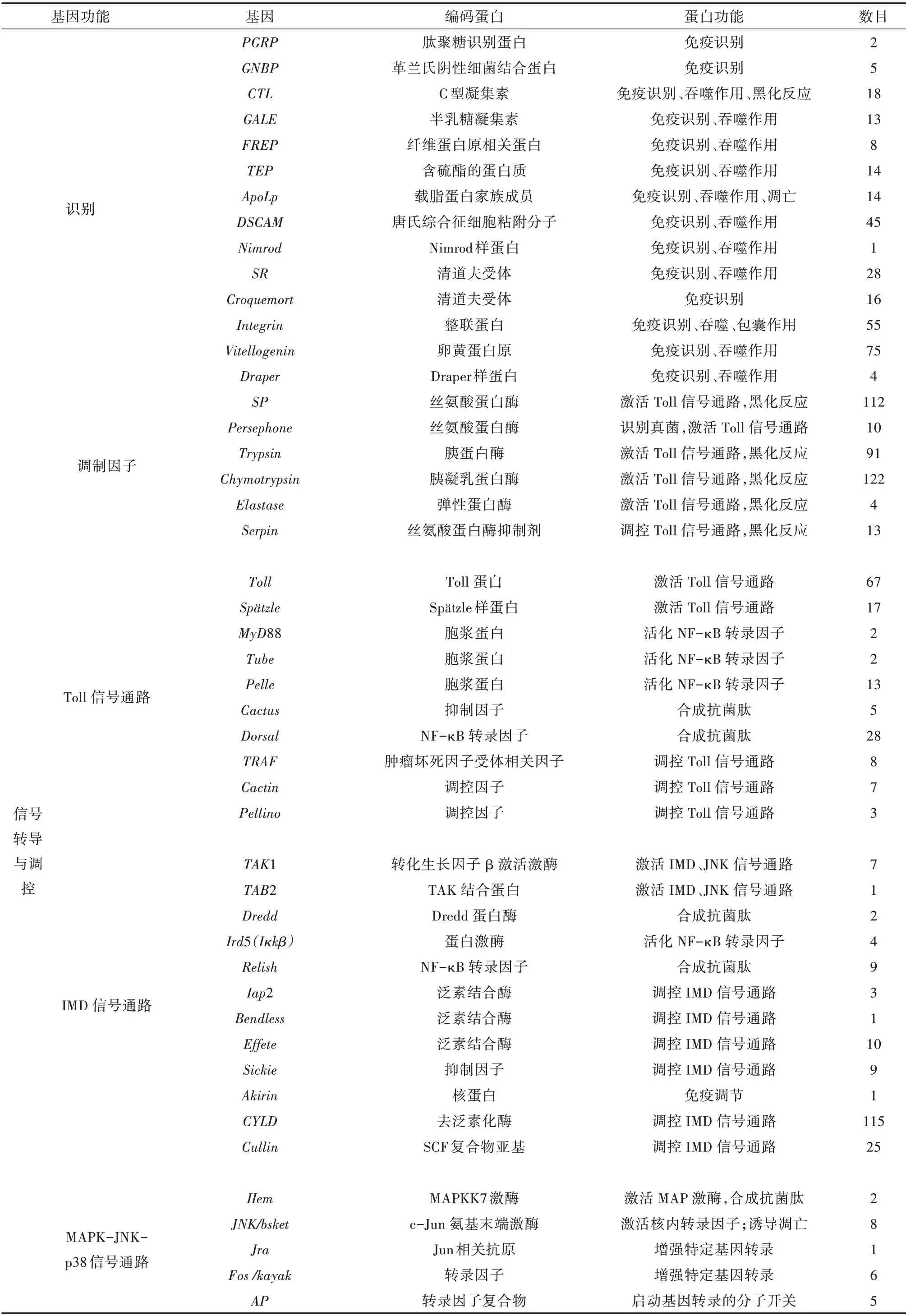
表4 小胸鳖甲主要免疫基因

续表4

续表4
2.3 小胸鳖甲免疫信号通路
参照模式昆虫果蝇、家蚕、赤拟谷盗和烟草夜蛾的研究结果,绘制小胸鳖甲的免疫通路(图5),囊括了小胸鳖甲中编码模式识别受体、免疫信号转导及调控因子和免疫效应因子的免疫相关基因,及Toll、IMD、MAPK-JNK-p38 和JAK-STAT 免疫通路、RNAi机制、细胞自噬和细胞凋亡过程中的免疫相关基因。
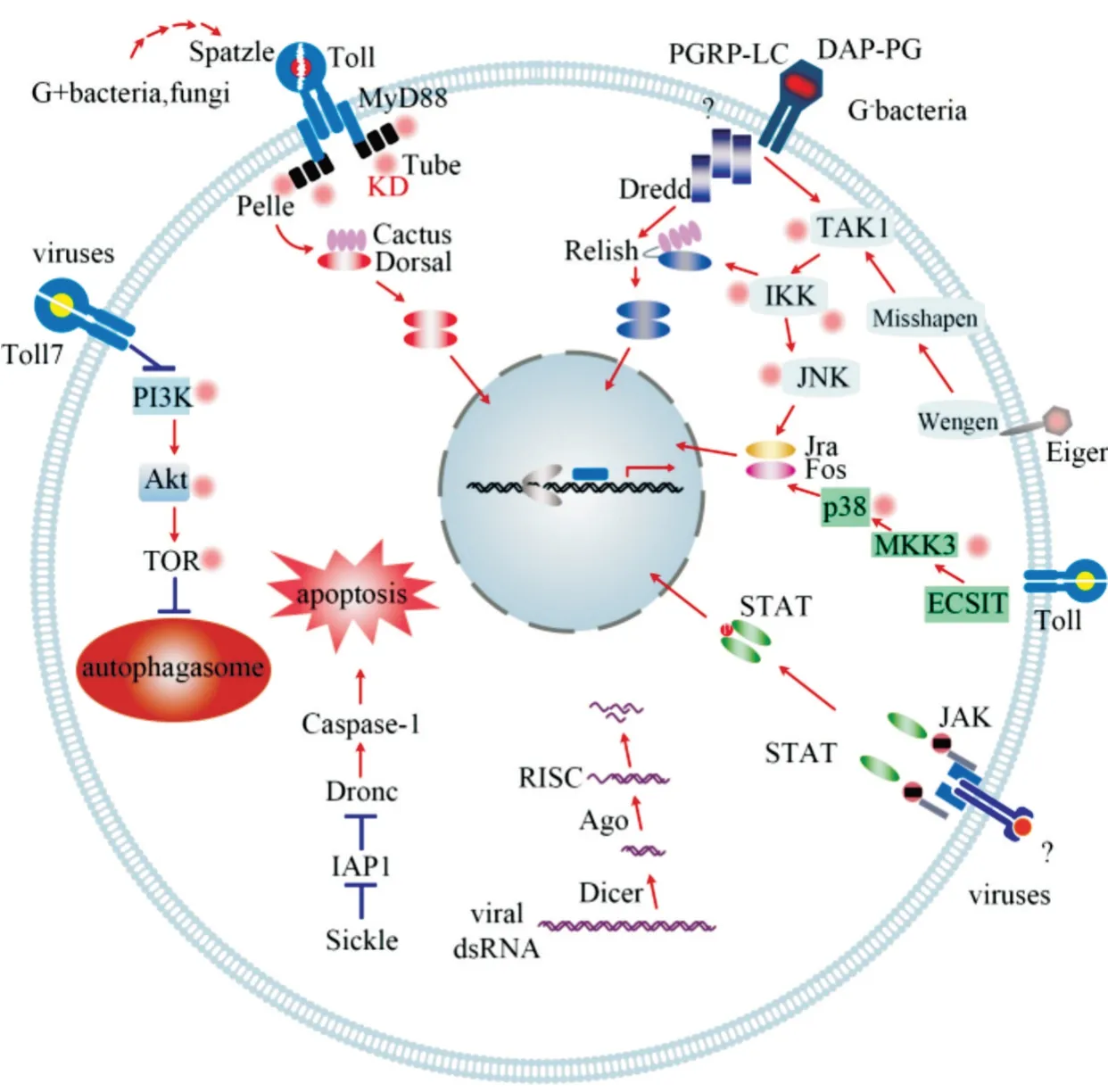
图5 小胸鳖甲的免疫通路
3 讨论
昆虫免疫系统由各种细胞免疫和体液免疫反应组成,这些免疫成分具有多种组合形式来对抗病原体和其他有害物质[8,15]。为明确感染的分子机制,有必要对免疫反应的参与基因、蛋白质进行分析。遗憾的是,目前的研究结果仍未将昆虫免疫相关基因做出细致的分类。本研究开展对昆虫小胸鳖甲免疫系统的分析,为了构建小胸鳖甲免疫库,并在其免疫系统的多种免疫反应过程中呈现蛋白质的分类,通过比对同源序列和GO 分类,结合手工筛选,共完成小胸鳖甲100 个免疫相关基因的注释。本研究是参考其他学者研究的昆虫免疫相关蛋白基础上来进行蛋白质的功能注释[8,15],包括果蝇[9,11-14,16,17]、家蚕[26]、赤拟谷盗[27]以及烟草天蛾[5,28]等昆虫。除了直接编码昆虫免疫蛋白的基因外,还有其他特定的基因可以参与免疫反应,尽管有许多差异表达的调节因子与应激反应重叠而不是由免疫攻击引起的[29],但是理论上免疫攻击后差异调节的基因都可能具有免疫功能。因此,本研究基于序列同源性和文献报道构建了小胸鳖甲免疫系统的信号传导通路图,其中,对病原体进行准确识别是引发免疫反应的基础:PRR 识别结合入侵病原体的PAMP,它们直接或者在丝氨酸蛋白酶介导的酚氧化酶级联反应后,触发信号转导系统的激活,进而激活抗微生物防御机制,如抗菌肽的表达、RNAi、自噬以及凋亡等;有些还会启动细胞免疫反应,将入侵者吞噬,发生包囊、集结并伴随黑化反应[15]。
昆虫免疫系统可与环境和微生物共同进化从而达到动态平衡,在进化过程中,一些免疫相关基因为了满足生物的生理需求变化,适应新的外界环境,会以适应、复制及丢失等形式做出应对反应[15]。目前在果蝇[9,11-14,16,17]、家蚕[26]、豌豆蚜[20]以及烟草天蛾[5,28]等不同类别的昆虫中,已检测出很多免疫相关基因。冈比亚按蚊(Anopheles gambiae)基因组中有335 个免疫相关基因,与埃及伊蚊(Aedes aegypti)的353 个在基因数目上相似,但研究认为,与其他基因相比,免疫相关基因具有更高的进化速率[30]。从基因的个数、基因家族方面进行比较,冈比亚按蚊与果蝇的基因组也十分相似,仅在抗菌肽基因家族中存在差异[31]。对比5 种昆虫的基因组[32],家蚕具有218 个免疫相关基因,与果蝇、赤拟谷盗数目相似,与意蜂的139 个免疫相关基因数目则具有较大的差异。另外,意蜂的免疫相关基因数量与果蝇相比,仅占50%,表明意蜂的免疫机制可能与其他几种昆虫存在较大差异[19,32]。类似的,将小胸鳖甲转录组中编码病原体识别、信号转导与调控以及效应蛋白的107 个免疫相关基因,与其他昆虫进行分析比对,发现编码模式识别受体和效应蛋白的基因在不同物种中显示出更高水平的类群特异性[19,20,26-28,30-32],而信号传导通路基因的进化相对保守,变异程度较低[33]。
小胸鳖甲并未开展全基因组测序研究,故转录组数据De novo 组装获得的246 648 个unigene 中,难免会有冗余现象。同时,多数属于未注释完成、功能模糊的unigene,许多基因可能分布于基因组内,但因为装配或注释错误导致未精准识别[34]。所以本研究初步建立的小胸鳖甲免疫防御通路网络后续还需要进行深入的验证、补充、丰富。
3.1 模式识别受体
通过模式识别受体蛋白PRR,昆虫能够识别分布于病原体表面的模式分子PAMP[15,35],进而激活体液、细胞免疫来应答不同的病原体[35]。因此昆虫识别和结合不同PAMP 的PRR,也具有不同的结构和功能[15,35]。PRR 识别并结合病原体的PAMP 后,激活Toll 等信号通路,诱导合成抗菌蛋白发挥作用,或引发酚氧化酶级联反应,从而使分解蛋白作用活化,并伴随着黑化反应,最终发挥清除病原体的作用,这类的PRR 包括肽聚糖识别蛋白(PGRP)[36]、β-1,3-葡聚糖识别蛋白(βGRP)[37]、革兰氏阴性菌结合蛋白(GNBP)[3,38]、C 型凝集素(CTL)[39]和载脂蛋白(ApoLp)[40]等。有些PRR 可启动细胞免疫反应,通过合成和分泌一系列炎症细胞因子和趋化因子,促进病原体与血细胞结合形成集结或包囊,并调节细胞吞噬入侵者,如CTL、ApoLp、半乳糖凝集素(galectin)[41]、含硫酯键蛋白(TEP)[42]、Nimrod 超级家族[43]和唐氏综合症细胞黏附分子(Dscam)[44]、清道夫受体(SR 和Croquemort)[45]、整联蛋白(Integrin)[46]和卵黄蛋白原(vitellogenin)[47]等。在昆虫的PRR 中,纤维蛋白原相关蛋白(FREP)还可参与细胞-细胞相互作用,介导活性氧的释放[48];另外,Draper 作为巨噬细胞中重要的损伤受体,也可在昆虫损伤修复、防御病原体和细胞自噬等免疫反应中发挥重要作用[49]。
3.2 免疫信号通路
3.2.1 调制因子 小胸鳖甲转录组中SP、persephone和SPH(trypsin、chymotrypsin 和elastase)基因编码的蛋白可作为调制因子,参与昆虫病原体识别、信号中继/调节和执行机制,在先天免疫系统中发挥重要作用[50]。昆虫PRR 识别病原体PAMP 后激活血浆中SP 和SPH,介入2 条免疫通路,第一条,激活胞内酚氧化酶原proPO,从而得到能够氧化酚类分子的PO,由于PO 的作用,伤口、病原体周围会产生黑色素引发黑化反应;第二条,血淋巴中具有Clip 结构域的SP 和SPE(Spätzle-processing enzyme),在活化Spätzle 蛋白后,再与膜受体Toll 蛋白结合,激活Toll通路并促进attacin、cecropin、gloverin 等抗菌蛋白的合成[50]。另外在小胸鳖甲转录组中注释到13 个serpin基因的同源unigene。serpin 超家族大部分都具有抑制丝氨酸蛋白酶(SP)的作用,可与丝氨酸蛋白酶结合形成共价复合物,确保了瞬时、集中的防御反应[51]。
3.2.2 免疫信号通路及其调控
1)Toll 通路及其调控。小胸鳖甲Toll 信号通路是保守的。PGRP、GNBP 将病原体识别出来的过程中会同步向Persephone 等丝氨酸蛋白酶传送信号,通过蛋白酶水解级联使胞外因子Spätzle 活化,并使其结合Toll 跨膜受体,从而促进Toll 受体胞内域招募聚集3 种胞浆蛋白(Myd88、Tube 和Pelle),Pelle激酶促使抑制因子Cactus 发生磷酸化和蛋白水解然后释放NF-κB 转录因子Dorsal,Dorsal 从细胞质中转运到细胞核中,并结合抗菌肽基因的启动子元件,在Cactin、Pellino 和Traf 等调控作用下诱导抗菌肽 drosomycin、defensin、cecropin、attacin 的 表达[5,8,10,12,15]。多数病毒、革兰氏阳性菌、真菌以及疟原虫均能够激活Toll 信号通路[3,10],而微生物不再入侵昆虫时,Serpin 抑制剂则能够发挥抑制作用,阻止Toll通路的持续激活[10,12,15]。
昆虫Toll 蛋白具有介导先天性免疫、表达抗菌肽、调控生长发育及形态发生等多种功能[12,52]。果蝇中已完成9 个Toll基因(Toll1 至Toll9)的鉴定,本研究中小胸鳖甲检测到67 个Toll基因的同源unigene,但未检测到全部种类的Toll基因,且尚不清楚每个Toll 蛋白在小胸鳖甲中的作用。小胸鳖甲中具有编码Dorsal 的基因同源unigene,但未发现Dif 的同源unigene,可能是Dif 属于高度衍生的分支,仅在短尾苍蝇(Brachyceran flies)中发现[19]。因此,Dorsal 是小胸鳖甲发生Toll 介导的免疫反应时,诱导抗菌肽所需的独特转录因子。
2)IMD -JNK 通路及其调控。IMD 信号通路可有效抵御革兰氏阴性菌的侵染[3,5,8,10,15],但小胸鳖甲缺少IMD、kenny以及FADD这3 个IMD 信号通路中的关键基因。从图3 可知,小胸鳖甲免疫系统中,G-菌体表附着的肽聚糖可以结合细胞跨膜受体PGRP,从而使PGRP 胞内域招募Dredd,完成胞内信号转导,在TAK1/TAB2 复合物的作用下IκB 激酶IRD5(IκBγ)磷酸化,促使NF-κB 转录因子Relish 蛋白断裂,其中Relish-N 经核转运因子NTF2(nuclear transport factor 2)的辅助,转位入细胞核,与Akirin共同调控cecropin,attacin,diptericin和drosocin等抗菌肽基因的表达[5,8,10,14,15]。IMD 信号通路也分支到JNK 通路和细胞凋亡:蛋白酶Dredd 不仅可以介入裂解Relish,还可以招募、裂解pro-caspase,形成的caspase 同时能够加快细胞凋亡进程;在hemipterous(MAPKK7)作用下,TAK1/TAB2 复合物还能够完成JNK 磷酸化,从而激活JNK 通路[5,8,10,14,15]。
相较小胸鳖甲缺失组分的IMD 通路,在果蝇、家蚕、伊蚊以及赤拟谷盗等昆虫中均已找到IMD 通路基因的直向同源物[5,8,10,14,15,32]。然而蜱螨(Tetranychus、Metaseiulus以及Ixodes)、木蚁(Camponotus floridanus)、豌豆蚜还有丽蝇蛹集金小蜂(Nasonia vitripennis)则类似于小胸鳖甲,缺失IMD 信号通路上的关键基因[15]。有研究表明,IMD 通路中的基因被敲除后会使果蝇对某些G+菌和真菌更加敏感从而导致死亡[53],揭示IMD 通路介导的组织损伤反应是防御微生物的重要过程。而小胸鳖甲IMD 通路核心组分的缺失现象,是否反映了小胸鳖甲抵御病原体的免疫潜力较低,或者是否存在未知因子参与构建IMD 通路,还有待深入研究。
在小胸鳖甲转录组中注释到9 个Sickie、115 个CYLD 以及25 个Cullin 同源unigene,它们表达的蛋白是IMD 通路的负调控因子。Sickie 对Dredd 诱导的Relish 活化具有相反的作用;去泛素化酶CYLD调节IKK 复合物以控制Relish 磷酸化,可抑制IMD信号传导;Cullin 蛋白参与调控Relish-N 的磷酸化[5,8,14,15]。IMD 通路释放过量的抗菌肽,对宿主本身并无益处。所以,精准的负调控机制才能保证IMD 途径可以在合理范围内反应。
3)MAPK-JNK-p38 通路及其调控。从实质上来看,JNK 信号是有丝分裂激活的蛋白激酶MAPK通路,参与调节昆虫的发育和代谢、免疫反应等[15-17]。小胸鳖甲具有JNK 通路的核心免疫相关基因Hep、JNK(basket)、Jra 和Fos[15],该通路以保守的状态进化。
JNK 信号通路由一系列胞外因子和胞内的应激物诱导激活,可通过多条分支接收传导信号:①JNK可 由IMD通路的TAK1 激酶(即MAPKKK7)激活[5,14,15];②可由混合连接激酶MLK1(MAPKKK 激酶)激活[5,15];③由MKK4(MAPKK 激酶)激活[5,15];④由血小板衍生和血管内皮生长因子(PVF)及其受体PVR(Ser/Thr 激酶)介导激活[5];⑤由肿瘤坏死因子同源物Eiger(egr/TNF)、受体Wengen(wgn/TNFR)、TRAF(TNF receptor associated factor)和Misshapen 途径依次激活TAK1、hemipterous(MKK7)和JNK[5,17];⑥通过Toll 受体与TRAF 激活p38 激酶,级联诱导Jra-Fos 复合物的形成(JNK 通路下游基因[5,17])。
JNK 收到多条上游分支传导的激活信号后,会诱导Jra-Fos 复合物即转录激活因子AP-1(Activator protein 1)的形成。该转录因子能够结合多种基因启动子区的AP-1 位点,促进特定基因的转录,从而表达靶蛋白参与到应激、伤口愈合、凋亡、炎症反应以及细胞免疫反应中[8,10,54]。
4)JAK-STAT 通路及其调控。小胸鳖甲转录组注释到编码JAK-STAT 通路核心组分JAK 和STAT的基因同源unigene,然而,跨膜受体Domeless 以及激活果蝇JAK-STAT 通路的关键配体细胞因子Unpaired(Upd1、Upd2 和Upd3)还没有检测到[8,13]。JAK 激酶(Hopscotch)接收信号后,使转录因子STAT磷酸化,磷酸化的STAT 以二聚体的形式进入细胞核,诱导表达含硫酯蛋白(TEP)为代表的抗病毒蛋白等效应物[42]。小胸鳖甲转录组具有调控基因SOCS和PIAS的多条unigene,其编码的SOCS(JAK抑制剂)和PIAS(活化STAT 的蛋白抑制剂)蛋白,可以调控JAK-STAT 信号通路,进而参与调节小胸鳖甲的免疫应答及多种发育过程,包括抗病毒免疫反应[3,10,13,18]。
昆虫JAK-STAT 信号通路高度保守,但小胸鳖甲未注释到Domeless 和Upd,考虑可能是遗漏或者存在其他未知的跨膜受体和配体,如烟草天蛾除了domeless 之外,还存在未知跨膜受体可以与Vago 的直系同源物结合,以类似于domeless 配体的方式激活JAK 和STAT[5]。同时还发现,赤拟谷盗、意蜂和烟草天蛾等昆虫也缺失Upd 配体[5,19,27]。
5)RNAi 途径。参与调节免疫应答的RNAi 包括piRNA、miRNA 和siRNA,RNAi 利用siRNA 的反义链切割靶mRNA 引发转录后基因沉默,在昆虫防御病毒感染机制中发挥重要作用[10,18,55]。小胸鳖甲转录组中具有编码siRNA 通路核心组分Dicer-2 和Argonaute-2 的基因同源unigene,以及编码miRNA和piRNA 的核心组分Argonaute-1 和Argonaute-3 的基因同源unigene,这些小RNA 可参与构成RNA 诱导沉默复合体,在小胸鳖甲抗病毒反应中发挥作用[56]。
6)自噬和凋亡过程。细胞自噬和细胞凋亡过程在昆虫机体适应环境变化的细胞应激反应、维持细胞稳态和新陈代谢、组织损伤反应和抗病毒感染机制等许多方面具有重要意义[57,58]。小胸鳖甲中自噬相关蛋白Atg,可以调控自噬过程。昆虫在自噬发生过程中受到磷脂酰肌醇3 激酶(PI3K)/丝/苏氨酸激酶(Akt)通路调控,该途径中PI3K 能够磷酸化底物并激活下游的Akt,Akt 进一步磷酸化雷帕霉素靶蛋白(TOR),TOR 通过磷酸化使形成的自噬调节复合物Atg13-ULK1 失活,影响自噬小体的生物发生,进而抑制自噬[57]。在小胸鳖甲转录组中注释到DNA 损伤自噬调整蛋白(DRAM),其参与自噬体与各种囊泡的融合过程,能够促进自噬体的积累并且调控自噬溶酶体的形成[57]。一些病原体可以靶向自噬体,然后被溶酶体降解[57]。在果蝇中,自噬被一些病毒、细胞内细菌(例如单核细胞增生李斯特氏菌)和其他病原体感染诱导[18,59],表明自噬也可能是一种经典的细胞免疫反应。
入侵昆虫细胞的病毒,可通过触发细胞外或细胞内的信号,激活一系列半胱氨酸蛋白酶caspase 引发一种主动的细胞凋亡,用以抑制入侵的病毒的扩散和复制[58]。小胸鳖甲具有凋亡途径的组分caspase Dronc、IAP、Sickle(与Reaper 显著相似)和Hid,可分别从内部和外部触发细胞凋亡,在应激反应和免疫防御机制中发挥作用[58]。在昆虫细胞内部,细胞凋亡的级联反应受到启动因子caspase Dronc 和caspase 的负调节因子(IAP)的共同调控,同时,促凋亡蛋白Sickle,即IAP 拮抗剂,也能通过使IAP 失活参与调控凋亡过程[60]。而在细胞外部引发的凋亡信号是通过JNK 通路来传导的。IMD 通路、toll 通路以及细胞膜锚定外部蛋白Eiger 都可以通过激活JNK 信号通路,诱导细胞凋亡。Eiger 诱导的细胞凋亡也受到IAP 抑制[58]。虽然凋亡通常涉及病毒致病,但某些病毒已学会利用该机制,在长期进化过程中获得了各种抗凋亡的基因,以不同的方式促进自身的生存和复制[61]。
3.3 免疫效应因子
1)抗菌肽。昆虫的免疫防御体系主要由多种抗菌肽发挥作用,已知的昆虫抗菌肽就有170 余种。在小胸鳖甲转录组数据中搜索昆虫抗菌肽的基因,检测到7 个drosomycin、4 个defensin、5 个attacin、3 个tenecin、2 个holotricin、1 个cecropin以及1 个anionic antimicrobial peptide基因同源unigene。由于物种特异性抗菌肽的存在,且这些分子的序列具备多样性特点,基于同源性的搜索可能遗漏了一些抗菌肽基因。防御素(Defensin)可抵御革兰氏阳性菌,攻击素(Attacin)与天蚕素(Cecropin)可抑制革兰氏阴性菌,而抗真菌肽(Drosomycin)具有较高的抗真菌活性[4,8,10,62],这些抗菌肽是组成小胸鳖甲免疫防御体系的重要成员。
2)溶菌酶与几丁质酶。小胸鳖甲转录组注释到c 型、i 型以及p 型lysozyme基因的同源unigene。Lysozyme 蛋白能够降解细菌细胞壁肽聚糖和胞壁酸[63],是抵抗细菌感染的关键因素。在小胸鳖甲的几丁质酶中,编码酸性哺乳动物几丁质酶(Acidic mammalian chitinase)基因的同源unigene 比较多,这类Chitinase 蛋白具有降解几丁质活性,可参与对抗线虫、真菌和其他病原体的防御,在免疫反应和炎症反应中发挥作用[64]。
3)热休克蛋白与肌动蛋白。小胸鳖甲转录组中具有多种不同分子量的Hsp和actin基因的同源unigene(表4)。已知HSP 是应激蛋白,因此病原体的侵染也能诱导HSP 的合成,在许多昆虫中,已显示HSP 在感染性损伤和微生物入侵后被上调表达[65]。在免疫反应中,HSP 也可作为重要的信号蛋白[65]。家蚕组学研究发现抗性添毒个体中actin 和HSP 呈现高表达,由于actin 的过表达能够干扰病毒多角体合成和组装[66],因此推测actin 和HSP 都参与家蚕抗病毒过程。小胸鳖甲表达的actin 和HSP 蛋白是否有助于抵御病毒也值得进一步研究。
4)其他免疫反应效应蛋白。小胸鳖甲注释到酚氧化酶(PO)、酚氧化酶原(proPO)、芳基贮存蛋白(Arylphorin)和六聚体储存蛋白(Hexamerin)的基因同源unigene,这些基因编码的蛋白都可参与细胞吞噬、集结、包囊和黑化作用,在昆虫的先天免疫系统中发挥着重要作用[67,68]。已有研究发现PO 和多巴脱羧酶(Dopa decarboxylase,Ddc)参与果蝇血细胞的集结[6,68]。PO 与hexamerin、arylphorin 都属于节肢动物血蓝蛋白hemocyanin 超家族,在昆虫免疫防御中,有些血蓝蛋白表现出酚氧化酶催化活性,甚至可以转化为酚氧化酶,hemocyanin 和hexamerin 均已证实与节肢动物的免疫功能相关[69]。集结、包囊以及黑化作用可将小胸鳖甲免疫反应定位到损伤部位以迅速清除病原物和受损细胞[2,6,68]。
细胞免疫反应过程中,局部产生自由基也是非常重要的免疫反应,对防御病原微生物十分有效[2,6,8]。自由基以及自由氧簇(包括O2-、ROS、OH-、H2O2和RNS)均可协助血细胞吞噬病原体,并在包囊作用中杀死病原体[2,6,8]。由于ROS 和RNS的细胞毒性,它们的转化率和浓度受机体抗氧化酶系统的严格调节,从而防止昆虫受到过剩自由基攻击造成损伤[2,6,8]。小胸鳖甲注释到的抗氧化酶包括:过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、硫醇抗氧化酶(thiol peroxiredoxin,TP)、谷胱甘肽硫转移酶(glutathione S-transferase,GST)、硫氧还蛋白(thioredoxin)、硫氧还蛋白还原酶(thioredoxin reductase)、一氧化氮合酶(nitric oxide synthase,NOS)以 及NADPH 氧 化 酶(NADPH oxidase)。在小胸鳖甲氧化应激反应和免疫防御反应中,上述成分可发挥重要的作用[2,6,8]。有报道称,基因突变或基因敲除引起的自由基水平的变化,对按蚊的繁殖力及其抗疟疾反应均有较大影响[70]。
综上所述,小胸鳖甲转录组中有1 750 个免疫相关基因的同源unigene,共107 个编码免疫相关蛋白的基因,表达的蛋白可以参与到toll、IMD、MAPKJNK-p38、JAK-STAT 免疫信号通路中,以及RNAi、自噬、凋亡以及吞噬、包囊和黑化反应。本研究构建的小胸鳖甲免疫信号网络中,一些免疫通路(IMD 通路和JAK-STAT 通路)和一些组分(如IMD、FADD 和domeless 等)与模式生物之间存在差异。下一步还需要使用生物化学、分子生物学和细胞生物学方法验证本研究基于转录组数据构建的免疫信号通路。本研究对荒漠昆虫小胸鳖甲免疫相关基因的注释和分析,既充实了昆虫免疫相关基因的研究内容,也加深了对昆虫天然免疫机制的认识。

