粉红单端孢 TrPLD基因家族鉴定及其在侵染甜瓜过程中的表达
柳漆利,张倩倩,薛华丽,毕 阳,宗元元,彭 慧
(1.甘肃农业大学 理学院,甘肃 兰州 730070;2.甘肃农业大学 食品科学与工程学院,甘肃 兰州 730070)
粉红单端孢 (Trichotheciumroseum)是导致苹果、甜瓜、番茄、杏、芒果等水果采后腐烂的主要病原菌,在侵染果实过程中,除造成严重的经济损失外,还会产生单端孢霉烯族类毒素[1-6]。这类毒素具有致癌、致畸、致突变等作用,严重威胁人类健康[7]。因此,如何减轻粉红单端孢对果蔬的侵染、削弱其代谢产生真菌毒素的能力,是目前生产中亟待解决的关键问题。
已有研究表明,磷脂酶D(Phospholipase D,PLD)在病原真菌致病过程中具有重要的作用[8-9]。根据水解磷脂中磷酸二酯键位点的不同,磷脂酶可分为磷脂酶A(PLA)、B(PLB)、C(PLC) 和D(PLD)。PLD主要功能是水解宿主膜磷脂结构中磷酸二酯键产生磷脂酸(PA)和胆碱阳离子自由基团,其活性决定了磷脂的水解强度[10-13]。PLD参与真菌多种细胞功能,在禾谷镰刀菌(Fusariumgraminearum)中[14],敲除FgPLD1导致菌落生长抑制,对小麦的致病力显著降低。FgPLD2和FgPLD3的缺失对菌丝生长和致病性无显著影响。在内生真菌(Epichlo⊇festucae)中[15],EfPLDB对菌丝生长,菌落形态、囊泡融合和毒力具有调节作用,而EfPLDA对菌丝生长和毒力无显著影响。在烟曲霉(Aspergillusfumigatus)[16]中,AfPLD敲除后降低了对人肺细胞A549和小鼠的侵染力,但对菌落形态、菌丝生长及其生物膜的形成均无显著影响。在构巢曲霉(Aspergillusnidulans)[17]中,也鉴定出3种PLD亚型,AnPLDA缺失突变体(ΔPLDA)生长形态无显著变化,但钙依赖性PLD显著降低磷脂酰乙醇胺含量。在淡紫拟青霉(Purpureocilliumlilacinum)[18]中,PLD基因缺失显著降低了对根结线虫的致病性,但对菌丝生长、孢子萌发和分生孢子形态无显著影响。由此可见,PLD的功能因病原菌而异,同时,同一病原真菌的不同PLD家族基因,在病原菌菌丝生长、产孢和致病性等方面也存在显著差异。
在禾谷镰刀菌和酿酒酵母(Saccharomycescerevisiae)[19]中只有缺失包含PX (phox)结构域的PLD基因突变株的生长和产毒受到抑制,而没有PX结构域的PLD基因的缺失对菌株生长和致病性无显著影响;淡紫拟青霉的PLD结构中无PX结构域,导致PlPLD的缺失对菌丝生长、分生孢子形成和孢子萌发均无明显影响[18]。由此表明,PLD的结构对其功能的发挥具有显著的影响。因此,解析病原真菌PLD基因及其编码蛋白的结构,对研究其生物学功能和致病性具有重要的作用。
目前,在植物和哺乳动物中,对不同PLD亚型的作用及其在细胞过程中的不同功能的研究已经取得了很大进展,但关于植物病原真菌粉红单端孢中PLD的作用未见报道。为了进一步探究粉红单端孢中TrPLD家族基因及其编码蛋白的功能,本研究通过RT-qPCR技术研究了TrPLD在粉红单端孢侵染甜瓜果实过程中的表达特性,并利用生物信息学的方法对其编码蛋白的理化性质、结构特征及系统进化等方面进行预测分析,以期为全面揭示这4种蛋白的结构和功能的研究提供理论依据。
1 材料和方法
1.1 试验材料
粉红单端孢(菌株号:Tr-1)由甘肃农业大学食品科学与工程学院采后实验室提供,分离自具有典型粉霉病病害症状的甜瓜果实的病部组织,经分离纯化、形态学和分子生物学技术鉴定后,保存于马铃薯葡萄糖琼脂培养基(PDA)上备用。
供试玛瑙厚皮甜瓜(CucumismelonL.cv.malao)于2021年7月采收于甘肃省民勤县金谷源农业科技有限公司,选取大小均匀、无机械损伤的甜瓜果实,单果套发泡网袋后装入瓦楞纸包装箱,于当天运抵实验室贮藏(温度22~25 ℃,相对湿度55%~60%)。
1.2 试验方法
1.2.1 TrPLD基因测序结果 本实验室通过广州基迪奥生物科技有限公司对粉红单端孢进行全基因组测序,通过基因注释及保守结构域分析筛选出4个TrPLD基因。
1.2.2 TrPLD基因及其编码蛋白的生物信息学分析 采用MEGA 7软件用邻接法(Neighbor-joining)构建TrPLD基因家族系统进化树;利用在线工具GSDS(http://gsds.gao-lab.org/)进行基因结构分析;通过ORF finder(https://www.ncbi.nlm.nih.gov/orffinder)平台预测获取基因的开放阅读框;利用在线生物信息学数据库 ExPASy-ProtParam(https://web.expasy.org/protparam/)进行蛋白质的基本理化性质分析;利用SMART网站(http://smart.embl-heidelberg.de/)进行保守结构域分析;利用TMHMM Serverv.2.0(http://www.cbs.dtu.dk/services/TMHMM/)、SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP)及ProtScale(https://web.expasy.org/protscale/)预测蛋白的跨膜区域、信号肽和亲疏水性;分别利用SOPMA(NPS@ SOPMA secondary structure prediction results (ibcp.fr))和SWISS-MODEL(https://swissmodel.expasy.org/)对蛋白质二级结构和三级结构进行预测;通过Softberry数据库 (http://linux1.softberry.com/)预测蛋白的亚细胞定位;在线利用NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)分析工具预测磷酸化位点。
1.2.3 模拟甜瓜体内粉红单端孢接种 挑选大小和成熟度均匀、无明显病虫害和机械伤的甜瓜果实,用自来水冲洗后自然晾干,1%次氯酸钠对果实表面进行消毒,晾干后,用榨汁机进行榨汁、灭菌备用。在100 mL PDB 培养基中加入100 μL 1.0×106cfu/mL的粉红单端孢孢子悬浮液,在28 ℃,150 r/min的摇床中培养3 d后,向对照组加入20 mL 的PDB培养基,向处理组中加入20 mL灭菌的甜瓜汁,继续培养,然后在第2,4,6,8 小时取样,液氮冷冻,-80 ℃贮藏待用,试验包括3次生物学重复。
1.2.4 总RNA的提取 分别取第2,4,6,8小时处理组和对照组的菌丝,液氮冷冻后迅速研磨,将研磨好的样品用总RNA试剂(TRNzol Universal,天根生化科技有限公司,北京)提取,整个操作过程在4 ℃条件下进行,具体操作参考使用说明书。提取的总RNA采用超微量分光光度计检测其纯度,然后置于-80 ℃保存待用。
1.2.5 实时荧光定量PCR分析 将上述提取的总RNA使用GoldenstarTMRT6 cDNA Synthesis Kit Ver 2试剂盒(金牌逆转录试剂盒TSK302M,北京擎科新业生物技术有限公司)进行基因组gDNA消除以及反转录合成cDNA。使用 Primer 3.0 软件设计引物,用于RT-qPCR(表1)。RT-qPCR反应体系(20 μL): 10 μL Extaq Ⅱ,0.8 μL 引物F(10 μmol/L),0.8 μL 引物 R(10 μmol/L),0.4 μL Rox Ⅱ,6 μL ddH2O,2 μL cDNA。PCR反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃ 34 s, 40个循环。以TRACTIN为内参基因,采用2-ΔΔCt算法进行基因相对表达量分析,每组数据重复3次。

表1 实时荧光定量PCR引物序列Tab.1 The primers used for Real-time quantitative
1.2.6 数据处理 试验数据采用Microsoft Excel 2010和SPSS 20.0(SPSS Inc,美国)数据处理软件进行分析,用Origin 8.0(Northampton,MA,美国)绘制图表,用Duncan′s法进行差异显著性分析和标准偏差计算。
2 结果与分析
2.1 基因组测序
通过对全基因组测序注释结果进行查找和筛选,初步确定了6个PLD基因,并对其进行保守结构域分析,发现只有4个PLD基因具有特征保守结构域,因此确定粉红单端孢中只有4个PLD同源基因。
2.2 基因结构及蛋白理化性质分析
基因结构及序列信息分析表明,TrPLD1基因全长为3 237 bp,包含7个内含子和8个外显子,其CDS区长度为2 694 bp,共编码897个氨基酸;TrPLD2基因全长为2 796 bp,包含3个内含子和4个外显子,其CDS区长度为2 577 bp,共编码 858个氨基酸;TrPLD3基因全长为5 563 bp,仅包含1个外显子,其CDS区长度为5 511 bp,共编码1 836个氨基酸;TrPLD4基因全长为5 634 bp,包含2个内含子和3个外显子,其CDS区长度5 550 bp,共编码1 849个氨基酸(图1)。通过 ORF finder平台预测结果表明,TrPLD1共有14个开放阅读框(ORF),最长的ORF长度为1 476 nt,位于正义链,读码框为1;TrPLD2共有18个ORF,最长的ORF长度为1 944 nt,位于正义链,读码框为2;TrPLD3共有43个ORF,最长的ORF长度为5 049 nt,位于正义链,读码框为3;TrPLD4共有30个ORF,最长的ORF长度为3 204 nt,位于正义链,读码框为1。
利用在线生物信息学数据库ExPASy-ProtParam对TrPLD1、TrPLD2、TrPLD3和TrPLD4的理化性质进行预测分析,结果显示,TrPLD1、TrPLD2、TrPLD3和TrPLD4的分子质量分别是102.62,99.29,206.85,206.23 ku。分子式分别是C4482H6850N1328O1401S27、C4400H6756N1254O1317S31、C9048H14184N2654O2793S63和C9158H14322N2660O2696S44。理论等电点分别是5.38,5.71,6.23和6.24,属于酸性蛋白。TrPLD1、TrPLD2、TrPLD3和TrPLD4的正电荷氨基酸残基数分别为119,108,238和203,负电荷氨基酸残基数分别为157,141,259和226,负电荷氨基酸残基数均大于正电荷氨基酸残基数,表明这4种蛋白整体均带负电。TrPLD1、TrPLD2、TrPLD3和TrPLD4的总平均亲水性均小于0,尽管稳定性系数有所差异,但均大于40,脂肪系数均小于100,表明TrPLD1、TrPLD2、TrPLD3和TrPLD4这4种蛋白均属于亲水性不稳定蛋白。
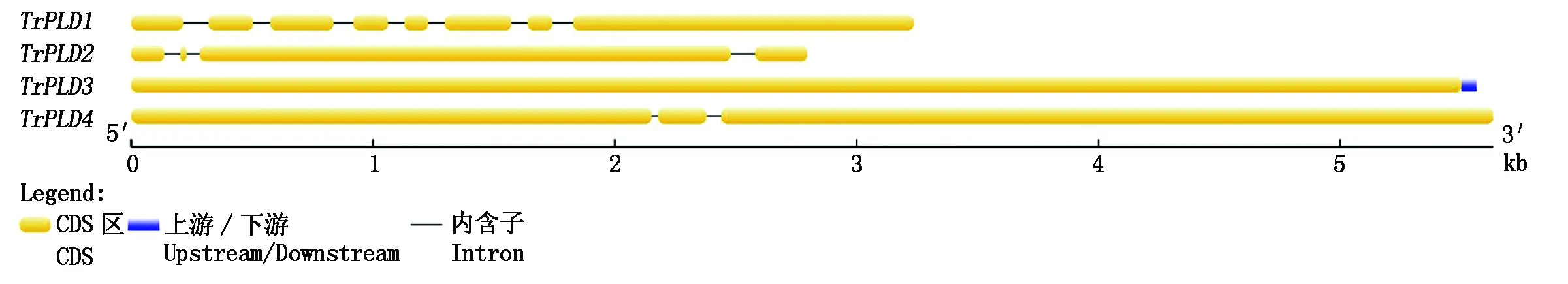
图1 TrPLD1、TrPLD2、TrPLD3和TrPLD4基因结构Fig.1 Genetic structures of TrPLD1,TrPLD2,TrPLD3 and TrPLD4
2.3 保守结构域分析
通过SMART网站在线分析TrPLD 4种氨基酸序列的结构域,并绘制蛋白结构域,结果显示,TrPLD1、TrPLD2、TrPLD3和TrPLD4 等4个序列都包含磷脂酰转移酶活性必需的2个HKD保守结构域。分析还发现,TrPLD3中有能与N端磷酸肌醇结合的PX和PH结构域,但其他3个TrPLD中不存在该结构域(图2)。对每个结构域进一步分析发现,HKD结构域均含有27个保守氨基酸,PX和PH结构域分别含有219,132个保守氨基酸。

PX.PX结构域;PH.PH结构域;PLDc.包含HKD活性位点。PX.Phox homology domain;PH. Pleckstrin homology domain;PLDc domain contains the HKD motif forming the active site.
2.4 系统进化树分析
在粉红单端孢全基因组测序结果中,通过结构域分析筛选得到4个PLD基因,TrPLD1、TrPLD2、TrPLD3和TrPLD4。通过MEGA 7软件对TrPLD1、TrPLD2、TrPLD3和TrPLD4氨基酸序列构建系统进化树(图3),结果表明,TrPLD1与炭疽菌(Colletotrichumaenigma)基因位于同一分支,亲缘关系最近,同源性为63.89%;TrPLD2与淡紫拟青霉(Purpureocilliumlilacinum)基因聚于同一分支,同源性高达74.57%;TrPLD3和TrPLD4分别与禾谷镰刀菌(Fusariumgraminearum)和铜绿假单胞菌(Pseudomonasaeruginosa)基因聚于同一分支,亲缘关系最近,同源性分别为65.38%和55.45%。
2.5 跨膜结构域、信号肽和亲/疏水性分析
利用TMHMM Serverv.2.0预测TrPLD1、TrPLD2、TrPLD3和TrPLD4蛋白的跨膜区域,结果显示,TrPLD1、TrPLD2、TrPLD3和TrPLD4蛋白均无跨膜区,属于非跨膜蛋白(图4-A~D)。利用SignalP 4.1 Server 预测TrPLD1、TrPLD2、TrPLD3和TrPLD4信号肽的可能性,其值分别为0.001 6,0.000 5,0.004 7和0.001 2,因此,这4种蛋白均无信号肽,属于非分泌蛋白(图4-E~H)。利用ProtScale预测TrPLD1、TrPLD2、TrPLD3和TrPLD4蛋白的亲疏水性(图4-I~L),(其中负值表示亲水,正值表示疏水),结果显示,4种蛋白序列均存在明确的亲疏水区域,且亲水区域明显高于疏水区域。其中,TrPLD1基因编码蛋白氨基酸序列第471位氨基酸疏水性最强(1.967),第834位氨基酸为亲水性最强(-3.656)。TrPLD2基因编码蛋白氨基酸序列第462位氨基酸疏水性最强(2.733),第327,328位氨基酸为亲水性最强(均为-3.611),TrPLD3基因编码蛋白氨基酸序列第409位氨基酸疏水性最强(2.544),第232位氨基酸为亲水性最强(-3.644),TrPLD4基因编码蛋白氨基酸序列第118位氨基酸疏水性最强(2.378),第409位氨基酸为亲水性最强(-2.967)。因此,初步推测TrPLD1、TrPLD2、TrPLD3和TrPLD4这4种蛋白均为亲水性蛋白。

图3 TrPLD1、TrPLD2、TrPLD3和TrPLD4的系统进化树Fig.3 Phylogenetic tree of TrPLD1,TrPLD2,TrPLD3 and TrPLD4
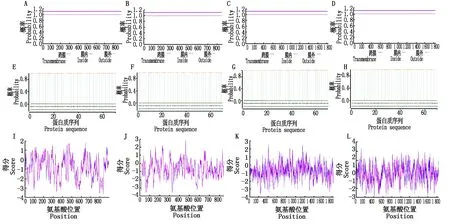
图4 TrPLD1、TrPLD2、TrPLD3和TrPLD4蛋白的跨膜结构域(A~D)、信号肽(E~H)和亲疏水性(I~L)预测Fig.4 Prediction of transmembrane domains(A—D),signal peptides(E—H),and hydrophobicity predictions(I—L) of TrPLD1,TrPLD2,TrPLD3 and TrPLD4 proteins
2.6 蛋白二、三级结构预测
使用SOPMA软件预测TrPLD1、TrPLD2、TrPLD3和TrPLD4蛋白二级结构,如图5-A所示,TrPLD1、TrPLD2、TrPLD3和TrPLD4蛋白二级结构均由α-螺旋、β-折叠、延伸链以及无规则卷曲组成。其中,无规则卷曲和α-螺旋结构是出现较多的结构,而β-折叠和延伸链出现比例较小(图5-A)。利用在线工具SWISS-MODEL对TrPLD1、TrPLD2、TrPLD3和TrPLD4蛋白进行同源建模得到三级结构图(图5-B)。
2.7 亚细胞定位
基因编码的蛋白质只有在特定的亚细胞器中才能发挥稳定的生物学功能。因此,了解蛋白质的亚细胞定位,才能有助于分析不同蛋白质的生物学功能。利用Softberry预测结果表明,TrPLD1主要定位于细胞核上,TrPLD2主要定位于质膜上,TrPLD3主要定位于细胞核上,TrPLD4主要定位于质膜上(表2)。
2.8 磷酸化位点分析
利用NetPhos 3.1 Server在线分析工具预测TrPLD1、TrPLD2、TrPLD3和TrPLD4的磷酸化位点。结果发现,TrPLD1蛋白存在51个Ser磷酸化位点,24个Thr磷酸化位点和25个Tys磷酸化位点(图6-A);TrPLD2蛋白存在31个Ser磷酸化位点,16个Thr磷酸化位点和13个Tys磷酸化位点(图6-B);TrPLD3蛋白存在105个Ser磷酸化位点、69个Thr磷酸化位点和29个Tys磷酸化位点(图6-C);TrPLD4蛋白存在91个Ser磷酸化位点、44个Thr磷酸化位点和15个Tys磷酸化位点(图6-D)。蛋白潜在的磷酸化位点越多,表明蛋白可能发挥更多的生物学功能,因此,可以推测TrPLD3蛋白具有更重要的作用。
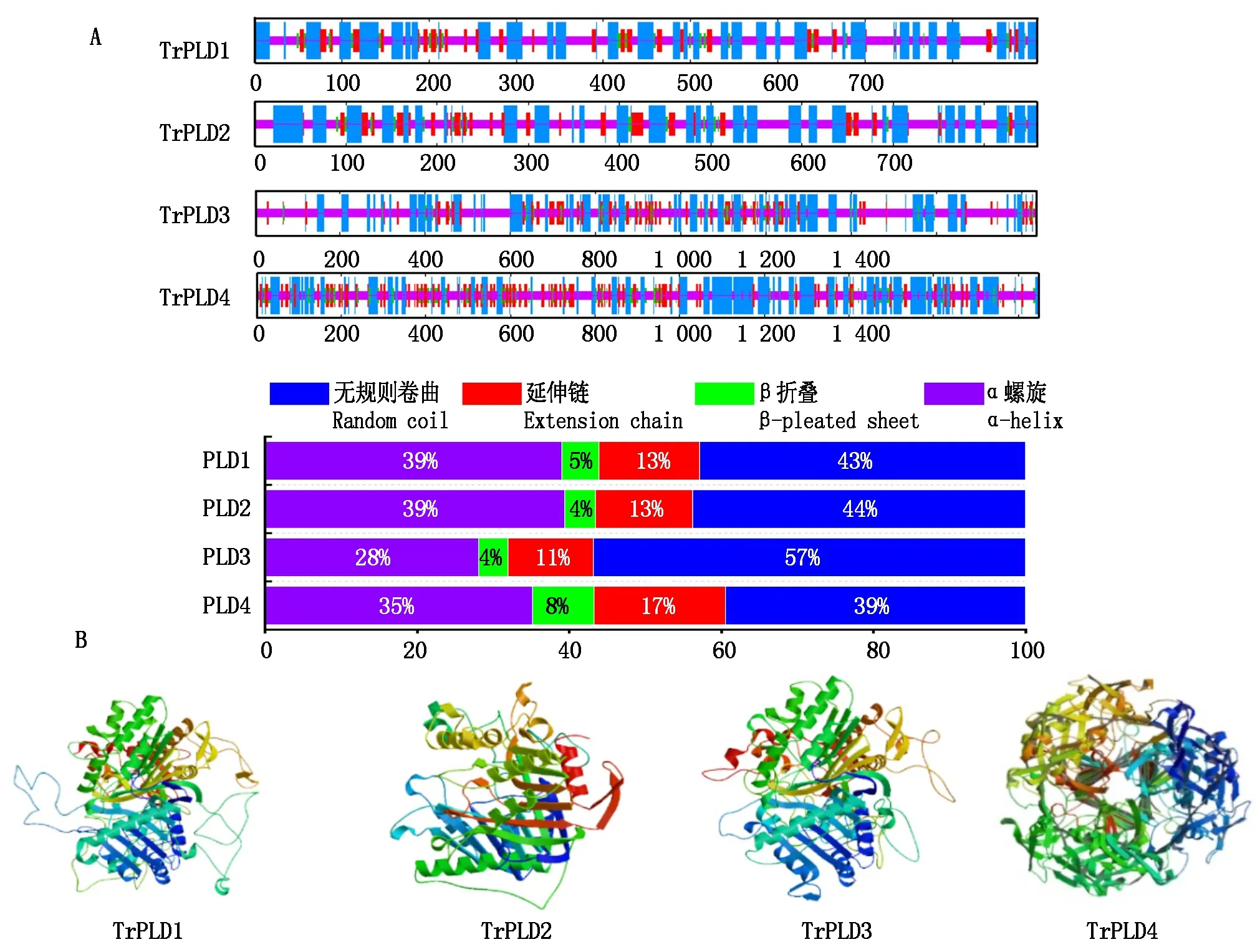
图5 TrPLD1、TrPLD2、TrPLD3和TrPLD4基因编码产物的二、三级结构Fig.5 TrPLD1,TrPLD2,TrPLD3 and TrPLD4 genes coding products of secondary and tertiary structure

表2 TrPLD1、TrPLD2、TrPLD3和TrPLD4亚细胞定位预测Tab.2 Prediction of TrPLD1,TrPLD2,TrPLD3 and TrPLD4 subcellular localization
2.9 粉红单端孢在侵染甜瓜果实不同时期TrPLDs的表达分析
通过模拟粉红单端孢侵染甜瓜果实体内试验,其中TrPLD1、TrPLD2、TrPLD3和TrPLD4与对照相比,表达量均存在显著差异(P<0.05)(图7)。如与对照相比,处理组的TrPLD1表达量在侵染的第2,4,6,8 小时分别为对照组的2.07,2.17,3.89,9.51倍;TrPLD2的表达量在侵染的第2,4,6,8小时分别是对照组的1.07,2.19,3.27,13.64倍;TrPLD3的表达量在侵染的第2,4,6,8 小时分别是对照组的1.72,6.36,6.82,21.56倍;TrPLD4的表达量在侵染的第2,4,6,8 小时分别是对照组的2.13,7.36,9.32,12.04倍。由此可见,甜瓜汁的加入,显著上调了TrPLD基因的表达,也表明TrPLD在调控粉红单端孢侵染甜瓜果实过程中,具有重要的致病作用。同时,第8小时的TrPLD3的表达量显著高于TrPLD1、TrPLD2和TrPLD4(P<0.05)。由此表明,与其他基因相比,TrPLD3在粉红单端孢侵染果实过程中具有更加重要的调控作用。

图6 TrPLD1、TrPLD2、TrPLD3和TrPLD4蛋白的磷酸位点分析Fig.6 Protein phosphorylation sites analysis of TrPLD1,TrPLD2,TrPLD3 and TrPLD4 proteins

竖线表示标准误(±s);不同字母代表差异显著(P<0.05)。Vertical line indicating standard error(±s); different letters indicating significant differences(P<0.05).
3 结论与讨论
本研究通过对粉红单端孢全基因组测序注释发现,该病原菌中同时存在4个TrPLD基因,分别命名为TrPLD1、TrPLD2、TrPLD3和TrPLD4。利用生物信息学软件分别对4个PLD蛋白的序列进行分析,对结构和功能进行预测,结果显示,4个蛋白分别含有100,60,203,150个潜在的磷酸化位点,磷酸化具有重要的调节、控制蛋白质活力功能作用,蛋白经磷酸化后,对后续参与细胞增殖、分化等生命活动有重要意义[20]。通过Softberry生物学软件分析发现,粉红单端孢中TrPLD1、TrPLD2、TrPLD3和TrPLD4蛋白具有不同的亚细胞定位,TrPLD1和TrPLD3定位于细胞核上,TrPLD2和TrPLD4定位于质膜上。已有研究结果发现,定位于不同细胞器的蛋白对调控病原菌的致病性具有不同的作用[21]。因此,TrPLD基因家族的具体生物学功能还需进一步研究。
保守结构域是生物进化或一个蛋白家族中具有不变或者相同的结构域,通常是基因的核心,具有非常重要的生物学功能。通过对蛋白结构域分析发现,4种TrPLD蛋白均具有PLD的2个保守结构域PLDc的HKD基序,该结构域是磷脂酰转移酶活性所必需的,其主要包含组氨酸、赖氨酸和天冬氨酸[22-25]。通过对PLD晶体结构的研究也发现,2个HKD基序结合能够形成PLD的活性位点,具有催化水解的活性,因此2个HKD基序对于PLD功能的发挥是必需的[26]。C端的HKD基序促进磷脂复合酶基底的形成,N端HKD基序主要为亲核基团,在生物体内二者共同作用发挥功能[27]。这些高度保守的结构域表明,TrPLD基因对调控病原菌生长、发育和致病性具有重要的作用。但由于同一个基因家族中的不同基因包含不同的结构域和作用位点,因此不同的TrPLD基因在不同细胞中行使不同的生物学功能。保守结构域分析还发现,与其他TrPLD蛋白相比,TrPLD3除HKD基序外,还具有能与N端磷酸肌醇结合的PX和PH结构域,因此,可推测该蛋白对粉红单端孢的生长发育和致病性可能具有更加重要的调控作用。
本研究通过qRT-PCR分析了在模拟粉红单端孢体内侵染甜瓜果实过程中TrPLD1、TrPLD2、TrPLD3和TrPLD4的基因表达,发现4个TrPLD基因的表达量具有显著差异,随着侵染时间的延长,4个TrPLD表达量均发生显著上调,由此说明TrPLDs基因对粉红单端孢的致病性具有重要调控作用。其中,与其他TrPLD基因相比,TrPLD3表达量上调最为显著,这说明TrPLD3基因在粉红单端孢侵染甜瓜过程中具有更重要的调控作用。所以,PLD家族中的PX或PH结构域对真菌的生长、发育和致病等具有重要作用。为进一步研究PX结构域的功能,仅对FgPLD1基因的PX结构域进行了敲除,结果表明,敲除PX结构域后的突变株与ΔFgPLD1有相似的表型特征,包括影响菌丝生长、菌落形态、无性和有性生殖过程等。这些结果均表明,PX结构域是PLD基因的重要的功能区[12]。在内生真菌和酿酒酵母中[15,19]也有相同的试验现象,只有敲除包含PX/PH结构域的基因缺失突变株在分生孢子萌发、菌落形态、毒力和菌丝融合上表现出一定的缺陷,而敲除不包含这两类结构域的其他基因则没有显著的影响;而淡紫拟青霉的PLD结构中由于只存在HKD保守序列,无PX结构域,导致PlPLD的缺失对菌丝生长、分生孢子形成和孢子萌发均无明显差异[18]。由此表明,PLD对病原真菌的生长发育、致病及产毒是否具有重要的作用,关键是PLD结构中是否存在PX结构域。由此表明,TrPLD3结构中PX结构域对粉红单端孢侵染果实具有重要的调控作用。
本研究对粉红单端孢TrPLD基因家族进行了鉴定,通过保守结构域分析推测,4个TrPLD基因中只有TrPLD3基因调控菌丝生长、菌落形态和产毒等。同时qRT-PCR分析表明,粉红单端孢侵染甜瓜果实过程中,与其他3个TrPLD基因相比,TrPLD3的表达量最高,随着侵染时间的延长,其表达量的上调最为显著。综上所述,TrPLD3可能对粉红单端孢的致病性具有更加重要的调控作用,其具体的分子作用机制尚需进一步深入研究。

