马铃薯野生种SpSBP1基因的克隆及CRISPR/Cas9载体构建
陈 娜,邵 勤,李晓鹏,高 阳,卢其能
(宜春学院 生命科学与资源环境学院,江西 宜春 336000)
马铃薯为茄科茄属作物,当前仍然是我国甚至是世界上重要的块茎类粮食作物之一。长期以来都是以马铃薯栽培种四倍体为主要生产及研究对象,这样就使得马铃薯的产业面临着2个重要的结构性障碍。第1个就是其四倍体的遗传规律非常复杂,在非常高度杂合的四倍体马铃薯之中则隐藏着非常多的有害基因,而有利基因则都是分散在各个不同的染色体之中,要把这些有利性状同时集中到一个品种中仅仅依靠传统的育种技术是非常困难的,这就容易导致马铃薯的育种周期延长,使得其品种更新非常缓慢,通常情况下要育成一个比较好的品种需要历时十几年[1];第2个就是马铃薯的繁殖通常是以薯块进行无性繁殖,这种方式存在着储存运输成本偏高、繁殖系数偏低以及容易携带各种病虫害等问题。为了彻底打破产业发展中的障碍,越来越多的科学家呼吁用二倍体马铃薯进行实生种子育种[2]。目前,在自然界中有70%的马铃薯种质是二倍体,这种丰富的遗传变异能够为马铃薯实生种的育种实施提供一定的基础。而二倍体马铃薯则普遍存在着一种现象——自交不亲和(Self-incompatibility,SI),正是这种现象导致其自交系品种的创制受到限制[1]。
在被子植物中普遍存在着自交不亲和现象,这种现象主要是用于防止植物进行自交受精从而促进杂交的一种机制[3],植物自交不亲和性根据其遗传机制不同主要可以分为两大类:第一类是配子体型自交不亲和型(Gametophytic self-incompatibility,GSI);第二类是孢子体型自交不亲和型(Sporophytic self-inconmpatibility,SSI)[4]。截至目前,国内外都围绕植物的自交不亲和性方面做了大量的研究,这些研究结果都证实:植物自交不亲和反应是一个极其复杂的过程[5]。蔷薇科(Rosaceae)、车前科(Plantaginaceae)、茄科(Solanaceae)均属于配子体型自交不亲和型[6]。在该体系中,其高度特异性的S-位点存在2个相对独立的基因:S-locus F-Box(SLF)和S-核糖核酸酶基因(S-RNase),其中,SLF基因决定了雄蕊的特异性,相反S-RNase基因决定了雌蕊的特异性[7]。研究表明,当植物的花粉粒落在柱头上开始萌发时,延伸的花粉管顶端的细胞就会通过胞吞作用吸入在花柱中高量表达的S-RNase[8-9],接着S-RNase与SLF就会发生互作,如果是具有相同S单倍型的相互杂交或者为自交,经过胞吞作用进入到花粉管中的S-RNase就会降解其中的rRNA,这样就会使得花粉管在延伸到柱头大概1/3的位置时其延伸将会停止,紧随其后花粉粒就会出现死亡[10];但如果是杂交,那么S-RNase蛋白就会被加以泛素化,然后经过26S蛋白酶体会将其降解,因此,花粉管能够进行正常的延伸,可以一直延伸到子房,最后能够完成正常的受精过程。大量的研究都已证实,在矮牵牛和苹果中的S-RNase是维持其自交不亲和的关键因素[11]。由于马铃薯和番茄均属茄科类作物,因此,二者在亲缘关系上十分接近,加之二者在基因组上也同样具有高度的共线性[12]。野生番茄和栽培番茄二者的倍性都是二倍体,虽然大部分的野生番茄都存在自交不亲和现象,而栽培番茄却均为自交亲和。据研究证实,主要是由于栽培番茄的S-RNase发生了突变,S-RNase的突变造成其功能缺失,使得其核酸酶活性也随之丧失,核酸酶活性的丧失使得其不能排斥自身的花粉,因此,最终导致了自交亲和现象的发生[13]。基于以上结果,可以利用基因组编辑技术定点编辑S-RNase基因,从而破坏其功能,最终达到植物自交亲和的目的。据报道,在新疆杏品种中鉴定出27个自交不亲和雌蕊的S基因型,为杏品种商业化栽培配置适宜授粉树提供了理论依据[14]。研究证实,在枸杞属植物中存在着S-RNase的等位基因,该基因序列和茄科植物的基因序列具有一定的相似性,研究表明,枸杞S-RNase是控制其自交不亲和性的关键基因[15]。通过对来自3种不同的二倍体马铃薯的S-RNase序列进行试验,进一步从S-RNase序列数据中确定了S-基因型[16]。利用基因组编辑技术敲除自交不亲和基因S-RNase,从而克服了马铃薯自交不亲和难题[1]。通过运用转录组测序技术,采用生物信息学方法从乌头属铁棒锤中鉴定出2个在雌蕊中特异或高表达的花柱S基因(ApSRNase)和2个在雄蕊中特异表达的花粉S基因(ApSLF),并分析了其序列特征及蛋白质理化性质,以期为进一步铁棒锤的自交不亲和性的分子机制研究提供理论依据[17]。据报道,马铃薯基因(S-locus inhibitor(Sli))能够编码一种F-box蛋白,该蛋白在自交亲和性植株的花粉中能够特异性表达。在该基因的启动子中插入533 bp的片段得到功能获得性突变体,从而能够克服自交花粉排斥的不亲和性,揭示了Sli基因的新功能化引发马铃薯的自交亲和性并促进马铃薯精准育种[18]。同时当一种自交亲和(SC)二倍体马铃薯RH89-039-16(RH)与自交不亲和系杂交时,它可以有效地诱导植株从自交不亲和性到自交亲和性的交配转变。进一步在RH中鉴定发现,Sli基因能够与雌蕊特异性S-RNases的多个等位基因变体互作。此外,Sli基因的功能类似于一般的S-RNase抑制剂,能够将SC赋予RH和其他自交不亲和的马铃薯。Sli的发现打破了二倍体马铃薯的自交不亲和性,为二倍体杂交育种计划提供了一条新的有效途径[19]。
据报道,植物配子体自交不亲和性除了SLF和S-RNase基因外,还存在其他的位于S位点外的新的基因[20-21],SBP1基因(S-RNase-binding protein 1),其蛋白序列含有典型的RING(Really Interesting New Gene)保守结构域,它最早是从矮牵牛花粉的cDNA文库中筛选出的[20],起着SSK1(Skp1-like)和 Rbx1 的作用,并且能够形成一个 SCFSLF/SFB的复合体,从而用于非自身的S-RNase泛素化的进程进而调控配子体植物自交不亲和性反应的进程[22-23]。O′Brien等[24]和Lee等[25]已分别在茄科植物马铃薯和烟草中鉴定到SBP1同源基因。Minamikawa等[26]在蔷薇科植物中首次发现了苹果花粉表达的SBP同源基因MdSBP1,随后Zeng等[27]在新疆野扁桃中发现SBP1的新型SCFSFB复合物。Yuan等[28]通过研究得出苹果MdSBP1可能是唯一负责识别S-RNase的因子,并且需要包含MdSSK1的SCF复合体来介导S-RNase的泛素化。以上研究表明,SBP1可能作为泛素连接酶行使着对S-核酸酶标记多聚泛素链的功能。
本研究利用二倍体马铃薯野生种(Solanumpinnatisectum)为材料克隆得到自交不亲和基因SpSBP1(登录号:MZ803088),使用多种生物信息学软件及在线程序对克隆到的基因进行序列分析,以及构建CRISPR/Cas9载体,以期为今后进一步研究马铃薯自交不亲和分子机制提供理论依据,并为建立二倍体马铃薯杂交育种平台提供起始育种材料及理论基础。
1 材料和方法
1.1 试验材料
供试植物材料为二倍体马铃薯野生种,由江西省作物生长和发育调控重点实验室提供。
CRISPR/Cas9系统载体pKSE401为中国农业科学院蔬菜花卉研究所崔霞教授惠赠[29-30]。
pMDTM19-T克隆载体购自宝生物工程(大连)有限公司。大肠杆菌(Escherichiacoli)感受态细胞DH5α和农杆菌感受态细胞EHA105均购自广州围谷润仪器有限公司。
1.2 试验方法
1.2.1 马铃薯野生种SBP1基因的克隆 根据马铃薯RNA-Seq转录组数据,筛选到4个与自交不亲和相关的基因,其中一个SBP1表达差异较显著,因此,运用Primer 5.0软件设计引物,使用引物SpSBP1-F/R扩增SpSBP1基因(表1)。PCR扩增程序为94 ℃预变性5 min;94 ℃变性30 s,退火温度55 ℃ 30 s,72 ℃延伸1 min 20 s,30个循环;最后72 ℃再延伸10 min。PCR产物进行电泳检测,并用胶回收试剂盒(Genstar,北京康润诚业生物科技有限公司)将PCR产物进行纯化回收,最后将回收产物连接到pMD19-T载体上,用通用引物pMD19-F/R检测,挑取阳性单克隆菌落摇菌,将摇好的菌液寄送至生工生物工程(上海)股份有限公司进行测序,根据测序结果确定基因的最终序列。

表1 引物序列Tab.1 Primer sequences
1.2.2 马铃薯野生种SpSBP1基因的生物信息学分析 将测序结果正确的SpSBP1基因序列通过NCBI-ORF在线程序确定该基因的最大开放阅读框,同时将该基因的核苷酸序列翻译成氨基酸序列;运用 NCBI-PROGRAM在线程序对该基因编码的蛋白结构域进行分析;运用ClustalW2在线工具进行同源性比对;运用MEGA 6.0软件构建系统进化树;运用ProtParam在线程序预测SpSBP1基因编码的蛋白的理化性质;运用 SOPMA在线程序预测其二级结构;运用SignalP 5.0在线程序和TMHMM Server v.2.0在线程序分别对马铃薯野生种SpSBP1基因编码的蛋白的信号肽和跨膜结构进行预测。具体网站见表2。

表2 生物信息学分析网站Tab.2 Bioinformatics analysis web site
1.2.3 马铃薯野生种SpSBP1基因靶位点的选择与CRISPR/Cas9载体的构建 利用在线网站CRISPR-GE(http://skl.scau.edu.cn/)选择适宜的靶位点并分析其特异性。根据CRISPR/Cas9系统的识别原理,PAM序列上游约20 bp核苷酸序列即为识别靶位点,靶位点序列GC含量应高于40%,脱靶预估值低于0.6。根据靶位点设计特异性引物:SpSBP1-CRISPR/Cas9-F和SpSBP1-CRISPR/Cas9-R(表1)。然后以pCBC-DT1T2载体(gRNA表达盒)为模板[29],通过PCR扩增(扩增程序:94 ℃预变性5 min; 94 ℃变性30 s,退火温度55 ℃ 30 s,72 ℃延伸30 s,30个循环;最后再72 ℃延伸10 min),得到含有gRNA-scaffold和靶位点序列的DNA片段。然后采用边切边连体系将扩增后的片段连接到pHSN401载体上,连接体系为DNA片段2 μL、pHSN401载体3.5 μL、BsaⅠ(10 U/μL)1 μL、10×T4DNA ligase Buffer 1.5 μL、T4DNA ligase(350 U/μL)1 μL、ddH2O 6 μL,总15 μL。37 ℃酶切5 h,50 ℃连接5 min,80 ℃酶失活10 min。最后将连接产物通过热激法转化至大肠杆菌感受态细胞DH5α中,涂布于LB(+ 50 mg/L卡那霉素)固体平板上,倒置放于生化培养箱中,37 ℃培养16~24 h。挑取单菌落用载体特异性引物SpSBP1-CRISPR/Cas9-F和SpSBP1-CRISPR/Cas9-R进行PCR验证,将PCR阳性菌落进行摇菌提取质粒,最后将质粒导入农杆菌感受态细胞EHA105中,将构建好的载体命名为SpSBP1-CRISPR/Cas9。
1.2.4 农杆菌介导的马铃薯野生种遗传转化
1.2.4.1 外植体的获得与预培养 马铃薯野生种的幼苗由宜春学院遗传育种与分子生物学实验室一直继代培养,试验以马铃薯茎段为转化材料。取苗龄为15 d左右的无菌苗,将茎段(不含腋芽)切成0.5 cm左右。将该茎段平放在分化培养基上(MS+3%蔗糖+2 mg/L 6-BA+1.5 mg/L 2,4-D+0.8%琼脂),每瓶接种30~40个外植体,于人工培养室预培养2 d。
1.2.4.2 农杆菌的侵染 提前3 d取出已经构建好的SpSBP1-CRISPR/Cas9表达载体,于YEP固体培养基上(利福平50 mg/L,卡那霉素50 mg/L)划平板,28 ℃恒温黑暗培养,36~48 h后长出单菌落。挑取一单菌落置于10 mL含利福平50 mg/L,卡那霉素50 mg/L的YEP液体培养基中,28 ℃ 200 r/min振荡过夜,次日转至50 mL YEP液体培养基中,继续培养至OD600为0.8左右。5 000 r/min,4 ℃,离心10 min,去除上清液,收集菌体。重悬于灭过菌的MS液体培养基(pH=7.0,+1‰ AS)中,稀释至OD600为0.4~0.6左右。将预培养2 d的外植体在菌液中浸泡20 min。
1.2.4.3 共培养 将在农杆菌中浸泡过的外植体再重新转移到新鲜的分化培养基中(MS+3%蔗糖+2 mg/L 6-BA+1.5 mg/L 2,4-D+1‰ AS+0.8%琼脂),每瓶接种30个左右的外植体,并在(25±1)℃条件下恒温黑暗培养2 d。
1.2.4.4 抑菌培养及筛选培养 将共培养2 d的外植体插入到含浓度为300 mg/L的特美汀抑菌培养基中(MS+3%蔗糖+0.5 mg/L TDZ+0.03 mg/L GA3+200 mg/L 特美汀+0.8%琼脂),放在人工培养室培养5~7 d。将进行了抑菌培养的外植体插入到含浓度为50 mg/L的卡那霉素筛选培养基中(MS+3%蔗糖+0.5 mg/L TDZ+0.03 mg/L GA3+200 mg/L 特美汀+50 mg/L卡那霉素+0.8%琼脂),直到少许外植体能在选择培养基上长出抗性芽,大部分外植体在含卡那霉素的选择培养基上褪绿,变黄为止。
1.2.4.5 不定芽的生根培养及再生植株的移栽 当分化的不定芽伸长至1.5~2.5 cm时,将其自基部切下,分别接种于生根培养基中(MS+3% 蔗糖+200 mg/L特美汀+0.8%琼脂)诱导其生根。当根长至足够长度,大约1个月,即可开瓶盖炼苗2~3 d,移栽到装有泥炭土的营养钵中,并覆盖塑料薄膜,置于人工气候箱进行培养,并且每天要揭开塑料薄膜进行通风透气2~3 h,待移栽苗长出新叶之后可以置于外界自然环境条件下培养。
1.2.5 抗性植株的鉴定 采集适量的再生植株叶片提取基因组DNA,使用CRISPR/Cas9载体特异引物F:5′-CGGCCTCGATATTGGGACTAACTCT-3′和R:5′-CTTA
TCTGTGGAGTCCACGAGCTTC-3′进行PCR扩增。确认外源DNA片段是否已经插入到植物基因组中。
2 结果与分析
2.1 马铃薯野生种SpSBP1基因的cDNA序列克隆
以二倍体马铃薯野生种为试验材料,提取总RNA,并反转录成cDNA,以cDNA为模板扩增SpSBP1序列,得到1 000 bp左右的扩增产物(图1-A)。切胶回收,将纯化后的片段连接至pMD19-T载体上(图1-B),挑取阳性克隆摇菌,将菌液送至生工生物工程上海股份有限公司测序。
2.2 马铃薯野生种SpSPB1基因的序列分析
测序结果显示,马铃薯野生种SpSBP1基因大小为1 176 bp,包含92 bp的5′非编码区(5′ UTR)和163 bp的3′非编码区(3′ UTR),其最大开放阅读框(ORF)为921 bp(图2),起于93位,止于1 013位,共编码了306个氨基酸。SpSBP1存在由Smc组成的Smc超家族结构域(111~223 bp)以及RING finger(254~297 bp)和Zinc finger(zf-C3HC4_3)(256~296 bp)结构域(图3)。将测序正确的序列上传至NCBI数据库,获得登录号为:MZ803088。
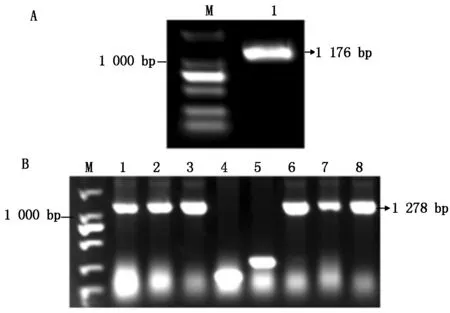
A: M.Marker DL2000,1.SpSBP1基因;B: M.Marker DL2000,1—3,6—8.阳性克隆,4—5.阴性克隆。A: M.Marker DL2000,1.SpSBP1 gene;B: M.DL2000,1—3,6—8.Positive clone,4—5.Negative clone.

图2 SpSBP1 cDNA及预测的开放阅读框Fig.2 Sequences of SpSBP1 cDNA and predicted ORF
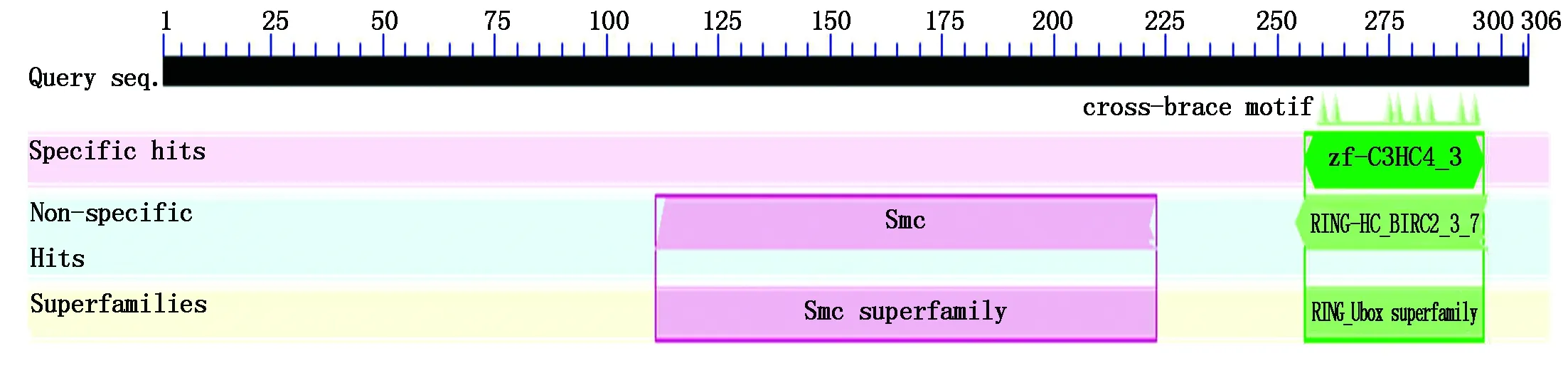
图3 SpSBP1的保守区Fig.3 Conservative domain of SpSBP1
2.3 马铃薯SpSBP1基因编码的蛋白同源性比对和系统进化分析
使用在线软件进行同源序列比对,各个物种的SBP1基因也有所差异(表3)。通过马铃薯野生种SBP1编码的蛋白与其他物种的SBP1编码的蛋白序列比对可知,马铃薯野生种SBP1编码的蛋白与其他物种SBP1编码的蛋白相似度较高,并且发现蛋白序列的N端的保守性不强,而中间和C端的保守性很强(图4)。运用MEGA 6.0软件对马铃薯野生种和其他10种植物的氨基酸序列进行聚类分析,并制作进化树,结果表明,马铃薯野生种SpSBP1基因编码的蛋白与马铃薯野生种ScSBP1编码的蛋白的同源性最高,其次为花烟草,但与拟南芥、甜樱桃、苹果等植物SBP1编码的蛋白的同源性较低(图5)。

表3 试验中各物种的SBP1基因Tab.3 SBP1 genes of species in the experiment
2.4 马铃薯野生种SpSBP1基因编码蛋白的生物信息学分析
马铃薯野生种SpSBP1蛋白的理化性质用ProtParam在线程序进行分析,得出其相对分子质量为34.731 44 ku,理论等电点pI为5.10,总负电荷残基数(Asp+Glu)为48,总正电荷残基数(Arg+Lys)为38,其蛋白的分子式为C1486H2408N430O481S23,脂肪系数为83.46,不稳定指数为47.60,为不稳定蛋白,平均亲水指数为-0.586,表现亲水性。综上,推测该蛋白为酸性不稳定亲水性蛋白(图6)。
通过SOPMA在线程序对SpSBP1蛋白进行二级结构预测,得出α-螺旋比例为45.42%,延伸链结构的比例为13.07%,β-折叠的比例为1.96%,无规则卷曲比例为39.54%(图7)。以上结果表明,该蛋白质的二级结构主要由α-螺旋和无规则卷曲所构成,而延伸链结构和β-折叠所占的比例则较低。
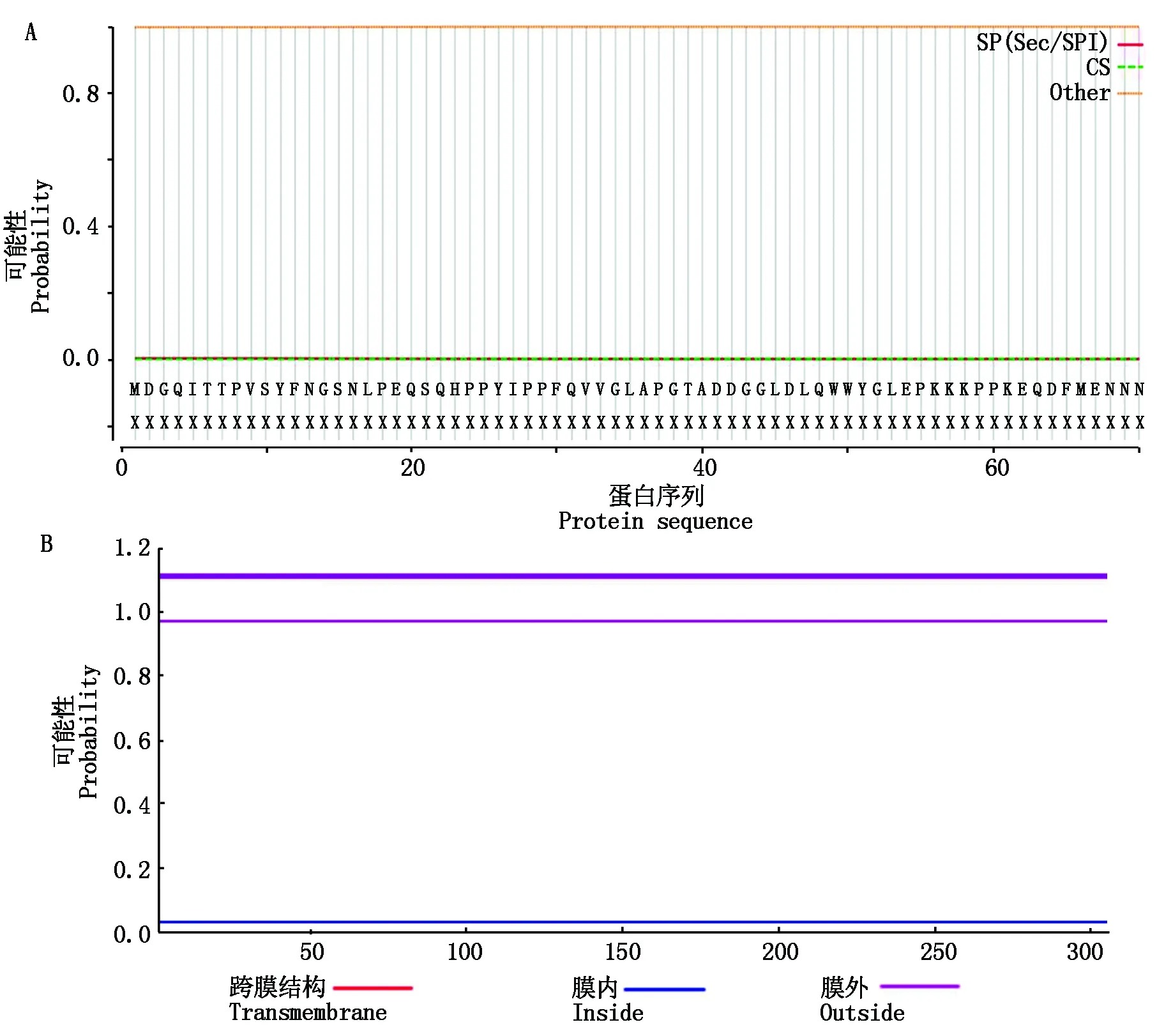
使用SignalP 5.0和TMHMM Server v.2.0在线程序分别对马铃薯野生种SpSBP1蛋白的信号肽和跨膜结构域进行预测分析,结果显示,SpSBP1蛋白没有信号肽,因此,属于非分泌蛋白,同时预测显示,该蛋白不存在跨膜结构(图8)。
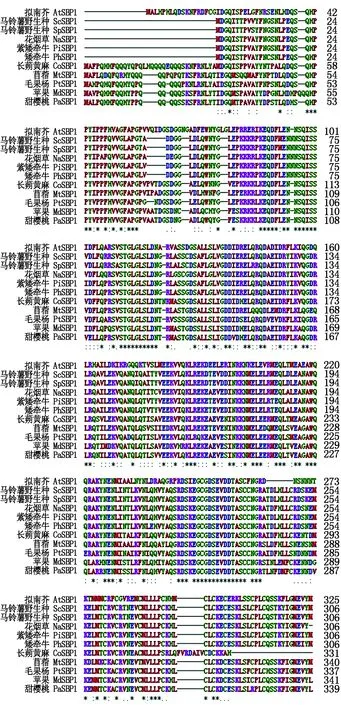
图4 马铃薯野生种SpSBP1编码的蛋白与其他物种同源蛋白多重序列比对Fig.4 Multiple alignment of homologous protein for the SpSBP1 in S.pinnatisectum and other species
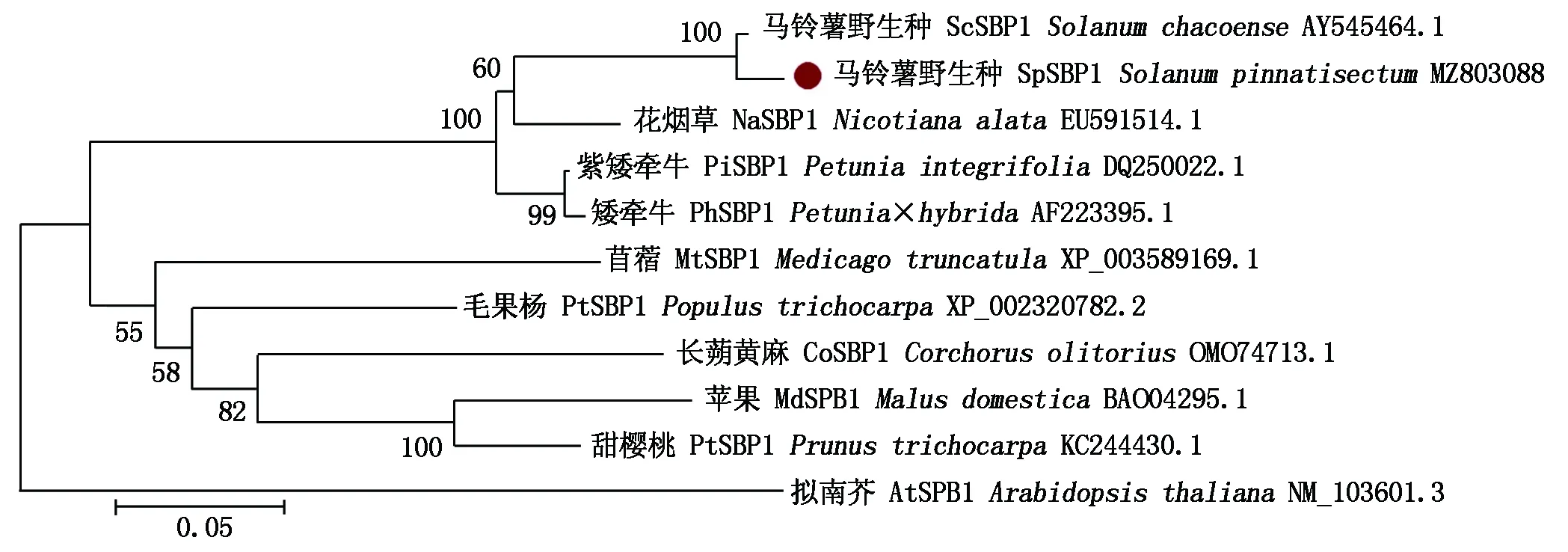
图5 SpSBP1同源蛋白的系统进化树Fig.5 Phylogenetic tree of SpSBP1 homologous protein
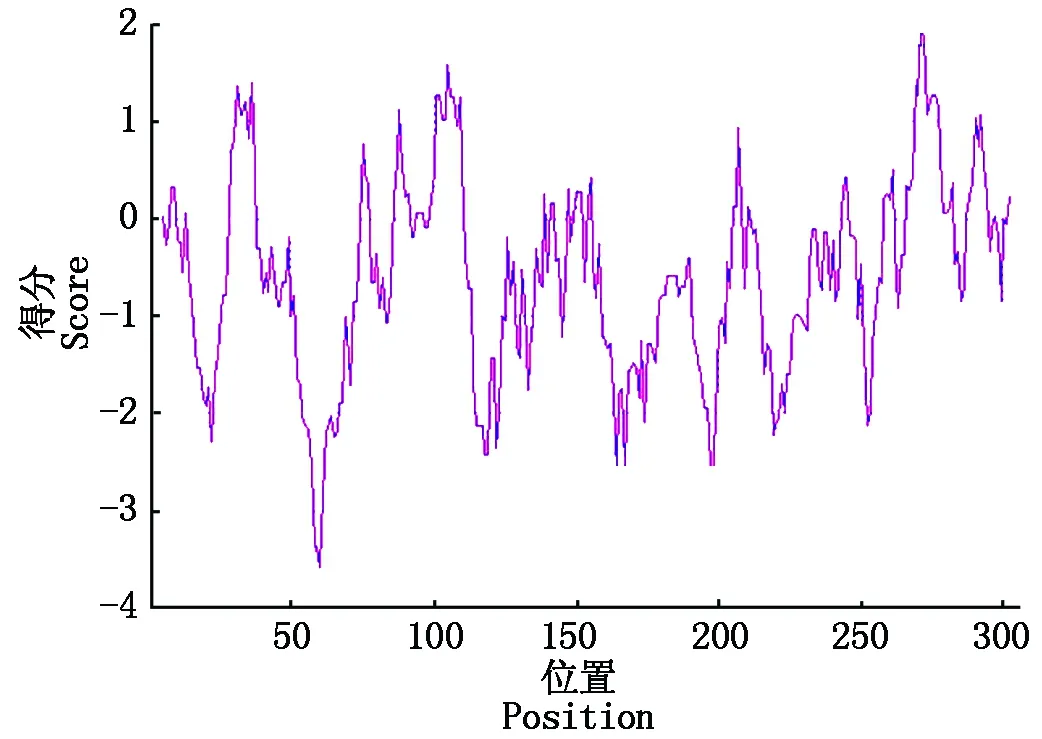
图6 SpSBP1蛋白亲疏水性分析Fig.6 Hydrophilic analysis of SpSBP1 protein
2.5 SpSBP1-CRISPR/Cas9载体构建
利用CRISPR-GE在线网站,以及根据设计靶点的原则和CRISPR/Cas9系统的特异性切割原则,设计二倍体马铃薯野生种SpSBP1的靶点序列,分别位于该基因的248~266 bp,321~339 bp,以pCBC-DT1T2载体为模板,进行PCR扩增(图9-A),将扩增片段切胶回收,然后将回收片段连接到pHSN401载体上,挑取菌落进行PCR验证(图9-B),然后将PCR阳性菌落进行摇菌提取质粒,最后将质粒导入农杆菌感受态细胞EHA105中,将构建好的载体命名为SpSBP1-CRISPR/Cas9(图10)。
图7 SpSBP1编码的蛋白的二级结构预测Fig.7 Secondary structure prediction of protein encoded by SpSBP1 gene
A.SpSBP1基因编码的蛋白的信号肽预测;B.SpSBP1基因编码的蛋白的跨膜结构预测。A.Signal peptide prediction of protein encoded by SpSBP1 gene;B.Transmembrane structure prediction of protein encoded by SpSBP1 gene.
2.6 马铃薯野生种的遗传转化
以马铃薯野生种的幼苗为材料(图11-A),将构建好的SpSBP1-CRISPR/Cas9表达载体,利用农杆菌介导的遗传转化法侵染马铃薯野生种的茎段(图11-B),在24 ℃下共培养2 d(图11-C),之后转移到抑菌培养基中进行培养(图11-D),经过5~7 d后转移至含50 mg/L卡那霉素的筛选培养基上进行抗性筛选(图11-E、F),然后将分化出的长至1.5~2.5 cm抗性芽自基部切下,分别接种于生根培养基中诱导其生根(图11-G、H)。当根长至足够长度,大
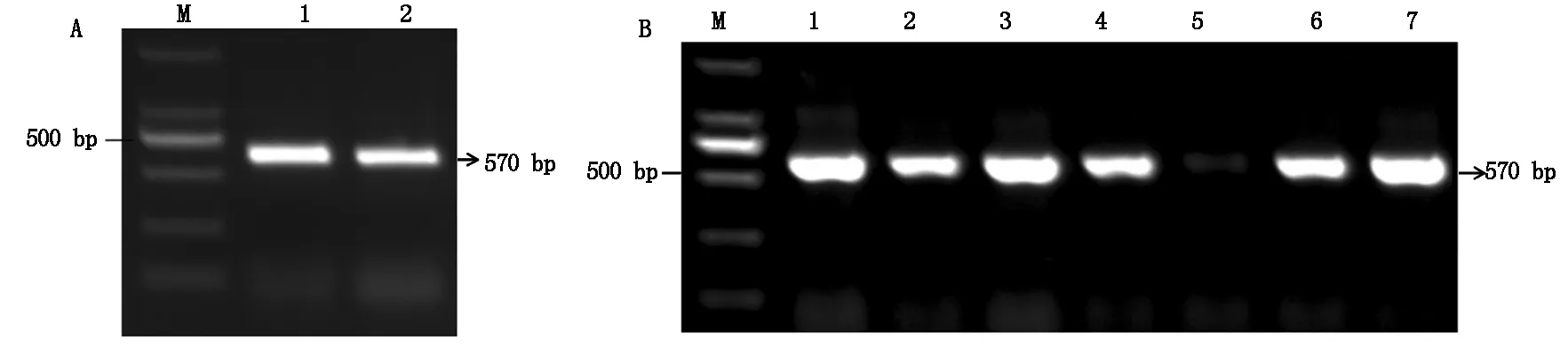
A: M.Marker DL2000,1—2.SpSBP1基因;B: M.Marker DL2000,1—4,6—7.阳性克隆,5.阴性克隆。A: M.Marker DL2000,1—2.SpSBP1 gene;B: M.Marker DL2000,1—4,6—7.Positive clones,5.Negative clones.
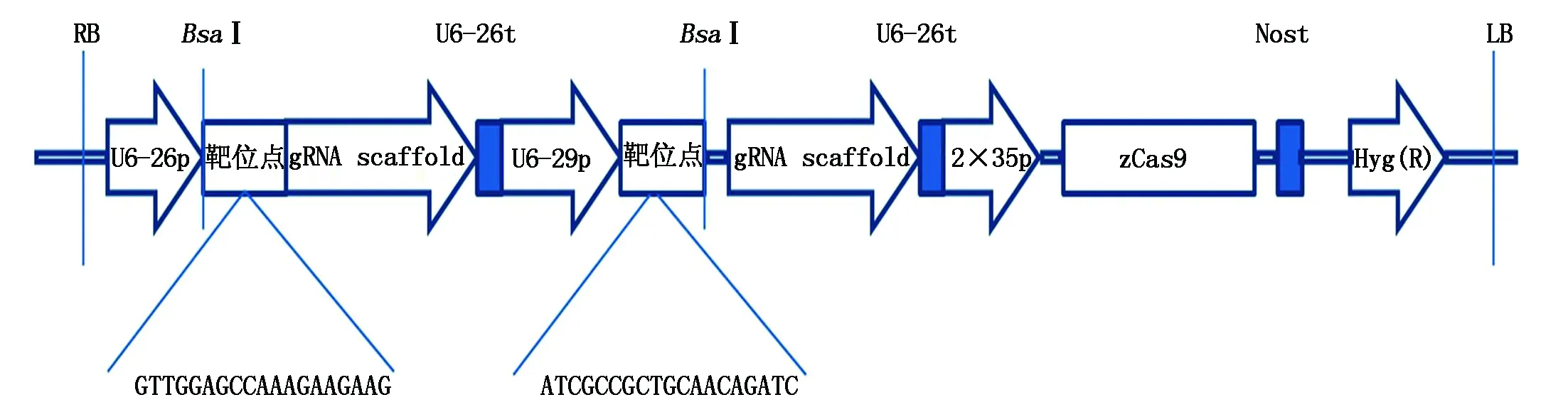
图10 马铃薯SpSBP1-CRISPR/Cas9载体示意图Fig.10 Structural diagram of S.pinnatisectum SpSBP1-CRISPR/Cas9 vector
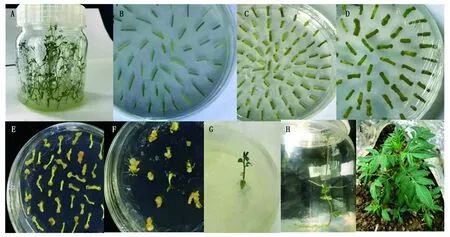
A.马铃薯幼苗;B.预培养;C.共培养;D.抑菌培养;E、F.筛选培养;G、H.生根培养;I.移栽。A.Potato plantlet in vitro;B.Pre-culture;C.Co-culture;D.Antibacterial culture;E,F.Screening culture;G,H.Rooting culture;I.Transplanting.
约1个月,即可开瓶盖炼苗2~3 d,移栽到装有泥炭土的营养钵中,待移栽苗长出新叶之后可以置于外界自然环境条件下培养(图11-I)。
2.7 再生植株的分子鉴定
提取32株抗性植株的基因组DNA,利用载体特异引物进行PCR扩增(图12)。带有目标靶点的CRISPR/Cas9载体质粒阳性对照(CK+)可扩增出约424 bp的目的片段(SpSBP1基因的N-端序列);而野生型植株(CK-)则无法扩增出目的片段;抗性植株中可扩增出与阳性对照大小相同片段的为PCR阳性植株。
3 结论与讨论
马铃薯的营养比较全面,是仅次于水稻和小麦的第三大重要的粮食作物[31]。就整体而言,马铃薯的育种进程相对来说比较缓慢,究其主要原因是马铃薯栽培种的倍性主要为同源四倍体,遗传特性复杂,加之其繁殖方式主要是利用薯块进行繁殖,因此大大限制了马铃薯基础研究的开展和育种水平的提高[32]。基于以上原因,在马铃薯二倍体的水平上进行再驯化的研究得到越来越多科学家的呼吁,并最终将马铃薯驯化成为能够用种子来进行繁殖的作物。但是,这种方法的一个重要的障碍是大多数的二倍体马铃薯种质中存在着自交不亲和现象[33]。而自交不亲和性是一种生殖隔离的现象,在自然界中40%的开花植物都存在着自交不亲和,其中包括十字花科、茄科、蔷薇科和罂粟科等至少100种植物种类[34-35]。前人研究证实,植物配子体自交不亲性除了SLF和S-RNase之外,还存在其他位于S位点外的SBP1基因。目前,马铃薯自交不亲和相关的研究主要集中在S-RNase[1,16,31,33,36]和SLF[18-19]2种基因,而关于SBP1基因的研究较少。本研究以二倍体马铃薯野生种为材料,克隆得到一个自交不亲和相关基因SpSBP1,进一步对该基因的序列和功能进行了分析及生物信息学预测,序列分析得出,SpSBP1蛋白包含RING finger结构域,前人研究表明,SBP1是一类RING-finger蛋白,是植物体内存在的一类新的参与基于核酸酶的自交不亲和反应因子[20]。另外,Zeng等[27]在野生矮杏仁中也鉴定出含有 SCFSFB复合物新的SBP1基因。序列比对及进化树分析得出,二倍体马铃薯野生种SpSBP1具有一定的序列保守性,并且与马铃薯野生种ScSBP1及花烟草NaSBP1亲缘关系最近,而这几个物种同属茄科植物,推测SPB1基因可能在同一科作物中具有更高的保守性,这与同科植物基因家族成员具有更高的保守性研究结果相符[37]。O′Brien等[24]报道,马铃薯ScSBP1基因几乎在所有的组织中均有表达,其作用比仅参与自交不亲和的基因更普遍。通过进一步研究证实,ScSBP1在马铃薯自交不亲和性中具有重要的作用。Lee等[25]通过研究表明,花烟草NaSPB1和NaPCCP与雌蕊AGPs之间的结合可能对植物中正在生长的花粉管内信号的传导和运输有帮助。以上研究表明,SBP1与植物配子体自交不亲和存在一定关系,因此,SpSBP1也可能与二倍体马铃薯野生种自交不亲和相关。
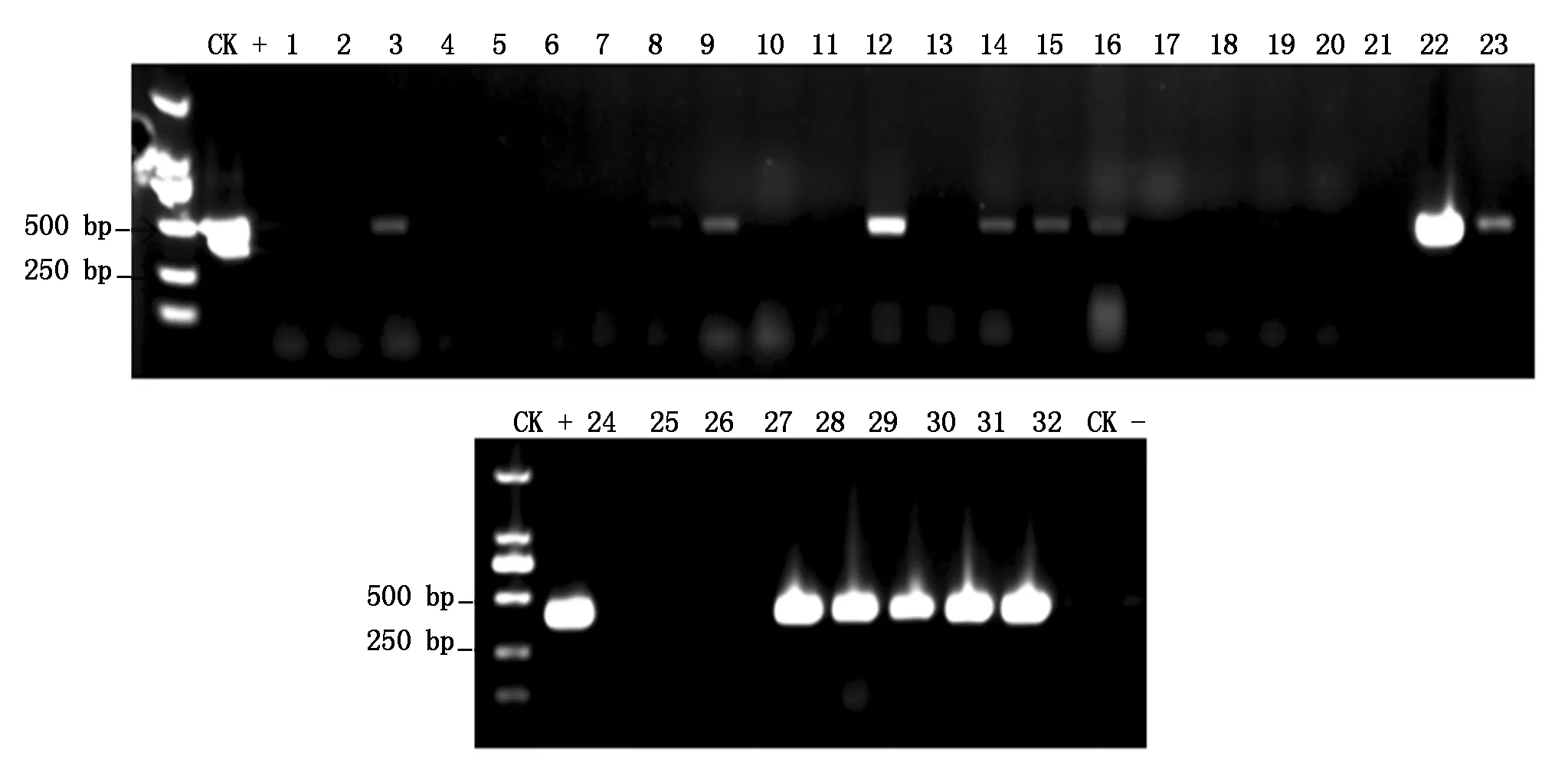
M.Marker DL2000;CK+.阳性质粒对照;CK-.未转化植株对照;3,9,12,14—16,22—23,27—31.阳性植株;1—2,4—8,10—11,13,17—21,24—26,32.阴性植株。M.Marker DL2000;CK+.Positive plasmid control;CK-.Untransformed plant control;3,9,12,14—16,22—23,27—31.Positive plants;1—2,4—8,10—11,13,17—21,24—26,32.Negative plants.
近年来,CRISPR/Cas9技术在植物基因编辑研究中应用的越来越多,其通过对目标基因进行高效准确的修饰,为植物遗传改良开辟了新途径[38-41]。Sun和Kao[42]通过CRISPR/Cas9技术证实,矮牵牛PiSSK1在自交不亲和中发挥了特殊的作用,并支持了含SLF蛋白的SCF复合体对授粉亲和性至关重要的假设。Ye等[1]利用CRISPR-Cas9系统敲除自交不亲和基因S-RNase,培育出了自交亲和的二倍体马铃薯。Ma等[43]通过研究表明,CRISPR/Cas9系统能够与内源tRNA处理系统相结合,能够作为一种改善卷心菜性状的有效工具。Enciso-Rodriguez等[31]利用CRISPR-Cas9技术敲除S-RNase,从而克服二倍体马铃薯的自交不亲和性,为马铃薯二倍体育种提供一种有效的途径。Dou等[44]利用CRISPR/Cas9技术制备新型自交不亲和甘蓝型油菜,从而能够加速杂种优势的利用。在本试验中,也成功利用CRISPR/Cas9系统构建出二倍体马铃薯野生种SpSBP1基因的敲除载体,并转化马铃薯外植体获得阳性植株。
本研究应用RT-PCR技术从二倍体马铃薯野生种中克隆得到自交不亲和相关基因SpSBP1的cDNA序列,全长为1 176 bp,其最大开放阅读框大小为921 bp,编码的氨基酸数为306个,分子质量大小为34.731 44 ku。多序列比对及进化树分析表明,马铃薯野生种SpSBP1与马铃薯野生种ScSBP1的亲缘关系最近,其次为花烟草。对其理化性质进行预测分析,得出其编码蛋白SpSBP1为酸性不稳定亲水性非分泌蛋白。同时成功构建了SpSBP1-CRISPR/Cas9载体,并通过遗传转化法,获得了阳性植株,后续将进一步研究该基因在二倍体马铃薯野生种自交不亲和性中的调控机制,研究结果能够为二倍体马铃薯杂交育种平台的建立提供理论依据及起始育种材料。

