水分活度对贮藏脱水香葱的风味和菌群的影响
谢旻皓,浦浩亮,苏安祥,胡秋辉,杨文建*
(南京财经大学食品科学与工程学院,现代粮食流通与安全协同创新中心,江苏 南京 210023)
香葱(Allium schoenoprasum)是一种广受欢迎的百合科类蔬菜和调味品,具有味清香微辣、可去腥调味等风味特点以及抗氧化、抑菌和抗炎等生物活性[1-2]。新鲜香葱含水量高,容易腐败变质;脱水干制后香葱货架期延长,并且具有易储存、体积小、运输及食用方便等优点,因此脱水干制品也是香葱重要的消费形式[3-4]。目前关于脱水香葱的研究主要集中在干制工艺和品质保持等方面,主要加工方式包括热风干燥、冷冻干燥、红外干燥、联合干燥等[4-6],但脱水香葱在贮藏过程中的品质劣变和安全控制还较少研究。
在贮藏过程中,脱水蔬菜常常发生因受潮吸水而导致的严重品质劣变和微生物生长等问题,从而大大降低了其商品价值。环境水分活度(water activity,aw)对果蔬干制品的品质稳定性至关重要[7]。脱水蔬菜在贮藏期间水分含量及水分流动性持续增加,从而影响香葱等脱水蔬菜的化学稳定性和微生物多样性和组成[2,8-9]。微生物生长和增殖与aw密切相关,相关研究报道了多种食品体系中aw对微生物生长以及群落组成的影响[10-12]。Martins等研究表明,aw越高,葡萄皮表面的微生物代谢活性越强,多样性越丰富,可培养的微生物种群也越多[13]。微生物的生长会消耗基质营养物质并产生多种代谢产物,由此引起食品品质和风味的劣变,从而影响其市场价值。贮藏期间的aw也会显著影响脱水食品的风味特征。高aw贮藏条件能够导致脱水胡萝卜、脱水香菇等食品特征性风味成分的丢失和风味品质的下降[8,14],贮藏期间的水分迁移也会诱导海参多肽干粉异味挥发性成分的产生[15]。
本课题组前期研究了脱水香葱在不同aw贮藏条件下的外观、水分含量以及分布、微观结构、槲皮素含量等品质变化规律,结果表明脱水香葱在高aw贮藏条件下结合水含量和流动性增加,色泽和硬度下降,微观结构坍塌,槲皮素降解加剧,并且风味成分变化显著[2]。本实验通过分析不同aw贮藏条件下脱水香葱的细菌多样性与菌群变化,通过气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)测定挥发性成分的相对含量,阐释aw贮藏条件对细菌菌群和挥发性成分的影响,并分析挥发性成分与细菌组成之间的关系,探讨不同aw环境下脱水香葱的品质劣变规律和原因,为脱水香葱在贮藏过程中的品质保持和货架期延长提供进一步的理论参考和技术支撑。
1 材料与方法
1.1 材料与试剂
热风干燥脱水香葱购自江苏兴化脱水食品集团有限公司。
C7~C33正构烷烃、二硫基丙醇 美国Sigma-Aldrich公司;TIANamp细菌DNA提取试剂盒 天根生化科技(北京)有限公司;其他常用化学试剂均为国产分析纯。
1.2 仪器与设备
GNP9160型隔水式恒温培养箱 上海精宏实验设备有限公司;7890A-5975C GC-MS仪 美国Agilent公司。
1.3 方法
1.3.1 样品处理与贮藏实验
采用Hatzidimitriou等的方法[16],配制K2CO3、NaNO2、NaCl和KCl饱和溶液各1 000 mL,分别置于直径30 cm干燥器中,用凡士林密封并在25 ℃恒温恒湿箱中平衡2 d,形成aw别为0.43、0.67、0.78和0.84的密闭环境。挑选大小均一、颜色鲜艳的新制备热风干燥脱水香葱200 g放入培养皿中,并放置于干燥器内,不同aw环境设置10 个平行,取贮藏0 d和50 d的样品观察并进行各项指标的测定。
1.3.2 脱水香葱的细菌群落分析
脱水香葱总菌液参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[17]方法获得,按照TIANamp细菌DNA提取试剂盒说明书的步骤提取总菌液DNA。将提取的DNA样品密封,干冰氛围下送至上海天昊遗传分析中心,采用Illumina Miseq平台和进行高通量扩增子测序分析。测序区域为细菌16S rDNA V3~V4区,引物序列为341F:5’-CCTACGGGNGGCWGCAG-3’和805R:5’-GACTACHVGGGTATCTAATCC-3’。每组样品取3 个重复,细菌DNA测序数据经FLASH软件拼接和Usearch过滤非特异性扩增片段,得到有效序列。有效序列由UPARSE软件(v7.0.1001)按97%相似度聚类得到可操作分类单元(operational taxonomic units,OTUs)[18]。使用Mothur软件,参照Ribosomal database project(RDP)数据库,注释OTUs表示的物种信息,并统计样品在生物分类学各分类水平下的物种组成和相对丰度[19]。使用R软件包vegan统计各样品的微生物群落的多样性(Shannon指数和Simpson指数),采用主成分分析(principal components analysis,PCA)、非度量多维尺分析(nonmetric multidimensional scaling,NMDS)和基于Bray-Curtis距离的聚类分析判别细菌群落的组间相似性。
1.3.3 挥发性成分的测定
采用顶空-固相微萃取法(hand space solid-phase microextraction,HS-SPME)萃取不同贮藏条件下脱水香葱的挥发性成分[8,20]。称取1.0 g样品研磨后置于20 mL顶空固相萃取瓶,并加入10 μL内标溶液(二硫基丙醇,0.1 μg/mL),用聚四氟乙烯盖密封,于60 ℃恒温水浴平衡10 min,将老化后的三涂层DVB/CAR/PDMS固相萃取头插入顶空瓶中,固相萃取40 min左右。通过GC-MS对脱水香葱的挥发性成分分离鉴定,将萃取头插入GC-MS进样口中,在250 ℃解析30 min。解析后化合物通过DB-5MS毛细管柱(30 m×0.25 mm,0.25 μm)进行分离。
GC条件:初始温度45 ℃,保持2 min,以5 ℃/min升至130 ℃,再以8 ℃/min升温至200 ℃,最后以12 ℃/min升温至250 ℃,保持7 min;载气He;流速0.8 mL/min;分流比1∶1。MS条件:电子轰击离子源;电子能量70 eV;离子源温度200 ℃;质量扫描范围45~450 u。
将GC-MS分析的质谱数据通过计算机检索与Wiley质谱数据库、NIST/EPA/NIH质谱数据库和NIST 08质谱数据库比较,分析匹配度高于90%的挥发性物质[21]。利用正构烷烃的保留时间计算挥发性化合物的保留指数[22]。
1.4 数据统计与分析
数据结果以平均值±标准差表示。采用SPSS软件对实验数据进行统计分析,以单因素方差分析(one-way analysis of variance,ANOVA)检验显著性,P<0.05表示差异显著。采用线性判别分析(linear discriminant analysis,LDA)和LDA差异贡献分析(LDA effect size,LEfSe)检验微生物物种丰度的组间差异,LDA>2表示差异显著[23]。使用Simca 14.1软件的正交偏最小二乘法(orthogonal partial least squares,OPLS)分析可挥发性成分与细菌之间的相关性。
2 结果与分析
2.1 不同aw环境下脱水香葱的细菌多样性
在不同aw环境下贮藏50 d后,脱水香葱样品表现出不同的外观品质。高aw条件(0.78和0.84)下贮藏的香葱样品发生非常明显的褐变和微生物增殖的情况,已经失去了实际利用价值,而低aw贮藏条件(0.43)下的脱水香葱样品变化较小。进一步采用高通量测序技术研究不同aw环境下脱水香葱的细菌群落组成的差异。随着测序深度的增加,各脱水香葱样品中检测到的细菌OTUs数量增加并逐步趋于平稳(图1A),Shannon指数也达到稳定(图1B),表明测序深度已经几乎覆盖脱水香葱样品中的所有细菌物种,测序数据可信。Shannon和Simpson多样性指数分析结果表明,贮藏前的脱水香葱样品细菌多样性最低,贮藏50 d后,脱水香葱的细菌多样性相比贮藏前显著升高,但是不同aw条件下香葱的细菌多样性之间没有显著性差异(图1C、D)。

图1 不同aw贮藏条件下脱水香葱样品细菌的稀释曲线(A)、Shannon曲线(B)、Shannon指数(C)和Simpson指数(D)Fig.1 Rarefaction curves (A), Shannon curves (B), Shannon indexes (C)and Simpson indexes (D) of the microbiota in chive samples stored at different aw conditions
2.2 不同aw环境下脱水香葱细菌组成的相似性
所有脱水香葱样品含有的细菌的DNA一共被归为1 714 个OTUs,其中所有样品共有的OTUs 137 个,有4 个和257、121、274、158 个OTUs分别仅出现在贮藏0 d和aw为0.43、0.67、0.78和0.84下的脱水香葱样品中(图2A)。PCA、NMDS和聚类分析结果表明,在不同aw条件下贮藏50 d之后,脱水香葱样品的细菌群落结构与贮藏前的样品显著不同(图2B~D)。值得注意的是,在NMDS分析中,随着贮藏环境aw的增加,贮藏50 d后的脱水香葱的细菌群落结构在MDS1轴上距离贮藏前的样品的距离越来越远。这些结果表明,贮藏环境的aw对贮藏脱水香葱的细菌群落有显著影响。

图2 不同aw贮藏条件下脱水香葱样品细菌的相似性Fig.2 Similarity in the microbiota in chive samples stored at different aw conditions
2.3 不同aw环境对脱水香葱细菌菌落组成的影响
如图3A、D所示,在贮藏前,脱水香葱样品含有的细菌以Proteobacteria和Firmicutes为主,其他门的细菌很少;在不同aw条件贮藏50 d后,Firmicutes的相对丰度下降,出现大量Actinobacteria以及Bacteroidetes等其他门的细菌,并且高aw条件(0.78和0.84)下的脱水香葱样品Actinobacteria相对丰度高于低aw条件(0.43和0.67)下贮藏的香葱样品。如图3B、D所示,在科水平上,相比贮藏前样品(0 d),在不同aw条件贮藏50 d,所有样品的Leuconostocaceae和Enterobacteriaceae相对丰度都显著降低(LDA>2);贮藏在最高aw条件(0.84)下的脱水香葱样品中,Micrococcaceae、Microbacteriaceae、Sphingomonadaceae、Nocardiaceae、Propionibacteriaceae、Burkholderiaceae等17 个科的相对丰度显著高于其他所有组(LDA>2)。如图3C、D所示,在属水平上,不同aw条件贮藏50 d后的所有香葱样品中的Weissella、Erwinia、Rosenbergiella、Ewingella的相对丰度显著降低(LDA>2);在aw0.84条件下贮藏的样品有Kocuria、Rhodococcus、Microbacterium、Streptococcus、Propionibacterium、Clostridium_sensu_stricto、Bacillus等20 个属的相对丰度高于其他组(LDA>2)。本课题组前期实验观察到,Leuconostocaceae、Enterobacteriaceae、Weissella、Ewingella等也是未经贮藏的脱水香菇样品中的优势菌种群,贮藏50 d后脱水香菇的Weissella、Lactococcus等菌的相对丰度下降,Kocuria、Bacillus等的相对丰度随着aw增加而上升[9]。Park等研究了Saeng-sik(一种含有谷物、水果、蘑菇、海藻等原料的干燥粉状即食食品)中的细菌组成,发现随着的aw增加,Bacillus相对丰度显著上升[24],与本实验结果趋势一致。Streptococcus等乳酸菌可能引起食品腐败变质并产生异味化合物[25]。Kocuria、Rhodococcus、Microbacterium、Streptococcus、Propionibacterium、Bacillus等都是革兰氏阳性菌,它们相较于革兰氏阴性菌对干燥和机械处理的耐受程度更高,更容易在脱水和加工过程中存活[26]。Weissella可产生细菌素等物质,能抑制食源性病原菌和腐败微生物的生长[27],其相对丰度降低可能为其他微生物生长提供条件。
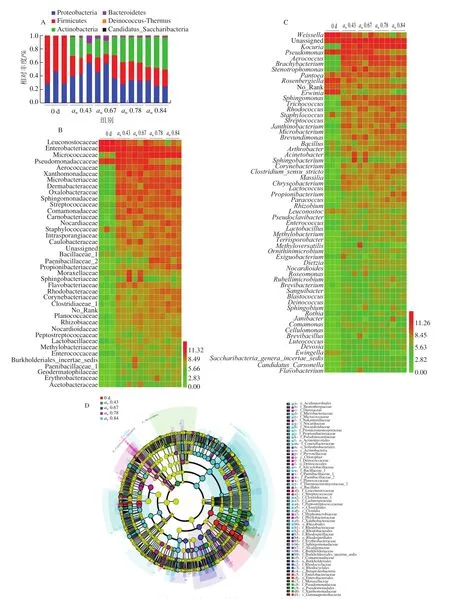
图3 不同aw贮藏条件下脱水香葱样品细菌的群落组成Fig.3 Microbial community composition in chive samples stored at different aw conditions
2.4 不同aw环境对脱水香葱挥发性成分的影响
表1列出了贮藏前和在不同的aw条件下贮藏50 d脱水香葱中的挥发性化合物的相对含量。将鉴定出的32 种挥发性化合物,根据风味物质的化合物类别,归为烃类、酮类、硫化物类、醇类和醛类、酯类和其他(杂环和芳香族化合物)6大类,包括烃类15 种、酮类5 种、硫化物3 种、酯类3 种、醇类和醛类2 种,其他4 种。对于贮藏前的样品,共检测出20 种挥发性物质,其中硫化物是主要挥发性风味化合物,包括二甲基三硫、2,5-二甲基噻吩、甲基丙基二硫醚,其相对含量分别为4.22%,13.77%和2.63%;另外,2,3-二甲基吡啶相对含量最高,达25.86%。刘源[28]、田震[29]等采用SPME-GC-MS检测了新鲜香葱的挥发性成分,表明含硫化合物是主要的挥发性成分,包括甲基丙基二硫醚、三甲基二硫醚、二丙基二硫醚、二丙基三硫醚等。田震等还发现烃类化合物是香葱干制品中主要挥发性成分,并且干燥方式会显著影响香葱挥发性化合物的种类和含量[29]。经过50 d贮藏之后,硫化物的种类和相对含量均出现下降的现象。当贮藏在aw高于0.67的环境下,脱水香葱失去了典型的挥发性物质二甲基三硫和甲基丙基二硫醚。硫化物的相对含量也从0 d样品的20.62%最低下降到3.38%(aw0.78)。在硫化物损失的同时,贮藏50 d之后烃类的种类和相对含量增加,尤其是4-异丙基甲苯,在aw0.78和0.84条件下的相对含量均超过了30%;萜品油烯相对含量随着aw的升高而增加,从贮藏前的2.27%达到12.57%(aw0.84)。硫化物种类和相对含量减少和烷烃类种类和相对含量的增加,表明贮藏条件的高aw会引起特征风味物质损失。在本课题组之前的研究中也发现了类似的结论,高aw贮藏条件能够加剧脱水胡萝卜、香菇等脱水果蔬食品的特征性风味成分的丢失和风味品质的下降[8,14]。
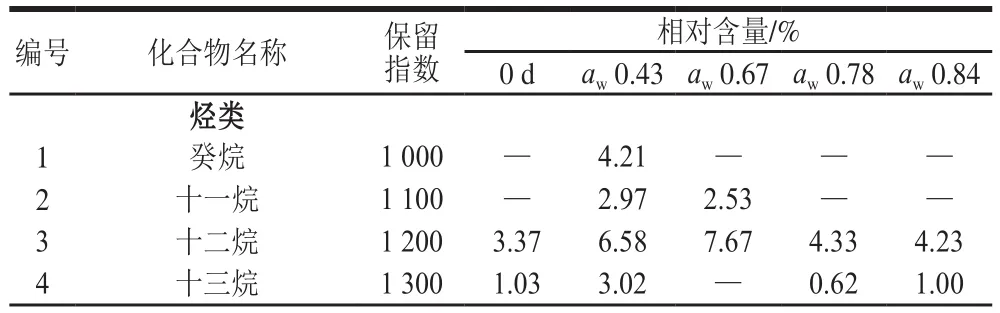
表1 不同aw环境下脱水香葱挥发性成分含量的变化Table 1 Changes in the contents of volatile compounds in dried chives stored at different aw conditions
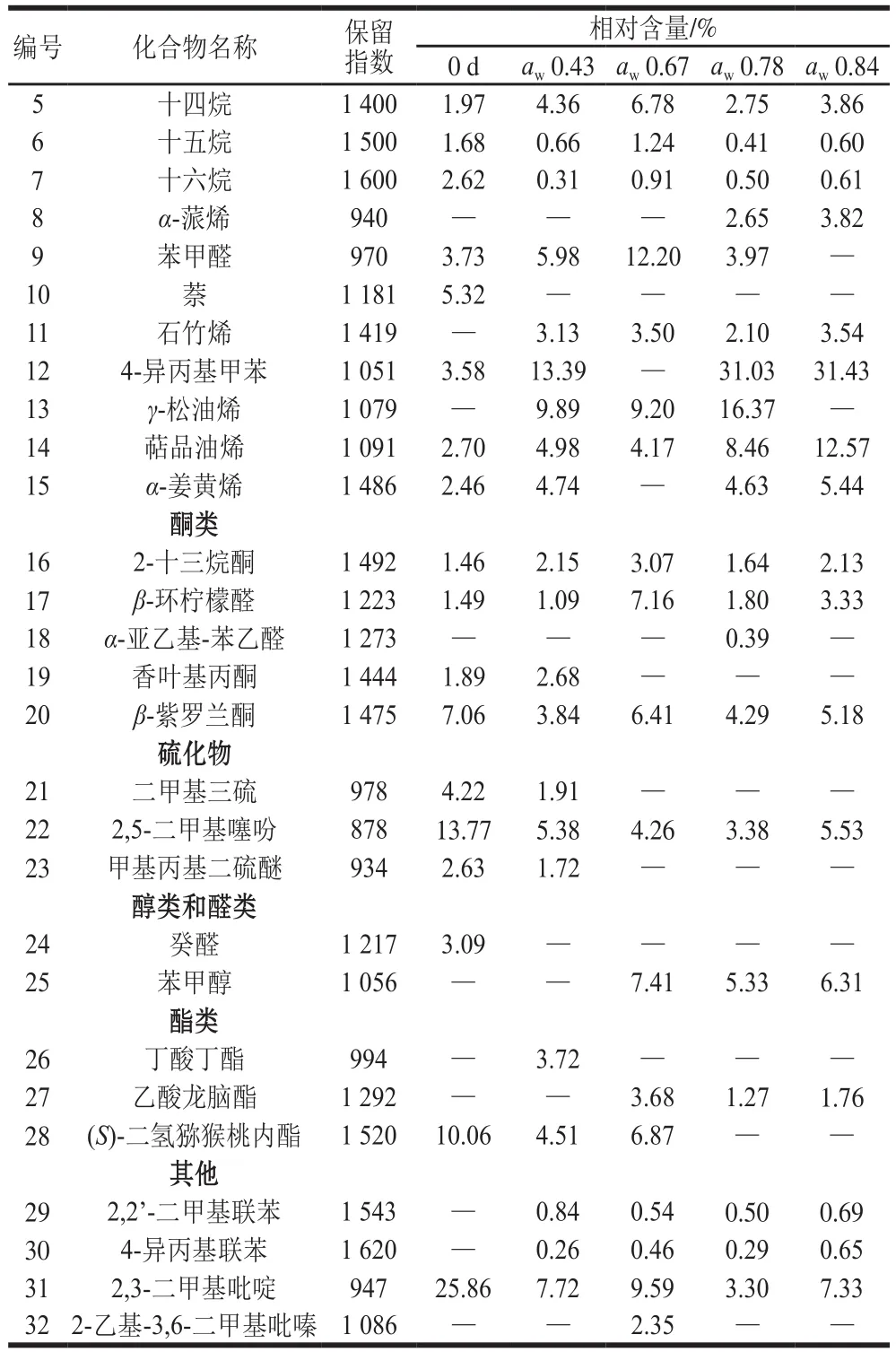
续表1
2.5 挥发性成分与细菌之间的相关性
脱水香葱的挥发性成分的变化可能是由微生物代谢引起的,细菌会产生一系列挥发性有机化合物,从而影响食物的风味。为探明脱水香葱贮藏前及在不同aw条件下贮藏50 d的细菌群落和挥发性化合物相对含量的相关性,采用OPLS模型建立脱水香葱样品中挥发性化合物的相对含量与细菌种属相对丰度之间的相关性。OPLS模型的R2Y和Q2分别为0.659和0.605,表明OPLS方法适合于该实验的分析和预测。根据挥发性化合物和属水平上细菌之间的相关系数可知,36 种细菌和30 种挥发性化合物相关(|ρ|>0.70)。挥发性化合物与细菌的关系如图4所示,可以看出Kocuria、Streptococcus、Nocardioides、Ewingella、Rosenbergiella、Dietzia、Erwinia、Microbacterium、Bacillus等菌的相对丰度与多种挥发性成分的生成和相对含量降低关系密切,可能对脱水香葱的贮藏特性和产品品质具有重要影响。脱水香葱在贮藏过程中的气味变化可能来源于挥发性化合物前体的转化,也可能是微生物的生长和代谢产生的挥发性有机成分影响了食品的风味[30-31]。
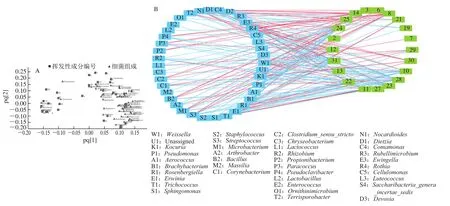
图4 脱水香葱挥发性成分和细菌组成的相关性Fig.4 Correlation between volatile compounds and microbial communities in dried chives
3 结 论
本实验研究了脱水香葱在不同aw条件下贮藏50 d后的挥发性成分和细菌群落组成,并探讨两者之间的相关性。实验结果表明,在不同aw条件下贮藏50 d后,脱水香葱的细菌多样性显著升高,但是不同aw条件下香葱的细菌多样性之间没有显著性差异;脱水香葱样品的细菌群落结构与贮藏前的样品显著不同,并且贮藏环境的aw对贮藏脱水香葱的细菌群落有显著影响。贮藏50 d后,脱水香葱样品的Firmicutes门,Leuconostocaceae和Enterobacteriaceae科,Weissella、Erwinia、Rosenbergiella和Ewingella属的相对丰度显著降低;贮藏在最高aw(0.84)下的脱水香葱样品中的Micrococcaceae、Microbacteriaceae、Nocardiaceae等17 个科和Kocuria、Streptococcus、Bacillus等20 个属的相对丰度显著高于其他组。贮藏50 d之后,脱水香葱挥发性成分中的硫化物的种类和相对含量下降,烃类的种类和相对含量增加。另外,Kocuria、Streptococcus、Bacillus等菌的相对丰度与多种挥发性成分的生成和相对含量降低关系密切。本研究揭示了aw对脱水香葱的贮藏特性和产品品质的重要影响,可为脱水香葱在贮藏过程中的品质保持和货架期延长提供进一步理论参考和技术支撑。
- 食品科学的其它文章
- 花中多糖化学组成与生物活性研究进展
- 番茄碱的制备及其对乙酰胆碱酯酶的抑制作用
- 色氨酸抑制体外模型中晚期糖基化终末产物形成机理
- 松油烯-4-醇对荧光假单胞菌抑菌能力及作用机理
- Widely Targeted Metabolomic and Transcriptomic Analyses Reveal the Regulation of Trypsin on Antioxidant Enzymes and Saturated Fatty Acids in Hylocereus undatus Fruit during Storage
- 乙烯利处理‘赤霞珠’葡萄果实对其葡萄酒中酚类物质组分的影响

