外源蔗糖处理对采后桃果皮色泽形成的影响
田梦瑶,周宏胜*,唐婷婷,张映曈,凌 军,罗淑芬,李鹏霞,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.江苏省农业科学院农业设施与装备研究所,江苏 南京 210014;3.江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014)
桃(Prunus persica(L.) Batsch)果实因其独特的风味和优良的外观品质深受消费者的喜爱,其中果皮色泽是评价桃外观品质的最重要指标之一。套袋栽培可有效提升桃果外观品质,既可保持果面光洁又会促进摘袋后果皮的着色[1]。套袋桃果实需在成熟前摘袋接受光照,进而促进色泽的形成,但生产中由于人工成本较高等因素常不摘袋采收,这影响了桃采后果皮色泽的形成和商品价值。因此,在采后环节,寻求一种安全有效的提升套袋采收桃果实外观色泽的方法具有重要意义。
花色苷是苯丙烷类合成通路的重要次生代谢产物,是桃、苹果和草莓等水果的主要呈色物质,在果实色泽和外观品质提升方面起着重要的作用[2]。花色苷类物质具有较强的抗氧化能力和抗炎功能,且花色苷的积累有助于果实耐寒性和真菌抗病性的增强[2]。研究发现,桃果实颜色的变化主要是花色苷类物质积累的结果,导致桃果皮呈红色的主要花色苷为矢车菊素-3-葡萄糖苷[3-5]。
研究发现,除光和温度等环境因子会影响花色苷的合成外,糖对花色苷的合成也有促进作用[6]。刘玉莲[7]研究发现4 个不同品种的苹果果皮中花青苷的积累都与蔗糖和果糖含量变化呈显著正相关。李紫薇等[8]研究发现蔗糖能够明显抑制亚硝酸钠对采后野生樱桃李中花色苷的氧化降解作用,有助于花色苷的积累。花色苷的合成与果实内部的糖紧密相关[9-11],糖可能是作为信号分子通过调控花色苷合成相关酶和表达相关基因而影响果实的着色[12]。目前,糖信号影响桃采后花色苷积累的相关报道较少,本实验以套袋采收的‘春美’桃为试材,探究采后外源蔗糖处理对桃果皮着色的影响,旨在为套袋桃果实采后着色机理提供参考,且为桃色泽提升技术研发提供理论依据。
1 材料与方法
1.1 材料与试剂
本实验的桃品种为‘春美’桃,果实在花后45 d套“内黑外黄”双层纸袋,果实七成熟后连同果袋采收于江苏省新沂市商业化果园。桃果实采后4 h内运至江苏省农业科学院农业设施与装备研究所,挑选外观、大小一致且无机械损伤的桃果实作为实验材料。
β-巯基乙醇 北京盛科博源生物科技有限公司;牛血清白蛋白 北京索莱宝科技有限公司;聚乙二醇20000、甘露醇和花旗松素 上海源叶生物科技有限公司;柚皮苷、酮戊二酸和聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP) 上海麦克林生化科技有限公司;蔗糖 西陇科学股份有限公司;肉桂酸-4-羟化酶(cinnamate-4-hydroxylase,C4H)、4-香豆酰辅酶A连接酶(4-coumarate-CoA ligase,4CL)、查耳酮合成酶(chalcone synthase,CHS)、查耳酮异构酶(chalcone isomerase,CHI)、二氢黄酮醇4-还原酶(dihytroflavonol 4-reductase,DFR)和类黄酮-3-O-葡萄糖基转移酶(UDP-glucose: flavonoid 3-O-glucosyltransferase,UFGT)ELISA试剂盒 南京晶美生物科技有限公司。
1.2 仪器与设备
PL202-L电子天平、Seven multi pH计 梅特勒-托利多仪器(上海)有限公司;HH-S系列数显恒温水浴锅常州万达升实验仪器有限公司;7820A气相色谱仪美国Agilent公司;3K-15离心机 美国Sigma-Aldrich公司;2695高效液相色谱仪 美国Waters公司;CR-400全自动测色色差仪 日本Konica Minolta公司;A11 Basic液氮研磨器 艾卡(广州)仪器设备有限公司;UV-1102型紫外-可见分光光度计 上海天美科学仪器有限公司;雪花制冰机FM40 北京长流科学技术公司;FT-02型硬度计 意大利Breuzzi公司;手持式折射仪 日本Atago公司。
1.3 方法
1.3.1 外源蔗糖浸泡处理最适浓度的筛选
将桃果实分别用0、50、100、200 mmol/L和500 mmol/L的蔗糖水溶液浸泡处理3 h后清水冲洗晾干,将5 组果实置于常温((20±1)℃)条件下贮藏,在贮藏4 d后测定其色差并拍摄照片,通过外观确定外源蔗糖处理的最适浓度。
1.3.2 外源蔗糖的处理
将桃果实用1.3.1节中确定的外源蔗糖最适处理浓度(200 mmol/L)浸泡处理3 h后清水冲洗、晾干,作为蔗糖处理组,清水浸泡3 h后冲洗晾干的桃果实作为对照组,将2组果实置于室内((20±1)℃、自然光照)条件下贮藏5 d,每个处理设3 次重复实验。取样:贮藏期间每隔1 d取样,每组随机取桃果实24 个,其中每次重复8 个桃果实,测定呼吸强度、乙烯释放速率和色差并拍摄照片。用不锈钢刀片分离桃果皮和果肉后分别置于液氮中速冻,存放在-80 ℃冰箱中,用于测定相关指标。
1.3.3 色差的测定
色差的测定参照王瑶等[13]的方法:用CR-400全自动色差仪测定桃皮的L*、a*和b*值,并分别按式(1)~(3)计算出对应的色饱和度C*、色调值H和色泽指数(color index of red grape,CIRG)。每次处理测定20 个桃,结果取平均值。
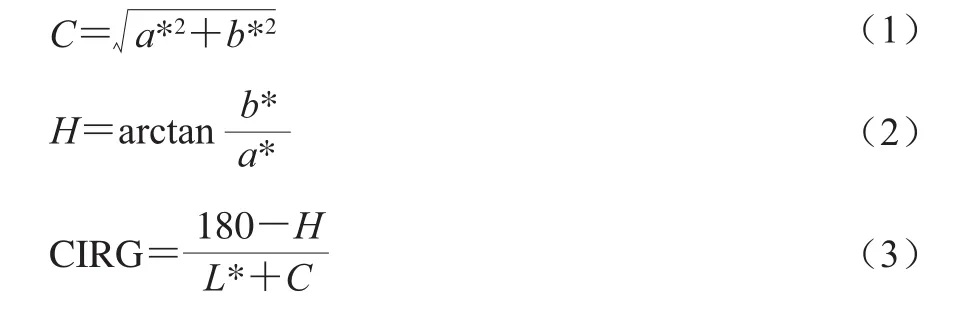
1.3.4 呼吸强度、乙烯释放速率、可溶性固形物质量分数和硬度的测定
呼吸强度的测定参照周宏胜等[14]的方法;乙烯释放速率的测定参照王瑶等[13]的方法;可溶性固形物(total soluble solid,TSS)质量分数和硬度的测定参照梁敏华等[15]的方法。
1.3.5 果皮内源糖含量的测定
参照刘玉莲等[16]的方法测定桃皮中蔗糖、葡萄糖、果糖和山梨醇4 种内源糖的含量,并稍作修改:称取1 g桃皮样品,加4 mL纯净水,室温浸提20 min后离心(10 000×g、20 min、4 ℃),上清液过0.45 μm纤维素酯滤膜。
高效液相色谱条件:流动相为超纯水;采集数据时间25 min;色谱柱:Hi-Plex Ca(300 mm×7.7 mm,8 μm);柱温:80 ℃;流速:0.6 mL/min;检测器:示差检测器;进样量:10 μL。
1.3.6 总花色苷含量的测定
桃皮中总花色苷含量的测定采用pH值示差法[17]:取1 g桃皮样品,加入6 mL体积分数95%的酸化甲醇(0.1 mol/L HCl),于黑暗条件下振荡提取4 h,离心(10 000 ×g、20 min、4 ℃)提取上清液。提取液分别用0.025 mol/L KCl缓冲液(pH 1.0)和0.4 mol/L醋酸钠缓冲液(pH 4.5)稀释3 倍,室温下放置15 min后测定溶液在520 nm和700 nm波长处的吸光度。按式(4)计算总花色苷含量。
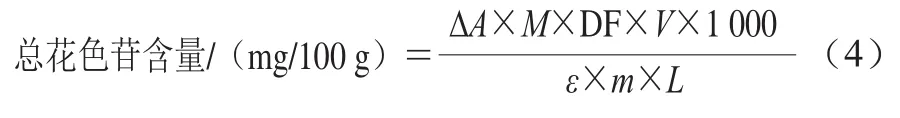
式中:ΔA=(A520nm-A700nm)pH1.0-(A520nm-A700nm)pH4.5;M为氰化-3-葡萄糖苷的摩尔质量(C21H21O11,449.4 g/mol);V为提取液定容体积/mL;DF为总稀释倍数;ε为对照品摩尔吸光系数(26 900 L/(mol·cm));m为样品质量/g;L为比色皿的宽度(1 cm)。
1.3.7 花色苷代谢相关酶活力的测定
花色苷代谢相关酶粗酶液的提取参照Zhou Dandan等[18]的方法。
苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活力的测定:取0.5 mL PAL粗酶液和3 mL苯丙氨酸(10 mmol/L)的反应混合物在37 ℃下孵育1 h,之后立即加入0.2 mL 6 mol/L HCl溶液终止反应。在相同的反应体系和条件下,以煮沸的PAL粗酶液为对照,测定反应液在290 nm波长处的吸光度,酶活力单位为U/g。
F3H活力的测定:取0.5 mL F3H粗酶液加入2.5 mL F3H酶反应液(50 mmol/L,pH 7.4 Tris-HCl内含5 mmol/L NADPH-Na2、1.5 mmol/L柚皮苷),充分混匀后在35 ℃孵育1.5 h后用5 mol/L HCl溶液停止反应。以等体积的酶反应液加入煮沸的F3H粗酶液和HCl为对照,测定反应液在320 nm波长处的吸光度,酶活力单位为U/g。
花青素合成酶(anthocyanidin synthase,ANS)活力的测定:取0.5 mL ANS粗酶提取液加入2.5 mL ANS反应液(40 mmol/L,pH 7.0磷酸盐缓冲液内含1 mol/L NaCl、100 mmol/L麦芽糖、100 mmol/L二硫苏糖醇、80 mmol/L抗坏血酸、40 mmol/L酮戊二酸、16 mmol/L FeSO4和1 mmol/L花旗松素),充分混匀后于340 nm波长处测定吸光度,酶活力单位为U/g。
C4H、4CL、CHS、CHI、DFR和UFGT活力采用ELISA试剂盒测定。
1.4 数据统计与分析
所有实验平行测定3 次,数据采用平均值±标准误差表示,用SPSS 24.0软件进行统计学分析,以单因素方差分析和Tukey’s多因素t检验进行比较(P<0.05为差异显著),并用Origin 8.5软件作图。
2 结果与分析
2.1 外源蔗糖处理最适浓度的筛选
色泽是评价桃外观品质的重要指标之一,色差是反映果实外观色泽的重要指标。a*值表示红色和绿色之间的转换程度,正值为红色,a*值越大,表明果实红色越深;CIRG可评价果实的色泽和成熟度,果实颜色越深,CIRG越大。L*值表示果实的明亮度,L*值越大,表明果皮颜色越白亮[19-20]。由图1可知,200 mmol/L蔗糖溶液浸泡处理的桃果皮a*值和CIRG都显著高于其他处理组,且L*值显著低于其他处理组,说明200 mmol/L为外源蔗糖浸泡处理的最适浓度,着色效果最好。
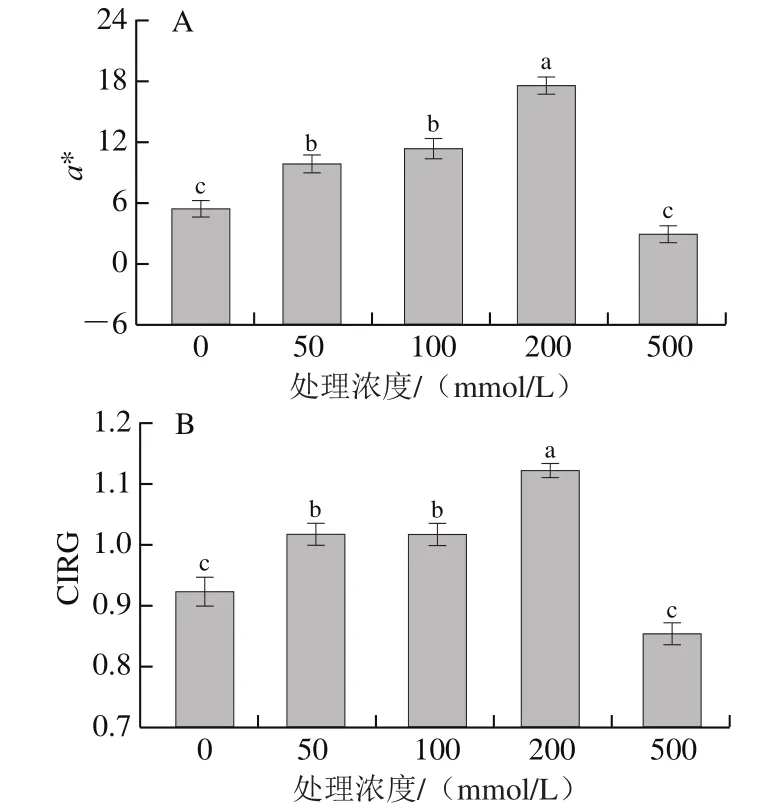
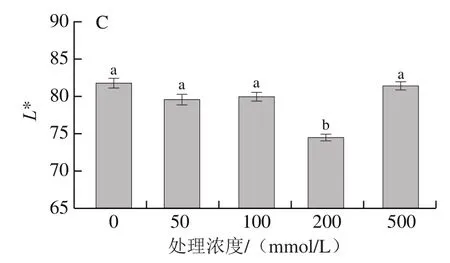
图1 不同浓度蔗糖处理对采后桃果皮a*(A)、CIRG(B)和L*(C)值的影响Fig.1 Effect of sucrose treatment at different concentrations on a* (A),CIRG (B) and L* (C) values of peach peel during postharvest storage
2.2 外源蔗糖处理对采后桃果皮着色的影响
套袋会影响桃果面花色苷的形成和积累[21-22],由图2可知,套袋采收的桃果实果面偏白,缺乏该品种应有的色泽。贮藏过程中,桃果皮色泽逐渐形成,与对照组相比,外源蔗糖处理桃果实的着色时间较早且颜色更为鲜红;外源蔗糖处理能够明显促进采后桃果实果皮色泽的形成,提升桃果实的外观品质。

图2 外源蔗糖处理对采后桃果皮着色的影响Fig.2 Effect of exogenous sucrose treatment on the peel coloration in postharvest peach
2.3 外源蔗糖处理对采后桃果皮色差的影响
由图3A可知,采收时桃果面a*值仅为-5.35,贮藏3 d后蔗糖处理组和对照组果皮a*值分别为5.66和-0.09,说明蔗糖处理组第3天时果面明显变红。由图3B可知,两个处理组的CIRG均呈现先上升后下降的趋势,且从贮藏第3天开始,蔗糖处理组的CIRG显著高于对照组(P<0.05),说明外源蔗糖处理可以促进桃果皮色泽的形成。由图3C可知,采收时果皮L*值为90.08,贮藏4 d后蔗糖处理组和对照组果皮L*值分别为79.34和83.30,且处理组与对照组差异显著(P<0.05),说明果面明亮度已明显发生变化。
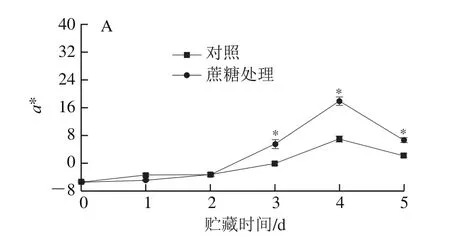

图3 外源蔗糖处理对采后桃果皮a*(A)、CIRG(B)和L*(C)值的影响Fig.3 Effect of exogenous sucrose treatment on a* (A), CIRG (B) and L* (C) values of peach peel during postharvest storage
2.4 外源蔗糖处理对采后桃呼吸强度、乙烯释放速率、TSS质量分数和硬度的影响
桃属于呼吸跃变型果实,在采后的贮藏过程中出现明显的呼吸高峰和乙烯释放高峰是果实成熟和衰老的重要标志[23]。由图4A、B可以看出,两组桃果实的呼吸强度和乙烯释放速率在采后均有明显的上升趋势但两组处理间无明显差异,外源蔗糖处理对采后桃果实的乙烯释放速率和呼吸强度没有明显的影响。
由图4C可知,两组桃果肉的TSS质量分数变化趋势类似。硬度是桃果实重要的感官指标[24],两个处理组的桃果实硬度都随贮藏时间的延长呈下降的趋势(图4D),但两组桃果实硬度间无显著差异,说明外源蔗糖处理对采后桃果实的软化没有明显影响。
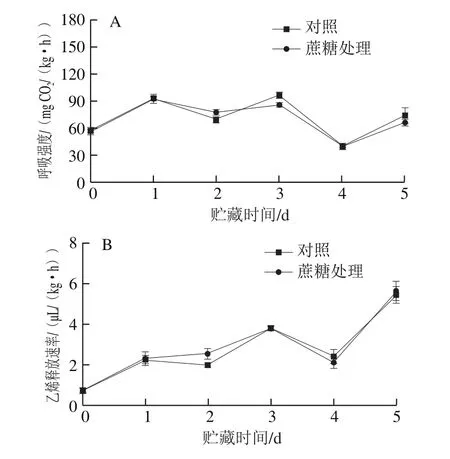
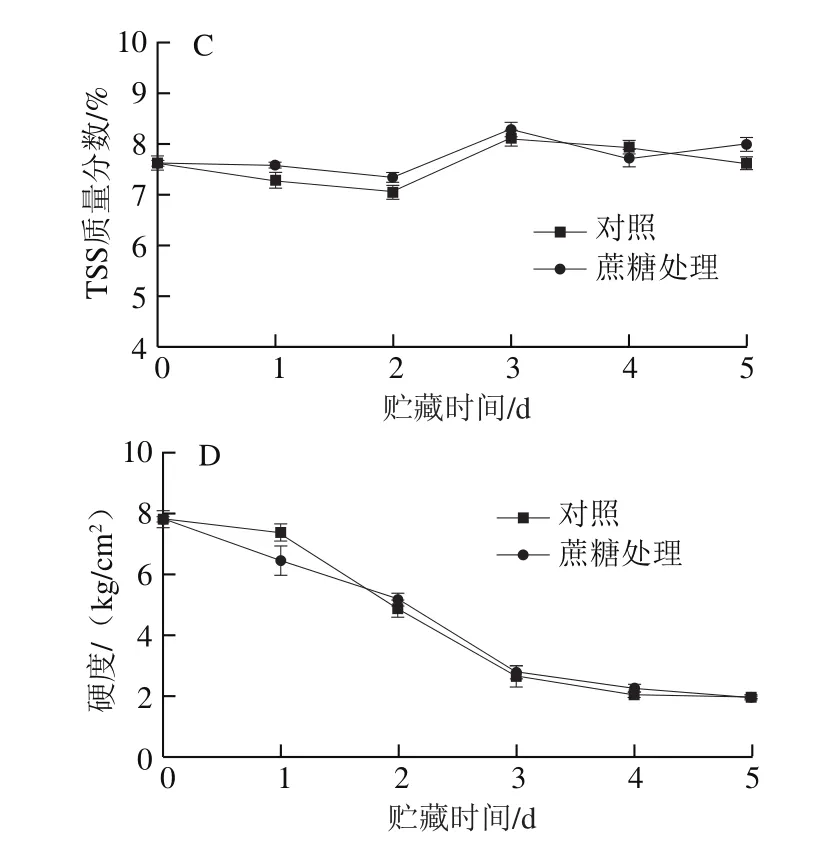
图4 外源蔗糖处理对采后桃呼吸强度(A)、乙烯释放速率(B)、TSS质量分数(C)和硬度(D)的影响Fig.4 Effect of exogenous sucrose treatment on respiratory intensity(A), ethylene release rate (B), TSS content (C) and hardness (D) of postharvest peaches
2.5 外源蔗糖处理对采后桃果皮糖含量的影响
外源糖处理会促进果实内源糖的积累[25],桃果实中主要有蔗糖、葡萄糖、果糖和山梨醇4 种糖,其中蔗糖含量最高,是葡萄糖和果糖含量的数倍,也是影响桃总糖含量的关键因素[26]。由图5A可知,两组桃果皮中蔗糖的含量随贮藏时间的延长呈波动上升的趋势,且在整个贮藏期间处理组蔗糖含量要显著高于对照组(P<0.05),说明外源蔗糖处理促进了桃皮蔗糖的积累;两组桃果皮的葡萄糖含量差异不显著(图5B);贮藏第1天时,蔗糖处理组桃果皮的果糖含量显著高于对照组(图5C),说明蔗糖处理可以抑制贮藏前期果皮果糖含量的下降;两组桃果皮的山梨醇含量均呈现先下降后上升的趋势(图5D),但蔗糖处理组桃果皮中山梨醇含量在贮藏前期显著高于对照组(P<0.05)。


图5 外源蔗糖处理对采后桃果皮蔗糖(A)、葡萄糖(B)、果糖(C)和山梨醇(D)含量的影响Fig.5 Effect of exogenous sucrose treatment on sucrose (A), glucose (B),fructose (C) and sorbitol (D) contents of postharvest peach peel
2.6 外源蔗糖处理对采后桃果皮总花色苷含量的影响
桃果实色泽的提升主要是花色苷类物质积累的结果[3]。由图6可以看出,在整个贮藏期间,桃果皮的总花色苷含量呈先上升后下降的趋势,并均在采后第4天达到最大值,此时处理组和对照组的总花色苷含量分别为29.64 mg/kg和15.98 mg/kg,处理组含量是对照组的1.85 倍,说明蔗糖处理可明显诱导桃果皮花色苷的合成和积累。花色苷含量的变化趋势与色泽指数CIRG的变化趋势一致,表明蔗糖诱导的花色苷含量的升高可能是导致果面色泽提升的重要原因。
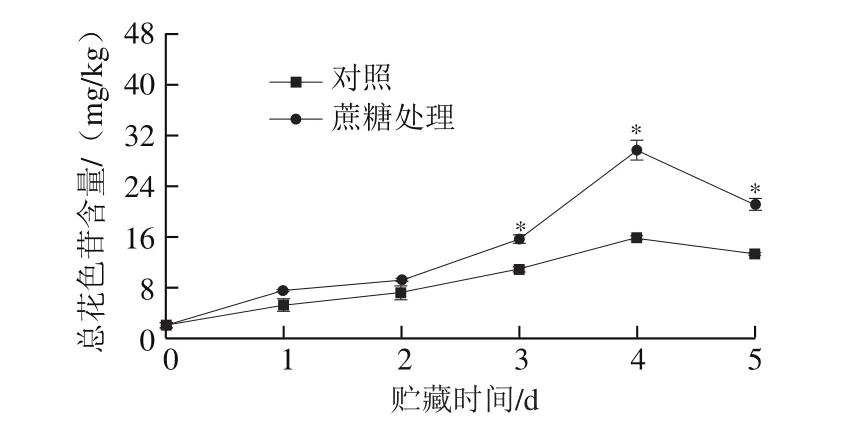
图6 外源蔗糖处理对采后桃果皮总花色苷含量的影响Fig.6 Effect of exogenous sucrose treatment on total anthocyanin content of postharvest peach peel
2.7 外源蔗糖处理对采后桃果皮花色苷合成代谢相关酶活性的影响
PAL、C4H和4CL是苯丙氨酸代谢途径的3 个关键酶,能将苯丙氨酸转化为查耳酮类物质,影响苯丙氨酸代谢途径[27]。由图7A可知,两组处理桃果皮PAL活力的变化趋势相似,蔗糖处理组在第2天达到峰值,而对照组在第3天达到峰值,说明外源蔗糖处理可以加快PAL活性峰值的出现;两处理组的C4H活力均先下降后缓慢上升(图7B),但蔗糖处理组C4H的活力都要显著高于对照组(P<0.05);由图7C可知,对照组的4CL活力在贮藏期间略有上升,蔗糖处理组呈波动上升的趋势,且酶活力显著高于对照组(P<0.05),说明外源蔗糖处理可以明显提高桃果皮在整个贮藏期间的4CL活性。
CHS、CHI和F3H是类黄酮途径中的3 个关键酶,能将香豆素CoA转化为二氢黄酮类物质[27]。由图7D可知,蔗糖处理组和对照组在贮藏期间CHS的变化趋势一致,但蔗糖处理组的CHS活力高于对照组,说明蔗糖处理可以提高贮藏期间CHS的活性;在整个贮藏期间蔗糖处理组的CHI活力要高于对照组,且在第1天和第3天差异显著(P<0.05)(图7E);由图7F可知,蔗糖处理组的F3H活力在贮藏期间均高于对照组,且在贮藏第2天处理组的F3H活力是对照组的1.37 倍。
二氢黄酮类物质主要经过DFR和ANS的作用生成花青素,并在UFGT的作用下与糖苷结合生成具有稳定结构的花色苷类物质[27]。贮藏前期,蔗糖处理组果皮DFR活力显著高于对照组(P<0.05),贮藏第2天时蔗糖处理组的DFR活力是对照组的2.71 倍(图7G);两组处理间ANS活力均呈现波动上升的趋势,但贮藏期间蔗糖处理组的ANS活力均高于对照组(图7H);由图7I可知,蔗糖处理组的UFGT活力呈现先下降后上升的趋势,且在整个贮藏期间的活力都显著高于对照组(P<0.05),表明蔗糖处理可以在整个贮藏期间提高UFGT的活性。
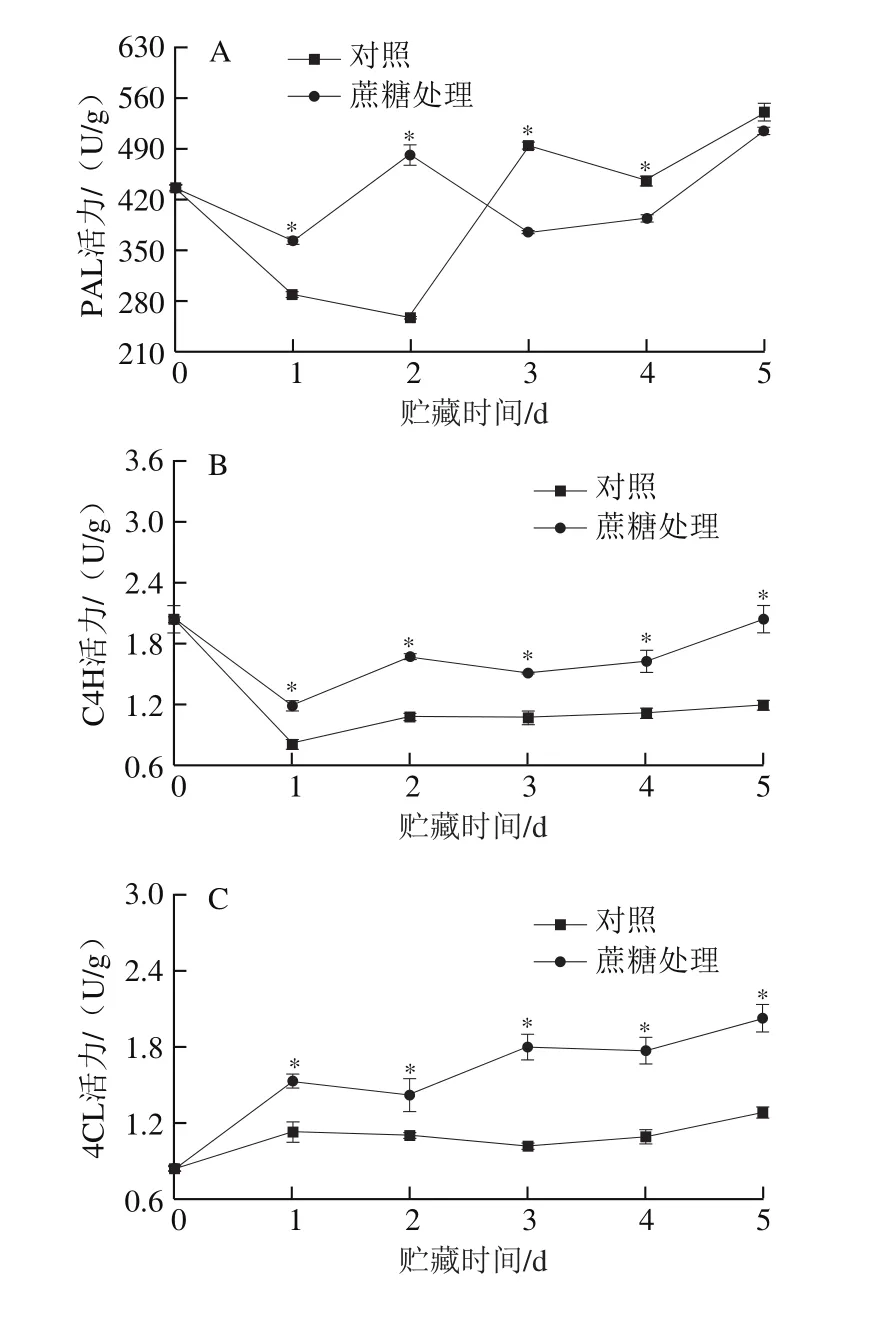

图7 外源蔗糖处理对采后桃果皮花色苷代谢合成相关酶活力的影响Fig.7 Effect of exogenous sucrose treatment on enzyme activities related to anthocyanin synthesis and metabolism in postharvest peach peel
3 讨 论
本研究以套袋‘春美’桃为实验材料,通过采后蔗糖溶液浸泡处理来研究外源蔗糖处理对采后桃果实品质和桃皮花色苷合成的影响。研究发现,外源蔗糖处理可以明显地促进套袋桃果皮的着色,导致果皮红色相关的a*值和CIRG的上升,这与喷施外源蔗糖和果糖可促进采后红皮梨着色的结果[27]一致;乙烯可以启动呼吸跃变型果实的成熟衰老[28],本研究发现蔗糖处理对果实乙烯代谢的影响并不显著,推测糖不仅作为花色苷合成的前体物质,可能也是调控其合成的信号物质[29]。本研究中发现外源蔗糖处理显著促进了桃果皮中蔗糖含量的提升,这与前人研究中发现的外源蔗糖处理促进采后草莓果实糖积累的结果[25,30]类似,说明外源糖处理可能影响果实内源糖代谢。外源蔗糖处理促进了套袋‘春美’桃果皮采后花色苷含量的提高,这与外源蔗糖处理能够增加采后葡萄[31-32]、杜鹃花瓣[33]和花椰菜芽[34]花色苷含量的结果类似。PAL、C4H、4CL、CHS、CHI、F3H、DFR、ANS和UFGT是花色苷合成代谢过程中的关键酶,这些酶活性的提高可以促进花色苷的积累[25]。本研究发现,蔗糖处理组桃果皮中多数花色苷代谢相关酶的活性均要高于对照组,这说明蔗糖处理可能是通过提高套袋桃果皮中花色苷合成相关酶的活性,进而诱导花色苷的积累和外观色泽的改善,这与对草莓[25]和红皮梨[27]研究中发现的结果类似。
综上所述,外源蔗糖处理可以有效促进套袋桃采后着色,原因可能是蔗糖处理影响了桃果皮内源糖的代谢和转化,最终通过提升花色苷代谢相关酶的活性诱导了花色苷的积累和果皮色泽的提升。本研究可为采后桃果皮色泽形成的技术和机理研究提供重要的参考。

