人乳与牛乳N-链寡糖组对小鼠肠道菌群的影响
郭晶宇,陈亚然,毛慧敏,王 婷,Josef VOGLMEIR,刘 丽*
(南京农业大学食品科学技术学院,江苏 南京 210095)
乳是婴幼儿生长发育的理想食品,其含有各种可供婴幼儿生长发育的营养物质和生物活性因子[1]。除了提供基础营养物质外,乳的摄入还有助于婴儿肠道菌群的定植,减少肠道病原体感染和促进肠道上皮细胞的发育等,这主要与乳中的寡糖成分相关[2-4]。寡糖是乳中继乳糖和脂质之后的第三大固体营养成分[5]。与乳糖、脂质和蛋白质等不同,寡糖不易被机体消化系统消化降解,可直接进入大肠[6]。许多研究表明,寡糖可作为碳源被肠道微生物利用,进而影响肠道菌群的组成和代谢产物短链脂肪酸(short chain fatty acids,SCFAs)的产生,具有潜在的益生作用[7-8]。然而大多数的研究都集中在乳游离寡糖上,与乳中结合寡糖相关的研究较少。
结合寡糖一般通过糖苷键与蛋白质或脂质共价连接形成糖缀合物,主要分为N-链寡糖和O-链寡糖,其中研究较广泛的是N-链寡糖。N-链寡糖具有统一的核心五糖结构,由2 个乙酰氨基葡萄糖和3 个甘露糖组成。N-链寡糖可作为某些特定微生物生长的底物,如双歧杆菌[9-10]、拟杆菌属[11]及粪肠球菌属[12]等。这些微生物能够分泌特异性糖苷酶将N-链寡糖从糖蛋白中释放,并作为碳源或者唯一碳源被微生物自身利用。此外,不同类型的N-链寡糖所具有的功能也不相同。岩藻糖基化的N-链寡糖可通过与金黄色葡萄球菌、李斯特菌、沙门氏菌等肠道致病菌竞争,从而影响致病菌对肠道上皮细胞的黏附[13-15]。另外,唾液酸化的N-链寡糖也可抵抗致病性大肠杆菌与肠道上皮细胞的黏附,从而避免炎症的发生[16]。
牛乳配方奶粉通常被用作人乳的替代品。本课题组前期的研究已发现人乳N-链寡糖组(human milkN-glycome,HMN)与牛乳N-链寡糖组(bovine milkN-glycome,BMN)的含量与组成不同,人乳中鉴定到43 种N-链寡糖,而牛乳中鉴定到80 种,其中共有结构为28 种[17]。HMN中唾液酸化与岩藻糖基化的N-链寡糖各占46%和29%,BMN中则各占36%与39%[18]。因此,HMN与BMN在结构与组成上的差异,可能对机体肠道微生物的定植与发展产生不同的影响。
本实验以HMN与BMN为底物,通过体外实验研究肠道微生物对HMN与BMN的降解利用;同时进行体内实验,研究HMN与BMN的摄入对鼠肠道菌群的构成及其代谢产物SCFAs的影响,并将两者进行比较,旨在进一步分析人乳与牛乳之间由于N-链寡糖带来的功能上的差异,为未来婴儿配方食品和功能性乳制品的开发提供参考。
1 材料与方法
1.1 动物、材料与试剂
C57BL/6J型4 周龄雄性小鼠(SPF级,平均体质量(19±1)g)购自上海斯莱克实验动物有限责任公司,生产许可证号为SCXK(沪)2017-0005,使用许可证号为SYXK(苏)2017-0007。
人乳取自江苏省南京市28~32 周岁健康女性产后乳;牛乳 南京西岗果牧厂;三氯乙酸(trichloroacetic acid,TCA)、三氟乙酸(trifluoroacetate,TFA)、2-氨基苯甲酸胺(2-aminobenzamide,2AB) 天津希恩生化科技有限公司;乙腈(色谱纯) 德国默克公司;乙酸、丙酸、丁酸、2-乙基丁酸、2,5-二羟基苯甲酸标准品(色谱纯)和氨水 上海阿拉丁试剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)等其他试剂国药集团化学试剂品有限公司;E.Z.N.A.®Soil DNA Kit试剂盒 美国Omega Bio-Tek公司。
1.2 仪器与设备
Nexera超高压液相色谱仪(配有SIL-30AC自动进样器、LC-30AD泵、RF-20Axs荧光检测器和LC-solution工作站) 日本岛津公司;BEH Glycan column色谱柱(2.1 mm×150 mm,1.7 μm) 美国Waters公司;6890N气相色谱仪 美国Agilent公司;真空离心浓缩干燥机LNG-T83B 太仓市华利达实验设备有限公司;LGJ-12型冷冻干燥机 北京松源华兴科技发展有限公司;PHS-3C型pH计 上海今迈仪器仪表公司;Multiscan FC 35型酶标仪 美国赛默飞世尔科技有限公司。
1.3 方法
1.3.1 人乳与牛乳N-链寡糖组的制备
参考本课题组前期研究中的方法[17]制备HMN与BMN,具体如下。
1.3.1.1N-链寡糖的酶解释放
首先将1 L人乳与牛乳样品分别离心30 min(4 500 r/min、4 ℃),除去上层脂肪。再将样品分别与等体积的40%(质量分数)TCA混合,离心30 min(4 500 r/min、4 ℃)得到蛋白沉淀并水洗至中性。然后加入150 mL 6 mol/L尿素充分溶解蛋白,依次加入115 mL 0.50 mol/L的磷酸盐缓冲液(pH 7.5)和62.5 mL的蛋白变性剂(含质量分数2% SDS、体积分数7%β-巯基乙醇),置于100 ℃水浴锅中热变性30 min。待冷却后,加入150 mL PNGase F酶液、95 mL 10%的Triton-100溶液及560 mL的超纯水,置于37 ℃的恒温培养箱中反应16 h。反应结束后,将整个反应体系与活化好的碳粉充分搅拌混匀,然后用20%乙腈和40%乙腈(含体积分数0.1% TFA)进行洗脱,收集洗脱液并冻干浓缩。最后使用聚丙烯酰胺凝胶Bio-Gel P2柱进行脱盐和纯化处理,洗脱液为体积分数1%冰乙酸溶液,收集洗脱下来的N-链寡糖。
1.3.1.2N-链寡糖的测定
参考文献[17]取少量纯化后的N-链寡糖旋转蒸干,加入2AB,于65 ℃下标记反应4 h,然后利用超高压液相色谱进行检测分析。
1.3.2 动物饲养与样品采集
动物实验方案经过南京农业大学动物实验中心伦理委员会批准。21 只实验小鼠喂养在12 h光照、12 h黑暗、温度(21.0±1.0)℃、相对湿度(60±10)%的SPF级实验动物中心。经7 d的适应性饲喂后,清晨收集小鼠的新鲜粪便用于肠道微生物的体外培养。然后将21 只小鼠随机平均分为3 组,分别为对照组、HMN组和BMN组,每笼放置3~4 只。对照组每只小鼠灌胃200 μL/d无菌水,HMN组每只小鼠灌胃200 μL/d HMN溶液(总物质的量为70 nmol),BMN组每只小鼠灌胃200 μL/d BMN溶液(总物质的量为70 nmol),自由采食和饮水。灌胃21 d后,每组随机选取5 只小鼠,收集清晨新鲜的小鼠粪便,用于总DNA的提取和肠道菌群的检测,同时收集盲肠内容物,并于-80 ℃保存[19]。
1.3.3 肠道微生物的体外培养
1.3.3.1 厌氧培养基的制备
参照李春保等[20]实验方法并稍加修改。参考文献[20]配制微量矿物元素溶液、脂肪酸溶液、氯高铁血红素溶液、维生素溶液;取0.3 g KCl、0.3 g NaCl、0.1 g CaCl2·2H2O、0.25 g MgSO4·7H2O、0.25 g胰蛋白胨、0.25 g NH4Cl、0.34 g KH2PO4、0.125 g酵母提取物、2 g Na2CO3、0.5 mL刃天青(质量分数0.1%)、5 mL微量元素溶液、5 mL脂肪酸溶液和5 mL氯高血红素溶液混合,用去离子水溶解后定容至500 mL,配制培养基。培养基微波加热约15 min,待呈现粉红色后向培养基中通入CO2至培养基澄清,添加L-半胱氨酸盐酸盐(终质量浓度1 g/L)然后继续通入CO2至培养基澄清,最后每管分装9 mL培养基,121 ℃高压灭菌15 min。待培养基冷却至室温后按体积分数1%将维生素溶液(经0.22 μm滤膜除菌)加入培养基中备用。
1.3.3.2 体外培养肠道微生物
向灌胃前收集的新鲜粪便中加入0.01 mol/L、pH 7.4的脱氧磷酸盐缓冲液(1∶10,m/V),混匀后低速离心除去不溶的粪便颗粒,制备菌液。分别取1 mL菌液添加到含有HMN、BMN(总物质的量为700 nmol)的9 mL厌氧培养基中,对照组中加入等体积的脱氧磷酸盐缓冲液,每组5 个重复,37 ℃培养箱中恒温培养24 h,并在0、6、12、24 h分别取样分析HMN与BMN的变化。
1.3.4 鼠粪便菌群中糖苷酶活力的测定
糖苷酶活力的测定参考文献[21]并稍作修改。取1 mL 1.3.3.2节中制备的菌液,8 000 r/min离心5 min,上清液用于胞外糖苷酶活性的测定,沉淀物洗去残留培养基后,用1 mL Lysis buffer重悬,加入10 μL 100 mmol/L苯甲基磺酰氟,超声破碎5 min,离心(12 000 r/min、5 min)取上清液用于胞内糖苷酶活力的测定。以1 μL 10 mmol/L的对硝基苯基-β-D-吡喃半乳糖苷(p-nitrophenyl-β-D-galactopyranoside,pNP-β-Gal)、对硝基苯基-β-D-乙酰氨基葡萄糖苷(p-nitrophenylacetamido-2-deoxy-β-D-glucopyranoside,pNP-β-GlcNAc)、对硝基苯基-α-L-岩藻糖苷(p-nitrophenylα-L-fucopyranoside,pNP-α-Fuc)与对硝基苯基-α-D-吡喃-甘露糖苷(p-nitrophenyl-α-D-mannopyranoside,pNP-α-Man)分别作为底物,加入9 μL的磷酸盐缓冲液(0.01 mol/L、pH 7.4)后,再分别加入20 μL具有糖苷酶的上清液,混匀后置于37 ℃恒温培养箱中反应12 h。反应结束后,95 ℃灭活5 min并离心(12 000 r/min、10 min)取上清液。用酶标仪检测样品在405 nm波长处的吸光度以表征糖苷酶活力,对照组(Control)为与底物等体积的磷酸盐缓冲液。
1.3.5 SCFAs含量的测定
取1.3.2节收集的小鼠盲肠内容物100 mg左右,按1∶5(m/V)的比例溶于水中,然后与等体积的2-乙基丁酸(25 mmol/L,内标物质)混合,8 000 r/min离心5 min,取上清液与草酸溶液(0.15 mol/L)等体积混合均匀并再次离心(8 000 r/min、5 min),取上清液过0.45 μm滤膜后采用气相色谱检测乙酸、丙酸、丁酸的含量。SCFAs的气相色谱检测条件[22]: 6890N气相色谱工作站;HP-INNOWAX毛细管色谱柱(30 m×0.32 mm,0.25 μm);火焰离子化检测器;载气为高纯度的氮气(19.0 mL/min);柱温以10 ℃/min的升温速率从100 ℃升至180 ℃,并在180 ℃下保持4 min。
1.3.6 16 S rDNA高通量测序
按照E.Z.N.A.®Soil DNA Kit试剂盒说明书提取小鼠粪便微生物的总DNA。细菌群落结构研究采用16S rRNA V4~V5区引物515F(上游引物)5’-barcode-GTGCCAGCMGCCGCGG)-3’和907R(下游引物)5’-CCGTCAATTCMTTTRAGTTT-3’进行PCR扩增。利用Qubit®3.0对纯化后PCR产物进行精准定量,然后将带有不同标签序列的24 个扩增子样本等量混合。混合后的DNA产物参照Illumina基因组测序文库构建流程构建Illumina双端测序的PE文库。该扩增子文库参照标准流程采用Illumina MiSeq平台进行PE250模式测序,建库测序工作由上海凌恩生物科技有限公司承担。使用UCHIME软件鉴定并移除嵌合序列,采用UPARSE 7.1软件(http://drive5.com/uparse/)将相似性达97%的序列聚类为操作分类单元(operational taxonomic unit,OTU)。采用RDP classifier(http://rdp.cme.msu.edu/)贝叶斯算法对OTU代表序列进行分类学分析,比对Silva数据库,置信度阈值为0.7,最终获得每个OTU在各个分类学水平上的物种信息,并由此统计各个分类水平上各样本的微生物群落构成[19]。
1.4 数据处理与分析
应用Excel 2016软件对数据进行处理,使用SPSS 22软件进行单因素方差分析,采用Tukey检验判定差异显著性,P<0.05表示组间差异显著。
2 结果与分析
2.1 小鼠粪便菌群的糖苷酶活性
以pNP-β-Gal、pNP-β-GlcNAc、pNP-α-Fuc、pNP-α-Man作为底物,通过测定吸光度分析粪便菌群中相应几种糖苷酶的活性。综合图1A和图1B中结果可看出,小鼠粪便菌群具β-有半乳糖苷酶、β-N-乙酰氨基葡萄糖苷酶以及α-岩藻糖苷酶活性,且β-半乳糖苷酶活性>β-N-乙酰氨基葡萄糖苷酶活性>α-岩藻糖苷酶活性。该结果表明,小鼠肠道菌群具有降解N-链寡糖的能力,可以将暴露的末端单糖释放下来作为碳源进行利用,且对末端是半乳糖和乙酰氨基葡萄糖的N-链寡糖利用效率更高。
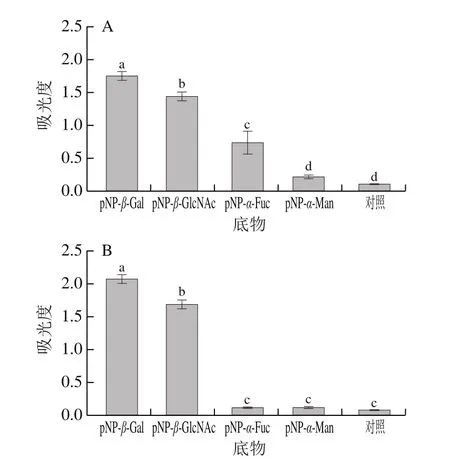
图1 小鼠肠道菌群胞内(A)与胞外(B)糖苷酶活力Fig.1 Intracellular (A) and extracellular (B) glycosidase activities of mouse intestinal flora
2.2 HMN与BMN在体外发酵过程中的变化
以HMN与BMN分别作为底物对小鼠粪便菌群进行体外培养,分别在0、6、12、24 h取样,使用超高压液相色谱对HMN和BMN进行分析。从图2可以看出,随着体外培养时间的延长,HMN与BMN的液相峰图谱均发生明显变化,峰的数目和高度逐渐降低。HMN组在12 h时还残留有少数较低的峰(图2A),而BMN组在12 h时寡糖峰完全消失(图2B)。上述结果表明,在体外厌氧培养条件下,HMN与BMN均可被小鼠粪便菌群逐渐降解利用。
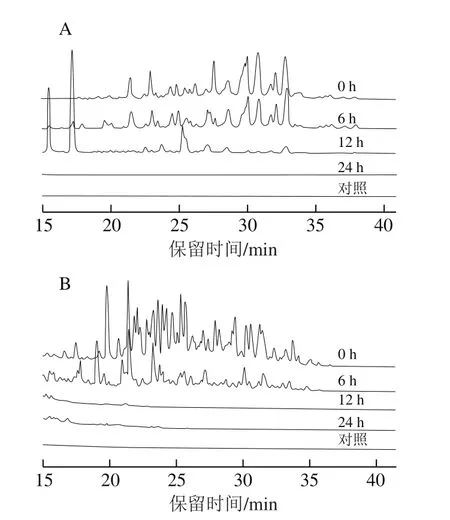
图2 HMN(A)与BMN(B)在体外发酵过程中的变化Fig.2 Changes in HMN (A) and BMN (B) during fermentation in vitro
2.3 HMN与BMN对小鼠盲肠内容物中SCFAs含量的影响
SCFAs是肠道末端发酵的主要代谢产物之一,主要由乙酸、丙酸和丁酸等组成,对机体的健康具有重要的积极影响。如图3所示,与对照组相比,HMN处理组的乙酸含量显著增加(P<0.05),BMN处理组的乙酸含量虽较对照组增加,但并不显著(P>0.05);而HMN与BMN处理组的丙酸含量均显著高于对照组(P<0.05)。与丙酸和乙酸变化不同的是,经过HMN与BMN处理后,HMN组丁酸的含量与对照组的差异并不显著(P>0.05),而BMN处理后的丁酸含量显著低于对照组(P<0.05)。对于总SCFAs含量,经过HMN处理后的实验组其含量显著高于对照组(P<0.05),而BMN处理组与对照组的总SCFAs的差异并不显著(P>0.05)。

图3 HMN与BMN对小鼠盲肠内容物中SCFAs含量的影响Fig.3 Effects of HMN and BMN on the contents of SCFAs in cecal contents of mice
2.4 HMN与BMN对小鼠肠道菌群结构的影响
2.4.1 物种多样性分析结果
通过16S rDNA高通量测序研究了不同处理条件下鼠肠道菌群的变化。所有样本序列在97%的相似水平下进行OTU分析,计算多样性指数。稀释性曲线显示,随着测序量的增加,样本物种的丰度也在增加,测序深度也在增加(图4A)。由图4B可知,3组处理组的Shannon曲线均逐渐趋于平缓且达到平衡,表明样品的测序深度已足够反映样本中绝大多数微生物的组成。
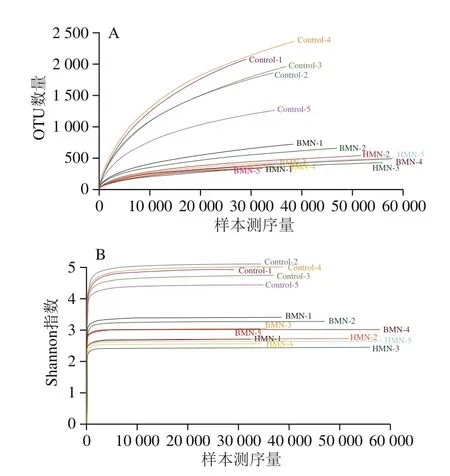
图4 稀释性曲线(A)和Shannon-Winner曲线(B)Fig.4 Rarefaction curves (A) and Shannon-Winner curves (B)
Alpha多样性常用来反映样本内多样性,评估指标包括Chao、Shannon和Simpson指数等。Chao指数与微生物菌群的丰度有关,Chao指数越大则丰度越高。Simpson指数与Shannon指数常用于反映菌群多样性,Shannon指数越大,说明群落多样性越高,而Simpson指数与样品中的群落多样性成反比。根据表1可知,与对照组相比,HMN与BMN处理后的小鼠肠道微生物的Chao指数、Shannon指数等均显著低于对照组,这说明处理组的样品的Alpha多样性显著降低(P<0.05)。从Shannon指数与Simpson指数可知,BMN处理组的样品中的菌群多样性显著高于HMN处理组(P<0.05),这可能与肠道中的某些微生物对BMN或HMN的利用有关。
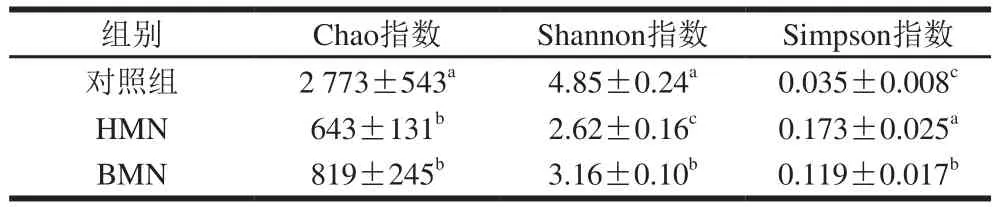
表1 小鼠肠道菌群Alpha多样性Table 1 Alpha diversity of intestinal flora in mice
Beta多样性主要反映微生物群落的构成,用来评估不同样品对微生物群落组成的影响。由图5可知,HMN与BMN处理组的肠道菌群组成比二者分别与对照组(Control)相比更相似。图6为粪便微生物主成分分析的结果,主成分分析是在不同处理组样本相似度为97%的前提下,对OTU组成进行分析来反映样本间的差异和距离,样本组成相似度越高的在主成分分析图中的距离越近。由图6可知,第一主成分(PC1)和第二主成分(PC2)的贡献率分别为50.8%和22.8%。对照组(Control)、HMN组和BMN组的各个样本较集中,说明其组内差异较小。从整体来看,3 组样本的位置较远,表明对照组、HMN组和BMN组的组间差距明显,可以将3 组区分开来。综上,HMN和BMN的摄入可以影响小鼠粪便微生物的组成。

图5 不同处理组小鼠粪便微生物的聚类树分析Fig.5 Dendrogram from cluster analysis of fecal microorganisms in mice from different treatment groups
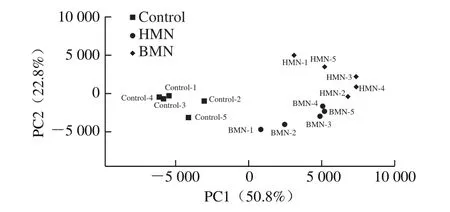
图6 不同处理组小鼠粪便微生物主成分分析Fig.6 Principal component analysis of mouse fecal microorganisms from different treatment groups
2.4.2 物种组成分析结果
如图7所示,从门水平上可看出,对照组、HMN组和BMN组的优势菌均以拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为主,对照组的拟杆菌门、厚壁菌门和变形菌门分别占79.14%、13.95%和6.04%,HMN组分别占60.86%、32.87%和5.87%,而BMN组分别占82.48%、15.23%和1.2%。与对照组和BMN组相比,HMN的摄入降低了小鼠肠道中拟杆菌门的相对丰度,增加了厚壁菌门的相对丰度,而与对照组和HMN组相比,BMN的摄入则降低了小鼠肠道中变形菌门的相对丰度。这说明了HMN与BMN的摄入可以在门水平上影响肠道菌群的构成,且两处理组之间在门水平上也存在差异。
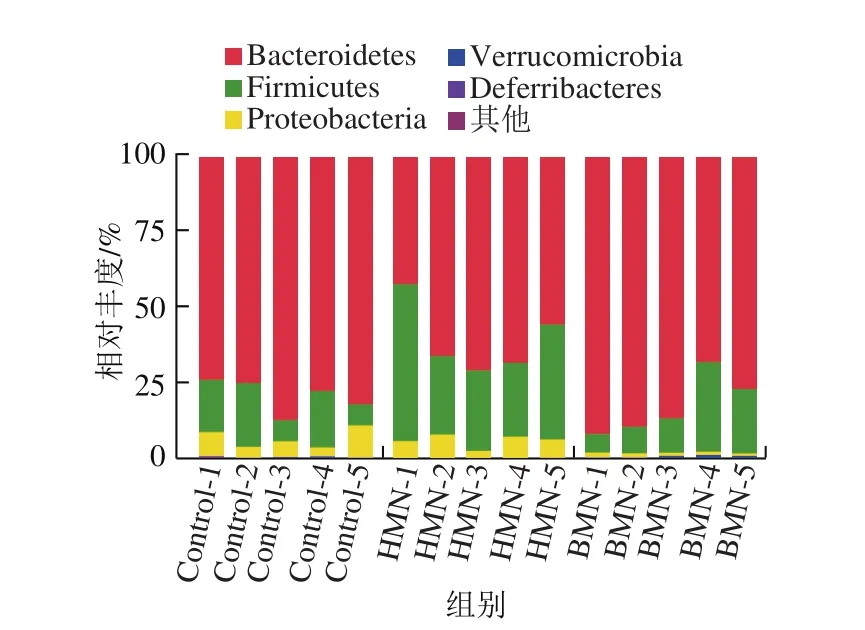
图7 不同处理组小鼠粪便微生物区系在门水平上的比较Fig.7 Comparison of fecal microflora in mice from different groups at the phylum level
如图8所示,从属水平来看,HMN与BMN干预前后的肠道菌群发生了明显的变化。对照组中的主要菌群为Muribaculaceae_norank(65.91%)、拟杆菌属(Bacteroides)(6.76%)、副鞭毛菌属(Parasutterella)(4.84%)、Erysipelotrichaceae_Unclassified(2.26%)、链杆菌属(Catenibacterium)(1%);HMN处理组的主要菌群为拟杆菌属(Bacteroides)(59.66%)、Erysipelotrichaceae_Unclassified(12.8%)、毛霉菌属(Erysipelatoclostridium)(6.27%)、乳杆菌属(Lactobacillus)(2.3%)、粪肠球菌属(Enterococcus)(2.85%)、大肠埃希氏菌属(Escherichia)(5.35%);BMN处理组的主要菌群为Muribaculaceae_norank(33.04%)、拟杆菌属(Bacteroides)(49.3%)、毛霉菌属(4.7%)、粪肠球菌属(3.23%)、阿克曼菌属(Akkermansia)(1.05%)。与对照组相比,HMN与BMN处理组的Muribaculaceae_norank与副鞭毛菌属的相对丰度均降低,拟杆菌属及粪肠球菌属的相对丰度均升高,而HMN与BMN之间的拟杆菌属与粪肠球菌属相对丰度差异不明显。此外,HMN组的乳杆菌属、Erysipelotrichaceae_Unclassified与大肠埃希氏菌属的相对丰度高于对照组和BMN组,而BMN组的阿克曼菌属的相对丰度高于对照组与HMN处理组。

图8 不同处理组小鼠粪便微生物区系在属水平上的比较Fig.8 Comparison of fecal microflora in mice from different groups at the genus level
2.4.3 差异性分析结果
线性判别分析效应量(linear discriminant analysis effect size,LEfSe)常用来反映不同处理组的肠道菌群在不同分类水平上的差异。结果如图9所示,蓝色、红色与绿色分别表示HMN、BMN组和对照组小鼠粪便菌群中影响组间差异性的优势菌种。在门水平上,HMN处理组的优势物种为Firmicutes和Epsilonbacteraeota,BMN处理组的优势物种为Bacteroidetes和Verrucomicrobia,而对照组的优势物种为Actinobacteria。从其他水平分析,对照组纲水平的优势物种为Betaproteobacteriales,目水平为Clostridiales,科水平为Muribaculaceae、Tannerellaceae、Lachnospiraceae、Ruminococcaceae与Burkholderiaceae等;而BMN组纲水平的优势物种为Bacteroidia、Verrucomicrobiae与Alphaproteobacteria,目水平为Bacteroidales、Rhizobiales与Verrucomicrobiales,科水平为Akkermansiaceae;HMN组纲水平的优势物种为Bacilli和Erysipelotrichia,目水平为Lactobacillales、Enterobacteriales、Campylobacterales与Erysipelotrichales,科水平为Bacteroidaceae、Helicobacteraceae、Campylobacteria、Enterobacteriacea、Enterococcacea和Erysipelotrichaceae等。

图9 各组间菌群差异分析结果Fig.9 Analysis of differences in intestinal flora between groups
3 讨 论
人体内的肠道微生物菌群自胎儿期便开始建立[23]。与成人相比,新生儿的肠道菌群并不稳定,容易受到喂养方式等因素的影响[24]。研究表明,牛乳配方奶粉喂养婴儿的肠道菌群与人乳喂养的婴儿肠道菌群之间存在一定的差异[25],乳中难消化性的寡糖被认为是造成这一差异的主要因素之一[26-27]。Midtvedt等[28]研究证明了粪便微生物会产生多种不同类型的糖苷酶,这些糖苷酶可降解各种类型的聚糖。N-链寡糖一般由半乳糖、岩藻糖、葡萄糖、N-乙酰氨基葡萄糖以及唾液酸组成。本研究对鼠粪便菌群中与N-链寡糖相关的几种糖苷酶活力进行了测定,发现其具有β-半乳糖、β-N-乙酰氨基葡萄糖以及α-岩藻糖苷酶等糖苷酶活性,然后以HMN和BMN为底物在体外进行了粪便菌群的厌氧发酵,发现粪便菌群可以利用HMN与BMN。因此推测出HMN与BMN能够被肠道微生物利用,原因可能与肠道菌群中的糖苷酶有关。
通过动物体内实验,研究HMN与BMN摄入对鼠粪便微生物组成以及代谢产物SCFAs的影响。从门水平来看,对照组、HMN以及BMN处理组的优势菌门均为拟杆菌门、厚壁菌门、变形菌门等,这与Ke Jin等[29]研究得到的鼠肠道中优势菌门的结果一致。与对照组和BMN处理组相比,HMN的摄入提高了厚壁菌门的相对丰度,且降低了拟杆菌门的相对丰度。厚壁菌门与拟杆菌门是肠道菌群中利用一系列难消化降解的聚糖的优势菌门,拟杆菌门通常可参与各种类型的聚糖代谢,厚壁菌门则参与特定聚糖的代谢[30]。二者相对丰度的变化不同可能与其对N-链寡糖利用方式不同有关。然而,相较于对照组和HMN组,BMN的摄入降低了变形菌门的相对丰度。变形菌门[31]包括沙门氏菌和霍乱弧菌等一系列病原菌,这些病原菌可能会引起肠道微生物菌群紊乱并影响宿主的健康,所以较低的变形菌门相对丰度对于机体肠道健康是有利的。
在属水平上,与对照组相比,摄入HMN或者BMN后,鼠肠道菌群中的拟杆菌属与粪肠球菌属均增加,且拟杆菌属取代Muribaculaceae_norank成为鼠肠道中的最优势菌属。Mu Chunlong等[16]通过研究猪乳中N-链寡糖对其后代肠道微生物的影响,也发现了N-链寡糖摄入显著提高了仔猪肠道菌群中的拟杆菌属的丰度,但其研究中没有排除乳中游离寡糖的影响,本研究则通过除去游离寡糖的N-链寡糖证明了其结论。除了促进拟杆菌属的生长外,HMN与BMN的摄入还可促进鼠肠道中不同有益菌属的生长。HMN处理组中的优势有益菌属为乳杆菌属,而BMN处理组则为阿克曼菌属。乳杆菌属作为一种常见的有益菌,可以促进肠道上皮细胞的生长,而阿克曼菌属具有缓解氧化应激反应,抑制肠道炎症等功能[32]。此外,HMN组中乙酸与丙酸的含量相较于对照组与BMN组显著增加,这可能与该菌群中拟杆菌属相对丰度的增加有关。拟杆菌属是肠道中主要的产生SCFAs的属,主要产生乙酸和丙酸代谢产物[33]。HMN与BMN处理组丁酸含量降低可能是肠道中产丁酸菌与产乙酸和丙酸菌如拟杆菌等竞争的结果[34]。
综上所述,本研究发现小鼠粪便菌群中具有β-半乳糖苷酶、β-N-乙酰氨基葡萄糖苷酶以及α-岩藻糖苷酶等与N-链寡糖降解有关的糖苷酶活性,能够在体外条件下降解并利用HMN与BMN。此外,HMN与BMN的长期摄入不仅可以改变鼠肠道菌群的丰度和组成,而且不同源的N-链寡糖对于鼠肠道微生物的影响不同。本研究有利于进一步了解人乳与牛乳N-链寡糖的在肠道菌群发展过程中所具有的生物学功能,可为未来牛乳婴儿配方食品和功能性乳制品的开发提供一定的理论参考。
- 食品科学的其它文章
- 花中多糖化学组成与生物活性研究进展
- 番茄碱的制备及其对乙酰胆碱酯酶的抑制作用
- 色氨酸抑制体外模型中晚期糖基化终末产物形成机理
- 松油烯-4-醇对荧光假单胞菌抑菌能力及作用机理
- Widely Targeted Metabolomic and Transcriptomic Analyses Reveal the Regulation of Trypsin on Antioxidant Enzymes and Saturated Fatty Acids in Hylocereus undatus Fruit during Storage
- 乙烯利处理‘赤霞珠’葡萄果实对其葡萄酒中酚类物质组分的影响

