大肠杆菌O157:H7实时荧光定量PCR快速检测试剂盒的组建及活菌检测
魏婉晴,孔梁宇,胡瑞瑞,陆兆新,周立邦,孟凡强,别小妹
(南京农业大学食品科技学院,江苏南京 210095)
大肠杆菌(Escherichia coli)是一种条件致病菌,在一定条件下可以引起人和多种动物发生胃肠道或尿道等多种局部组织器官感染。肠出血性大肠杆菌(EnterohemorrhagicE. coli,EHEC)是大肠杆菌的一个亚型,以O157:H7血清型为代表菌株[1]。感染大肠杆菌O157:H7可导致广泛的临床表现,包括无症状感染、轻度腹泻或严重疾病,如出血性结肠炎和溶血尿毒症综合征等[2-4]。食品和水源中的该病原体的监测是一个重要的公共卫生问题[5,6]。目前检测大肠杆菌O157:H7主要依据国标GB 4789.36-2016[7],虽准确性高、结果可靠,但步骤繁琐、实验周期长、难以达到快速检测目的。而且大肠杆菌O157:H7的最小感染剂量非常低[8],因此更需要建立具有高灵敏度的、简单快速且可靠的检测方法。
使用饱和荧光染料的实时荧光定量 PCR(Quantitative real-time PCR,RT-PCR)可以通过实时监测染料和双链DNA结合后发出荧光信号的改变获得高分辨熔解曲线(High-resolution melting curves,HRM)[9,10],通过熔解温度(Melting temperature, Tm)区分不同的靶基因[11,12],同时还可以利用标准曲线对未知模板进行定量分析,具有高通量、高灵敏度、特异性强等特点[13,14],广泛应用于食品、生物学、临床医学等领域[15-18]。
同时,在实际检测中,死菌的存在有可能会导致假阳性检测结果,在外界应激条件下细菌有可能进入一种可存活但不可培养(Viable but non-culturable,VBNC)状态,在这种状态下,细菌可以长时间存活并保持潜在毒性[19],因此,对食品样品中致病菌活菌部分的定量区分是非常关键的。叠氮溴化丙锭(propidium monoazide,PMA)是对核酸具有高度结合能力的光敏染料,能够穿透死亡细胞/膜损伤细胞的细胞膜插入核酸,在强光照射下与DNA 形成稳定的共价碳氮键,不可逆地修饰DNA,从而阻止死菌细胞DNA 进行PCR扩增[20,21]。PMAxx是PMA的升级版,作用方式与PMA相同,可以使活菌与死菌之间的扩增差异增加 3~7个Ct值,在区分活菌和死菌方面更有效。
本研究旨在组建新型大肠杆菌 O157:H7 HRM-RT-PCR快速检测试剂盒,探讨试剂盒的特异性、灵敏度、稳定性及抗干扰能力,并通过人工污染样品试验探究试剂盒的实际应用能力。通过单因素变化试验对PMAxx处理体系中的曝光时间、暗孵育时间、PMAxx浓度进行优化,最后将PMAxx处理体系与HRM-RT-PCR检测试剂盒相结合,进一步构建能够有效地定量大肠杆菌O157: H7活菌的方法。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株与试剂
实验菌株共计27株,其中大肠杆菌9株,包括7株 O157:H7血清型(其中 2 株为标准菌株 ATCC 43889、CICC 21530,5株为实验室自筛菌株,分别为P247、P248、P254、P255、P256),2 株非 O157:H7 血清型(ATCC HG15、ATCC 18683)。非大肠杆菌18株,其中有肠炎沙门菌(CICC21482)、鼠伤寒沙门氏菌(CICC 21483)、阪崎克罗诺杆菌(CICC 21563、CICC 21560)、藤黄微球菌(CMCC 28001)、奇异变形杆菌(CMCC 49005)、短小芽孢杆菌(CMCC 63202)、蜡样芽孢杆菌(CMCC 63301、CCTCC AB 204038、CCTCC AB 2010134)、单增李斯特菌(CICC 21662、CICC 21633)、金黄色葡萄球菌(CICC 26074、CICC 22942)、荧光假单胞菌(CICC 21620、ASI.55)、副溶血性弧菌(CICC 17802、CICC 21528),以上菌株分别购自美国模式微生物保藏中心、中国工业微生物菌种保藏管理中心、中国医学微生物菌种保藏管理中心、中国典型培养物保藏中心。
主要试剂:TaKaRa Ex Taq® Hot Start Version,宝生物工程(大连)有限公司;SYTOTM9绿色荧光核酸染料,Molecular Probes公司;Omega细菌DNA提取试剂盒,Archimedes公司;PMAxxTMdye,Biotium公司。
1.1.2 主要仪器设备
T1300Ⅱ级生物安全柜、实时荧光定量 PCR仪,赛默飞世尔科技公司;Centrifuge 5418R微量离心机,Eppendorf公司;Nanodrop-2000核酸浓度测定仪,基因有限公司;500 W卤素灯,衢州市柯城华源电子商行。
1.1.3 引物
本研究所用引物如表1所示。
1.2 实验方法
1.2.1 HRM-RT-PCR试剂盒反应体系及程序
大肠杆菌O157:H7 HRM-RT-PCR试剂盒反应体系见表2,反应体系扩增程序为:95 ℃预变性5 min,95 ℃变性 30 s、60 ℃退火 30 s、72 ℃延伸 30 s,循环数为30,熔解曲线升温速度0.1 ℃/s。

表1 实时荧光定量PCR体系引物序列及参数Table 1 Sequences and parameters of the primers of the HRM-RT-PCR system

表2 实时荧光定量PCR反应体系(20 μL/Test)Table 2 The reaction system for HRM-RT-PCR (20 μL/Test)
1.2.2 试剂盒的组装
商品化试剂盒应尽可能把各种反应物一次性添加、分装,确保试剂盒的准确与简便。将两对引物、10×Ex Taq Buffer、dNTP Mix混合为HRM-RT-PCR反应预混液。Ex Taq HS酶、SYTOTM9绿色荧光核酸染料分别-20 ℃单独保存。试剂盒的具体组成如表3所示。

表3 实时荧光定量PCR试剂盒组成(48 T)Table 3 Components of the HRM-RT-PCR kit (48 Tests)
1.2.3 灵敏度试验
将大肠杆菌O157:H7标准菌株菌悬液按照10倍倍比稀释,提取基因组,使用本研究组建的HRM-RT-PCR试剂盒进行检测,获得试剂盒的最低检测限。
1.2.4 特异性评价试验
煮沸法提取金黄色葡萄球菌、鼠伤寒沙门氏菌、单增李斯特菌等常见食源性致病菌基因组,应用试剂盒进行各菌种特异性验证。
1.2.5 试剂盒稳定性评价
1.2.5.1 重复性试验
为验证试剂盒在检测同一目标模板时的重复性以及检测低浓度模板时扩增是否稳定,选取中、低浓度的大肠杆菌O157:H7菌液、基因组模板,分别使用试剂盒对同一浓度的阳性核酸样本进行10次平行扩增。分析比较各重复间Ct值的差异情况,对扩增体系的重复性进行评价。
1.2.5.2 反复冻融试验
试剂盒中的酶、饱和荧光染料、引物等需要保存在-20 ℃低温环境,生化试剂容易受环境温度变化的影响,因此反复冻融容易使试剂盒失效,造成假阴性结果。将保存在-20 ℃试剂盒中的试剂取出,置于室温至液体融化后再置于-20 ℃,如此反复冻融50次,每反复冻融5次用同一份标准阳性模板进行检测,验证试剂盒的稳定性。
1.2.5.3 模拟运输环境试验
模拟运输条件下温度变化对试剂盒稳定性的影响,首先将试剂盒在-20 ℃储存5 d,模拟冷链运输,然后将试剂盒储存在放置有冰袋的泡沫盒中,每隔12 h更换冰袋,每隔4 h测温,模拟人工运输。每12 h应用试剂盒检测同一份基因组模板,共计检测3 d,根据Ct值变化判断运输环境对试剂盒的影响。
1.2.6 抗干扰试验
选取大肠杆菌O157:H7 ATCC 43889作为目标菌,副溶血性弧菌ATCC 17802、金黄色葡萄球菌CICC 26074、单增李斯特菌CICC 21662、蜡样芽孢杆菌CCTCC AB 204038作为干扰菌。二次活化培养后进行平板菌落计数。将四种干扰菌按照10倍倍比稀释9个梯度,1:1:1:1混合得到9组混合菌液,同时将目标菌稀释至3×103CFU/mL,与不同浓度梯度的混合菌液进行1:1混合,采用水煮法提取混合菌液基因组,试剂盒检测后观测其对应的Ct值及Tm值差异,判断试剂盒在四种常见食源性致病菌干扰下对大肠杆菌O157:H7的检测能力。
1.2.7 人工污染试验
使用大肠杆菌O157:H7污染食品样品,验证试剂盒的实际应用能力。取新鲜无菌牛奶4 mL 6份、生鲜牛肉10 g 6份,各取1份经GB 4789.36-2016验证无大肠杆菌O157:H7污染后,将已知初始浓度的大肠杆菌O157:H7用无菌生理盐水以10倍倍比进行稀释,获得浓度分别为7.97×105CFU/mL~7.97×101CFU/mL的5份菌液,将每份菌液取1 mL分别添加到准备好的牛奶及牛肉样品中,均质后获得人工污染食品样品,取1 mL人工污染牛奶样品于1.5 mL离心管中,12000 r/min离心10 min[22],弃上清、留下底部沉淀物,分别将牛奶样品沉淀物、牛肉污染样品转置到有9 mL mEC+n肉汤的均质袋中[7],在拍击式均质器上连续均质1 min~2 min,菌浓度稀释10倍,37 ℃增菌培养0 h、6 h、8 h后,分别取1 mL菌液提取基因组并采用试剂盒进行检测,通过分析扩增曲线判断实验结果。
1.2.8 PMAxx处理条件优化
1.2.8.1 细菌培养及热灭活菌的制备
将大肠杆菌O157:H7 ATCC 43889培养至细胞悬液OD600≈1.0。吸取处于对数期的细菌培养液于离心管中,100 ℃水浴10 min,获得热灭活菌细胞悬液[23]。将10 μL的热灭活细胞悬液置于TSA培养基平板,37 ℃培养24~48 h后观察是否有菌落长出。
1.2.8.2 曝光时间优化
取500 μL活菌菌悬液及热灭活菌菌悬液各7份,1份活菌菌悬液和热灭活菌菌悬液为1组,向其中6组菌悬液中分别添加PMAxx充分混匀,使其终浓度为25 μmol/L。室温避光孵育10 min后,将样品置于冰上,在距光源20 cm、500 W卤素灯下,分别均匀曝光0、5、7、9、11、13 min后,12000 r/min离心5 min,PBS清洗三次,所得沉淀加入100 μL无菌蒸馏水混匀,100 ℃煮沸10 min,4 ℃冷却5 min,12000 r/min离心3 min,上清用作DNA模板。未经PMAxx处理的1组为对照组。最后进行HRM-RT-PCR试剂盒检测,探究最优曝光时间。
1.2.8.3 暗孵育时间优化
前处理工作同1.2.8.2。盖上铝箔纸置于摇床暗孵育不同时间(分别为0、5、10、15、20、25 min)。样品置于冰上、卤素灯下曝光11 min,DNA提取步骤同1.2.8.2。未经PMAxx处理组为对照组。试剂盒扩增后探究最佳暗孵育时间。
1.2.8.4 PMAxx浓度的优化
取6组500 μL活菌菌悬液和热灭活菌菌悬液,向其中分别添加不同浓度的PMAxx使其终浓度分别为0、10、30、50、70、90 μmol/L,充分混匀。室温避光暗孵育20 min、卤素灯下曝光11 min,其后操作步骤同1.2.8.2。未经PMAxx处理组为对照组。试剂盒扩增后探究PMAxx最优浓度。
1.2.9 PMAxx对与活/死细胞的选择性
将活菌和热灭活菌两种菌悬液按照不同比例0%、5%、25%、50%、75%、100%进行混合,每个比例混合菌液取500 μL各2份作为待测样品,一份使用PMAxx处理,另一份不使用PMAxx处理作为对照组,试剂盒检测后判断PMAxx处理体系对与活/死细胞的选择性。
1.2.10 大肠杆菌O157:H7 PMAxx-qPCR标准曲线的制备
将大肠杆菌O157:H7菌液按照10倍倍比进行稀释,经PMAxx处理体系处理后,分别提取基因组作为模板,使用本研究组建的试剂盒进行检测,根据相应的动力学曲线绘制标准曲线,建立PMAxx-qPCR活菌定量检测技术。
1.2.11 数据统计分析
运用IBM SPSS Statistics软件对实验数据进行统计分析。实验数据为三次测定平均值,以平均值±标准偏差(Mean±SD)呈现。多组间比较采用单因素ANOVA检验,显著水平p<0.05,具有统计学意义。图表采用Microsoft Excel、GraphPad Prism软件进行绘制。
2 结果与分析
2.1 试剂盒结果判定
每反应管中取HRM-RT-PCR预混液6 μL、饱和荧光染料 2 μL,Ex Taq HS 酶 0.1 μL,dd H2O 9.9 μL,并加入2 μL待测样品基因组DNA。设置空白对照(dd H2O)、阳性对照(大肠杆菌O157:H7 DNA)、阴性对照(沙门氏菌 DNA)[24]。根据扩增曲线、熔解峰曲线判断实验结果,如图1所示,在30循环内有扩增曲线(即Ct值<30)和熔解峰曲线(G1、G10的Tm值分别为79.1±0.5 ℃、83.6±0.5 ℃)为阳性,判定为检出,在 30循环内无特异性扩增曲线(即 Ct值为undetected)、无熔解峰曲线为阴性,判定为未检出。
2.2 试剂盒灵敏度试验
初始浓度为8.4×107~8.4×100CFU/mL的大肠杆菌O157:H7菌悬液分别提取基因组作为梯度模板进行灵敏度评价。如图1a、1b所示,84 CFU/mL的大肠杆菌O157:H7菌悬液在30个循环内仍有扩增曲线(Ct值=29.403)和熔解峰曲线(79.1±0.5 ℃、83.6±0.5 ℃),即试剂盒最低检测限为84 CFU/mL。

表4 试剂盒可重复性评价结果Table 4 Results of repeatability evaluation of the HRM-RT-PCR kit
2.3 试剂盒特异性评价
检测结果特异性良好,试验中的9株大肠杆菌中,仅7株O157:H7血清型出现扩增曲线及相应的熔解峰曲线,2株非O157:H7血清型未出现特异性扩增;其他18株常见食源性致病菌检测结果均为阴性。
2.4 试剂盒稳定性评价
2.4.1 重复性试验
重复性试验结果如表 4所示,因大肠杆菌O157:H7的实际污染剂量非常低,选取中、低浓度的菌液和基因组(1.02×104CFU/mL、1.02×102CFU/mL、3.99 ng/μL、3.99 pg/μL),使用试剂盒对其进行检测。同一模板的10次平行扩增Ct值标准偏差SD值<0.5,在可接受范围之内,说明该试剂盒扩增重复性好。
2.4.2 反复冻融对试剂盒的影响
在实际操作过程中,较大容积的 HRM-RT-PCR预混液通常不会一次性消耗完毕,在使用过程中会反复冻结与融化,使生化试剂效用降低。如表5所示,虽实验结果有显著性差异但数值差异较小,Ct值相差约1.482个循环,本研究验证试剂盒经过50次反复冻融后,仍能有效地检测出大肠杆菌O157:H7。

表5 反复冻融对HRM-RT-PCR试剂盒的影响Table 5 Effects of repeated freeze-thaw cycles on the HRM-RT-PCR kit
2.4.3 运输环境对试剂盒的影响
试验结果如图2所示,随着时间推移,泡沫盒中的温度开始逐渐上升,冰袋的更换使得泡沫盒内温度起伏较大,在0.7~14.3 ℃温度范围内波动。8 d模拟运输实验后,该试剂盒仍可有效检测出大肠杆菌O157:H7,24 h后Ct值无差异显著性,72 h的Ct值与0 h相差约0.75个循环,表明短期运输对其无不良影响。

表6 大肠杆菌O157:H7人工污染试验试剂盒检测结果Table 6 Detection results of artificial contamination with E. coli O157:H7
2.5 试剂盒抗干扰试验
平板菌落计数结果:大肠杆菌 O157:H7 ATCC 43889为3×108CFU/mL、副溶血性弧菌ATCC 17802为1.14×108CFU/mL、金黄色葡萄球菌CICC 26074为3.9×109CFU/mL、单增李斯特菌CICC 21662为8×106CFU/mL、蜡样芽孢杆菌CCTCC AB 204038为7.3×107CFU/mL。如图 3a,9组不同浓度梯度干扰菌的混合菌液,都能准确地检测出3×103CFU/mL的目标菌大肠杆菌O157:H7 ATCC 43889,扩增曲线几乎重叠;如图3b,熔解峰曲线Tm值均在79.1±0.5 ℃、83.6±0.5 ℃范围内,试剂盒抗干扰性能良好。
2.6 人工污染试验
如表6所示,大肠杆菌O157:H7人工污染试验结束后,未增菌培养即可检测到初始污染量为7.97×101CFU/mL的人工污染食品样品,增菌培养至 6 h,7.97×100CFU/mL初始污染量的食品样品可被检测到,试剂盒实际应用效果好。
2.7 PMAxx处理条件优化
2.7.1 PMAxx曝光时间优化
接种热灭活细胞悬液的平板培养后未有菌落长出。PMAxx曝光时间的长短影响其与DNA共价交联的效果。如图4,热灭活菌检测结果显示,0~5 min时间范围内,Ct值迅速升高,这是由于PMAxx逐渐与死菌DNA相结合对其扩增产生抑制;曝光5~9 min内,Ct值在较小范围内波动,说明随着曝光时间增加,残留PMAxx的光解率升高,对死菌DNA扩增的抑制作用不稳定;9 min后PMAxx与死菌DNA结合逐渐稳定,11 min时Ct值达到最高点,此时PMAxx处理热灭活菌组与活菌组Ct值相差最大,即PMAxx对热灭活菌DNA扩增的抑制程度最大;使用PMAxx处理活菌菌悬液后,Ct值数值波动较小,PMAxx对活菌DNA扩增几乎没有影响,随着曝光时间的增加,活菌菌悬液Ct值微小的降低可能是由于PMAxx光解,对活菌仅有的一点抑制作用也消失了。综上,选择11 min作为PMAxx处理的最优曝光时间。
2.7.2 PMAxx暗孵育时间的优化
如图5,PMAxx不能进入到活细胞内与DNA分子结合,因此随着暗孵育时间延长,活菌扩增的 Ct值折线变化平缓;使用PMAxx对热灭活菌菌悬液进行处理时,随着暗孵育时间的延长,Ct值显著增加,这是因为在暗孵育过程中,PMAxx与死菌DNA逐渐结合,对其扩增的抑制作用增强,暗孵育 20 min后Ct值达到峰值,说明此时 PMAxx与热灭活细胞的DNA最大程度相结合,有效抑制了死菌DNA的扩增。因此,20 min确定为最佳暗孵育时间。
2.7.3 PMAxx浓度优化
由图6可知,活菌组Ct值在0、10、50、90 μmol/L PMAxx处理时无差异显著性,总体来看折线平缓,Ct值基本不变,PMAxx浓度变化对活菌DNA的扩增影响很小;而使用 PMAxx对热灭活菌组进行理时,其Ct值随PMAxx质量浓度增加显著增大:70 μmol/L后随着PMAxx浓度的增大Ct值不存在差异显著性。当质量浓度为30 μmol/L时,PMAxx对热灭活菌抑制作用达到最大,可最大限度地抑制死菌细胞DNA的扩增。因此,选择30 μmol/L作为PMAxx处理的最优浓度。
2.8 PMAxx对与活/死细胞的选择性
由图7可知,当PMAxx处理组活菌数为0%时,Ct值达到最高28.603,而未经PMAxx处理的对照组样本 Ct值为 12.225,说明 PMAxx处理后热灭活菌DNA扩增受到显著抑制。当活菌比例逐渐上升,处理组Ct值逐渐下降,但仍明显高于对照组,且对照组折线变化不大,说明 PMAxx处理可对样本中的死菌DNA扩增进行抑制而对活菌的抑制作用较小,使处理组可扩增的DNA数量小于对照组,在一定程度上消除了因死菌DNA扩增造成的信号干扰,降低了假阳性结果产生的概率。随着活菌比例的上升,ΔCt值逐渐减小,活菌数100%时处理组与对照组Ct值几乎重合。综上,PMAxx处理组结果更接近样本中活菌真实的定量值,可实现对样本中活菌的准确检测。
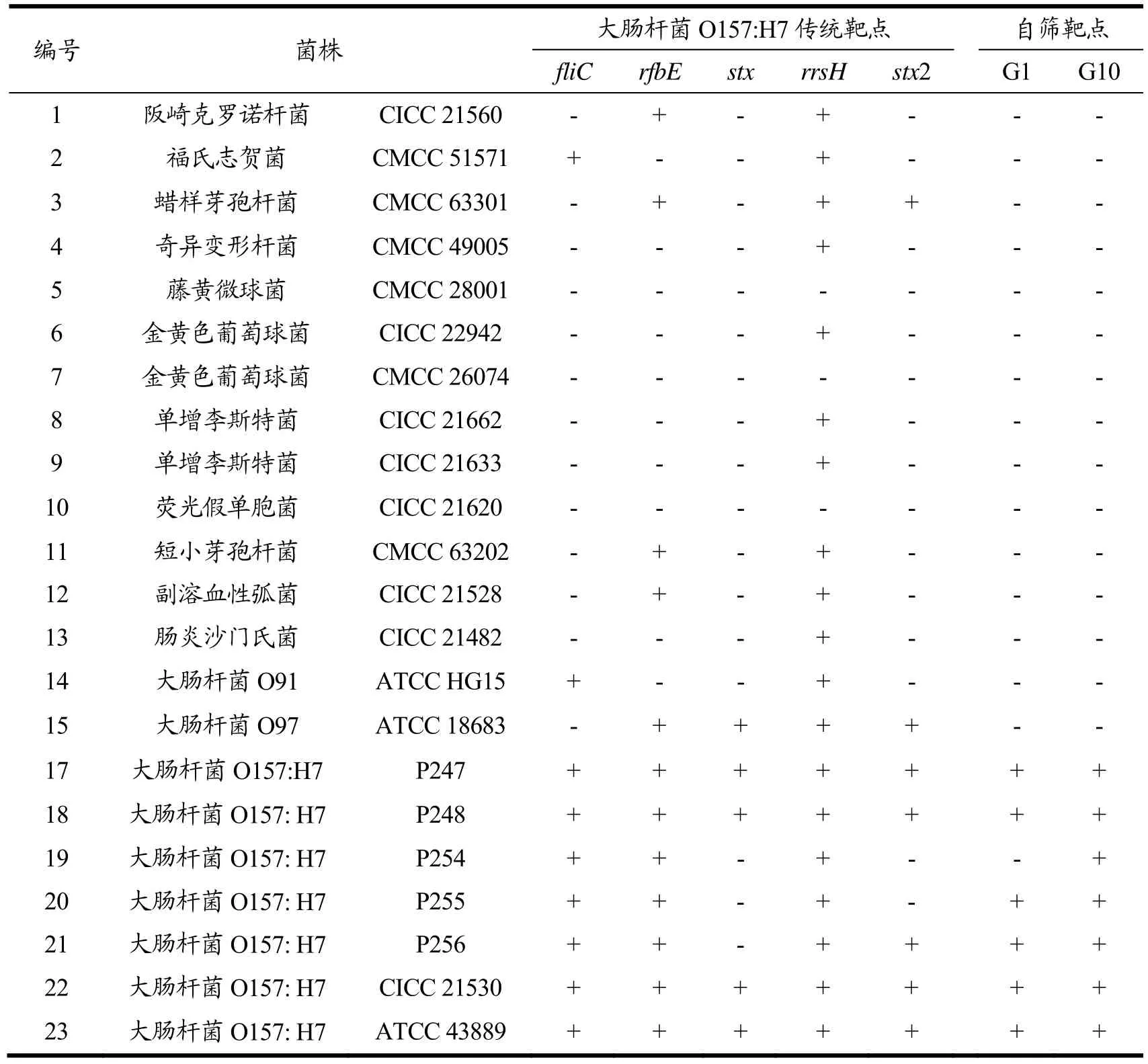
表7 大肠杆菌O157:H7传统靶点与自筛靶点对比Table 7 Comparison of traditional targets with self-screening targets of E. coli O157: H7
2.9 大肠杆菌O157:H7 PMAxx-qPCR标准曲线的制备
如图8,在浓度范围3.4×107~3.4×102CFU/mL 内Ct值与菌液浓度线性关系良好,R2为0.9895,建立起了一种大肠杆菌O157:H7活菌定量检测的方法。
3 讨论
HRM-RT-PCR试剂盒的准确性受到酶活性、反应体系中各组分浓度的差异等多种因素的影响,反应体系中各组分含量、比例的微量差异都有可能造成较大的结果偏差,这就对加样的精确性提出了更高的要求,因此,标准化加样步骤成为组建检测试剂盒必不可少的先决条件。试剂盒在商业化过程中应尽可能简化操作步骤,将不同组分如Ex Taq酶缓冲液、dNTP Mix、引物预先混合,减少加样步骤,缩短检测时间,在一定程度上有效消除加样误差,最大程度地保证了试剂盒操作的简便性与精确性。
使用HRM-RT-PCR检测病原体,通常使用带有高分辨熔解曲线分析的饱和荧光染料和多色荧光标记的探针[14],饱和荧光染料如SYBR Green、Eva Green和SYTO 9在HRM-RT-PCR中的使用,不仅大大优化了其分辨率及检出限,而且相对来说比使用探针成本更低,并且可采用一种核酸染料同时对多种病原微生物或多种目标基因同时进行检测。本研究使用的饱和荧光染料SYTO 9具有较好的生物兼容性和较高的荧光信号值;高浓度SYTO 9可以降低扩增Ct值,从而降低检出限,且不会影响PCR扩增程序;在形成高分辨熔解曲线过程中分布均匀,进一步提高熔解峰曲线的精确度。Singh等[25]采用饱和荧光染料 SYTO 9,对HRM-RT-PCR检测技术进行了优化,设计了一种低成本的多重RT-PCR检测STEC的stx1、stx2基因和沙门氏菌的方法。
根据前期 Blast 比对及电泳实验,发现传统靶点检测大肠杆菌 O157:H7血清型菌株时存在较多假阳性,无法准确检测该血清型。如表7所示,传统靶点fliC、rfbE、rrsH不仅在大肠杆菌O157:H7菌株中有特异性扩增,还在多株非大肠杆菌O157:H7菌株中出现特异性扩增,stx2靶点也会在少数非大肠杆菌O157:H7菌株扩增中出现假阳性结果。
本研究中发掘的特异性靶点G1是一种编码假定蛋白的基因,假定蛋白质是一种已经预测到其存在的蛋白质,通过当前分子生物学技术难以预测该类蛋白功能;G10编码 GDP-L-岩藻糖合酶,这种酶属于氧化还原酶家族,这种酶参与果糖和甘露糖代谢。经验证,本研究中筛选的靶点具有较好的特异性,所选菌株中只有O157:H7血清型的大肠杆菌能扩增出G1、G10基因,而非大肠杆菌O157:H7菌株均不能检测到该靶点。
本研究组建试剂盒采用实验室自筛靶点 G1、G10,因为一般单个基因无法准确检测O157:H7血清型,单个自筛靶点的检测特异性虽有所提高,但仍存在个别漏检现象,即仅有G1扩增仍不能完全确定是该血清型。因此,本研究组建双重检测体系,引入另一个基因G10进行辅助检测,使得检测特异性大幅度提高。
4 结论
本研究旨在组建新型大肠杆菌 O157:H7 HRM-RT-PCR快速检测试剂盒。试剂盒使用实验室自筛靶点,特异性强,研究使用的27株菌株中,仅大肠杆菌O157:H7血清型检测呈阳性结果;采用饱和荧光染料SYTO 9,具有较高的荧光信号值,不仅进一步提高了熔解峰曲线的精确度,同时降低了检出限,最低可检测到84 CFU/mL的大肠杆菌O157:H7。操作简便快捷,无需繁琐的电泳操作;检测结果精准、快速。在重复性实验、反复冻融实验、模拟运输实验中表现出较强的稳定性;在四种其他种类常见食源性致病菌同时存在的情况下能准确检测出大肠杆菌O157:H7,抗干扰能力强;最低可检测到初始污染量为7.97×100CFU/mL的人工污染食品样品,为大肠杆菌O157:H7的检测提供了有价值的工具。最后,本研究进一步将PMAxx与 HRM-RT-PCR检测试剂盒相结合,用PMAxx处理活菌悬液后再提取基因组,可以去除死菌、VBNC状态细菌等的存在对大肠杆菌O157:H7活菌检测的干扰,降低假阳性检测结果出现的可能性,进一步建立了一种大肠杆菌O157:H7活菌定量检测的方法。

