日粮精料水平和蛋氨酸铬添加对滩羊瘤胃发酵特性、细菌和脂肪酸组成的影响
金亚东,赵海霞,桂瑞麒,马青,周玉香*
(1.宁夏大学农学院,宁夏银川 750021;2.宁夏农林科学院动物科学研究所,宁夏 银川 750002)
共轭亚油酸(conjugated linoleic acid,CLA)是亚油酸的同分异构体,是一类含有共轭双键的十八碳二烯酸(亚油酸)异构体混合物。常见的CLA为C18:2 cis-9 trans-11和C18:2 trans-10 cis-12,其中C18:2 cis-9 trans-11在所有共轭亚油酸中的比例最高,达87%左右[1]。共轭亚油酸作为一种新兴的营养素,具有抗癌、预防心血管疾病和糖尿病等作用。与其他动物产品相比,反刍动物产品(肉和奶)中CLA含量较高[2]。CLA在反刍动物体内的合成主要通过两个途径,一是在瘤胃生物加氢化过程中作为C18:2n6和C18:3n3氢化的中间体产生,二是组织内的反式异油酸(trans vaccenic acid,TVA,trans-11 C18:1)在硬脂酰辅酶A去饱和酶(stearyl coenzyme A dehydrogenase-1,SCD)的作用下合成c9t11CLA,这是内源合成CLA的重要机制。研究表明,CLA内源途径合成主要与瘤胃内的TVA含量有关。此外,暂无报道显示组织内的C18:2 trans-10 cis-12合成与SCD酶之间存在相互关系,但组织内和奶中C18:2 trans-10 cis-12的合成与瘤胃中C18:2 trans-10之间存在一定的联系。溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)和蛋白溶解梭菌(Butyrivibrio proteoclasticus)是参与瘤胃内C18不饱和脂肪酸氢化的主要细菌,此外其他细菌如白色瘤胃球菌(Ruminococcus albus)、黄色瘤胃球菌(Ruminococcus flavefaciens)以及埃式巨型球菌(Megasphaera elsdenii)等也在瘤胃不饱和脂肪酸的氢化过程中起一定的作用[3-4]。
研究表明,放牧或饲喂低精料日粮的羊只的肌肉中含有较高的CLA[5-6]。此外,大量的体外研究也表明,高精料日粮或者低瘤胃pH对发酵液中CLA和TVA的浓度,以及相关氢化细菌生长具有一定的抑制[3-4]。而关于体内试验条件下,日粮精料水平对反刍动物瘤胃内CLA和TVA,以及相关氢化细菌生长的影响的研究报道则较少。Wang等[7]和Xu等[8]的研究表明,当羊只日粮精料水平高于60%时会对羊只胃肠道健康产生一定的威胁。过高的精料水平会引起瘤胃pH降低,对瘤胃内相关微生物的生长繁殖产生不利影响[9-10],最终导致组织内CLA含量的降低。铬是人和动物所必需的微量元素,与其他价态的铬相比,三价态铬的安全性及稳定性相对较高,并且与无机铬相比,有机铬的吸收利用效率更高。蛋氨酸铬(chromium methionine,Cr-Met)作为有机铬的一种,由于其与蛋氨酸螯合,可借助蛋氨酸铬的吸收途径进入机体,因此其吸收效率高于其他有机铬。在单胃动物上的研究也表明,日粮铬的添加对提高动物机体组织CLA的含量具有积极的作用[11]。之前的研究表明,动物的小肠是铬的主要吸收部位,其在瘤胃内的吸收效率极低[12-13]。这意味着铬的添加可能并不会对反刍动物瘤胃微生物的生长产生影响。因此,日粮铬添加对反刍动物,尤其是瘤胃方面的研究鲜有报道。然而,Dallago等[14]的研究表明,添加0.375 mg·d-1(按元素含量计)的铬显著降低羔羊瘤胃内原虫的数量,而0.250和0.500 mg·d-1的添加量对瘤胃原虫的数量则没有显著影响。这表明,即使铬在瘤胃内的吸收效率极低,但适量的Cr添加也有可能影响到反刍动物瘤胃内相关微生物的活动。并且相关报道表明,铬可作为CLA合成过程中的催化剂,增加CLA的合成效率[15-16]。据此,本研究以低精料(low concentrate,LC)日粮为对照组,选择精料水平低于60%的日粮作为试验组日粮,观察其对滩羊瘤胃发酵特性,瘤胃脂肪酸组成和相关氢化细菌的DNA丰度是否有不利影响,并且在高精料(high-concentrate,HC)日粮中添加Cr-Met,观察其对以上指标是否有积极的作用。
1 材料与方法
1.1 试验设计与饲养管理
试验于2019年6-9月在宁夏回族自治区吴忠市宁鑫生态牧场进行。选取体重相近[(21.00±1.23)kg]、健康状况良好的5月龄滩羊公羔40只,随机分配到4个试验组,每组10只。LC组饲喂精粗比为35∶65的全混合饲粮,日粮中不添加Cr-Met;HC组饲喂精粗比为55∶45的全混合饲粮,日粮中不添加Cr-Met;HCM组和HCH组均饲喂精粗比为55∶45的全混合饲粮,Cr-Met的添加量分别为0.75和1.50 g·d-1·只-1。试验周期80 d,预饲期15 d,正试期65 d。参考《肉羊饲养标准》(NY/T 816-2004)[17]配制饲粮,试验饲粮组成及营养水平见表1。试验开始前对圈舍进行消毒,对所有羊只进行体内和体外驱虫,并按照牧场相关防疫程序对羊只注射疫苗。每日饲喂两次(07:00和17:00)全混合饲粮,自由饮水。Cr-Met由金宝(中国)动物营养科技有限公司馈赠(铬≥1000 mg·kg-1,纯度99%,蛋氨酸含量≥0.9%),并以胶囊的形式于每日晨饲前单独口服投喂。
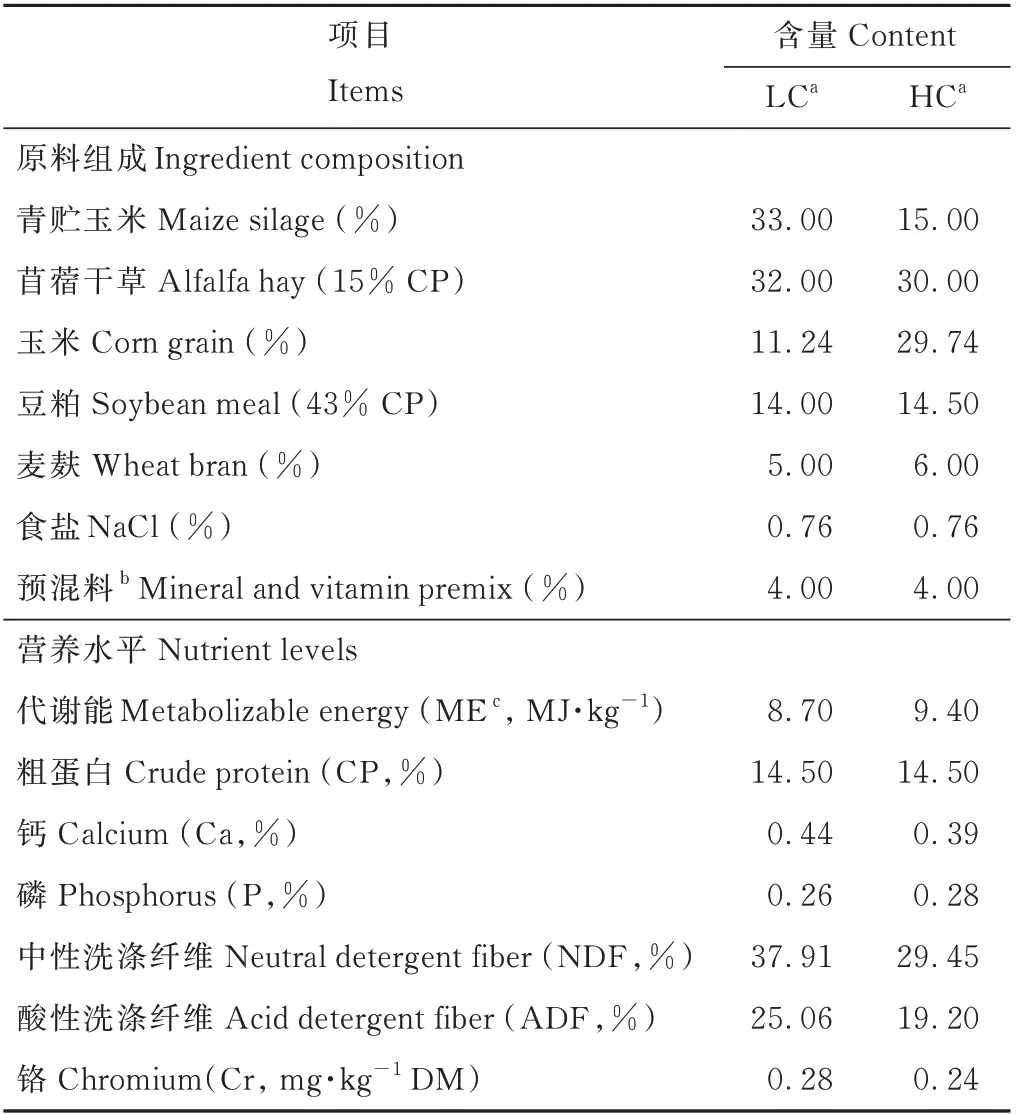
表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrition levels of diet(DM basis)
1.2 瘤胃液采集与前处理
试验第65天在每组选择5只平均体重相近的羊只,晨饲后3 h利用瘤胃液采集器(科立博,武汉,中国)通过口腔采集瘤胃液(约50 mL)。在每次样品采集前和结束后用温水(约39.0℃)对采集器内部和外部进行清洗,并弃去最开始采集到的瘤胃液。在每份瘤胃液中取1.8 mL,用无菌无酶的2 mL冻存管进行分装,并用液氮速冻,随后转移到-80℃冰箱保存,备测相关细菌的DNA丰度。在样品收集结束后立即用便携式瘤胃p H计检测瘤胃液p H值。随后,用洁净无菌的4层纱布对剩余的瘤胃液过滤,将过滤后的液体分为4份:取5 mL滤液与1 mL 250 g·L-1(W/V)偏磷酸混合均匀,-20℃保存,备测瘤胃挥发性脂肪酸。另取5 mL瘤胃液加入1 mL 20 g·L-1(W/V)H2SO4混合均匀,-20℃保存,备测瘤胃氨态氮(ammoniacal nitrogen,NH3-N)浓度。第3份约5 mL,-20℃保存,备测瘤胃微生物蛋白(microbial protein,MCP)含量。剩余瘤胃液-20℃保存,备测瘤胃脂肪酸组成。
1.3 样品检测方法
1.3.1 MCP、NH3-N和VFA的检测 参照王加启[18]的方法,用分光光度计检测瘤胃NH3-N浓度。利用气相色谱仪(安捷伦,GC7890,美国)检测瘤胃脂肪酸,具体步骤参照王加启[18]和武晓东[19]的方法。MCP用考马斯亮蓝比色法进行检测,具体步骤参照Makkar等[20]的方法。
1.3.2 瘤胃相关细菌定量分析 用粪便基因组提取试剂盒(DP328)对瘤胃液样品中的总基因组DNA进行提取,具体方法参照试剂盒说明书进行。样品DNA提取成功后,用超微量分光光度计检测总DNA的浓度和纯度(OD260/280和OD260/230),用琼脂糖凝胶电泳法检测DNA的质量。然后将总DNA于-20℃冰箱中保存,直到进行荧光定量PCR分析。以瘤胃内总菌(general bacteria,GB)DNA作为内参基因,利用相对定量法对选择的细菌进行定量,具体计算公式如下:目标菌(总菌16SrDNA含量,%)=2-(目标菌CT值-瘤胃总菌CT值)。
待测细菌引物参照Fuentes等[4],Gudla等[3]和Stevenson等[21]设计,具体信息见表2,引物由上海生工合成。用BIO-RAD荧光定量PCR仪(CFX Connect,美国)和CFX Manager软件对ButyrivibrioSA、ButyrivibrioVA、R.albus、R.flavefaciens、B.proteoclasticus、Anaerovibrio lipolytica和M.elsdenii的DNA丰度进行荧光定量PCR分析,每个样品3个生物学重复。荧光定量PCR的反应体系为25μL,包括12.5μL的SYBR®Green Master Mix(YEASEN,中国),1μL的PCR正向引物(10μmol),1μL的PCR反向引物(10μmol),1μL DNA模板和9.5μL的dd H2O。反应条件:95℃预变性30 s,95℃变性10 s,60℃退火20 s,40个循环,72℃延伸20 s,在延伸期收集荧光信号。全部样品检测均设置一个去离子水代替模板的阴性对照。

表2 荧光定量PCR引物Table 2 Pr imer s used for real-time PCR quantification
1.4 数据统计与分析
用SAS 8.2统计软件中的one-way ANOVA方法对4个试验组以及HC和LC组的各指标进行差异显著性分析;用GLM程序中的不相关比较法(orthogonal contrast)对高精料条件下各指标随Cr-Met添加水平增加的线性(linear,L)和二次函数(quadratic,Q)变化进行统计分析。以P<0.05作为判断差异显著的标准。
2 结果与分析
2.1 日粮精料水平和Cr-Met添加对滩羊瘤胃发酵参数的影响
由表3可知,HC、HCM和HCH组滩羊瘤胃液p H值均显著低于LC组,HC、HCH组乙酸/丙酸也均显著低于LC组(P<0.05);与LC组相比,HC组滩羊瘤胃MCP、丙酸和戊酸浓度显著升高(P<0.05)。高精料日粮中添加Cr-Met对瘤胃p H、NH3-N、MCP和挥发性脂肪酸组成均无显著影响(P>0.05)。与HC组相比,HCM组滩羊瘤胃内乙酸/丙酸显著升高(P<0.05),但与其他组间无显著差异(P>0.05)。
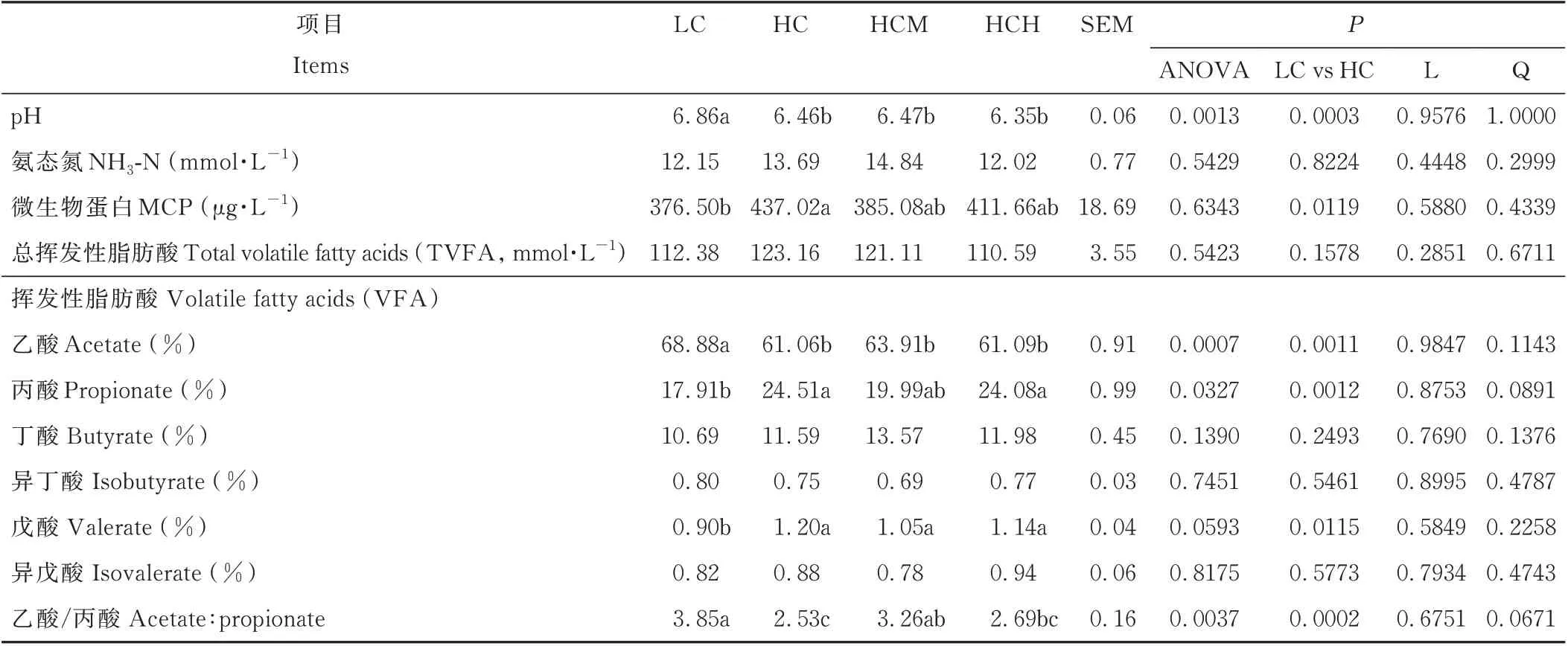
表3 日粮精料水平和Cr-Met添加对瘤胃发酵参数的影响Table 3 Effects of dietary concentrate level and Cr-Met supplementation on rumen fermentation parameter
2.2 日粮精料水平和Cr-Met添加对滩羊瘤胃细菌DNA相对丰度的影响
由表4可知,与LC组相比,HC组滩羊瘤胃液中反式油酸溶纤维丁酸弧菌和黄色瘤胃球菌的DNA丰度显著降低(P<0.05),但解脂厌氧弧杆菌的DNA丰度却显著增加(P<0.05)。高精料日粮条件下,滩羊瘤胃液中硬脂酸溶纤维丁酸弧菌、反式油酸溶纤维丁酸弧菌、蛋白溶解梭菌和解脂厌氧弧杆菌的DNA丰度随Cr-Met剂量的增加而线性降低(P<0.05),但黄色瘤胃球菌的DNA丰度则线性升高(P<0.05)。
2.3 日粮精料水平和Cr-Met添加对滩羊瘤胃脂肪酸组成的影响
由表5可知,与LC组相比,HC组滩羊瘤胃液中C18:1、t9 C18:1、t11 C18:1、trans C18:1、c9t11 CLA、t10c12 CLA、C18:2n6和C18:3n3浓度均显著降低(P<0.05),而C18:0浓度则显著升高(P<0.05)。高精料日粮条件下,滩羊瘤胃液中C18:1、t9 C18:1、t11 C18:1和trans C18:1浓度随Cr-Met剂量的增加而线性上升(P<0.05)。
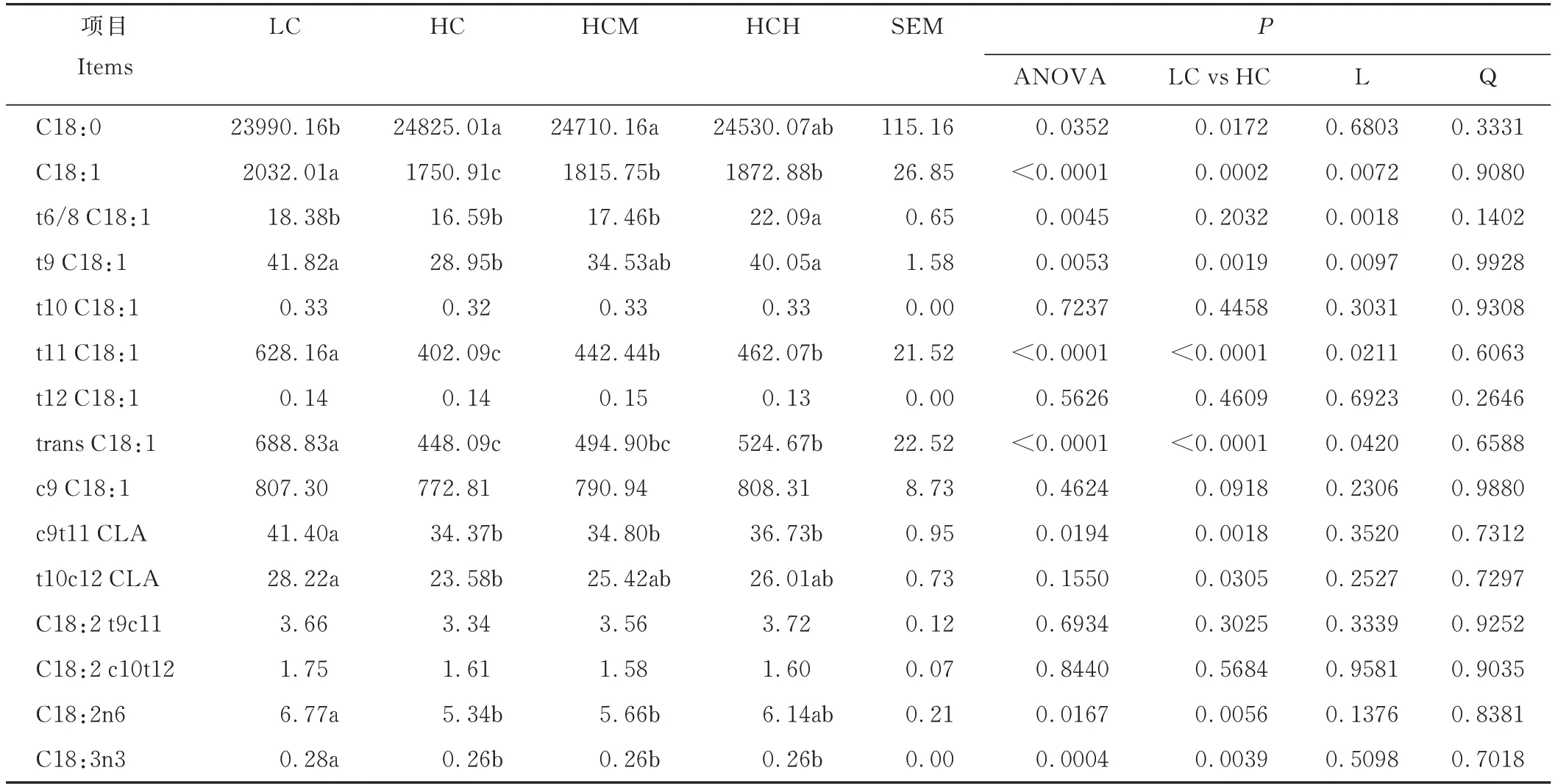
表5 日粮精料水平和Cr-Met添加对瘤胃脂肪酸组成的影响Table 5 Effects of dietary concentrate level and Cr-Met supplementation on fatty acid composition of rumen fluid(mg·kg-1)
3 讨论
3.1 日粮精料水平和Cr-Met添加对滩羊瘤胃发酵参数的影响
本研究表明,提高日粮精料水平可显著降低瘤胃乙酸比例,这与之前的研究结果一致[4,22]。饲喂高精料日粮可引起瘤胃pH降低,抑制瘤胃内相关纤维降解菌的生长繁殖,最终导致乙酸/丙酸的降低[3,9]。由表3和表4可知,本研究中HC组滩羊瘤胃pH值显著低于LC组,并且相关纤维降解菌如:反式油酸溶纤维丁酸弧菌和黄色瘤胃球菌的DNA丰度显著低于LC组。高精料日粮条件下丙酸浓度的含量较高,这与以前的研究结果一致[22-23]。这可能与高精料日粮促进了相关淀粉分解菌的繁殖有关[23]。相对于纤维分解菌而言,淀粉分解菌对低瘤胃pH的耐受性更强。本研究中,增加日粮精料水平略微提高了丁酸的浓度,但并无显著影响,这与Wang等[24]的研究结果一致。但Kljak等[25]的研究则表明,在以高粱(Sorghum bicolor)青贮为粗饲料来源的情况下,提高奶牛日粮精料水平可线性提高其瘤胃丁酸浓度。以上研究结果的不同,可能与动物种类和日粮组成的不同有关。提高日粮精料水平可显著提高戊酸浓度,这与Gudla等[3]的研究结果一致。Fuentes等[4]的体外研究也表明,提高日粮精料水平可增加发酵液中戊酸的比例,并且在同一精粗比条件下,发酵液的p H越低,其戊酸的比例则越高,本研究结果与此类似。Fuentes等[26]和Gudla等[3]的体外研究也有类似的发现,说明高精料日粮或低瘤胃p H有利于戊酸生成菌的生长。日粮精料水平的增加提高了瘤胃内MCP的浓度,这可能与高精料日粮增加了瘤胃内MCP合成时所需的能量和碳架有关。随着日粮精料水平的添加,瘤胃乙酸/丙酸由3.85降至2.53,这与Wang等[24]和Zhang等[9]的研究报道类似。说明精料比例的增加促进了动物瘤胃发酵类型由乙酸型转变为丙酸型,这对提高动物育肥效果具有重要意义[27]。目前关于日粮添加Cr-Met对反刍动物瘤胃挥发性脂肪酸影响的研究报道较少。本研究表明,高精料日粮中添加Cr-Met对瘤胃挥发性脂肪酸的比例并无显著影响。如表4所示,Cr-Met的添加对不同纤维降解菌的DNA丰度的影响并不一致。因此,瘤胃内挥发酸的变化可能是Cr-Met对瘤胃微生物的不同作用结果所导致的。与HC组相比,HCM组乙酸/丙酸显著升高,说明在HC日粮添加0.75 g·d-1·只-1Cr-Met改变了瘤胃发酵类型。
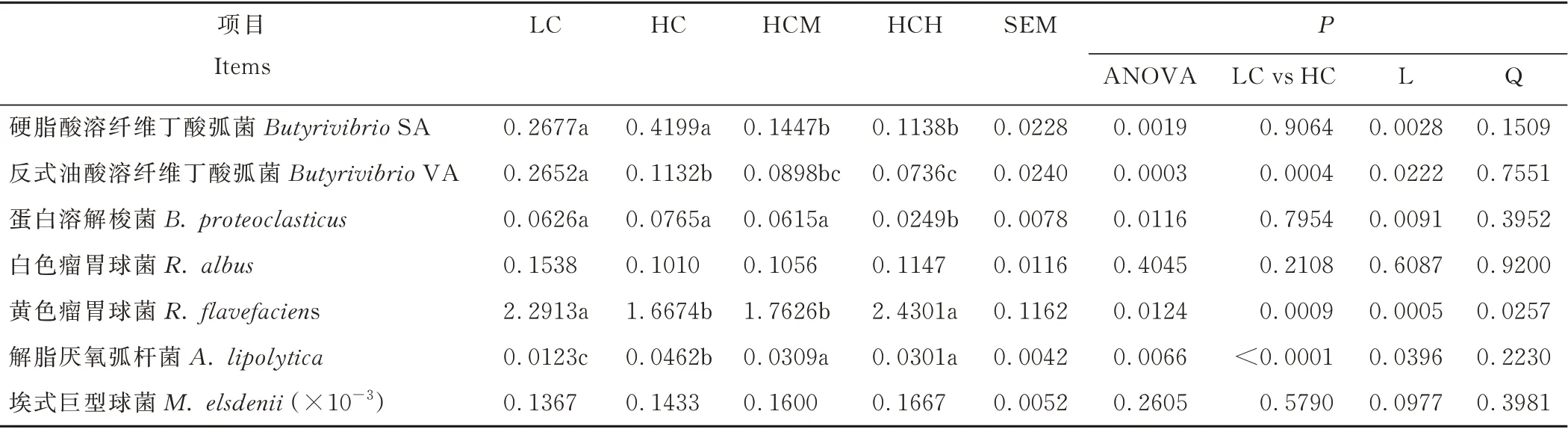
表4 日粮精料水平和Cr-Met添加对瘤胃细菌DNA相对丰度的影响Table 4 Effects of dietar y concentrate level and Cr-Met supplementation on the DNA abundance of selected rumen bacter ial(%of total bacteria)
3.2 日粮精料水平和Cr-Met添加对滩羊瘤胃细菌DNA相对丰度的影响
前人研究显示[3,28],瘤胃p H的降低会抑制瘤胃内纤维降解菌的生长如:反式油酸溶纤维丁酸弧菌和黄色瘤胃球菌的DNA丰度出现显著下降,即使是在瘤胃p H没有达到亚急性酸中毒的情况下。Latham等[29]的研究也表明,瘤胃纤维降解菌对pH的变化较为敏感。硬脂酸溶纤维丁酸弧菌也属于纤维降解菌,并且和反式油酸溶纤维丁酸弧菌都属于溶纤维丁酸菌属,共同参与瘤胃内C18:2n6氢化产生TVA的过程,但硬脂酸溶纤维丁酸弧菌的最终产物为C18:0[30]。本研究表明,瘤胃p H的降低并未显著影响硬脂酸溶纤维丁酸弧菌的DNA丰度,这与Fuentes等[4]的研究结果一致。表明硬脂酸溶纤维丁酸弧菌对瘤胃p H变化的敏感程度比反式油酸溶纤维丁酸弧菌低。Fuentes等[4]和Gudla等[3]的体外研究表明,低瘤胃p H(5.60~5.74)条件下,解脂厌氧弧杆菌的数量显著降低,本研究结果与此刚好相反。以上结果的不同,可能与体内和体外试验之间的差异,培养时间长短和瘤胃pH的不同有关。Hobson[31]的研究表明,解脂厌氧弧杆菌的活性在pH为5.7时开始受到抑制,在pH为5.3时其活性完全被抑制,但当p H维持在6.3以上时可避免其活性被抑制。Fuentes等[4]的体外研究表明,在p H为6.4的条件下孵育3 d后,发酵液中解脂厌氧弧杆菌的DNA丰度显著降低,但当继续孵育2 d后,发酵液中解脂厌氧弧杆菌的DNA丰度显著升高;但在p H=5.6的条件下孵育时,解脂厌氧弧杆菌的DNA丰度随时间的增加呈线性降低。表明在pH适宜的情况下,解脂厌氧弧杆菌在经过短暂的适应过程后,其活性开始复苏。Mackie等[32]和Tajima等[33]的体内研究也表明,当反刍动物逐步适应高精料日粮后,其瘤胃内解脂厌氧弧杆菌的数量开始增加。
以前的研究表明,铬在瘤胃的吸收率极低[12,34],相关研究发现某些金属元素的添加会抑制瘤胃微生物的生长[14],此外铬在羊养殖中的使用一直未有明确的规定。因此,目前关于铬添加对反刍动物瘤胃微生物影响的报道较少。本研究结果也表明,日粮添加Cr-Met降低了瘤胃内硬脂酸溶纤维丁酸弧菌、反式油酸溶纤维丁酸弧菌、蛋白溶解梭菌和解脂厌氧弧杆菌的DNA丰度,这与Dallago等[14]关于吡啶甲酸铬(chromium picolinate,Cr-Pic)添加降低了羔羊瘤胃原虫数量的报道类似。有研究认为,重金属可引起瘤胃微生物DNA损伤,干扰基本代谢功能或活性代谢物的产生,增加其氧化应激反应,导致其死亡或抑制其生长繁殖[14]。然而,与其他瘤胃细菌不同的是,黄色瘤胃球菌的DNA丰度则随高精料日粮中Cr-Met剂量的增加而升高。以上研究结果的不同,可能与不同瘤胃微生物对铬的耐受性和需求的差异有关。
3.3 日粮精料水平和Cr-Met添加对滩羊瘤胃脂肪酸组成的影响
与HC组相比,LC组滩羊瘤胃液内C18:1n9、C18:2n6和C18:3n3的浓度较高,表明饲喂LC日粮降低了滩羊瘤胃液内这些脂肪酸的表观脂解率或氢化。然而,Troegeler-Meynadier等[35]的体外研究表明,以干草为发酵底物或者在高瘤胃pH条件下(6.71 vs 6.21和6.56 vs 5.82)孵育6 h后,发酵液中的C18:2n6和C18:3n3的消失率显著增加,其含量也显著低于淀粉组和低p H组。Gudla等[3]的体外研究也表明,与精粗比70:30的日粮相比(p H=5.74),添加精粗比30∶70的日粮的发酵液(p H=6.47)在孵育3 h后,C18:2n6、C18:3n3和C18:1n9的浓度显著降低。解脂厌氧弧杆菌是瘤胃内参与不饱和脂肪酸脂解的主要细菌[36],LC组较高的C18:1n9、C18:2n6和C18:3n3可能与解脂厌氧弧杆菌DNA丰度的降低有关[3,27,35]。
Trans C18:1和CLA是瘤胃不饱和脂肪酸氢化的中间产物。Trans C18:1和CLA浓度的升高和C18:0浓度的降低表明瘤胃内的不饱和脂肪酸发生不完全氢化[3]。本研究中LC组滩羊瘤胃液中trans C18:1和c9t11 CLA浓度显著增加,其他CLA异构体的浓度也出现略微的增加,而C18:0则显著降低,表明LC日粮促进了瘤胃不饱和脂肪酸的不完全氢化。Troegeler-Meynadier等[35]的研究表明,以干草为发酵底物时trans C18:1还原为C18:0的效率显著低于以玉米(Zea mays)淀粉为发酵底物时的还原效率。Kalscheur等[37]的体内研究发现,当日粮粗料水平由25%升高到60%时,流入奶牛小肠中的C18:0的量降低了21.87%。表明在体内试验的情况下,饲喂高水平的粗饲料可抑制瘤胃trans C18:1转换为C18:0的还原反应。本研究中LC组滩羊瘤胃液中C18:0的浓度较低,这与以上研究报道的结果一致。Wallace等[38],Mckain等[39]和Ishlak等[27]的研究表明,蛋白溶解梭菌参与瘤胃氢化反应的最后一步,即将trans C18:1还原为C18:0的过程,并且蛋白溶解梭菌在该还原反应中起着重要作用。此外,Paillard等[30]的研究表明,硬脂酸溶纤维丁酸弧菌也参与C18:0的生成。本研究中HC组滩羊瘤胃液中硬脂酸溶纤维丁酸弧菌和蛋白溶解梭菌的DNA丰度均略高于LC组,这可能是HC组滩羊瘤胃液中C18:0的浓度显著高于LC组的原因。当然,HC组较高的C18:0也可能是由于某些未被检测的微生物的变化所导致的。
Trans C18:1的浓度随着高精料日粮中Cr-Met剂量的增加而线性上升,CLA浓度也有轻微的上升,而C18:0的浓度则略有降低,表明Cr-Met的添加促进了瘤胃不饱和脂肪酸的不完全氢化作用[39]。由表4可知,高精料日粮中添加Cr-Met线性降低了瘤胃内解脂厌氧弧杆菌的DNA丰度,这将导致瘤胃内不饱和脂肪酸脂解作用的降低。这与HCM和HCH组瘤胃液中略微增加的C18:1n9和C18:2n6的变化一致。同时高精料条件下滩羊瘤胃内硬脂酸溶纤维丁酸弧菌和蛋白溶解梭菌的DNA丰度随Cr-Met的添加线性降低,这与C18:0含量的变化规律一致。瘤胃液内trans C18:1浓度的线性升高也可能是Cr-Met的添加抑制了瘤胃内不饱和脂肪酸生物氢化的末端还原反应(trans C18:1转变为C18:0),从而导致trans C18:1在瘤胃内不断累积。
以前的研究表明,低精料日粮条件下,TVA是主要的trans C18:1异构体,而高精料日粮条件下t10 C18:1则是主要的trans C18:1异构体[4,35]。本研究则发现,无论在LC,还是在HC日粮条件下,TVA在所有trans C18:1异构体中的比例均为最高,这与以上研究者的报道部分相似。Abughazaleh等[40]的研究表明,当日粮精料水平由250 g·kg-1DM增加到500 g·kg-1DM时,发酵液中TVA依然是主要的trans C18:1异构体;但当日粮精料水平由500 g·kg-1DM增加到750 g·kg-1DM时,发酵液中t10 C18:1则成为主要的trans C18:1异构体。这表明只有当日粮精料水平达到一定比例时,t10 C18:1才有可能成为主要的trans C18:1异构体。TVA是反刍动物内源途径合成CLA的主要前体物,进入动物组织内的TVA在硬脂酰辅酶A去饱和酶的作用下合成c9t11 CLA。本研究中,饲喂高精料日粮虽然降低了瘤胃液中TVA的浓度,但是Cr-Met的添加则线性提高了瘤胃液中TVA的浓度。这表明Cr-Met的添加可能对增加机体CLA的合成有一定的促进作用。
以前的研究表明,C18:2n6可在反式油酸溶纤维丁酸弧菌的作用下产生TVA和c9t11 CLA[39]。本研究发现,Cr-Met的添加降低了瘤胃内反式油酸溶纤维丁酸弧菌的DNA丰度,但TVA的浓度却随Cr-Met的添加呈线性增加,c9t11CLA的浓度也略有上升,这似乎是一个矛盾。Paillard等[30]和Maczulak等[41]的研究表明,瘤胃内的纤维降解菌如:反式油酸溶纤维丁酸弧菌、白色瘤胃球菌和黄色瘤胃球菌参与瘤胃内C18:2n6的氢化。Gudla等[3]的研究也发现,3种纤维降解菌DNA丰度的降低是导致瘤胃内TVA和c9t11 CLA下降的主要原因。本研究中,HC组滩羊瘤胃液中反式油酸溶纤维丁酸弧菌的DNA丰度虽然随着Cr-Met剂量的增加而线性降低,但黄色瘤胃球菌的DNA丰度却线性上升,并且黄色瘤胃球菌的DNA丰度在所有已检测的细菌中占据主导地位,是反式油酸溶纤维丁酸弧菌的DNA丰度的19~33倍。据此推断,高精料日粮条件下TVA和c9t11 CLA浓度随Cr-Met添加量的增加而升高的变化趋势是反式油酸溶纤维丁酸弧菌和黄色瘤胃球菌共同作用的结果。此外,Cr-Met的添加线性降低了瘤胃内硬脂酸溶纤维丁酸弧菌和蛋白溶解梭菌的DNA丰度,这表明瘤胃内不饱和脂肪酸氢化反应的最后一步受阻。因此,瘤胃内TVA和c9t11 CLA浓度的增加也可能是由于氢化反应受阻所导致的底物浓度积累的结果。
t10c12 CLA的产生源自与c9t11 CLA不同的酶系[42]。以往的大部分研究表明,高精料日粮或低p H可提高瘤胃内t10c12 CLA的含量[3,26]。但本研究则发现,HC组t10c12 CLA的浓度显著低于LC组,Fuentes等[4]、Wallace等[42]和Troegeler-Meynadier等[35]也有类似的发现。有学者认为,埃式巨型球菌参与瘤胃内C18:2n6生成t10c12 CLA的过程[43],并且高精料或者低瘤胃p H可促进埃式巨型球菌的生长[44],从而提高t10c12 CLA的含量[3]。然而,Maia等[45]的研究表明,埃式巨型球菌不具有异构化C18:2n6的能力。本研究也发现,在LC组埃式巨型球菌的DNA丰度略低于HC组的情况下,LC组滩羊瘤胃液中t10c12 CLA的浓度显著高于HC组。这意味着瘤胃中存在其他适宜在低精料日粮或高瘤胃pH条件下生长的细菌参与了t10c12 CLA的产生。Verhulst等[34]的研究表明,痤疮丙酸杆菌具有将C18:2n6转化为t10c12 CLA的能力,并且其可在以干草为底物的发酵液中生存。因此,本研究中LC组滩羊瘤胃液中t10c12 CLA的浓度显著升高,可能与痤疮丙酸杆菌或者其他t10c12 CLA生成菌的大量繁殖有关。
4 结论
本试验条件下,饲喂精粗比为55∶45的高精料日粮降低了滩羊瘤胃内参与生物氢化作用的细菌的DNA丰度如:反式油酸溶纤维丁酸弧菌和黄色瘤胃球菌,但促进了解脂厌氧弧杆菌的生长繁殖。高精料日粮促进了瘤胃内不饱和脂肪酸的生物氢化,导致c9t11 CLA和TVA浓度的下降;Cr-Met的添加降低了大部分氢化细菌的DNA丰度,但增加了黄色瘤胃球菌的DNA丰度;同时也增加了瘤胃内TVA的含量,这对机体组织中c9t11 CLA含量的增加有一定促进作用。

