饲粮蛋白质水平对藏系绵羊瘤胃真菌菌群结构及功能的影响
王循刚,张晓玲,2,徐田伟,耿远月,2,胡林勇,赵娜,刘宏金,康生萍,2,徐世晓*
(1.中国科学院西北高原生物研究所,青海 西宁 810008;2.中国科学院大学,北京 100049)
瘤胃作为反刍动物重要的厌氧发酵器官,生活着大量的厌氧微生物,包括细菌、真菌、古菌,以及原虫等[1-2]。反刍动物摄入淀粉、蛋白质、糖类等营养物质后,通过瘤胃微生物的发酵分解产生大量的能量,对机体的健康维持起着重要的作用。研究表明,反刍动物瘤胃微生物区系受到年龄、遗传、饲粮等多个因素的影响[3-5]。不同类型的饲粮会使进入瘤胃的营养物质产生差异,影响瘤胃的发酵类型,进一步影响其营养代谢速率。蛋白质作为动物饲粮中重要的营养素之一,是一切生命活动的物质基础,对动物的生长发育起着重要的调节作用。瘤胃微生物在饲粮中蛋白质降解的过程中会产生大量的氨,为其合成微生物蛋白质提供必需的氮源,以此为机体提供蛋白质,促进生长发育[6]。藏系绵羊作为青藏高原的特有畜种,生活在海拔3000 m以上,对青藏高原严酷的高寒环境具有很强的适应性[7]。前人对藏系绵羊的营养学研究主要集中在不同饲粮类型对其生长性能、发酵参数和屠宰性能等的影响,对于其瘤胃微生物的研究仅局限于瘤胃细菌菌群[8-11],而对于瘤胃真菌菌群的研究鲜有报道。虽然瘤胃真菌的生物量仅仅占瘤胃微生物总量的8%,但是能够更大程度地对饲粮中的可溶性多糖和纤维素等营养物质起到降解作用[12]。因此,了解藏系绵羊瘤胃真菌菌群结构和功能对于丰富高寒家畜瘤胃微生物学研究以及高寒适应性研究具有重要的科学意义。高通量测序技术和生物信息学的发展应用,为研究反刍动物瘤胃微生物多样性提供了极大的便利。本研究在探讨饲粮蛋白质水平对藏系绵羊生长性能影响的基础上,以真菌ITS1高变区作为分子标记,利用Illumina高通量测序技术对藏系绵羊瘤胃真菌菌群结构组成和多样性进行探究,以此为藏系绵羊的健康养殖和相关营养学研究提供一定的科学参考。
1 材料与方法
1.1 试验动物与试验设计
本试验于2019年1-4月在青海省海北高原现代生态畜牧业科技示范园(N 100°57′06″,E 36°55′05″)进行。试验选取18只12月龄健康、平均体重为(31.71±0.72)kg的藏系绵羊羯羊为试验动物,随机分为3个处理组,每组6个重复。根据NRC(2007)和中国肉羊饲养标准(2004)配制3种代谢能(metabolizable energy,ME)相近而蛋白质(crude protein,CP)含量不同的饲粮,其代谢能约为10.1 MJ·kg-1,蛋白质含量分别为10.06%(LP)、12.10%(MP)和14.12%(HP),饲粮组成及营养水平详见表1。饲养试验开始前对藏系绵羊进行驱虫处理,对圈舍及饲喂器具进行清洁消毒。饲养过程中藏系绵羊每天饲喂两次(8:00和17:00),单栏饲喂,饲喂量为活体重的3.5%,期间自由饮水。试验正试期开始和结束时分别对藏系绵羊进行称重,计算平均日增重(average daily gains)。每天晨饲前收集前一天的剩料,准确记录平均日采食量(average daily feed intakes)。以平均日采食量和平均日增重之比作为料重比(feed conversion ratio,F/G)。
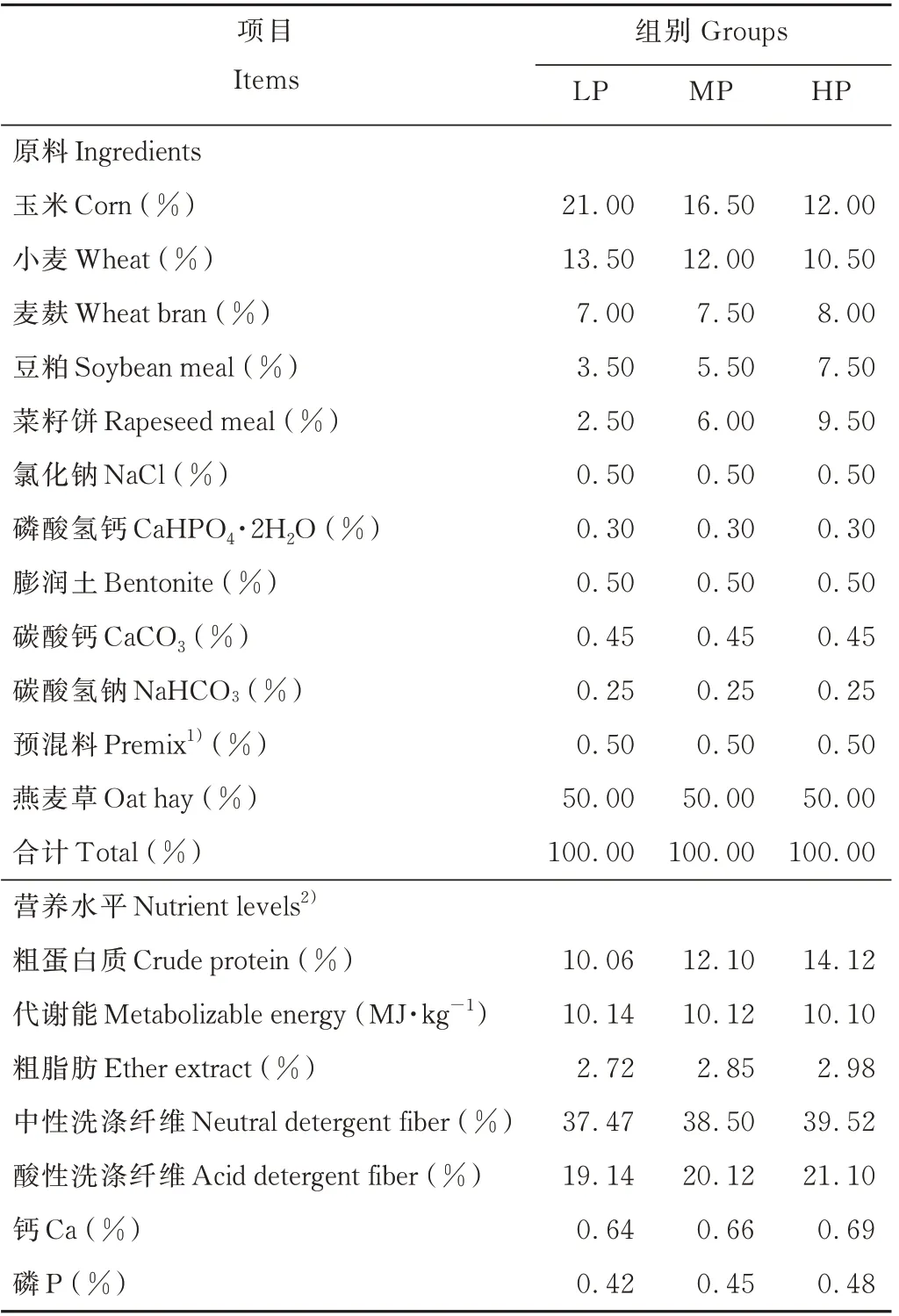
表1 饲粮组成及营养水平(干物质基础)Table 1 Composition and nutr ient levels of diets(dry matter basis)
1.2 瘤胃液样品的采集及处理
饲养试验结束时,采用瘤胃管法抽取藏系绵羊的瘤胃液。采集瘤胃液时打开羊的口腔,将瘤胃管从羊口腔缓慢插入,注射器抽取瘤胃内容物约50 mL,后用4层纱布过滤,将过滤后的瘤胃液装入冻存管编号后立即投入液氮中保存。所有样品带回实验室后于-80℃条件下保存,待测。
1.3 微生物DNA提取及高通量测序
取200 mg瘤胃液样品,采用CTAB方法对样品的总DNA进行提取。以样品提取的总DNA为模板对真菌ITS1高变区进行PCR扩增,扩增引物为:F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和R(5′-GCTGCGTTCTTCATCGATGC-3′),反应体系为30μL:Phusion Master Mix(2×)15μL,正向引物(2μmol)1.5μL,反向引物(2μmol)1.5μL,模板DNA 10μL,H2O 2μL。反应参数设置为:98℃预变性1 min;随后变性循环30次(98℃,10 s;50℃,30 s;72℃,30 s);72℃延伸5 min,4℃冷却,PCR产物检测合格后使用凝胶回收试剂盒进行目的片段回收。采用Illumina NovaSeq 6000测序平台对DNA片段进行高通量测序,获得原始测序数据后再进行后续生物信息学分析。
1.4 生物信息学及数据统计分析
得到原始数据后,为了使后续生物信息学分析的结果更加可靠、准确,避免一定比例的干扰数据,对数据进行拼接过滤,得到优化序列。使用Uparse软件根据相似度为97%的原则对序列进行操作分类单元(operational taxonomic unit,OTU)聚类。根据OTU聚 类 的 结 果,利 用RDP classifier(http://rdp.cme.msu.edu/)对每个OTU的代表性序列进行物种注释并得到相应的物种信息及物种丰度分布情况。计算每个样本的Alpha多样性和Beta多样性。Alpha多样性由反映群落丰富度的Chao1指数、ACE指数,反映群落多样性的Shannon指数、Simpson指数进行评估。式中,Chao1指数的计算公式为:Schao1=Sobs+n1(n1-1)/2(n2+1),式中:Sobs是观察到的物种数,n1是只有1条序列的物种数,n2是只有2条序列的物种数;ACE指数的计算方法参照https://mothur.org/wiki/ace/中的描述;Shannon指数的计算公式为:H=-∑PilnPi;Simpson指数的计算公式为:D=1-∑Pi2,式中:Pi是第i个物种所占的百分比。Beta多样性选择利用非加权遗传距离矩阵(unweighted unifrac distance)计算,并进行PCoA的可视化分析。将Unite数据库(http://unite.ut.ee/index.php)得到的物种注释结果进行不同分类水平上的群落组成分析,并进行柱状图和热图的可视化展示。使用LEfSe(linear discriminant analysis effect size)在线分析工具(http://huttenhower.sph.harvard.edu/lefse/)进行LEfSe分析,以线性判别分析的LDA值(LDA score>3)作为筛选条件寻找组间在丰度上有显著差异的物种。使用FUNGuid对菌群进行基因功能预测分析,并根据功能分类丰度进行主成分分析(principal component analysis,PCA)和功能丰度热图的绘制。采用SPSS 20.0软件进行ANOVA单因素方差分析和Duncan法多重比较检验,P>0.05为差异不显著,P<0.05为差异显著。
2 结果与分析
2.1 饲粮蛋白质水平对藏系绵羊生长性能的影响
由表2可知,各组间藏系绵羊的初始体重无显著差异(P>0.05)。试验结束时,LP组的终末体重、平均日增重和平均日采食量均显著低于MP组和HP组(P<0.05),而料重比显著高于MP组和HP组(P<0.05)。

表2 饲粮蛋白质水平对藏系绵羊生长性能的影响Table 2 Effects of dietary protein levels on growth performance of Tibetan sheep
2.2 饲粮蛋白质水平对藏系绵羊瘤胃真菌菌群多样性的影响
2.2.1 藏系绵羊瘤胃真菌菌群Alpha多样性分析 基于Illumina Nova测序平台对藏系绵羊18个瘤胃液样品进行ITS高通量测序,共获得1654534条原始序列(raw tags),平均每个样品测得91919条,原始序列经过质控后获得有效序列(clean tags)1547415条,平均每个样品85968条,每条序列平均长度为240.5 bp,质控有效率达69.89%。各样品的稀释曲线均趋于平缓(图1A),说明本试验测序所得数据量已经覆盖样本中的绝大多数物种,满足后续微生物多样性分析条件。以97%的一致性原则将序列聚类成OTUs(operational taxonomic units)(图1B),共得到4073个OTUs,其中LP组2650个,MP组1872个,HP组2080个,3组共享983个OTU,占总OTU数量的24.13%。饲粮蛋白质水平对藏系绵羊瘤胃真菌菌群Alpha多样性分析结果如表3所示,不同处理组间瘤胃真菌菌群的Shannon指数、Simpson指数、ACE指数及Chao 1指数差异均不显著(P>0.05)。

表3 饲粮蛋白质水平对藏系绵羊瘤胃真菌菌群Alpha多样性指数的影响Table 3 Effects of dietary protein levels on Alpha diversity index in rumen fungi flora of Tibetan sheep
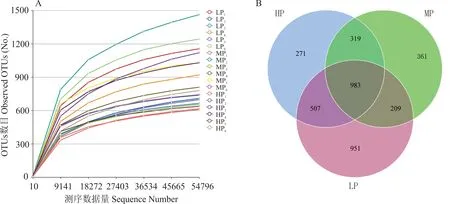
图1 样品稀释曲线和OTU韦恩图Fig.1 Rarefaction curve of sample(A)and OTUs Venn diagram(B)
2.2.2 藏系绵羊瘤胃真菌菌群Beta多样性分析为了探究饲粮蛋白质水平对藏系绵羊瘤胃真菌群落组成的影响,基于样本的OTU信息,计算各样本之间的非加权遗传距离(unweighted genetic dis⁃tance),并进行PCoA的可视化分析。结果如图2所示,3个不同处理组的样本分别聚类于不同的坐标位置。其中LP组样本与其余2组距离相隔较远,表明其真菌菌群结构差异较大。
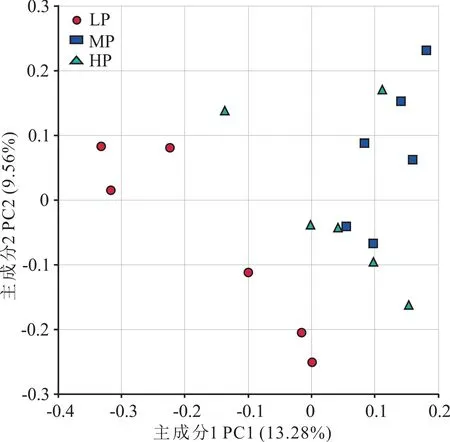
图2 基于非加权遗传距离的PCoA分析Fig.2 PCoA analysis based on unweighted genetic distance
2.3 饲粮蛋白质水平对藏系绵羊瘤胃真菌菌群组成的影响
在不同分类水平上对测序所得的有效序列进行物种注释,共注释到13个门、46个纲、117个目、244个科、489个属和520个种。
由图3可知,在门分类水平上,藏系绵羊瘤胃真菌的优势菌门主要为子囊菌门(51.06%~70.76%)、担子菌门(3.78%~4.70%)、被孢霉亚门(0.21%~2.50%)、新 美 鞭 菌 门(0.29%~5.67%)、毛霉亚门(0.10%~3.92%)、罗兹菌门(0.05%~0.11%)和球囊菌门(0.05%~0.27%)等。其中,子囊菌门是占绝对优势的菌门。进一步分析在属分类水平上藏系绵羊瘤胃真菌的菌群组成,由图4可知,优势菌属主要为青霉属(18.43%~37.58%)、无茎真菌属(1.49%~5.93%)、枝孢属(1.32%~4.27%)、镰孢霉属(0.65%~4.55%)、链格孢属(0.89%~3.07%)和葡萄孢属(0.69%~1.98%)等。分别对不同处理组间真菌优势菌门和优势菌属的相对丰度进行比较,结果发现饲粮蛋白质水平并没有对藏系绵羊瘤胃真菌的结构组成造成显著性影响(P>0.05)。

图3 藏系绵羊瘤胃真菌门水平相对丰度Fig.3 Relative abundance of rumen fungi flora of Tibetan sheep at phylum level
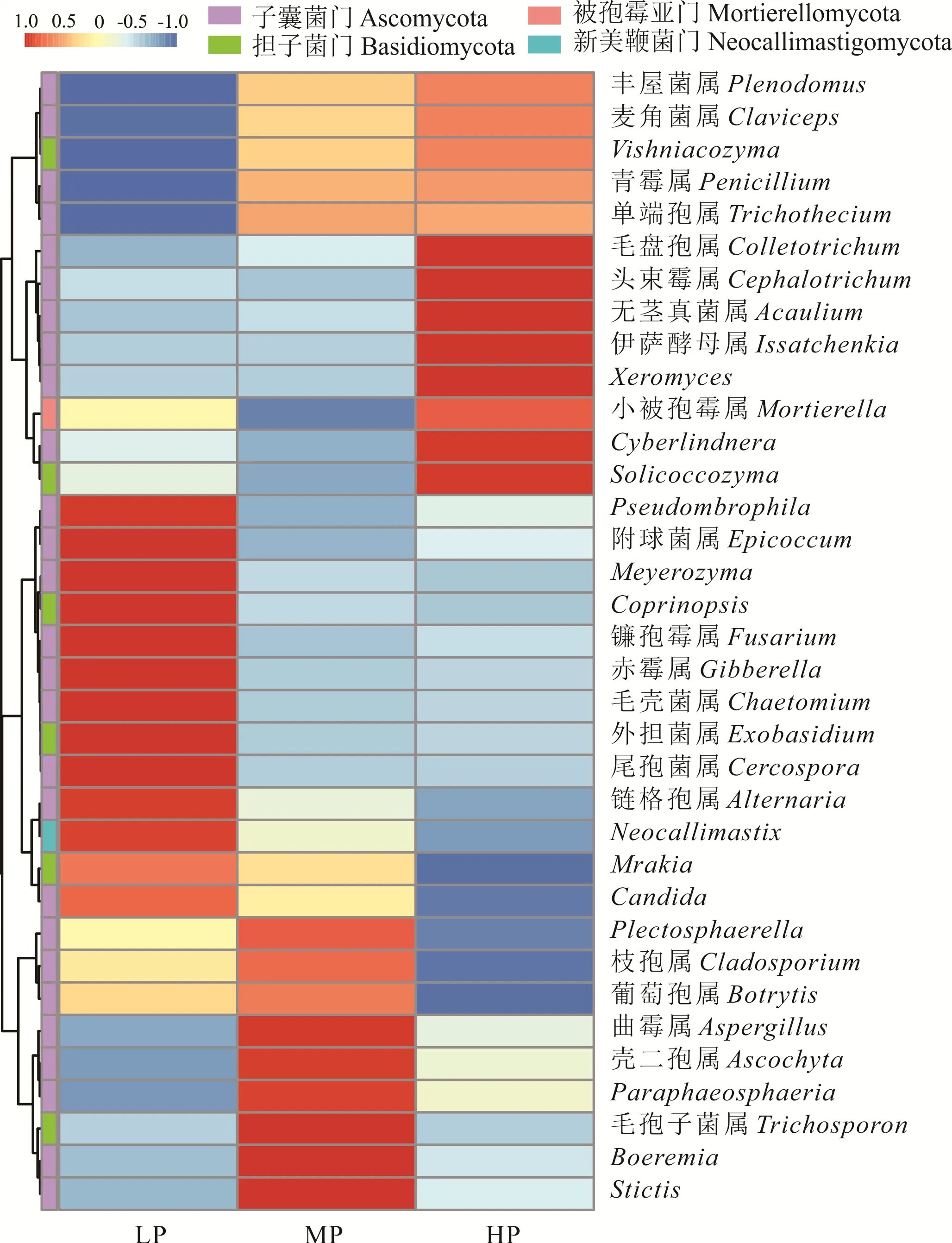
图4 藏系绵羊瘤胃真菌属水平相对丰度热图Fig.4 Heatmap of the relative abundance of rumen fungi flora of Tibetan sheep at genus level
2.4 瘤胃真菌差异物种分析
通过LEfSe对在各个分类水平上丰度有显著差异的微生物进行比较分析。如图5所示,发现33个符合生物标记物的真菌菌群(LDA score>3.0),其中LP组中有12个,包括盘菌目、盘菌纲、附球菌属、Epicoccum_sorghinum等;MP组中有12个,包括座囊菌纲、Plectosphaerella、Plectosphaerellaceae、Lecanoromycetes等;HP组中有9个,包括麦角菌、麦角菌属、被孢霉属、丰屋菌属等。

图5 LEf Se分析柱状图Fig.5 Column chart for LEf Se analysis
2.5 瘤胃真菌功能预测分析
对藏系绵羊瘤胃真菌进行功能注释,并将数据库功能注释的丰度统计结果进行PCA降维分析。如图6A所示,PC1和PC2的贡献率分别为31.59%和16.32%,且LP组样品在聚类结果上与MP、HP两组相对区分。基于FUNGuid预测藏系绵羊瘤胃真菌菌群的营养型。如图6B所示,藏系绵羊瘤胃真菌可以鉴定为共生营养型、腐生营养型、病原营养型、病原-共生营养型、病原-腐生营养型、腐生-共生营养型、病原-腐生-共生营养型、病原-共生-腐生营养型、腐生-病原-共生营养型以及未分类的营养型,其中腐生营养型为藏系绵羊瘤胃真菌中最主要的营养型。
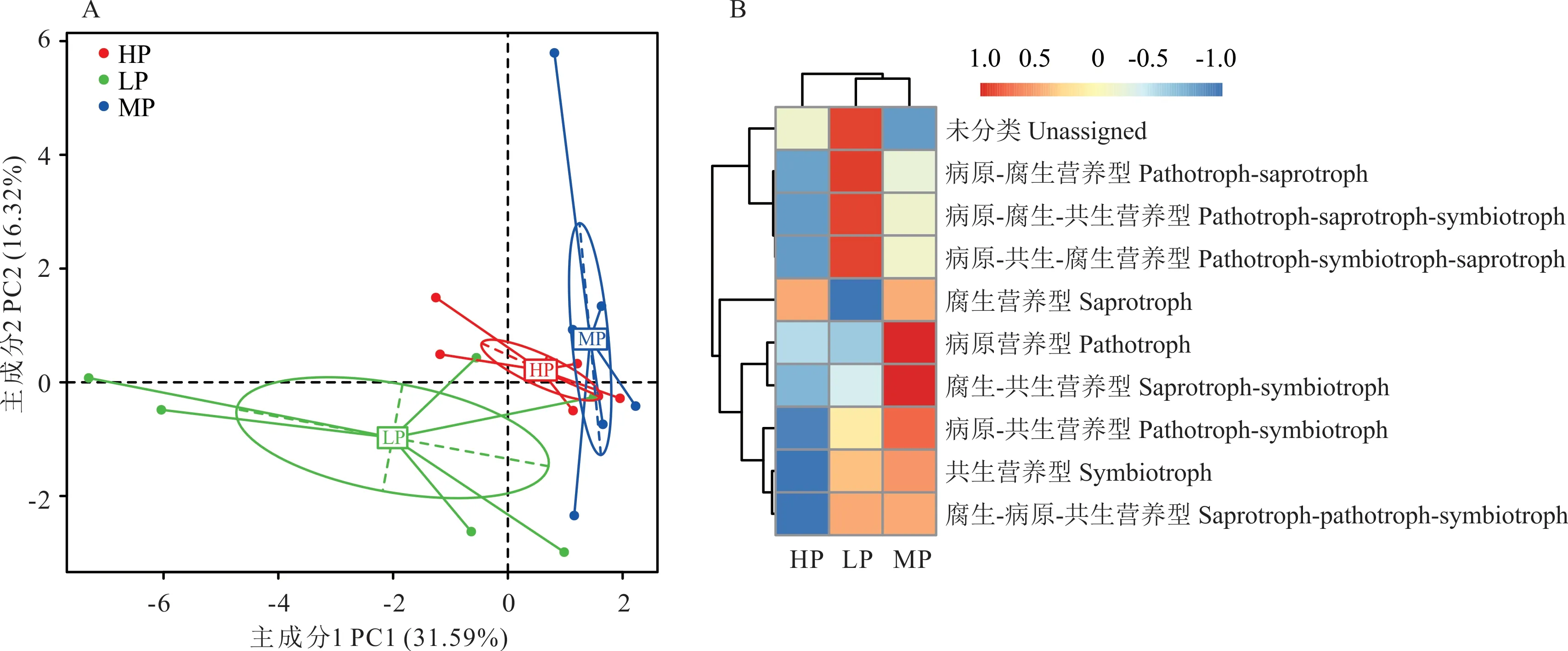
图6 FUNGuid功能注释分析Fig.6 Analysis of FUNGuid functional annotation
3 讨论
蛋白质是动物生长和发育过程中不可缺少的营养物质。不同蛋白质含量的饲粮在反刍动物瘤胃内降解的产物浓度不同。当饲粮中蛋白质水平过低时,会导致反刍动物瘤胃中可降解蛋白质含量降低,不能满足微生物合成所需要的氮源,减少瘤胃微生物种群的数量,最终减缓动物生长速度,影响畜产品产出。反之,当饲粮中蛋白质水平过高,超出机体最大氮沉积量时,会引起家畜的代谢障碍和一系列相关代谢疾病,同时造成环境氮排放污染[13-14]。李海琴等[15]研究表明,当饲粮中蛋白质含量为14%时,小尾寒羊羔羊的平均日增重达到最大值,且瘤胃组织发育更好。吴玉江等[16]研究发现,西藏白绒山羊生长期饲粮中最适宜的蛋白质含量为10.35%~11.29%。崔晓鹏等[17]研究发现,饲粮蛋白质水平可以显著影响藏系绵羊羔羊的生长发育,12%的蛋白质水平可以更好地提高藏系绵羊羔羊的日增重,降低料重比,改善其血清生化指标,本研究结果与此相似,即饲粮蛋白质水平为12.10%和14.12%组的藏系绵羊活体重和日增重显著高于10.06%组。另外,通过对大量研究结果汇总发现,不同品种羊的最适饲粮蛋白质水平有所差别,这可能是由于其所处地理环境和生理构造的不同,这也提示在相关营养学研究时要更加细致化。
反刍动物对饲粮中营养物质的消化利用主要依赖瘤胃内微生物的发酵吸收,瘤胃微生物多样性及结构组成在极大程度上又受到饲粮类型的影响[18]。研究表明,饲养方式、饲粮精粗比和饲粮营养水平等均可影响瘤胃中细菌多样性和优势菌群的组成[19-21],而对于瘤胃真菌的相关报道却较少。本研究采用ITS高通量测序技术解析藏系绵羊瘤胃真菌菌群结构和功能,并探讨饲粮蛋白质水平对瘤胃菌群的影响。微生物研究中主要以Alpha多样性指数来评估菌群多样性,包括衡量物种丰富度的Chao1、ACE指数和衡量物种多样性的Shannon、Simpson指数[22]。冶文兴等[23]研究发现,饲粮中添加果聚糖可以小幅改变中国荷斯坦奶牛瘤胃真菌ACE指数、Shannon指数和Simpson指数,但对瘤胃真菌菌群整体的多样性和丰富度均未产生显著影响。付子琳等[24]结合OTU以及Alpha多样性Chao1和ACE指数的分析发现,不同饲养模式下成年滩羊瘤胃真菌多样性有所差别且放牧组滩羊瘤胃真菌丰富度显著高于舍饲组。徐晓锋等[25]研究发现,随着日粮精粗比的增加,中国荷斯坦奶牛瘤胃真菌总数降低,多样性升高。本试验中不同处理组间Chao1、ACE、Shannon和Simpson指数有差别但均没有达到显著性水平,这表明改变饲粮中蛋白质水平对藏系绵羊瘤胃真菌菌群结构的多样性和丰富度有影响但不显著。
在不同分类水平上对藏系绵羊瘤胃真菌菌群结构组成进行分析。在门分类水平上,藏系绵羊瘤胃真菌的优势菌门主要为子囊菌门、担子菌门、被孢霉亚门和新美鞭菌门等,这也与牦牛、奶牛等其他反刍动物的瘤胃真菌组成相类似[23,26]。子囊菌门作为真菌界最大的一类微生物,在营养物质消化过程中主要参与木质素和角蛋白等有机物质的降解[27]。新美鞭菌门是广泛存在于山羊、绵羊、牛等食草动物消化道中的一种功能性真菌,在降解木质化纤维素方面起重要作用[28],还可以通过消耗瘤胃可降解蛋白为宿主提供生命活动所需营养成分[29]。进一步探究发现,在属分类水平上藏系绵羊瘤胃液中丰度较高的真菌菌属为青霉属、无茎真菌属、枝孢属、镰孢霉属、链格孢属等。张洁等[30]研究表明,滩羊瘤胃中的优势菌属主要为梨霉属、广义酿酒酵母和裂褶菌属等。冶文兴等[23]研究表明,中国荷斯坦奶牛瘤胃真菌中丰度较高的为柄孢壳属、曲霉属和德巴利酵母属等。王彩蝶等[31]研究发现,哈萨克羊瘤胃液真菌属水平相对丰度较高的为假丝酵母属、假散囊菌属和Metschnikow ia等。以上结果表明,不同物种在属水平上相对丰度较高的优势菌差别较大。由于NCBI、KEGG和SwissProt等现有的数据库缺少真菌的信息,所以导致真菌测序后仍存在大量未注释到的基因[32]。
使用FUNGuid对藏系绵羊瘤胃真菌菌群进行生态功能预测。研究发现,腐生营养型是藏系绵羊瘤胃真菌中最主要的营养类型。瘤胃菌群的生态功能与其结构组成密切相关,藏系绵羊瘤胃在门水平上相对丰度最高的优势菌门为子囊菌门,子囊菌门多营腐生生活,用以分解瘤胃内的有机物质[33]。另外,由于大部分瘤胃真菌主要参与的是植物纤维的降解,真菌产生的多种消化酶主要附着于饲草料的表面,起到降解碳水化合物和纤维素的作用[24]。本研究只对藏系绵羊的瘤胃液真菌进行了分析,未对瘤胃固态物进行分析,可能会造成饲粮蛋白质水平对真菌菌群影响不明显的结果。
4 结论
本研究结果表明,适当提高饲粮中蛋白质水平可以显著提高藏系绵羊的生长性能,但饲粮蛋白质水平并未对瘤胃真菌菌群的多样性和结构组成产生明显的影响。

