水热处理对黄豆秸秆体外发酵、甲烷生成及微生物的影响
周承福,汪水平,张佰忠,张秀敏,王荣,马志远,王敏
(1.西南大学动物科学技术学院,重庆 402460;2.湖南省畜牧兽医研究所,湖南 长沙 410131;3.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南 长沙 410125;4.白玉县牧旺农业科技有限公司,白玉县玉牧康源牧业有限公司,四川 白玉 627150)
黄豆(Glycine max)秸秆是世界上最丰富的农作物秸秆之一,产量大、成本低,可作为反刍动物的主要粗饲料来源。然而,黄豆秸秆紧密的纤维素-半纤维素(hemicellucose,HC)-木质素结构阻碍酶和微生物的接触与降解,阻碍其在反刍动物饲粮中的应用[1]。因此,提高黄豆秸秆的瘤胃降解率,不仅有利于这一丰富农副产品的利用,也有助于缓解反刍动物优质饲草短缺的现状。热处理可有效破坏作物秸秆的木质纤维素结构[2]。蒸汽处理利用高压蒸汽破坏木质素和HC之间的一些化学键,水解部分多糖,有利于瘤胃微生物的附着及酶的结合,进而提高秸秆的瘤胃降解率[3-4]。水热处理(hydrothermal treatment,HT)是在高温高压条件下使水保持液体状态,以水作为溶剂和催化剂破坏细胞壁结构,从而增加纤维素的可水解性[5]。与蒸汽处理相比,HT使水保持液态,从而可产生更多的溶解产物,并减少如糠醛和木质素化合物等不利降解产物的产生[6-7]。目前,HT广泛应用于生物能源处理中[8-10]。但是,HT提高农作物副产品在反刍动物饲粮中的营养价值及潜力还有待探索。瘤胃发酵产生的甲烷是导致气候变化的重要温室气体[11]。使用HT对黄豆秸秆进行预处理,可破坏细胞壁结构,促进糖的释放;含糖量的增加可提高瘤胃微生物对底物的降解并促进丙酸产生,进而减少瘤胃甲烷生成[12]。此外,HT过程中产生的一些化合物,如可溶性木质素、糠醛和羟甲基糠醛,对产甲烷菌的生长有抑制或毒害作用,从而抑制甲烷的产生[7]。基于此,本试验利用全自动体外模拟瘤胃发酵系统,研究HT对黄豆秸秆体外发酵、甲烷生成及微生物的影响,探究HT影响黄豆秸秆瘤胃降解率的机理,为科学开发和利用黄豆秸秆农副产品和有效缓解反刍动物优质饲草短缺的现状提供技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 黄豆秸秆和HT黄豆秸秆 本试验在2020年3月进行,试验所用黄豆秸秆来自中国安徽省。将收获黄豆后的秸秆晒干,粉碎过0.425 mm筛。HT黄豆秸秆的制作主要根据Yu等[13]描述的方法进行:将40 g长度为1 cm的黄豆秸秆放入装有200 mL水的密闭反应容器中,在饱和蒸气压下将固液混合物加热到180℃,并用磁力搅拌器以500 r·min-1搅拌10 min;反应结束后,将固液混合物在30℃条件下烘干,再粉碎过0.425 mm筛。将黄豆秸秆和HT黄豆秸秆在室温条件下保存于干燥器中,用于化学成分分析和体外模拟瘤胃发酵试验。
根据Aoac[14]的方法测定发酵底物干物质(dry matter,DM)、有机物及粗蛋白质含量。根据Van Soest等[15]的方法测定中性洗涤纤维(neutral detergent fiber,NDF)、酸性洗涤纤维(acid detergent fiber,ADF)和酸性洗涤木质素含量,在NDF测定过程中加入稳定的耐热α-淀粉酶。采用蒽酮法测定水溶性碳水化合物(water soluble carbohydrate,WSC)含量[16]。根据Yu等[17]的方法测定单糖和糠醛含量。
1.1.2 人工瘤胃培养液 3只健康、体重相近(25.0±2.0)kg且装有永久性瘤胃瘘管的成年湘东黑山羊作为瘤胃液供体动物,单笼饲养,自由饮水。山羊饲喂精粗比为50∶50的全混合饲粮(TMR),粗料为稻草,精料由50%玉米(Zea mays)、19.8%麸皮、18.5%豆粕、3.0%黄豆油、1.2%碳酸钙、1.1%氯化钠、1.0%维生素和微量元素预混料组成。每天08:00和18:00分两次等量饲喂,自由饮水。试验当天,在晨饲前1 h,随机从2只瘘管羊取得新鲜瘤胃液,迅速装入保温瓶带回实验室。人工瘤胃营养液的配制参照Menke等[18]的方法。将采集的瘤胃液用6层脱脂纱布过滤,量取600 mL的滤液迅速加入到准备好的2400 mL人工瘤胃营养液中(瘤胃液与人工瘤胃营养液体积比为1∶4),制成混合人工瘤胃培养液,其中整个过程的温度保持在39.5℃,通入纯二氧化碳以保持厌氧环境(以刃天青色变成无色来判断)。以磁力搅拌器搅拌人工瘤胃培养液,以保持瘤胃液与营养液混合均匀。
1.1.3 全自动体外模拟发酵设备 本研究采用的全自动体外模拟瘤胃发酵设备,包括厌氧瓶、三通电磁阀、培养箱、压力传感器、计算机和气相色谱仪[19]。培养箱设定:振荡频率50 r·min-1和培养温度39.5℃。厌氧瓶通过导管与三通电磁阀和压力传感器连接。压力传感器与计算机连接,每分钟测定并记录瓶中压力,通过压力与气体体积间关系计算气体生成量。三通电磁阀受计算机控制,当厌氧瓶中压力超过9 k Pa,电磁阀自动打开,厌氧瓶气体释放,并通过导管进入气相色谱仪(安捷伦7890A,安捷伦公司,美国)测定排出气体中的氢气和甲烷含量。氢气(甲烷)产量根据厌氧瓶顶部空间大小、压力与气体体积的转化系数和氢气(甲烷)含量进行计算[20]。
1.2 试验方法
1.2.1 试验设计 采用对照试验设计,将黄豆秸秆和HT黄豆秸秆分别作为对照组和HT组。试验分为3个批次,即3个重复,每批次内,每个处理做3个平行。
1.2.2 体外模拟瘤胃发酵试验操作 称取1.2 g底物于135 mL厌氧发酵瓶中。发酵前将所有发酵瓶置于振荡频率50 r·min-1和温度39.5℃的培养箱中预热。取出发酵瓶,通入二氧化碳以保证发酵瓶中为厌氧环境,用瓶口分液器向每个发酵瓶中加入60 mL人工瘤胃培养液,并将发酵瓶放入体外模拟瘤胃发酵设备中进行发酵,72 h后终止发酵,并采集固体、液体及微生物样品进行测定。
1.2.3 样品采集和分析[21-29]首先用p H计(Starter 300,上海奥豪斯仪器有限公司)对每个发酵瓶中的发酵液进行pH测定。然后将发酵瓶充分摇匀,取2 mL发酵液,15000 r·min-1和4℃下离心10 min,取1.5 mL上清液,加入0.15 mL 25%偏磷酸固定,静置15 min后,-20℃保存。样品在常温条件下解冻,15000 r·min-1和4℃条件下离心10 min,取0.6 mL上清液装于测定瓶中,在气相色谱仪(安捷伦7890A,安捷伦公司,美国)测定挥发性脂肪酸(volatile fatty acids,VFA)组分[21]。再取2 mL发酵液,放入液氮中速冻,置于-80℃冰箱保存,用于微生物分析。试验采用Qiagen公司的QIAamp DNA Stool Mini Kit试剂盒及按照试剂盒的说明书对微生物DNA进行提取。提取的DNA首先用微量紫外分光光度计(ND-1000)测定其核酸浓度(ng·μL-1)及纯度(OD260nm/OD280nm),最后用0.8%凝胶电泳检测其完整性,剩余的DNA置于-80℃保存。利用实时荧光定量PCR对总细菌、甲烷菌、真菌、原虫、纤维降解菌群(白色瘤胃球菌、黄色瘤胃球菌和产琥珀酸丝状杆菌)、甲烷菌群(甲烷杆菌目、甲烷短杆菌和甲烷微菌目)进行定量分析。使用的引物序列见表1,用1.8%凝胶电泳检测PCR产物,数据结果以log10表示[22]。最后,剩余发酵液用0.441 mm的尼龙纱布过滤,置于105℃烘箱中烘干至恒重。根据底物重量和烘干之后的发酵底物重量,结合取样过程中发酵液体积的变化,参考Zhang等[23]描述的方法计算DM降解率。
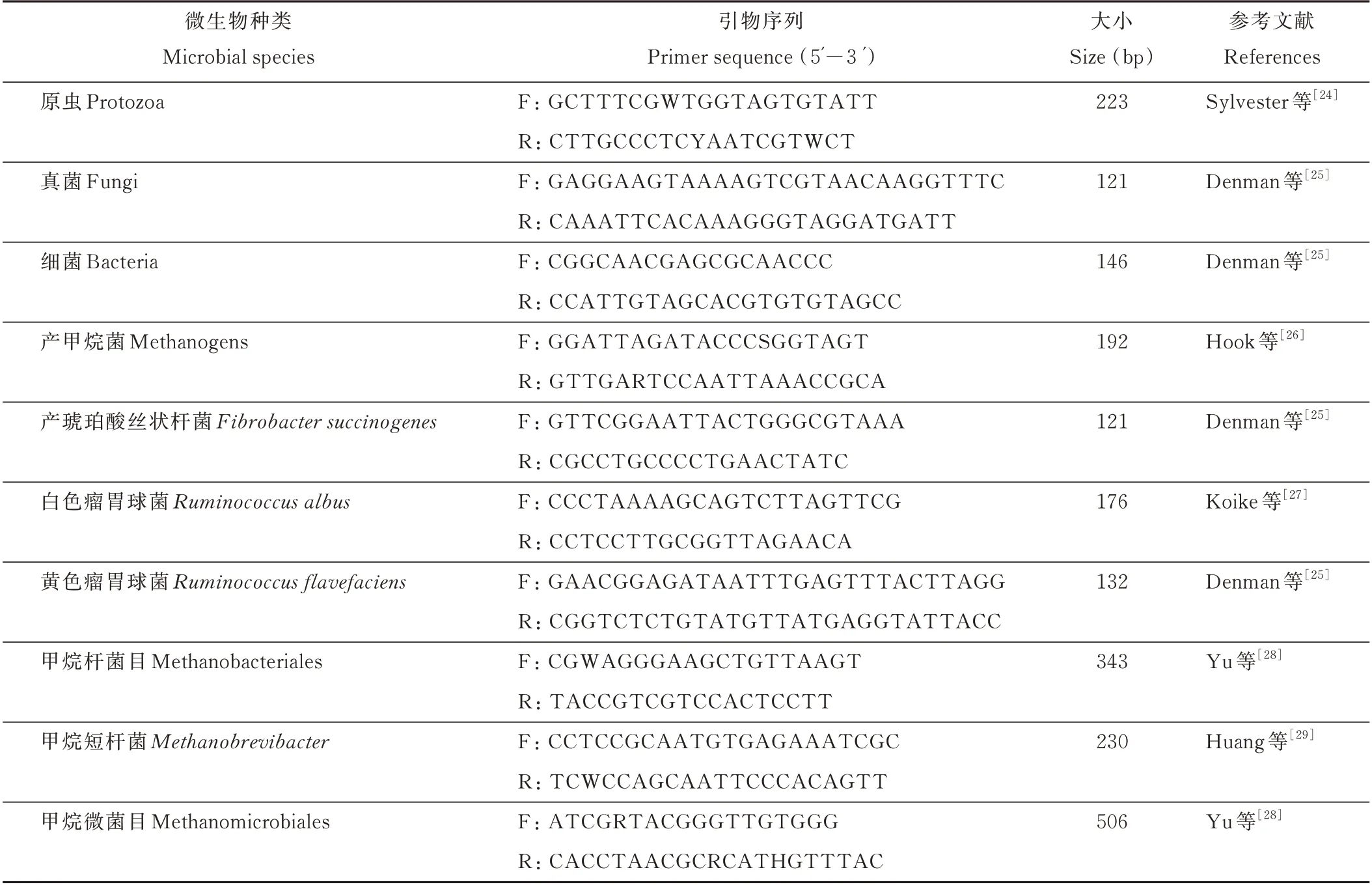
表1 微生物qPCR引物序列Table 1 M icrobial q PCR primer sequence
1.3 数据分析
1.3.1 计算公式 中性洗涤可溶液(neutral detergent soluble,NDS)与HC含量的计算公式分别是:NDS=100-NDF,HC=NDF-ADF[30]。
应用非线性软件程序,按照Wang等[31]的模型对体外模拟瘤胃发酵产气曲线进行拟合。模型及相关参数的计算公式如下:
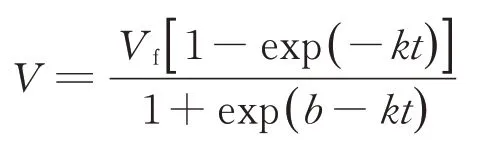
式中:V为t时间点底物累积产气量(mL·g-1),Vf为理论最大产气量(mL·g-1),k为产气速率(h-1),b为曲线形状指标。
起始底物降解速率(FRD0,h-1),即t=0时的底物降解速率,计算公式参考Wang等[31]的模型,数学表达方程为:
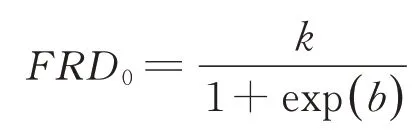
式中:k为产气速率(h-1),b为曲线形状指标。
按照Wang等[20]的模型对体外模拟瘤胃发酵氢气曲线进行拟合,模型及相关参数的计算公式如下:
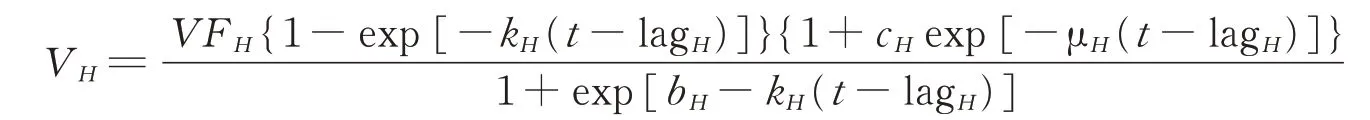
式中:VFH为潜在最大氢气产气量(mL·g-1),bH和cH为形状参数,kH为氢气产气速率(h-1),μH为氢气消耗速率(h-1),lagH为滞留时间(h)。
根据Wang等[21]描述的公式,挥发性脂肪酸(volatile fatty acid,VFA)产氢效率(RNH2)为:

式中:Cac、Cbu、Cibu、Cpr、Cva、Civa及CVFA分别为乙酸、丁酸、异丁酸、丙酸、戊酸、异戊酸及VFA浓度。
1.3.2 数据处理 使用Excel 2007软件进行试验数据基本处理,采用SPSS 11.5软件中的“比较均值”模块进行独立样本T检验,P<0.05为差异显著,P<0.01为差异极显著,0.05≤P<0.10为有趋势。
2 结果与分析
2.1 HT对黄豆秸秆化学成分变化的影响
由表2可知,与对照组相比,HT可提高(P<0.001)黄豆秸秆NDS(+66.5%)和WSC(+234%)含量,降低(P<0.001)NDF(-22.3%)、ADF(-10.2%)及HC(-87.7%)含量。此外,HT可提高(P<0.001)黄豆秸秆阿拉伯糖(+49.7%)、半乳糖(+45.3%)及木糖(+174.0%)含量,降低(P<0.001)葡萄糖(-78.6%)、鼠李糖(-30.8%)及果糖含量(-80.8%)。

表2 发酵底物化学组成和单糖含量Table 2 The concentrations of chemical compositions and monosaccharides for the fermentation substrates(g·kg-1,dry matter basis)
2.2 HT对黄豆秸秆体外降解与总产气参数的影响
由图1可知,HT对黄豆秸秆体外发酵总产气量和总产气速率有显著影响。发酵0~6 h对照组和HT组产气量差异不明显,发酵6~72 h HT组产气量均低于对照组;发酵0~18 h HT组产气速率均低于对照组,发酵24~45 h HT组产气速率均高于对照组,45~72 h对照组和HT组产气速率差异不明显。由表3可知,与对照组相比,HT提高黄豆秸秆DM降解率(P<0.001),降低每克DM产气量(P<0.001)、每克可消化DM产气量(P<0.001)、起始底物降解速率(P<0.05)。
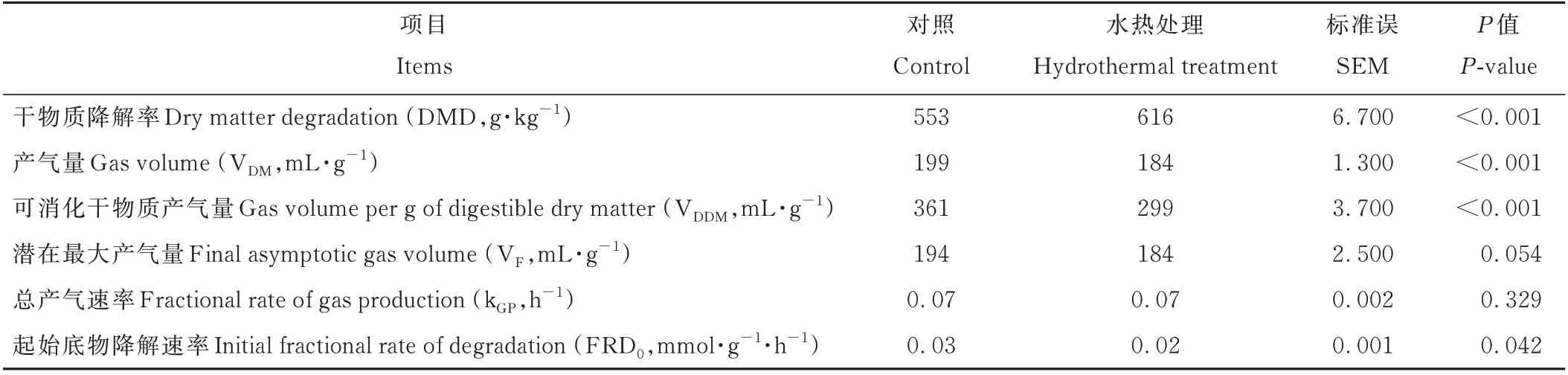
表3 HT对黄豆秸秆72 h体外模拟瘤胃发酵底物降解与总产气参数的影响Table 3 Effects of HT on the substrate degradation and the par ameter s of gas production of soybean str aw after 72 h in vitro ruminal incubation
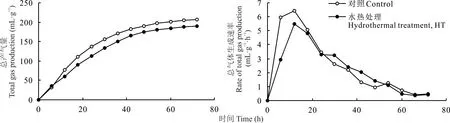
图1 HT对黄豆秸秆72 h体外模拟瘤胃发酵总气体生成曲线的影响Fig.1 Effects of HT on the kinetic of total gas pr oduction of soybean straw after 72 h in vitro ruminal incubation
2.3 HT对黄豆秸秆体外甲烷与氢气产气参数的影响
由图2可知,HT对黄豆秸秆体外发酵甲烷产量和甲烷生成速率具有显著影响。发酵0~9 h HT组甲烷产量均高于对照组,发酵12~72 h HT组甲烷产量均低于对照组;发酵0~30 h HT组甲烷生成速率均低于对照组。由表4可知,与对照组相比,HT降低(P<0.001)黄豆秸秆每克DM甲烷产量、每克可消化DM甲烷产量、甲烷浓度、甲烷潜在最大产气量及甲烷产气速率。由图3可知,发酵0~9 h HT组氢气产量均高于对照组,发酵9~72 h HT组氢气产量均低于对照组;发酵0~42 h HT组氢气生成速率均低于对照组。由表4可知,与对照组相比,HT降低(P<0.001)黄豆秸秆每克DM氢气产量、每克可消化DM氢气产量、氢气浓度、氢气潜在最大产气量及氢气产气速率。

表4 HT对黄豆秸秆72 h体外模拟瘤胃发酵甲烷和氢气产气参数的影响Table 4 Effects of HT on the par ameter s of methane and hydr ogen gas pr oduction of soybean str aw after 72 h in vitro r uminal incubation
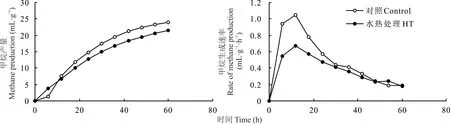
图2 HT对黄豆秸秆72 h体外模拟瘤胃发酵甲烷产量和生成速率曲线的影响Fig.2 Effects of HT on the kinetic of methane production of soybean straw after 72 h in vitro ruminal incubation

图3 HT对黄豆秸秆72 h体外模拟瘤胃发酵氢气产量和生成速率曲线的影响Fig.3 Effects of HT on the kinetic of hydrogen production of soybean straw after 72 h in vitro ruminal incubation
2.4 HT对黄豆秸秆体外发酵参数的影响
由表5可知,与对照组相比,HT可提高黄豆秸秆体外发酵TVFA(P<0.05)、丙酸(P<0.001)、丁酸(P<0.001)及戊酸(P<0.05)浓度,降低氨态氮(P<0.05)、乙酸(P<0.001)及异戊酸(P<0.001)浓度、乙酸/丙酸(P<0.001)及VFA产氢量(P<0.001)。
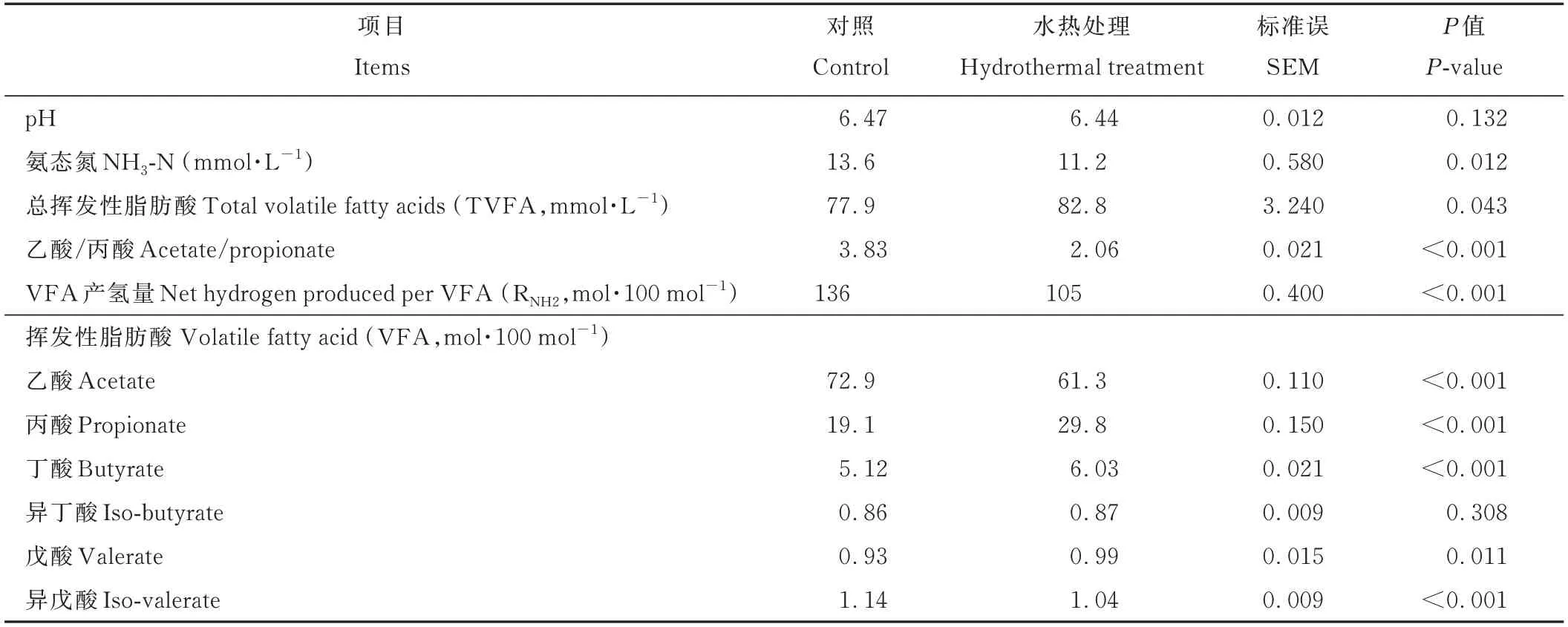
表5 HT对黄豆秸秆72 h体外模拟瘤胃发酵参数的影响Table 5 Effects of HT on the fer mentation parameter s of soybean straw after 72 h in vitro ruminal incubation
2.5 HT对黄豆秸秆体外发酵微生态的影响
由表6可知,与对照组相比,HT可减少黄豆秸秆体外发酵真菌(P<0.01)、原虫(P=0.067)、产甲烷菌(P<0.05)及产琥珀酸丝状杆菌(P<0.05)的数量。
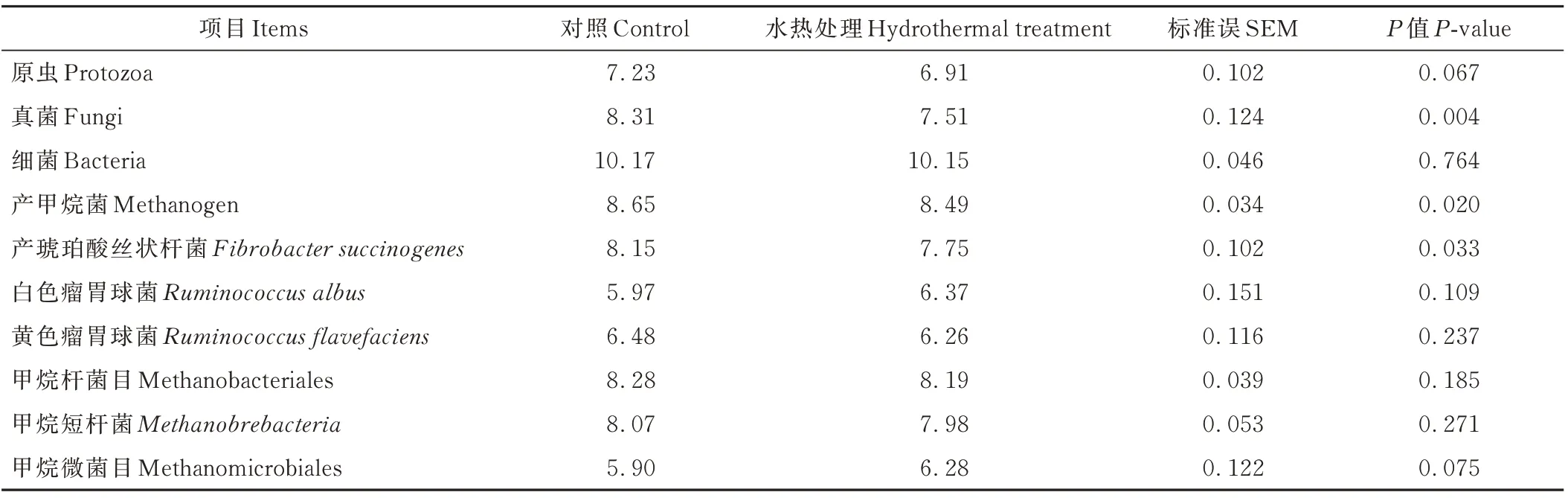
表6 HT对黄豆秸秆72 h体外模拟瘤胃发酵微生物种群的影响Table 6 Effects of HT on the populations of major micr oor ganisms of soybean str aw after 72 h in vitro r uminal incubation(log10,copies·mL-1)
3 讨论
HT主要利用高温高压条件下的水打断木质素和HC之间的一些化学键,水解部分多糖,进而破坏秸秆木质纤维素结构[2,4]。本试验发现,HT可显著降低黄豆秸秆NDF、ADF及HC含量。Li等[8]和Jiang等[10]也发现,HT可破坏棉花(Gossypium herbaceum)秸秆和南荻(Miscanthuslutarioriparious)的抗逆性物质结构,大幅降低HC含量。秸秆纤维素-HC-木质素结构遭到破坏时,纤维素的聚合度降低,进而增加WSC含量[5,17]。Nitsos等[32]发现,HT可促进HC水解,进而提高WSC含量。本试验发现,HT显著增加了黄豆秸秆NDS和WSC含量。因此,HT可有效破坏黄豆秸秆的纤维结构,降低纤维含量,提高WSC含量。WSC包含葡萄糖、果糖、阿拉伯糖、木糖、半乳糖及鼠李糖等糖类物质。Lopez等[9]指出,HT可将葡萄糖、木糖、果糖等单糖脱水形成5-羟甲基糠醛、糠醛、糖酐及有机酸,从而降低葡萄糖、果糖和木糖含量。本试验发现,HT显著改变黄豆秸秆WSC的组成,降低葡萄糖、鼠李糖和果糖含量,增加阿拉伯糖、半乳糖和木糖含量。
本试验中,HT显著提高黄豆秸秆DM降解率,促进VFA生成。与纤维相比,发酵底物NDS和WSC更易于被瘤胃微生物降解[33-34]。Getachew等[35]指出,瘤胃VFA产量与饲粮WSC含量呈正相关关系。Zhang等[23]发现,尿素和硝酸盐处理提高稻草NDS含量,进而提高稻草DM降解率和产气量。因此,HT提高黄豆秸秆NDS和WSC含量,这可能是DM降解率和VFA产量增加的原因。饲粮较高WSC和较低NDF有利于瘤胃氨的利用并促进微生物蛋白合成,进而提高氨态氮的利用效率[36]。本试验中,HT降低了发酵液氨态氮浓度,这可能也与黄豆秸秆WSC含量增加,促进了瘤胃微生物对氨态氮的利用有关。HT通过提高WSC含量促进了瘤胃微生物对黄豆秸秆的碳水化合物降解和氨的利用。
甲烷是瘤胃微生物发酵碳水化合物的产物之一,产量随饲粮碳水化合物组成而变化。提高反刍动物饲粮淀粉水平或降低纤维含量,可降低甲烷产量[37]。Aguerre等[38]指出,奶牛甲烷排放量随饲粮纤维水平的增加而增加。与纤维相比,WSC发酵的甲烷生成效率更低。本试验发现,HT抑制瘤胃甲烷生成,每克DM甲烷产量、每克可消化DM甲烷产量和甲烷潜在最大产气量都呈现明显下降。氢分子是瘤胃内甲烷合成重要前体物,产甲烷菌主要利用氢还原二氧化碳产生甲烷[39]。未被利用的氢分子进发酵瓶顶端,并通过排气释放到大气。本试验发现,HT抑制瘤胃氢气生成,每克DM氢气产量和氢气浓度都呈现明显下降。Shima等[40]指出,瘤胃氢气浓度会影响产甲烷菌甲烷合成酶的基因表达,从而改变甲烷产量。Patra[41]指出,可通过减少底物氢的产量或抑制甲烷菌的活性,来减少产甲烷菌对氢的利用,从而减少甲烷产生。HT可能通过降低黄豆秸秆NDF含量和提高可溶性糖含量,减少瘤胃氢和甲烷生成。
甲烷生成与饲粮碳水化合物结构和瘤胃发酵模式密切相关。瘤胃中80%的产甲烷菌主要以氢和二氧化碳为原料产生甲烷[39],甲烷产量受氢产量的限制。Janssen[12]指出,丙酸生成伴随着氢的消耗,而乙酸产生伴随着氢的生成。瘤胃纤维素和HC降解有助于乙酸和甲烷生成,而瘤胃淀粉和WSC降解生成更多丙酸和丁酸,进而抑制甲烷生成[42-43]。Song等[36]指出,较高WSC和较低NDF有助于丙酸产生,并抑制乙酸生成。本试验发现,HT提高发酵液丙酸和丁酸摩尔比例,减少乙酸摩尔比例。乙酸摩尔比例下降将减少氢的生成,进而降低VFA产氢效率。因此,HT改变瘤胃发酵模式,抑制乙酸生成,并促进丙酸和丁酸生成,降低VFA的产氢效率,进而抑制甲烷生成。
瘤胃内真菌、细菌、原虫及甲烷菌是瘤胃内降解碳水化合物的主要菌群,其中,原虫对植物细胞壁降解的贡献率约占20%,而真菌和细菌约占80%[44]。HT降低发酵液原虫、真菌及产琥珀酸丝状杆菌基因拷贝数。HT促进黄豆秸秆纤维降解形成WSC,这使得HT后的黄豆秸秆NDF更难降解,进而抑制瘤胃内主要纤维降解微生物种群的增殖。另外,HT降低发酵液甲烷菌基因拷贝数,这可能与原虫和真菌数量下降密切相关,因为瘤胃大部分甲烷菌附着在原虫与真菌上[45]。尽管HT促进黄豆秸秆碳水化合物的瘤胃发酵,但通过增加未破坏纤维的瘤胃微生物降解难度,抑制纤维降解微生物种群和甲烷菌增殖。
4 结论
HT可破坏黄豆秸秆纤维素-HC-木质素结构,降低纤维含量,增加WSC含量,提高体外发酵DM降解率和VFA含量,促进碳水化合物的发酵。HT改变黄豆秸秆的瘤胃发酵模式,抑制乙酸生成,促进丙酸与丁酸生成,进而减少VFA产氢效率,抑制氢气与甲烷生成。HT增加黄豆秸秆未破坏纤维的瘤胃微生物降解难度,抑制纤维降解微生物种群和甲烷菌增殖。总之,HT可成为提高黄豆秸秆碳水化合物瘤胃微生物降解效率和抑制甲烷生成的一种潜在策略,其用于反刍家畜生产的成本和效益仍需要进一步的试验研究。

