干旱胁迫对光叉委陵菜根系特征、结构和生理特性的影响
高鹏飞,张静,范卫芳,高冰,郝宏娟,吴建慧
(东北林业大学园林学院,黑龙江 哈尔滨 150040)
干旱严重影响植物的生长与观赏价值,甚至会导致植物的死亡。根系是植物吸收水分和养分的主要器官。有研究表明,经历干旱后,植物根系总长度、总表面积、总体积、平均直径和生物量等表型特征都会发生改变[1-2],根系细胞中的线粒体等细胞器的形态和数目也会出现变化[3]。干旱条件下,丙二醛(malondialdehyde,MDA)会在细胞中不断积累,损伤生物膜系统[4-5],而细胞中的脯氨酸、可溶性蛋白等渗透调节物质含量会增加,提高细胞的保水能力[6-7],一些抗氧化酶如超氧化物歧化酶(superoxide dismutase,SOD)等也会增加活性,帮助植物抵御干旱胁迫[8-12]。因此,这些都可以作为判断植物对干旱胁迫程度耐受性的重要指标。
东北地区因常年降水较少,在园林植被的选择上具有一定的特殊性。光叉委陵菜(Potentilla bifurcavar.glabrata)是蔷薇科(Rosaceae)委陵菜属(Potentilla)多年生草本植物,能够适应东北地区干燥的气候条件,株型优美,花色美观,根系发达,耐粗放管理,可以作为优良地被植物在园林中应用[13]。目前,对于委陵菜属植物的研究多集中于资源开发利用、药用和观赏价值、引种驯化及花粉、叶表皮形态等[14-17],在生理方面尤其是干旱生理的研究较少。根系直接接触土壤,当植物遭受干旱胁迫时,发达的根系是植物获得水分和养分的重要保证。本研究通过自然控水的方法,测定干旱胁迫下光叉委陵菜的根系表型、结构特征以及根系生理指标变化,探讨光叉委陵菜的耐旱能力临界值,可以扩大其应用范围,也可以为耐旱品种的选择和城市绿化植物品种的丰富提供理论依据。
1 材料与方法
1.1 试验材料
以东北林业大学园林学院苗圃地的光叉委陵菜多年生实生幼苗为研究对象,选取株高5 cm左右、生长周期一致的植株苗,缓苗处理2周待其生长。将生长正常且高度在15 cm左右的植株移植到直径15 cm的花盆里,培养基质比例为营养土∶蛭石=3∶1,在植物培养室内进行种植,培养室温度为25℃/18℃(昼/夜),光照强度为4000 lx,时间为16 h/8 h(光/暗)。
1.2 试验方法
2019年4月在东北林业大学园林学院植物综合实验室中进行试验。干旱胁迫处理前植株正常浇水。试验设定对照组和胁迫组,对照组每天正常浇水,胁迫组分为两组,其中一组在干旱胁迫0,5,10,15,20,25 d时分别取样测定根系表型特征及生理指标,在0,5,15,25 d时分别取样观察根系解剖结构和超微结构,另一组在干旱胁迫5,10,15,20,25 d时进行复水处理,并在复水5 d后对植物材料进行取样,以测定各项生理指标。每个测定取样3株(3次重复)植株。所取待测样品放入液氮后保存于-80℃超低温冰箱。
其中,土壤水分设置包括:自然状态(田间最大持水量的70%~80%)、轻度干旱胁迫(田间最大持水量的60%~70%)、中度干旱胁迫(田间最大持水量的50%~60%)、重度干旱胁迫(田间最大持水量的40%~50%)[18-19]。根据预先进行的土壤持水量测定,自然失水状态下的土壤在干旱0 d为自然状态,5、10 d为轻度干旱胁迫,15、20 d为中度干旱胁迫,25 d为重度干旱胁迫。
1.3 测定项目与方法
1.3.1 根系表型特征的测定 取植株根系洗去多余的土与杂质,用Expression 11000 XL根系扫描仪扫描整个根系,用WinRHIZO软件分析根系的总长、总表面积、总体积及根系直径的数据。参照陈丽飞[20]、袭梅[21]的方法,剪取根系洗净吸干水分,105℃烘干2 h,65℃下烘干48 h以上至恒重,测量其干重。
1.3.2 根系超微结构的观察 取植株根系距根尖1 cm以上的部位装在瓶中,取材大小为1 mm×3 mm,抽真空加入3%的戊二醛固定24 h以上,0.1 mol·L-1磷酸缓冲液冲洗3次,用1%锇酸固定4 h,去离子水冲洗3次,再用梯度浓度乙醇进行脱水处理,丙酮过渡,用环氧树脂812进行渗透包埋,一段时间后用LKB-5切片机(LKB Co,Switzerland)切片,醋酸双氧铀-柠檬酸铅双重染色。用H7650透射电镜观察。
1.3.3 根系生理指标的测定 参照王学奎[22]的方法,测定MDA、脯氨酸、可溶性蛋白的含量及SOD活性。
1.3.4 图片与数据处理 用Photoshop软件进行图片组合,将测定的试验数据采用Excel 2007软件进行计算和制表,用SPSS 22.0进行方差分析,ANOVA检验差异显著性。
2 结果与分析
2.1 干旱胁迫对光叉委陵菜根系表型特征的影响
光叉委陵菜的根系总长、根系体积、根系总表面积及根系平均直径随着干旱胁迫时间的延长逐渐增加,最大值均出现在25 d时,其中,5~15 d时增长速度较快,20、25 d时增长趋势变缓。说明植物的根系在轻度和中度的干旱胁迫时能正常生长,在重度的干旱胁迫时植物的根系生长受到抑制。25 d时的根系总长、总表面积、总体积和平均直径较0 d分别增加了118.45%、34.44%、80.00%、64.10%。根系干重在干旱前期大幅增加,在15 d时达最大值,最大变化率为38.30%,而在干旱后期则迅速减少,且低于0 d的干重(表1)。
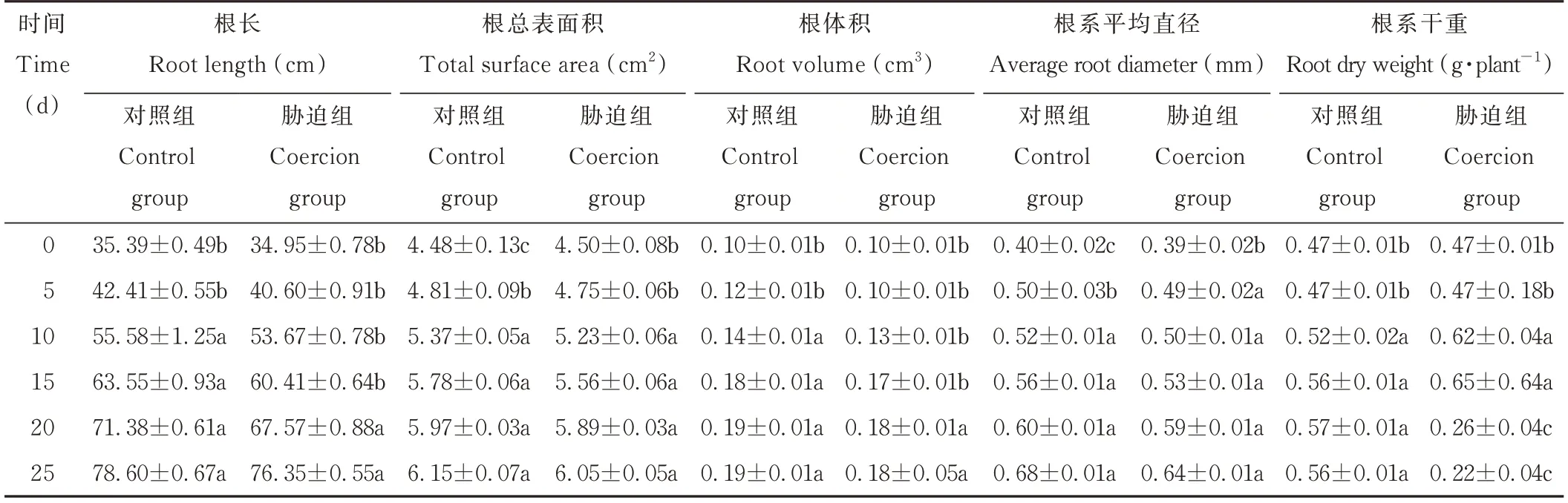
表1 干旱胁迫对光叉委陵菜根系表型特征的影响Table 1 Effect of drought stress on root characteristics of P.bifurca var.glabrata
2.2 干旱胁迫对光叉委陵菜根系超微结构的影响
0 d自然状态下(图1A),光叉委陵菜正常生长,根系的细胞结构完整,细胞壁较厚且完整;线粒体多为圆形或长椭圆形,沿细胞壁分布,内嵴结构明显;此时细胞中不存在淀粉粒。5 d轻度胁迫下(图1B),细胞壁较正常状态下变薄;线粒体数量呈下降趋势,形状与0 d自然状态下一致,内嵴结构明显;淀粉粒出现,数量较多,充满在细胞内。15 d中度胁迫下(图1C),细胞壁厚度进一步变薄;线粒体明显缩小,内嵴结构不明显;淀粉粒的数量减少,但是体积开始变大,分布在细胞中。25 d重度胁迫下(图1D),细胞壁变得更薄,并出现损坏的现象;线粒体消失;淀粉粒的体积与15 d中度胁迫时相比更大。液泡在光叉委陵菜的根系结构中始终没有出现,这可能与植物的品种或者与植物的生长周期和状态有关。
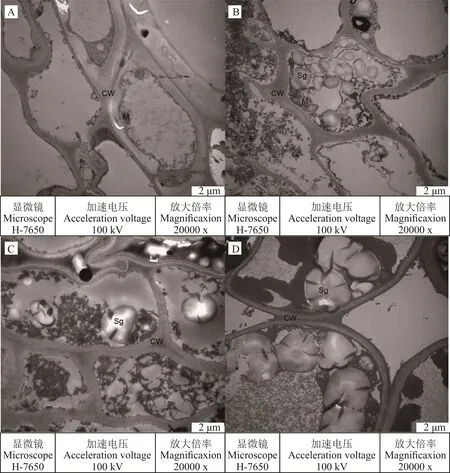
图1 干旱胁迫对光叉委陵菜根系超微结构的影响Fig.1 Effect of drought stress on root ultrastructure of P.bifurca var.glabrata
由表2可以看出,细胞壁的厚度呈现逐渐减小的趋势,5 d轻度胁迫、15 d中度胁迫和25 d重度胁迫下的厚度相较于前一胁迫程度分别减少了57.14%、8.33%、9.09%,其中5 d轻度胁迫相较于0 d自然状态的变化程度最大,两种状态下的细胞壁厚度存在显著差异(P<0.05)。对照时没有淀粉粒的存在,5 d轻度胁迫时淀粉粒出现,其个数在15 d中度胁迫时显著降低(P<0.05),25 d重度胁迫下淀粉粒数量较15 d中度胁迫时增加但不显著(P>0.05),但淀粉粒平均直径一直显著增加(P<0.05)。线粒体的个数显著减少,25 d重度胁迫时线粒体消失(P<0.05)。
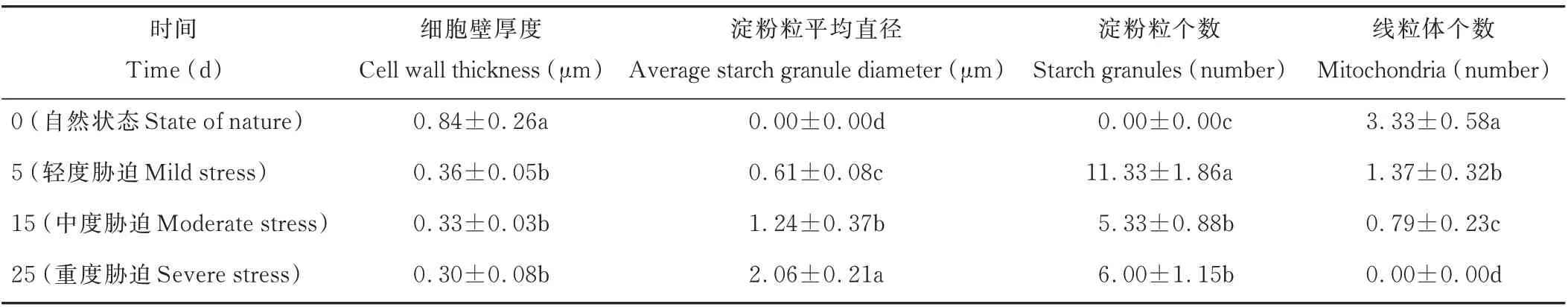
表2 干旱胁迫对光叉委陵菜超微结构细胞器的影响Table 2 Effect of drought stress on ultrastructure organelles of P.bifurca var.glabrata
2.3 干旱胁迫对光叉委陵菜根系生理指标的影响
2.3.1 干旱胁迫对光叉委陵菜根系MDA含量的影响 由图2A可知,随着干旱胁迫时间的延长,光叉委陵菜体内MDA含量持续显著增长(P<0.05),5、10、15、20、25 d较0 d分别增长了35.90%、121.99%、152.84%、172.03%、286.30%。说明在干旱胁迫前期,植株抗旱能力较强,能够有效地抑制MDA的产生,但后期,MDA含量急剧增长,可能是由于干旱胁迫程度的加深破坏了植株的干旱胁迫调节系统。复水后,同一胁迫时间下的MDA含量均有显著下降(P<0.05),5、10、15、20、25 d胁迫时的MDA含量分别下降了22.70%、34.96%、29.59%、23.26%、15.38%,下降后MDA含量整体水平仍较高。25 d复水后,MDA含量仍保持在很高的水平,说明重度干旱胁迫对植株造成了较为严重的伤害。
2.3.2 干旱胁迫对光叉委陵菜根系脯氨酸含量的影响 如图2B所示,当干旱时间延长时,光叉委陵菜根系脯氨酸含量呈增加的趋势。干旱胁迫0~15 d期间,脯氨酸含量增长速度缓慢,不同天数的含量差异不显著(P>0.05),但当胁迫时间超过15 d后,脯氨酸含量增长速度加快,含量差异显著(P<0.05)。5、10、15、20、25 d较0 d分别增长了5.43%、8.93%、10.77%、61.62%、181.27%。复水使胁迫程度减轻,5、10、15、20、25 d复水后的脯氨酸含量比胁迫时的含量分别下降了0.12%、2.12%、2.22%、9.41%、1.52%,但变化都不显著(P>0.05)。25 d复水后,脯氨酸含量仍保持在很高的水平,与复水前相比仅下降1.52%,说明在重度干旱胁迫下,植株受伤害程度较高,但其根部仍没有死亡。
2.3.3 干旱胁迫对光叉委陵菜根系可溶性蛋白含量的影响 由图2C可知,光叉委陵菜可溶性蛋白含量随干旱胁迫时间的延长呈现出先上升后下降的趋势。可溶性蛋白含量在0~10 d显著升高(P<0.05),并在15 d达到最大值,20~25 d显著降低(P<0.05),但仍高于0 d的含量。5、10、15、20、25 d较0 d分别增长了47.29%、69.27%、75.87%、62.56%、53.02%。这表明光叉委陵菜在应对干旱胁迫时可以产生大量的可溶性蛋白来调节细胞渗透压,但是超过一定程度的干旱胁迫可能会对植物细胞造成损伤,使细胞内可溶性蛋白含量降低。复水使胁迫程度减轻,5、10、15、20、25 d复水后的可溶性蛋白含量均比5、10、15、20、25 d胁迫时的可溶性蛋白含量低,分别下降了0.18%、9.74%、4.10%、10.74%、11.12%。20和25 d复水后,可溶性蛋白含量显著下降(P<0.05),但含量仍较高,说明可溶性蛋白在植物缓解较严重的干旱胁迫时仍发挥着较大的作用。
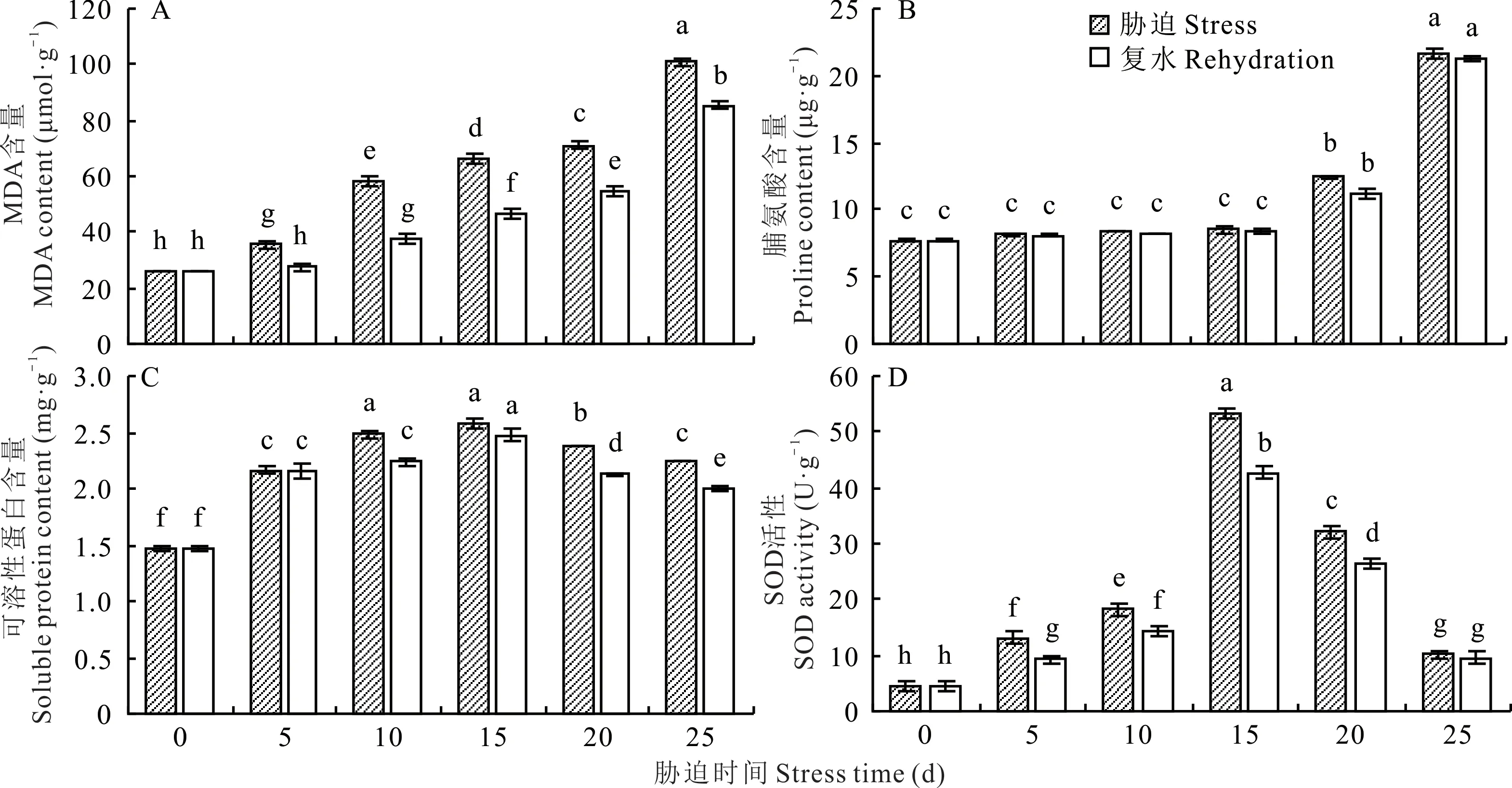
图2 干旱胁迫对光叉委陵菜根系生理指标的影响Fig.2 Effect of drought stress on physiological index of root system of P.bifurca var.glabrata
2.3.4 干旱胁迫对光叉委陵菜根系SOD活性的影响 由图2D可知,随着干旱处理的时间延长,光叉委陵菜SOD活性在不同的处理时间下均发生显著改变(P<0.05),并呈先上升后下降的趋势,在15 d时达到最大值。5、10、15、20、25 d的SOD活性均高于0 d,分别增长了183.61%、290.47%、1049.25%、590.19%、117.47%。说明SOD活性在光叉委陵菜遭受干旱胁迫时较为敏感。复水在一定程度上减轻了干旱对植物造成的损伤,不同干旱天数复水后,SOD活性均有所下降,5、10、15、20、25 d复水后的SOD活性比5、10、15、20、25 d胁迫时低,分别下降了29.44%、20.86%、20.22%、17.65%、6.12%。干旱5~20 d复水后SOD活性均有显著下降(P<0.05),但胁迫25 d时的SOD活性已下降到很低的水平,且复水后仅下降6.12%,下降不显著(P>0.05),说明重度干旱胁迫已对光叉委陵菜的SOD酶系统造成破坏。
3 讨论
3.1 干旱胁迫对植物根系表型特征的影响
根系是土壤-植株-大气水循环过程中的关键一环,在干旱的环境中,根系的适应能力尤为关键,植物的生长发育水平以及对外界环境的适应能力可以通过根系的结构特征来体现[23]。在遭受胁迫时,植物往往通过维持较大的根系长度、总表面积、总体积、平均直径和调节生物量等方面来维持自身的水分吸收和运输能力,提高自身抗旱性。根系长度是评价根系吸收能力的重要指标之一,较长的根系可以吸收更多的水分,使植物有效抵御干旱[24]。本研究发现,当干旱胁迫的时间延长时,光叉委陵菜的根系长度与对照组相比有所降低,说明根系生长受到了干旱的影响,而Wang等[25]发现,干旱胁迫显著降低了高羊茅(Festuca elata)的根系总长度,这与本研究结果一致。Pirnajmedin等[26]研究认为根系的体积、干重、总表面积等与植物的抗旱能力呈正相关。本研究中,光叉委陵菜根系的总表面积、总体积以及根系平均直径在干旱胁迫过程中呈现增加趋势,且在整个胁迫过程中的增长量与对照组相比较少但差异不显著,说明其根系具有一定的抗旱能力,能够抵抗一定程度的干旱胁迫,在受到胁迫时仍然会进行生长过程。对植物根系的干重进行比较分析发现,光叉委陵菜的根系干重先增加后降低,这可能是由于较严重的水分胁迫影响了植物的正常生长,根系被破坏,也可能是植物把碳水化合物的分配重心转移到了茎叶上,使植株能更好地进行光合作用,增强竞争力[27]。
3.2 干旱胁迫对植物根系结构的影响
植株超微结构的变化规律是判断其抗旱能力的重要指标[28]。本研究中,随着干旱胁迫加重,光叉委陵菜根系的细胞壁变薄,淀粉粒的数量先增加后减少但体积不断增加,线粒体数量减少且结构不清晰直至完全消失,液泡始终未出现。对于线粒体的变化,本研究结果与卫星等[29]结果一致。有研究表明,随着干旱程度的加重,线粒体会发生内嵴、外膜降解和内腔空洞化等一系列结构变化[30],这印证了本研究的结果。线粒体作为三羧酸循环和氧化磷酸化的主要场所,在细胞中消失,说明重度胁迫下根系细胞已经难以维持正常的生理功能,这或许导致了根系结构的扩散。有研究发现在干旱胁迫时,淀粉粒出现较少[31],原因可能是干旱胁迫使得类囊体膜结构发生了异常,从而降低了光合作用,导致光合产物减少,最终导致根系细胞淀粉粒数量减少[32]。但是在本研究中,随着干旱胁迫程度的增加,淀粉粒的数量先增后减,淀粉粒的体积不断地增加,这可能与植物材料本身有关,也可能是因为随着干旱胁迫程度的增加光叉委陵菜的根系通过增加淀粉粒的数量来缓解能量的短缺,从而抵抗遭受的逆境胁迫。
3.3 干旱胁迫对植物根系生理特性的影响
植物处在干旱状态下时,会产生大量的O2-和H2O2等具有强氧化能力的活性氧(reactive oxygen species,ROS),发生膜脂过氧化反应产生MDA,氧化膜的有序性、结构性会降低,膜透性增大,最终影响植物细胞的代谢[33]。在本研究中,干旱胁迫时间的不断延长,加剧了植物体内的过氧化反应,光叉委陵菜根系的MDA含量不断上升,严重的膜脂过氧化作用使生物膜系统遭到破坏,各类细胞器膜逐渐断裂、分解,这可能是导致线粒体消失的主要原因之一。复水能够显著降低MDA在植物体内的含量,缓解膜脂过氧化,这和肖凡等[34]的研究结果一致。完整且有序的膜系统可以保证细胞中各个区域的生理生化反应能够有条不紊地进行[35],而膜脂过氧化作用导致的渗漏会破坏这种代谢分区,从而释放或激活大量的水解酶,降低植物的抗旱性[36],因此随干旱胁迫时间的延长,复水前后的MDA含量差值逐渐减小。
干旱胁迫下,植物会增加细胞内渗透调节物质,以维持细胞内的膨压,保证植物进行正常生理代谢活动[37]。脯氨酸和可溶性蛋白作为理想的渗透调节物质,可以通过主动积累来降低细胞渗透势[38]。干旱胁迫前期,可能是因为光叉委陵菜抗氧化酶作用较大,能有效地清除细胞中的ROS,降低膜脂过氧化作用对细胞造成的影响,因此脯氨酸含量仅有略微升高,而干旱15 d后,较严重的干旱胁迫破坏了植物的抗氧化酶系统,此时脯氨酸迅速大量积累以调节细胞渗透压,缓解干旱对植物的伤害,李鹏等[39]的研究中也得出了类似的结论。植物在逆境胁迫下,会将体内的不溶性蛋白转化为可溶性蛋白,增强渗透调节能力[40]。本研究中,可溶性蛋白含量的最大值出现在15 d,呈现先上升后下降的趋势,这与陈明涛等[41]的研究结果一致。胁迫前期蛋白质含量增加,可能是由于膜损伤释放出了蛋白质,蛋白酶活性升高使蛋白质水解,而水解所得的氨基酸又用于合成如抗氧化酶和脱水蛋白等响应干旱胁迫的蛋白质,导致光叉委陵菜根系内可溶性蛋白含量进一步提高[42]。而在胁迫后期,较严重的干旱胁迫可能抑制了蛋白质的合成并加速了蛋白质的降解,使可溶性蛋白含量降低[43]。
一般研究认为,抗氧化酶的活性与植物的抗旱性密切相关[44-45]。SOD是植物体内的关键抗氧化酶,可以降低膜脂过氧化作用,有效清除ROS,从而保护膜结构,通常利用其活性变化情况来反映植物的逆境适应能力[46]。干旱胁迫前期,植物体内的SOD活性逐渐增加,增强了细胞清除ROS的能力,但随着胁迫继续进行,不断积累的ROS加剧了膜脂的过氧化程度,细胞有限的抗氧化能力使得ROS的形成和清除之间的动态平衡被打破,细胞内环境逐渐紊乱,抗氧化酶系统受到影响,SOD的活性随胁迫时间的延长逐渐下降。季杨等[47]的研究也得出了类似的结果。复水后,植物的干旱情况得到缓解,细胞内的膜脂过氧化作用减弱,因此SOD活性均较复水前有所降低。结果表明,光叉委陵菜的抗氧化防御系统具有一定的潜力去应对重度干旱胁迫对其造成的伤害。
4 结论
干旱胁迫对光叉委陵菜根系总长度、总表面积、总体积和根系平均直径的影响较小,但根系干重随干旱胁迫时间的延长呈现波动趋势,0~15 d上升,20~25 d显著下降(P<0.05)。
当干旱胁迫时间延长时,根系MDA的含量逐渐增加,复水后含量降低显著(P<0.05);根系脯氨酸的含量一直上升,20~25 d显著增加(P<0.05),复水后含量较复水前上升不显著(P>0.05);可溶性蛋白的含量先升高后降低,20~25 d复水后含量较复水前上升显著(P<0.05);SOD活性在0~15 d显著上升(P<0.05),20~25 d显著下降(P<0.05),复水后不同胁迫时间的SOD活性几乎都显著下降(P<0.05),但25 d复水后SOD活性基本无法恢复。
综合以上结果,光叉委陵菜能耐20 d的自然干旱,具有较强的抗旱性,可以作为东北地区的抗旱植物。

