上调NICD对人牙周膜干细胞增殖及迁移能力的影响
张大灵 王源元 刘莉 周嫣 李华






[摘要]目的:研究上調Notch胞内区域(Notch Intracellular Domain,NICD)对人牙周膜干细胞增殖及迁移能力的影响。方法:将细胞分为上调组、对照组及空白组,使用MTT比色法检测细胞增殖能力,流式细胞仪检测细胞凋亡能力,采用细胞划痕实验检测细胞迁移情况,并使用Western blot检测人牙周膜干细胞中Wnt/β-catenin信号通路蛋白(TGF-β、BMP-2、β-caten、LEF-1、Cyclin D1、Caspase-3、Bax、Bcl-2)表达量。结果:对照组各时间点的人牙周膜干细胞增殖率、碱性磷酸酶活性、迁移、黏附个数、TGF-β、BMP-2、β-caten、LEF-1、Cyclin D1、Bcl-2蛋白表达量均低于空白组,且凋亡率、Caspase-3、Bax蛋白表达量高于空白组,差异具有统计学意义(P<0.05)。上调组各时间点人牙周膜干细胞增殖率、碱性磷酸酶活性、迁移、黏附个数、TGF-β、BMP-2、β-caten、LEF-1、Cyclin D1、Bcl-2蛋白表达量均高于空白组和对照组,且凋亡率、Caspase-3、Bax蛋白表达量均低于空白组和对照组,差异具有统计学意义(P<0.05)。结论:上调NICD基因能促进人牙周膜干细胞的增殖和迁移,其机制可能与Wnt/β-catenin通路有关。
[关键词]Notch胞内结构域;人牙周膜干细胞;增殖;凋亡;迁移;信号通路
[中图分类号]R781 [文献标志码]A [文章编号]1008-6455(2022)01-0097-05
Effect of Upregulation of NICD on Proliferation and Migration of Human Periodontal Ligament Stem Cells
ZHANG Daling1,WANG Yuanyuan1,LIU Li2,ZHOU Yan1,LI Hua3
(1.Department of Orthodontics,People's Hospital of Guangxi Zhuang Autonomous Region,Nanning 530021,Guangxi,China;
2.Department of Stomatology,Affiliated Stomatological Hospital of Guilin Medical University,Guilin 541000,Guangxi,China;
3.Department of Oral and Maxillofacial Surgery,Hospital of Stomatology,Guangxi Medical University,Nanning 530021,Guangxi,China)
Abstract: Objective To investigate the effect of up regulating Notch intracellular domain (NICD) on the proliferation and migration of human periodontal ligament stem cells. Methods NICD cells were divided into the up regulation group, the control group and the blank group. MTT colorimetry was used to detect cell proliferation, flow cytometry was used to detect cell apoptosis, cell migration was detected by cell scratch test, and the expression of Wnt/β-catenin signaling pathway protein in human periodontal ligament stem cells was detected by Western blot (TGF-β、BMP-2, β-caten, LEF-1, Cyclin D1, Caspase-3, Bax, Bcl-2). Results The proliferation rate, alkaline phosphatase activity, migration, number of adhesion and TGF-β, BMP-2, β-caten, LEF-1, Cyclin D1, Bcl-2 protein expression of human periodontal ligament stem cells in the control group at each time point were lower than those in the blank group, and the apoptosis rate, the expression of Caspase-3 and Bax protein in the blank group were higher than those in the blank group, the differences were statistically significant (P<0.05). The proliferation rate, alkaline phosphatase activity, migration, number of adhesion and TGF-β, BMP-2, β-caten, LEF-1, Cyclin D1, Bcl-2 protein expression of human periodontal ligament stem cells in the up regulation group at each time point were higher than those in the blank group and the control group (P<0.05). The apoptosis rate, the expression of Caspase-3 and Bax protein in the up regulation group were lower than those in the blank group and the control group (P<0.05). Conclusion Upregulation of NICD gene can promote the proliferation and migration of human periodontal ligament stem cells, and its mechanism may be related to Wnt/β-catenin pathway.
Key words: Notch intracellular domain;human periodontal ligament stem cells; proliferation; apoptosis; migration; signaling pathways
慢性牙周炎是常见的一种口腔疾病,可对人们的口腔健康以及生活产生严重影响,甚者导致牙齿废用[1]。其主要特征包括:牙龈出血、不同深度的牙周袋、牙齿松动、牙槽骨吸收等,对人类牙齿健康带来严重损害[2]。牙周膜干细胞能够通过维持自身数量来实现自我更新能力,经诱导可分化为成骨样细胞和脂肪样细胞[3]。其是一种位于口腔位置的间充质干细胞,是由釉基质蛋白主要组成。有研究表明[4],Notch胞内区域(Notch intracellular domain,NICD)能够促进牙周组织的再生修复作用,但目前对于NICD作用调控牙周膜干细胞增殖、迁移机制研究较少,且尚无统一定论,因此在本研究中,上调NICD的表达研究其对牙周膜干细胞增殖、迁移的影响,以寻找其作用机制,为临床上人牙周膜干细胞的研究提供新的方向。
1 材料和方法
1.1 材料
1.1.1 研究细胞:人牙周膜干细胞NICD(上海研生实业有限公司),本研究获得医院伦理委员会批准。
1.1.2 主要试剂:兔抗人TGF-β抗体(武汉菲恩生物科技有限公司);大鼠抗小鼠BMP-2抗体、LEF-1抗体、Cyclin D1抗体(上海恒斐生物科技有限公司);人抗大鼠β-caten抗体(上海优予生物科技有限公司);大鼠抗小鼠Caspase-3抗体、Bax抗体、Bcl-2抗体(上海科敏生物科技有限公司)。
1.2 方法
1.2.1 细胞转染及分组:取人牙周膜干细胞,在培养皿中进行培养,当其融合率为75%左右时,使用胰酶进行消化,消化完成后则终止消化(在新鲜培养基中),随之便用细胞计数法测量终止消化后的细胞,测量其密度后,将其种植在六孔板中,每个板中种植4×105个细胞,加至新鲜的培养基中(3ml),进行培养,在温度为37℃、5%的CO2培养箱中进行培养,当期融合率达到40%~80%时,取1.5μl的放入100μl的双抗培养基中(去除血清),并进行完全混合,混合后进行离心处理,放置EP管底,并在管内加入12μl的PolyFect Reagent,进行上下重复颠倒,反复5次后,进行混合处理,然后放置室内静置,时间为5~10min,对转染复合物起到促进作用,将新鲜培养基中加入六孔板中的培养基(3ml),将600μl培养基加入EP管中,上下颠倒2次,放入六孔板,水平晃荡,然后培养24h后,换液处理。再次培养24h,倒置,使用荧光显微镜进行观察。NICD受体基因序列根据质粒特点进行引物设计,引入SacⅠ酶切位点(由上海生工生物工程技术服务有限公司完成),构建NICD上调慢病毒载体,分为上调组。对照组中加入一段无义序列空白载体;空白组只加生理盐水。
1.2.2 荧光定量qRT-PCR检测NICD的水平:采集样本5ml,置于一次性真空无抗凝剂的采血管中,使用Ficoll液分离单个核细胞。TRIzol提取细胞RNA,经过电泳检测RNA并定量,经过逆转录合成cDNA。之后进行实时荧光定量PCR实验,探针或SYBR 反应体系25μl,反应条件满足:94 ℃ 5 min,94 ℃ 45 s,60 ℃ 1 min,40个循环,设置标准组和空白对照。将PCR反应实验前3~15个循环荧光信号作为荧光本底信号,调节基线,采用2-△△Ct分析NICD基因表达。NICD引物序列:上游cDNA为模板、GAPDH为内参照,用以下引物(上游:5’-CGCGGATCCATGCACCTGGATGCCGCTGACCTG-3’;下游:5’-ACGTCTAGACTTGAAGGCCTCCGGAATGCG-3’)。
1.2.3 碱性磷酸酶活性检测:取第三代成长较好细胞hPDLSCs消化离心制成细胞悬液,按1×104 cell/ml的密度接种于96孔板中,24 h后,细胞贴壁后将培养液摒弃,PBS连续冲洗3次,在每孔180 μl中加无酚红成骨诱导培养液。各组分别在成骨诱导培养1、3、5、7 d后停止培养,使用PBS反复冲洗后按碱性磷酸酶活性试剂盒进行操作,酶标仪检测各孔520 nm波长处的吸光度值,取平均值。
1.2.4 人牙周膜干细胞增殖能力检测:MTT比色法检测三组人牙周膜干细胞增殖,在96孔培养板中对人牙周膜干细胞悬液进行接种,加入90μl细胞悬液放置每个孔内,将三组不同浓度曲古霉素A培养液划分为24 h、48h和72 h,并设置5个复孔。在加入10 μl的培养液中放入不同浓度的曲古霉素A进行培养。等达到相应时间后,加入150 μl的DMSO,摇晃10 s,增殖率=(细胞OD值/参照值-1)×100%。
1.2.5 人牙周膜干细胞凋亡能力检测:使用流式细胞仪对三组人牙周膜干细胞凋亡进行检测,对细胞进行传代处理,至5孔板中,在5% CO2、37 ℃的环境下对其进行培养,在24 h、48 h、72 h后,加入蛋白酶依次进行消化处理和离心处理,使用离心机将其离心,转速为2 000 r/min,离心时间5 min,收集离心后的细胞,使用PBS冲洗两次,每次3 min,然后再次离心处理和收集细胞,加入1MlPI,放置1h(避光),之后用特異性荧光进行标记,标记后在流动期间发射光子,利用发光信号对光子数值进行检测,最后使用流式细胞仪对人牙周膜干细胞凋亡进行检测。
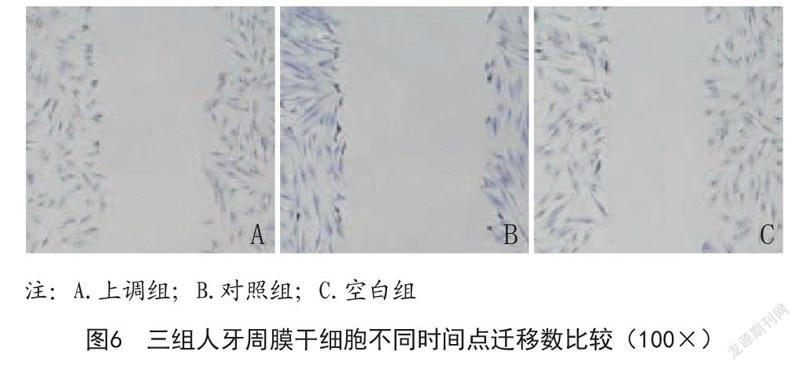
1.2.6 人牙周膜干细胞迁移能力检测:将人牙周膜干细胞NICD在18板孔内进行接种,在细胞增长到90%时,垂直划出三条直线,使用100μl枪头。采用PBS缓冲液连续冲洗3次,加0.5%血清培养基24h,在倒置显微镜下观察细胞迁移状况。
1.2.7 人牙周膜干细胞黏附能力检测:在96孔板中加入30 mg/L的纤维和50μl连接蛋白,过夜风干;通过3% BSA PBS液化,封存2 h;每孔中加RPM-1640清洗,将细胞稀释5×105个/毫升置于200 μl 10% FBS溶液中,在37℃、5% CO2培养箱中培养1 h;采用PBS反复清两次;每孔中100 μl无血清培养基,20 μl MTS(5 g/L)溶液;拍照,再次进行4 h培养,弃上清,加入100 μl的DMSO,晃荡10 min,溶解后,通过酶標仪观察490 nm波长的吸光值。
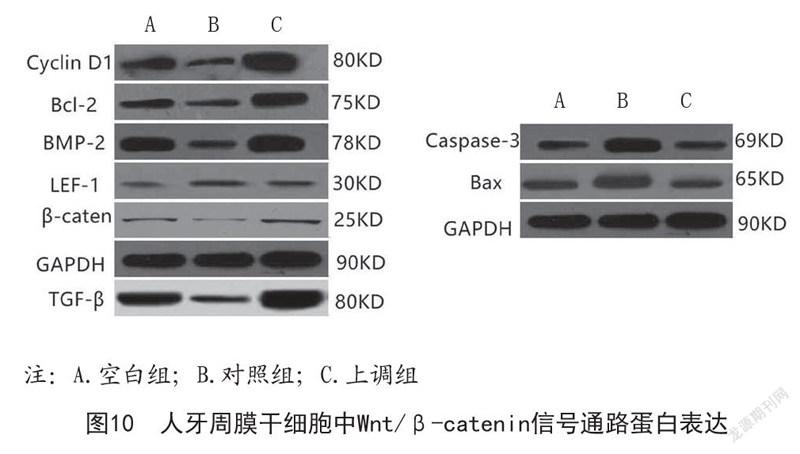
1.2.8 Western blot检测:将采集到的标本10 000×g离心处理10 min,对上清液进行提取后,BCA进行蛋白定量检测,在2×SDS凝胶缓冲液中加入50 μg蛋白,在100℃环境中加热5 min有助于蛋白发生变性。凝胶电泳完、转膜,取膜,4℃环境下在5%脱脂牛奶中固定、封闭处理时间为1h,将一抗使用0.05%~0.1% TBST给予稀释(TGF-β、BMP-2、β-caten、LEF-1、Cyclin D1、Caspase-3、Bax、Bcl-2一抗为1:1 000),4℃孵育过夜保存,之后使用0.05%~0.1% TBST洗膜,3次,每次为5 min,二抗被0.05%~0.1% TBST稀释(1:10 000),摇动孵育时间为 1h,再次采用TBST连续洗膜3次,处理时间为5 min。DAB显色,定量分析蛋白表达情况。以GAPDH为内参。
1.3 统计学分析:采用SPSS 19.0统计软件包进行统计分析处理。计量资料采用均数±标准差(x¯±s)描述,多组间比较采用F检验,两组间比较采用独立样本t检验,P<0.05差异具有统计学意义。
2 结果
2.1 三组NICD表达量比较:上调组NICD表达量高于空白组和对照组,差异具有统计学意义(P<0.05);空白组NICD表达量高于对照组,差异具有统计学意义(P<0.05)。见图1~2。
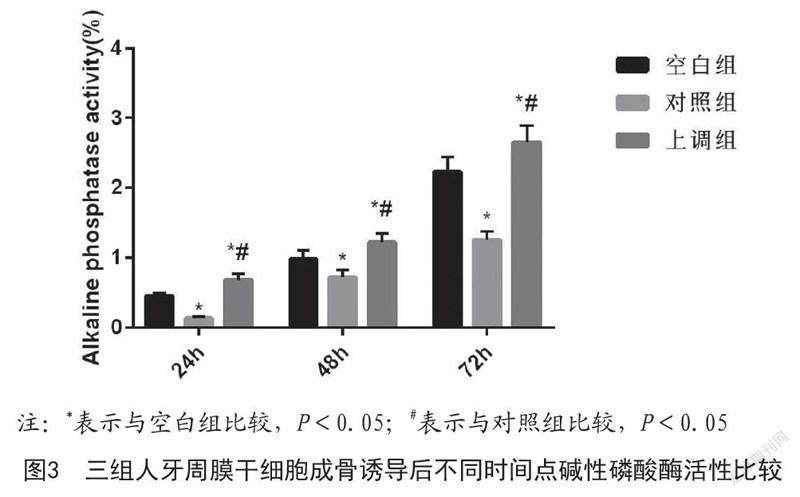
2.2 三组人牙周膜干细胞成骨诱导后不同时间点碱性磷酸酶活性比较:如图3所示,对照组碱性磷酸酶活性低于空白组,差异具有统计学意义(P<0.05);上调组碱性磷酸酶活性高于空白组和对照组,差异具有统计学意义(P<0.05)。
2.3 三组人牙周膜干细胞不同时间点增殖、凋亡情况比较:如图4所示,对照组各时间点人牙周膜干细胞增殖率低于空白组,且人牙周膜干细胞凋亡率高于空白组,差异具有统计学意义(P<0.05);上调组各时间点人牙周膜干细胞增殖率高于空白组和对照组,且凋亡率低于空白组和对照组,差异具有统计学意义(P<0.05)。
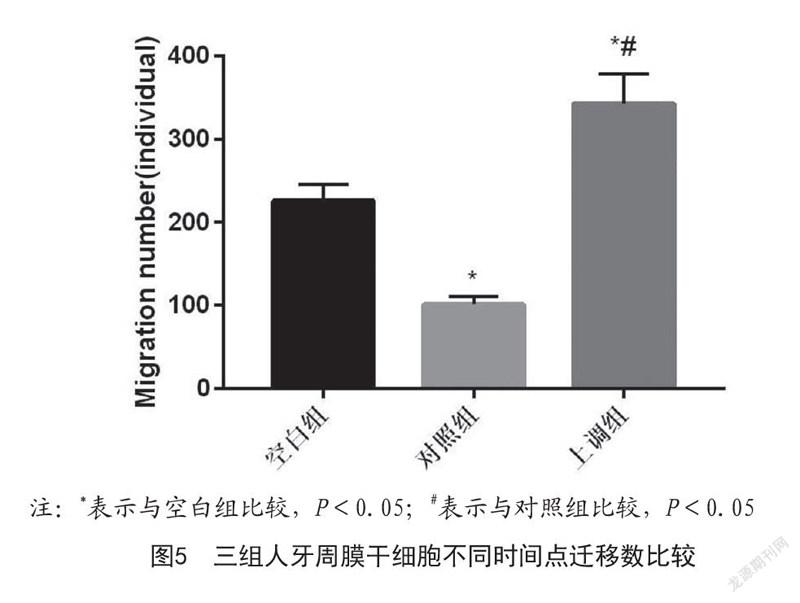
2.4 三组人牙周膜干细胞迁移、黏附情况比较:如图5~8所示,上调组人牙周膜干细胞迁移、黏附个数均高于对照组及空白组,差异具有统计学意义(P<0.05)。
2.5 三组人牙周膜干细胞中Wnt/β-catenin信号通路蛋白表达量比较:如图9~10所示,对照组人牙周膜干细胞中TGF-β、BMP-2、β-caten、LEF-1、Cyclin D1、Bcl-2蛋白表达量均低于空白组,且Caspase-3、Bax蛋白表达量高于空白组,差异具有统计学意义(P<0.05);上调组人牙周膜干细胞中TGF-β、BMP-2、β-caten、LEF-1、Cyclin D1、Bcl-2蛋白表达量均高于空白组和对照组,且Caspase-3、Bax蛋白表达量低于空白组和对照组,差异具有统计学意义(P<0.05)。
3 讨论
有学者指出,将牙周膜干细胞移植到牙槽骨缺陷区,可促使牙周组织的再生,从而为牙周干细胞的研究提供了新的理论依据[5]。Nagata M等[6]研究中认为培养牙周膜干细胞可增强牙周再生。牙周膜干细胞能够分化成为牙骨质和牙周膜样组织等,在维持牙周组织健康起着重要作用[7]。有研究表明[8],转录激活结构区和CDC10重复序列与胞内区激活有关,且能够改变引起转录活性的增强,而RAM结构蛋白域能够促进NICD与转录因子更好地结合[9]。
TGF-β能够在成熟有机体和发育中参与细胞生长、分化、凋亡过程,维持细胞动态平衡,能够与Ⅱ型受体结合而形成的受调控的SMAD蛋白[10-11]。有研究表明,BMP-2可通过转染基因上调牙周膜干细胞中的NICD等基因的表达[11]。BMP-2可通过激活Wnt信号通路中β-catenin通路来促进牙周膜干细胞的分化和迁移,有研究发现,BMP-2还可与其他因子相互作用[12]。LEF-1是Wnt通路中重要的调节因子,能够通过与DNA的结合,激活转录因子,调控基因的表达[13]。Cyclin D1是一种周期性蛋白,能够调控细胞周期的转化,在调节细胞由G1期向S期转换中也发挥着重要作用。其还能够促进细胞增殖,能够激活G1周期蛋白依赖性激酶CDK4。有研究发现,Cyclin D1除了能够促进细胞分裂外还能够促进基因转录的功能。Cyclin D1属于细胞周期依赖性激酶CDKs的调控者,不同周期蛋白表现其不同特异性和降解性,有益于每个有丝分裂时间的协调性[14]。Caspase-3属于Caspase家族中的一员,Caspase-3是凋亡反应中最为主要的凋亡蛋白[15]。Caspase-8参与执行凋亡,诱导Caspase-3激活,使Caspase启动联级反应,活化执行Caspase裂解特异性底物致使细胞凋亡。有研究表明,降低激活Caspase-3可有效抑制细胞凋亡的发生[16]。Bax是Bcl-2家族中重要促凋亡蛋白,是线粒体膜上离子通道的主要组成部分,诱导细胞色素C进入线粒体,激活Caspase-9,然后进一步激活Caspase-3,促进细胞凋亡[17-18]。Bcl-2具有抗凋亡的作用,能够阻止线粒体细胞色素C释放发挥其作用。有研究表明,Bcl-2能够促进细胞增殖和细胞周期,过表达则可抑制细胞凋亡,Bax能够对Bcl-2抑制凋亡起对抗作用[19]。Bcl-2/Bax属于一个平衡体系,Bcl-2过多时则可抑制凋亡,而Bax过多时,则可促进凋亡[20]。Wnt信号通路是生物过程中极为保守的一条通路,主要存在于细胞核生物代谢活动中。在本文中上调NICD受体基因,将Wnt/β-catenin信号通路激活,β-catenin蛋白能够在细胞内聚集,并与细胞核内转录因子结合,调节下游因子Cyclin D1、LEF-1、Caspase-3、Bax、BMP-2等表达,进一步调控干细胞的增殖、凋亡、迁移等一系列活动。
綜上所述,上调人牙周膜干细胞NICD,可有效促进人牙周膜干细胞的增殖和迁移,其机制可能与Wnt/β-catenin通路激活,调控其下游因子有关。
[参考文献]
[1]Cardoso E M,Reis C,Manzanares-Céspedes M C.Chronic periodontitis, inflammatory cytokines, and interrelationship with other chronic diseases[J].Postgrad Med,2018,130(1):98-104.
[2]Smith M M,Knight E T,Al-Harthi L,et al.Chronic periodontitis and implant dentistry[J].Periodontol 2000,2017,74(1): 63-73.
[3]Tomokiyo A,Wada N,Maeda H.Periodontal ligament stem cells: regenerative potency in periodontium[J].Stem Cells Dev,2019,28(15): 974-985.
[4]Onizuka S,Iwata T.Application of periodontal ligament-derived multipotent mesenchymal stromal cell sheets for periodontal regeneration[J].Int J Mol Sci,2019,20(11): 2796.
[5]Trubiani O,Pizzicannella J,Caputi S,et al.Periodontal ligament stem cells: current knowledge and future perspectives[J].Stem Cells Dev,2019,28(15):995-1003.
[6]Nagata M,Iwasaki K,Akazawa K,et al.Conditioned medium from periodontal ligament stem cells enhances periodontal regeneration[J].Tissue Eng Part A,2017,23(9-10):367-377.
[7]Zhang L N,Wang X X,Wang Z,et al.Berberine improves advanced glycation end products induced osteogenic differentiation responses in human periodontal ligament stem cells through the canonical Wnt/β catenin pathway[J].Mol Med Rep,2019,19(6):5440-5452.
[8]Boriushkin E,Zhang H,Becker M,et al.Kruppel-like factor 4 regulates developmental angiogenesis through disruption of the RBP-J-NICD-MAML complex in intron 3 of Dll4[J].Angiogenesis,2019,
22(2):295-309.
[9]Binesh A,Devaraj S N,Halagowder D.Molecular interaction of NFκB and NICD in monocyte-macrophage differentiation is a target for
intervention in atherosclerosis[J].J Cell Physiol,2019,234(5):
7040-7050.
[10]Vander Ark A,Cao J,Li X.TGF-β receptors: In and beyond TGF-β signaling[J].C12ell Signal,2018,52:112-120.
[11]Tanyildiz H G,Kaygusuz G,Unal E,et al.The prognostic importance of TGF-β, TGF-β receptor, and fascin in childhood solid tumors[J].Pediatr Hematol Oncol,2017,34(4):238-253.
[12]Khalilzadeh B,Shadjou N,Kanberoglu G S,et al.Advances in nanomaterial based optical biosensing and bioimaging of apoptosis via caspase-3 activity: a review[J].Mikrochim Acta,2018,185(9):
434-434.
[13]Shah A A,Oliai B R,Bishop J A.Consistent LEF-1 and MYB immunohistochemical expression in human papillomavirus-related multiphenotypic sinonasal carcinoma: a potential diagnostic pitfall[J].Head Neck Pathol,2019,13(2):220-224.
[14]Song J Y,Song L,Herrera A F,et al.Cyclin D1 expression in peripheral T-cell lymphomas[J].Mod Pathol,2016,29(11):1306-1312.
[15]Tammaro S,Simoniello P,Ristoratore F,et al.Expression of Caspase 3 in ovarian follicle cells of the lizard Podarcis sicula[J].Cell Tissue Res,2017,367(2):397-404.
[16]Liu F S,Zhou F Y,Zhang Y,et al. Effects of acupotomy therapy on mRNA expressions of Bcl-2, Bax, Caspase-3 in posterior cervical extensor muscles in cervical spondylosis rabbits[J].Zhen Ci Yan Jiu,2017,42(6):514-517.
[17]Tian Z Y,Li S M,Guo H,et al.Acupuncture of intraorbital and extraorbital acupoints reduces apoptosis of retinal ganglion by down-regulating expression of Caspase-3 and ratio of Bax/Bcl-2 in rabbits with nonarteritis anterior ischemic optic neuropathy[J].Zhen Ci Yan Jiu,2019,44(4):282-287.
[18]Subbarayan S,Subramanian S,Senthil Kumar N.Recombinant Pierisin-5 induces apoptosis and differential expression of Bcl-2, Bax, and p53 in human cancer cells[J].DNA Cell Biol,2019,38(8):773-785.
[19]Saleem M,Asif J,Asif M,et al.Amygdalin from apricot kernels induces apoptosis and causes cell cycle arrest in cancer cells: an updated review[J].Anticancer Agents Med Chem,2018,18(12):
1650-1655.
[20]Qiu X G,Chen Y D,Yuan J,et al.Functional BCL-2 rs2279115 promoter noncoding variant contributes to glioma predisposition, especially in males[J].DNA Cell Biol,2019,38(1):85-90.
[收稿日期]2020-07-13
本文引用格式:張大灵,王源元,刘莉,等.上调NICD对人牙周膜干细胞增殖及迁移能力的影响[J].中国美容医学,2022,31(1):97-101.

