高钙血症致急性肾损伤的研究进展
彭 丹 综述 戎 殳 审校
高钙血症是临床常见的电解质紊乱。正常成人血钙通常在2.15~2.60 mmol/L(8.6~10.4 mg/dL),血钙浓度超过正常上限但<3.0 mmol/L(10.5~11.9 mg/dL)为轻度高钙血症,血钙浓度3.0~3.5 mmol/L(12.0~13.9 mg/dL)为中度高钙血症,血钙浓度>3.5 mmol/L(14.0 mg/dL)为重度高钙血症[1]。中重度高钙血症可导致包括急性肾损伤(AKI)在内的多器官系统损害。波兰一项纳入了1 993例住院患者的横断面研究发现,1.81%的患者出现了高钙血症,其中56%发生了AKI[2]。有研究表明,入院时血清离子钙水平与院内AKI风险独立相关[3]。因此,早期识别和早期干预高钙血症所致AKI至关重要。
病因和临床表现
根据是否由甲状旁腺激素(PTH)介导,高钙血症病因可分为PTH依赖和非PTH依赖两类。PTH依赖性高钙血症的病因包括原发性甲状旁腺功能亢进、家族性低尿钙性高钙血症、多发性内分泌肿瘤综合征、三发性甲状旁腺功能亢进症等;非PTH依赖性高钙血症的病因包括恶性肿瘤、维生素D中毒、内分泌失调(甲状腺毒症、肾上腺功能不全等)、药物相关(噻嗪类利尿剂、锂、乳-碱综合征、维生素D、维生素A)、肾移植、制动等[1]。原发性甲状旁腺功能亢进和恶性肿瘤是高钙血症的最常见病因,占所有病例的90%以上。
高钙血症的临床表现多变,呈非特异性,与病因无关,而与血钙的绝对升高程度和升高速度密切相关。轻度高钙血症一般无症状,血钙浓度快速升高的中重度高钙血症可导致厌食、恶心、呕吐、便秘、腹痛、急性胰腺炎、消化性溃疡、嗜睡、意识模糊、昏迷、焦虑、认知功能障碍、抑郁、QT间期缩短、心律失常、梗塞样ST段抬高和AKI等[4]。
发病机制
增加血管阻力血清钙浓度升高可直接增加血管阻力,间接增加儿茶酚胺水平,对肾血管阻力的影响超过对外周血管阻力的影响[5],钙对血管平滑肌的直接作用导致可逆性血管收缩,肾血流量减少,进而导致肾前性AKI(图1)[6]。
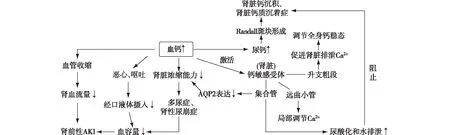
图1 高钙血症所致AKI的发生机制示意图AQP2:水通道蛋白2;AKI:急性肾损伤
减少血容量高钙血症可导致肾性尿崩症(NDI)和多尿症,引起容量不足。此外,高钙血症患者因恶心和不适导致经口液体摄入量的减少,进一步加剧容量不足的状态,导致肾前性AKI[4]。
Epstein等[7]研究发现,服用大剂量维生素D2大鼠的最大尿渗透压显著降低[从平均2 630 mOsm/(kg·H2O)下降至平均1 625 mOsm/(kg·H2O)],表明肾脏浓缩功能发生了改变,并且与肾髓质集合管结构的改变有关。Wang等[8]的实验表明,在维生素D诱导高钙血症相关的多尿症中,水通道蛋白(AQP)3、AQP2和磷酸化AQP2(p-AQP2)水平下调可能起关键作用,环腺苷酸-磷酸二酯酶抑制剂可显著抑制集合管AQP表达水平的下降,并阻止多尿症的发展。为进一步了解高钙血症所致NDI的早期分子变化,Khositseth等[9]以高钙血症诱导NDI大鼠为对象进行实验,从PTH治疗的大鼠分离出内髓集合管(IMCD),并进行了基于质谱的蛋白质组学分析,结果发现包括AQP2在内的41种蛋白质的丰度发生了显著变化,其中大部分呈下降趋势,该研究最终表明蛋白质的自噬降解增强在高钙血症诱导的NDI的初始机制中起着重要作用。
肾脏钙沉积持续性高钙血症可导致肾脏钙沉积或肾钙质沉着症[3],引起肾小管间质损伤或纤维化。当磷酸钙的浓度超过溶解度时,内髓间质的髓袢细段基膜上会形成Randall斑块,这些磷酸钙斑块可以延伸到周围的间质组织,从而产生髓质肾钙质沉着症,或穿透尿路上皮,为肾小管内结石形成提供病灶,导致肾结石、尿路梗阻和肾损伤[5]。
值得注意的是,多尿可能是一种适应性机制,因为尿钙稀释减少了钙在肾组织沉积的机会[6]。Sands等[10]的实验表明,大鼠肾脏末端内髓集合管(tIMCD)中存在一种钙离子受体蛋白(CaRs),当管腔Ca2+升高时,可特异性降低精氨酸加压素(AVP)引发的渗透水通透性。在随后的实验中,Sands等[11]在双氢速甾醇(DHT)诱导慢性高钙血症大鼠的离体灌注tIMCD中,测量了基础和AVP诱发的水和尿素通透性的变化,结果发现,tIMCD转运在高钙血症中发生选择性改变,肾脏可以处理多余的钙而不形成含钙的肾结石。
在培养的皮质集合管细胞中,高浓度的细胞外钙可激活钙敏感受体(CaSR),并通过钙调蛋白依赖性机制降低V2受体和腺苷酸环化酶之间的耦合效率,从而降低AVP诱导的AQP2的表达[12],影响肾脏浓缩能力。CaSR是一种C族G蛋白偶联受体(GPCR),通过G蛋白和β-arrestin传递信号,在甲状旁腺和肾脏中表达最多[13]。研究表明编码GPCR及其细胞内伴侣蛋白的种系功能丧失和功能获得性突变可分别导致遗传性高钙血症和低钙血症,如家族性低钙尿症(FHH)和常染色体显性低钙血症(ADH)[14]。CaSR 在肾脏升支粗段的基底外侧膜中高度表达,并通过感知Ca2+的增加和促进肾脏Ca2+排泄来调节Ca2+的重吸收,在全身钙稳态中起关键作用。升支粗段中的CaSR对肾脏Ca2+排泄的影响可能由紧密连接蛋白14介导,该蛋白调节二价阳离子的细胞旁重吸收[14]。CaSR还在远曲小管上皮细胞的顶膜中表达,并感知小管液Ca2+的增加,远曲小管CaSR可能不直接影响全身钙稳态,而是通过调节小管液Ca2+浓度发挥局部作用。在肾集合管中,CaSR通过增加尿酸化和水排泄来阻止高钙尿症介导的肾钙质沉着症的发展[14]。因此,一方面,CaSR可通过降低AVP诱导的AQP2的表达来影响肾脏浓缩能力,参与高钙血症所致AKI的发生;另一方面,CaSR可参与肾脏Ca2+排泄的直接调节,在全身钙稳态中发挥重要作用,并可减少尿路结石形成的风险。关于CaSR在高钙血症所致AKI发生机制中的具体作用以及CaSR是否能用于高钙血症所致AKI的治疗,目前尚无定论,仍有待于进一步的研究。
此外,有研究发现,钙对甲状旁腺功能亢进和非甲状旁腺功能亢进患者肾小球滤过率的影响不同,后者对高钙血症的影响更敏感,提示PTH可能对肾小球滤过具有保护作用[15]。
治疗和预防
治疗原发病高钙血症所致AKI通常可随着高钙血症的缓解而缓解,因此早期干预至关重要。首先应停用钙剂和维生素D等可能升高血钙的药物,排查并积极治疗原发性甲状旁腺功能亢进和恶性肿瘤等高钙血症常见病因[16]。
水化高钙血症可导致NDI和多尿症,并可引起厌食、恶心和呕吐,导致经口摄入液体量减少,引起血容量不足;血容量不足时肾脏钙清除率降低,反过来又加重高钙血症,因此扩充血容量是使用生理盐水的主要目的。一般24 h内静脉输入生理盐水4~6 L[17],应综合评估患者心肾方面情况后制订具体液体方案。
双膦酸盐双膦酸盐主要通过抑制破骨细胞作用而降低血钙[18]。对于过度骨质吸收导致的高钙血症,尤其是恶性肿瘤相关的高钙血症,双膦酸盐类是一线用药。双膦酸盐类药物在用药2~4 d达到最大疗效,通常与生理盐水和/或降钙素联合给药。在恶性肿瘤高钙血症中,唑来膦酸可作为首选药物[19],临床使用时应注意其肾毒性,对于存在基线肾功能不全的患者,应慎重使用,另外还要注意颌骨坏死和输液反应等不良反应。最近一项纳入了113例肌酐清除率<60 mL/min的高钙血症患者的回顾性分析发现,静脉注射双膦酸盐与血清肌酐升高率增加之间存在关联[20]。而另一项共纳入141例帕米膦酸给药患者的回顾性分析发现,对于基线肾功能不全的恶性肿瘤高钙血症患者,帕米膦酸剂量不超过90 mg时,对肾功能的影响较小[21]。Cipriani等[22]对23例骨质疏松的患者,初步研究表明,唑来膦酸对肾功能没有直接的急性影响。
降钙素降钙素是一种肽激素,药理剂量的降钙素可增加肾脏钙排泄,抑制破骨细胞功能,减少骨吸收,从而降低血钙[23]。降钙素安全且相对无毒,其疗效相对较弱(最多可使血钙浓度降低0.3~0.5 mmol/L),但起效快(用药后4~6 h内起效)。因此,降钙素联合补液可作为严重高钙血症的初始治疗方法。对于重度高钙血症的恶性肿瘤患者,降钙素与补液和双膦酸盐类药物联合是治疗的首选(对于不耐受双膦酸盐的患者,可联合地诺单抗)。但美国的一项队列研究发现,对于中重度高钙血症的恶性肿瘤患者,与单独使用双膦酸盐治疗相比,虽然静脉注射双膦酸盐联合降钙素在48 h校正钙水平变化更大,但两组前72 h的校正钙水平、达到正常血钙的时间及临床结果相似,研究者认为加用降钙素增加了成本而没有实质性的临床效益,临床医师在这种情况下可考虑避免使用降钙素以降低经济成本[24]。
地诺单抗地诺单抗是一种人源单克隆抗体,可结合核因子κB受体活化因子配体(RANKL)并阻止其与破骨细胞上的RANK结合,从而减少破骨细胞对骨的吸收,2012年首次报道用于治疗实体肿瘤相关高钙血症[25]。一项单臂国际研究纳入了33例恶性肿瘤高钙血症患者(在筛选前7~30 d已接受过双膦酸盐治疗,但血清校正钙水平仍>3.1 mmol/L),分别在第1、8、15和29天予皮下注射地诺单抗120 mg,此后每4周一次[26]。结果发现,在第10天,64%的患者校正钙≤2.9 mmol/L(主要终点),33%的患者校正钙≤2.7 mmol/L(完全缓解);研究结束时,部分和完全缓解率分别增加到70%和64%[26]。2014年美国食品药品监督管理局批准地诺单抗用于对双膦酸盐治疗无效的恶性肿瘤高钙血症。与双膦酸盐类药物不同,地诺单抗并不通过肾脏清除,可用于基线肾功能不全或因重度肾损害而禁用双膦酸盐的患者。需要注意的是,肾功能不全的患者使用地诺单抗可能引起低钙血症。一项病例系列研究对4例多发性骨髓瘤合并肾功能不全的难治性高钙血症患者使用了地诺单抗,除病例4对治疗无反应外,其余患者的血钙水平在48 h内得到了纠正,但病例1在接受单剂60 mg地诺单抗后(0.79 mg/kg),于第8天出现了持续性低钙血症(最低血钙6.9 mg/dL),需要长期使用钙及维生素 D 替代治疗[27]。为最大限度减少低钙血症的风险,在后续病例中将地诺单抗初始剂量降至0.3 mg/kg,病例2、3分别在第5、17天出现了轻度低钙血症,但随后恢复正常。研究者认为,肾功能不全患者较低初始剂量(0.3 mg/kg)地诺单抗更为安全,如给药1周后未达到目标血钙水平,可给予第2剂;同时应监测血钙,警惕低钙血症的发生。地诺单抗用于肾功能损害患者时的最佳剂量目前尚未确定。
糖皮质激素糖皮质激素可通过抑制肠钙吸收、增加尿钙排泄,或减少肺和淋巴结内活化单个核细胞的骨化三醇生成等方式降低血钙,可用于由淋巴瘤和肉芽肿性疾病(如结节病)导致的高钙血症,也可用于治疗维生素D中毒或内源性骨化三醇生成过多相关的高钙血症。
透析高钙血症所致AKI时,患者可能需要紧急透析,如腹膜透析、应用低钙或无钙透析液进行血液透析[28]。但研究发现,高钙血症也可能影响透析患者结局。一项纳入2 869例血液透析患者的多中心前瞻性队列研究发现,较高的血钙水平可能是血液透析患者感染相关和全因死亡的危险因素[29]。另一项纳入了129 076例透析患者(腹膜透析10 066例,血液透析119 010例)的研究发现,无论透析方式如何,校正钙>10.2 mg/dL与死亡风险增加有关[30]。
预防长期服用钙剂或可引起血钙升高药物的患者,应定期监测血钙和肾功能。烧伤、脊柱损伤、中风、髋部骨折和减肥手术后长时间制动可引起骨吸收增加,导致轻度至中度的高钙血症,因此提倡卧床患者尽早下床活动[31]。此外,Mondoni等[32]报道了1例在连续性静脉-静脉血液滤过结束10 d后出现高钙血症的病例,研究发现治疗过程中用于补偿枸橼酸盐抗凝的钙输注速率逐渐降低,表明内源性钙参与了枸橼酸盐螯合。因此,患者在接受枸橼酸盐抗凝治疗的连续性肾脏替代治疗期间也应警惕隐蔽性制动引起的高钙血症。
小结:近年来,高钙血症的发病率逐渐增加,临床上不适当补充钙剂所致的高钙血症也越来越多。高钙血症所致AKI的发病率很高,但由于其临床表现不具有特异性,易被忽视。高钙血症可能通过增加血管阻力、减少血容量及引起肾脏钙沉积等导致AKI,其具体机制仍未明确,是未来研究的重点。CaSR可能既通过影响肾脏浓缩能力而参与AKI的发生过程,又通过参与肾脏Ca2+排泄而起到保护作用,如何平衡CaSR在高钙血症所致AKI中的不同作用,可能成为未来研究的难点。高钙血症所致AKI通常可随着高钙血症的缓解而缓解,因此早期干预至关重要,应结合患者的具体情况选择合理的治疗方案。

