龙眼体胚发生早期SAUR63/64基因克隆及表达分析
傅卓然,李卓蕴,陈 燕,张舒婷,赖钟雄,林玉玲
(福建农林大学 园艺植物生物工程研究所,福州 350002)
生长素是人们最早发现的一类植物激素,在植物生长发育过程中具有重要的调节作用[1]。生长素早期响应基因包括3大基因家族:GH3(gretchen hagen 3)、Aux/IAA(auxin/indole-3-aceticacid)和SAUR (small auxin up-regulated RNA),其中SAUR是最大的基因家族[2]。1987年,SAUR基因在大豆(GlycinemaxL.)下胚轴首次被鉴定出[3],随后又在黄瓜(CucumissativusL.)[1]、柑橘(CitrusreticulataL.)[2]、水稻(Oryzasativa)[4]、拟南芥(ArabidopsisthalianaL.)[5]和番茄(SolanumlycopersicumL.)[6]中相继报道。尽管在很多植物种中对SAUR基因家族做了鉴定和表达分析,但其功能的研究目前处于早期阶段,只有部分家族成员进行了功能解析[7]。SAUR作为生长素早期响应基因,广泛参与了植物根系发育、下胚轴伸长与叶片向光生长等过程[8-10]。除此之外,SAUR家族成员在植物响应干旱、低温与盐胁迫中起重要作用[1, 11]。在拟南芥中,过表达AtSAUR41可以使下胚轴表皮细胞显著增长[12],AtSAUR36可以通过调节生长素来加快叶片衰老[13]。过表达OsSAUR39会降低水稻植株生长素合成和转运相关基因的表达,导致生长素含量降低,表明OsSAUR39对生长素的合成和转运起到负调控作用[14]。低温胁迫可以上调杨树中SAUR12、SAUR34、SAUR54、SAUR67、SAUR91和SAUR97的表达[15]。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200 nt,没有长的开放阅读框且不具有编码蛋白能力的非编码RNA[16]。lncRNAs虽然缺乏蛋白质编码能力,但lncRNAs 可以通过顺式(cis-acting, cis)或反式(trans-acting, trans)的方式调控靶基因的表达水平。研究发现,lncRNA参与调控激素信号、逆境胁迫响应、生长代谢和生殖发育等一系列重要生物途径[17]。Tan等[18]构建了耐旱及敏旱甘蓝型油菜(BrassicanapusL.)lncRNA-mRNA的共表达网络,筛选出在干旱中参与植物激素信号转导的lncRNAs,并验证了lncRNAs对其靶基因的正调控关系。在番茄中,lnc39042与其靶基因SPL100协同作用,提高番茄的抗病性[19]。在沙棘(HippophaerhamnoidesL.)中鉴定出了与果实发育相关的差异表达的lncRNA,并发现lnc1和lnc2可以通过抑制SPL9和MYB14的表达从而负调控花青素的合成[20]。在杨树(PopulusL.)中,lnc12可以负调控靶基因PeSAUR72,过表达lnc12后导致生根缺陷,而PeSAUR72过表达可以弥补过表达lnc12造成的生根缺陷[21]。
龙眼(DimocarpuslonganLour.)属于无患子科(Sapindaceae)龙眼属(Dimocarpus),是热带、亚热带名贵果树之一[22]。研究发现,龙眼果实品质和产量与胚胎发育情况密切相关。因此,对龙眼胚胎发育机理进行深入的研究对龙眼产业发展具有重大意义[23]。在自然状态下,龙眼早期胚胎发育研究存在取样困难、材料同步性差和发育进程不可控等不利因素,采用植物体细胞胚胎发生系统可替代常规途径来解决这一不足[24]。本课题组前期工作基于龙眼‘红核子’二代基因组,采用IlluminaHiSeq测序平台对龙眼体胚发生早期的愈伤组织(embryogenic callus, EC)、不完全胚性紧实结构(incomplete embryonic compact structure,ICpEC)及球形胚(globular embryo,GE)3个阶段的样本进行lncRNA测序,通过预测发现龙眼SAUR63与SAUR64(DlSAUR63和DlSAUR64)可同时作为LTCONS_00038949、LTCONS_00038950及LTCONS_00038952(lnc38949、lnc38950和lnc38952)的靶基因[25]。因此,本研究拟在前期工作基础上,进一步对DlSAUR63和DlSAUR64的CDS 序列进行全长克隆,与水稻、拟南芥的SAUR蛋白构建系统发育树;并对DlSAUR63和DlSAUR64进行亚细胞定位验证;利用qRT-RCR技术检测DlSAUR63、DlSAUR64和lncRNAs(lnc38949、lnc38950和lnc38952)在龙眼体胚发生早期阶段表达模式,并对其在激素处理、盐、干旱和温度等非生物胁迫下的响应模式进行分析;通过荧光原位杂交(fluorescence in situ hybridization,FISH)技术进一步研究DlSAUR63与lnc38949在合子胚中的亚细胞定位。研究结果为后续解析DlSAUR63、DlSAUR64作为lncRNA的靶基因参与调控生长素生物合成的作用机制奠定基础,同时也为研究SAUR基因在龙眼体胚中生长发育过程中的作用机制提供理论参考。
1 材料和方法
1.1 试验材料
DlSAUR63、DlSAUR64、lnc38949、lnc38950和lnc38952的基因序列、CDS序列与氨基酸序列下载于lncRNA数据库[25]和本课题组公布的龙眼基因组数据库[26](登录号为PRJNA792504)。选用‘本氏’烟草(Nicotianabenthamiana)作为亚细胞定位的受体材料。荧光原位杂交所用的‘红核子’龙眼合子胚材料于2021年4月17日采自福建农林大学拓荒广场。‘红核子’龙眼胚性培养物(EC、ICpEC及GE)由赖钟雄团队长期继代保存。将长势良好的龙眼EC材料接种到添加100、250与500 μmol·L-1赤霉素(gibberellin3, GA3),50、100与200 μmol·L-1水杨酸(salicylic acid, SA)和茉莉酸甲酯(methyl jasmonate, MeJA)的液体培养基中,置于摇床25 ℃、120 r·min-1处理24 h。取长势良好的龙眼EC材料接种于添加150 mmol·L-1NaCl与10%的PEG4000的MS固体培养基上暗培养,分别处理0、6、12和24 h。取生长旺盛的龙眼EC接种于MS固体培养基上,分别放入15、25 及35 ℃培养箱中黑暗培养24 h。每种处理均设置3次生物学重复。将上述样品取样后用滤纸吸干,液氮速冻3~5 min后保存在实验室-80 ℃冰箱。
1.2 方 法
1.2.1 RNA的提取以及cDNA逆转录采用Trizol Up试剂盒(TransGen,北京,中国) 对上述材料进行RNA的提取,具体方法参照说明书。采用超微量紫外分光光度计(Thermo Fisher Scientific,MA,USA)测定总RNA的OD值及浓度,OD值在1.8 ~ 2.2最佳。将龙眼EC、ICpEC和GE 3个阶段的RNA各取1 μL进行混合,使用逆转录试剂盒(TaKaRa,Japan)并参照说明书将其逆转录为克隆全长所需的cDNA,实时荧光定量PCR所用的cDNA采用Hifair1st Strand cDNA Synthesis kit试剂盒(Yeasen,上海,中国)逆转录得到。
1.2.2 龙眼SAUR63/64基因克隆利用DNAMAN软件设计DlSAUR63与DlSAUR64特异性引物(表1)。引物由福州尚亚生物技术有限公司合成。以上述cDNA为模板克隆DlSAUR63与DlSAUR64基因的全长,使用1%琼脂糖凝胶电泳对全长产物进行验证。将DlSAUR63与DlSAUR64基因CDS序列链接至pMD18-T载体上,具体方法参考说明书。将连接产物转化大肠杆菌DH-5α,将转化后的菌液涂布至抗性培养基。将筛选得到的阳性克隆子菌液PCR验证并送至福州尚亚生物技术有限公司测序。

表1 基因克隆及载体构建引物序列
1.2.3 系统发育进化树水稻和拟南芥的SAUR氨基酸序列分别从RGAP[http://Rice Genome Annotation Project (uga.edu)]和TAIR(https://www.arabidopsis.org/index.jsp)中获得。使用MEGA7.0软件中的邻接法(Neighbor-Joining, NJ)对拟南芥、水稻和龙眼(DlSAUR63和DlSAUR64)的SAUR蛋白序列进行系统发育进化树构建(Bootstrap抽样次数为1000)。利用网络工具ITOL在线软件(https://itol.embl.de/upload.cgi)可视化系统发育树。
1.2.4 龙眼DlSAUR63/64基因亚细胞定位以测序正确的pCAMBIA1302-DlSAUR63和pCAMBIA1302-DlSAUR64的质粒为模板,NcoⅠ-SAUR63-F、SpeⅠ-SAUR63R和NcoⅠ-SAUR64-F、SpeⅠ-SAUR64-R为引物扩增目的片段(表1)。用NcoⅠ和SpeⅠ限制性核酸内切酶酶切pCAMBIA1302-GFP空载。扩增的目的片段经过电泳检测后回收,进行同源重组后转化大肠杆菌感受态细胞。将成功构建的含有目的基因的融合表达载体命名分别为pCAMBIA1302-DlSAUR63-GFP与pCAMBIA1302-DlSAUR64-GFP。
提取表达载体pCAMBIA1302-DlSAUR63-GFP与pCAMBIA1302-DlSAUR64-GFP的质粒,转化根癌农杆菌GV3101感受态细胞,PCR验证阳性单克隆菌株。以pCAMBIA1302-GFP空载为对照将空载、pCAMBIA1302-DlSAUR63和pCAMBIA1302-DlSAUR64融合表达载体利用农杆菌介导的瞬时转化法导入烟草叶片中,套袋暗培养36 h。使用共聚焦显微镜(Olympus FV 1000)观察‘本氏’烟草GFP荧光信号并拍照。
1.2.5DlSAUR63/64与lncRNAs表达模式分析通过DNAMAN6.0软件设计龙眼DlSAUR63、DlSAUR64、lnc38949、lnc38950和lnc38952的qRT-PCR引物(表2)。UBQ为龙眼体胚发生早期3个阶段的内参基因,Fe-SOD为激素处理及盐、干旱和温度等非生物胁迫的内参基因。使用Light Cycler 480 qRT-PCR仪器检测,按照2-ΔΔCt法计算DlSAUR63、DlSAUR64、lnc38949、lnc38950和lnc38952的相对表达量,不同取样点设置3个技术重复,共进行3次生物学重复。用SPSS进行单因素方差分析(one-way ANOVA)和Fisher最小显著性差异检验组间差异,并通过Prism8.0.2软件制图。

表2 龙眼lncRNAs及其靶基因引物与探针序列信息
1.2.6DlSAUR63与lnc38949在合子胚中的荧光原位杂交探针(表2)用Primer5软件设计,由上海莱哲生物技术有限公司合成。常规脱蜡后将切片置于甲酰胺(35 mL)+5×SSC(35 mL)的湿盘中。30% H2O 和纯甲醇混合物在室温下处理10 min。用DEPC清洗3次;将切片放在湿盒中,室温下将0.2mol·L-1盐酸滴在组织上15 min,用DEPC水清洗2次。在分子杂交仪中用蛋白酶K涂抹组织,提高探针的结合效率。用0.2%甘氨酸洗涤1 min,终止蛋白酶K的作用(准备使用)。用PBS洗2次后用4%多聚甲醛PFA固定组织10 min。再用PBS洗3次,每次1 min。用乙酸酐(pH=8.0)在室温下洗2次。用PBS洗5次。用5×SSC pH 7.5洗2次,每次1 min。将切片放在一个湿盘中,在65 ℃下预杂交1 h。用500 μg·L-1FAM /CY3标记的阴性探针覆盖切片,在65 ℃黑暗中反应48 h。在室温下用2 × SSC(pH=7.5)洗1次,1 min。甲酰胺加4 × SSC(pH=4.5)的1∶1混合物在60 ℃洗3次,每次20 min。在室温下用PBS洗5次,每次1 min。将DAPI 稀释500倍,对细胞核进行染色5min。用PBS洗3次,每次5 min。滴加防抖剂并盖上盖子。载玻片密封后,用荧光显微镜(Nikon Eclipse Ci)进行观察。
2 结果与分析
2.1 DlSAUR63/64基因克隆
将龙眼体胚早期3个阶段的cDNA混样后作为模板(表1),对DlSAUR63和DlSAUR64进行PCR扩增,将PCR产物进行琼脂糖凝胶电泳。 结果发现,分别扩增出384和312 bp,与预期目的片段长度相符(图1)。将克隆得到的目的片段连接到pMD18-T载体并转化大肠杆菌DH5α,挑取阳性克隆子进行菌液PCR验证和测序。使用DNAMAN6.0将测序结果与转录组中的DlSAUR63和DlSAUR64的CDS序列进行比对。结果发现,DlSAUR63比对结果完全相同,DlSAUR64比对结果为仅有一个碱基的差异(图1,B、C)。

A.PCR扩增;B.DlSAUR63;C.DlSAUR64图1 DlSAUR63与DlSAUR64 CDS扩增与序列比对A. Amplification of PCR;B. DlSAUR63;C. DlSAUR64 Fig.1 CDS amplification and sequence alignment of DlSAUR63 and DlSAUR64
2.2 DlSAUR63/64基因编码蛋白的系统发育分析
为研究龙眼DlSAUR63和DlSAUR64与拟南芥和水稻SAUR蛋白的系统发育关系,对其氨基酸序列比对并构建了系统发育树。结果(图2)显示,139个SAUR家族蛋白被分为Subfamibly Ⅰ、Subfamibly Ⅱ和Subfamibly Ⅲ 3个亚族。Subfamibly Ⅰ蛋白成员最多含有109个,Subfamibly Ⅱ含有22个成员,Subfamibly Ⅲ含有8个成员。此外,大多数的水稻OsSAUR和拟南芥AtSAUR分别在不同分支中大量聚集。DlSAUR63、DlSAUR64与同为双子叶植物的拟南芥的AtSAUR42和AtSAUR48处于同一分支,亲缘关系较近;而与单子叶水稻的SAUR成员距离较远,说明与水稻进化关系较远。

At. 拟南芥;Os. 水稻图2 DlSAUR63、DlSAUR64和其他物种系统发育树At. Arabidopsis thaliana L;Os. Oryza sativaFig.2 Phylogenetic tree of DlSAUR63, DlSAUR64 and related genes in other species
2.3 DlSAUR63与DlSAUR64蛋白亚细胞定位
利用在线软件TargetP1.1Server(http://www.cbs.dtu.dk/services/TargetP/)对DlSAUR63与DlSAUR64进行亚细胞定位预测。结果(图3)显示,DlSAUR63蛋白最有可能定位到细胞核、胞外基质和叶绿体;DlSAUR64蛋白最有可能被定位于叶绿体。
亚细胞定位结果表明,pCAMBIA1302-GFP空载侵染烟草表皮细胞后整个细胞内都有绿色荧光(图3,I-L)。融合表达载体pCAMBIA1302-DlSAUR63侵染的烟草叶片在细胞核和细胞外基质检测到绿色荧光信号,没有与叶绿素自发荧光重叠,说明DlSAUR63定位于在细胞核和细胞外基质,但不定位在叶绿体(图3,A-D)。而pCAMBIA1302-DlSAUR64主要在叶绿体中呈明显的绿色,并与叶绿体自发荧光重叠,说明DlSAUR64定位在叶绿体(图3,E-H)。
2.4 DlSAUR63/64 与lncRNAs在龙眼体胚发生早期的表达分析
前期研究发现,SAUR63、SAUR64同时作为3个lncRNAs(lnc38949,lnc38950和lnc38952)的靶基因[25]。根据预测信息发现,lnc38949、lnc38950和lnc38952对靶基因DlSAUR63与DlSAUR64的调控方式均为cis调控。其中DlSAUR63、DlSAUR64位于lnc38949邻近上游10 kb,位于lnc38950与lnc38952邻近下游20 kb(图4)。

3个lncRNAs分别顺式调控靶基因DlSAUR63和DlSAUR64;EC. 胚性愈伤组织;ICpEC. 不完全胚性紧实结构;GE. 球形胚图4 lncRNAs靶基因预测与体胚发生早期的表达分析Three lncRNAs cis regulate target genes DlSAUR63 and DlSAUR64, respectively; EC. Embryogenic callus; ICpEC. Incomplete embryonic compact structure; GE. Globular embryoFig.4 Prediction of target genes of lncRNAs and expression analysis of early somatic embryogenesis
利用qRT-PCR技术进一步了解DlSAUR63、DlSAUR64和3个lncRNAs在龙眼体胚发生早期的表达模式。结果如图4所示,DlSAUR63、DlSAUR64与3个lncRNAs在龙眼体胚发生早期均有表达,且在ICpEC阶段表达最高,推测其可能在ICpEC阶段的形态建成起重要作用。结合转录组中的FPKM值分析表明,DlSAUR63、lnc38949、lnc38950和lnc38952表达趋势与转录组相同,但DlSAUR64表达趋势与转录组不同。
2.5 DlSAUR63/64与lncRNAs在激素处理下的表达模式分析
由上文可知,在龙眼体胚发生早期过程中3个lncRNAs正调控其靶基因DlSAUR63、DlSAUR64。采用qRT-PCR进一步分析DlSAUR63、DlSAUR64和lncRNAs在不同浓度、不同激素下的表达模式。结果表明(图5),DlSAUR63、DlSAUR64与3个lncRNAs对不同激素处理下不同浓度的响应模式存在差异。GA3处理下,DlSAUR63与3个lncRNAs在100和500 μmol·L-1上调表达,在500 μmol·L-1时表达量达到峰值。推测DlSAUR63、DlSAUR64与3个lncRNAs在龙眼体胚早期阶段参与GA3信号通路。在SA处理下,DlSAUR63、lnc38949和lnc38952的表达均受到抑制,而DlSAUR64在50 μmol·L-1上调表达,随后随着SA浓度升高其表达水平逐渐降低,lnc38950则在100和500 μmol·L-1上调表达。在MeJA处理下,DlSAUR63在MeJA浓度为50 μmol·L-1时表达量最高,浓度为100 μmol·L-1时表达量最低;DlSAUR64、lnc38949和lnc38950均在200 μmol·L-1处表达量最高,DlSAUR64的表达量与MeJA的浓度正相关且与lnc38952呈现负调控。DlSAUR63、DlSAUR64和3个lncRNAs在不同激素处理下呈现不同的调控模式,表明DlSAUR63、DlSAUR64和3个lncRNAs在龙眼体胚发生早期的过程中可能存在相对复杂的调控机制。
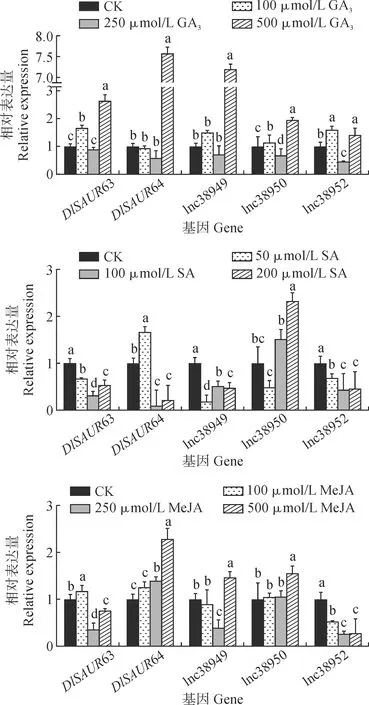
不同小写字母表示同一基因不同浓度处理间在0.05水平的显著性差异图5 不同激素处理下DlSAUR63/64与lncRNAs表达模式分析Different normal letters indicate significant difference with hormone treatments at 0.05 level for same geneFig.5 Expression patterns of DlSAUR63/64 and lncRNAs under different hormone treatments
2.6 DlSAUR63/64与lncRNAs在不同胁迫下的表达分析
采用qRT-PCR检测DlSAUR63、DlSAUR64与3个lncRNAs在盐、干旱和温度胁迫下的表达模式。结果表明,在不同时间NaCl处理下,DlSAUR63、DlSAUR64与3个lncRNAs的表达模式不同(图6)。在6 h时3个lncRNAs均上调表达,DlSAUR63、DlSAUR64均下调表达,可能存在负调控模式;在12 h,仅lnc38950上调表达,DlSAUR63、DlSAUR64、lnc38949和lnc38952均下调表达;24 h,lnc38950显著性上调表达,DlSAUR64显著下调表达。以上结果表明DlSAUR63、DlSAUR64与3个lncRNAs在盐胁迫处理下存在复杂的调控模式。

不同小写字母表示同一基因不同胁迫处理间在0.05水平的显著性差异图6 不同胁迫处理下DlSAUR63/64与lncRNAs表达模式分析Different lowercase letters represent significant difference between different stress treatments of the same gene at 0.05 levelFig.6 Expression patterns of DlSAUR63/64 and lncRNAs under different stress treatments
DlSAUR63、DlSAUR64与3个lncRNAs在10% PEG4000处理下的表达结果显示:DlSAUR63基因在不同时间10% PEG4000处理下表达略有上调,其响应不明显。在干旱处理后期(12~24 h),lnc38949、lnc38950和lnc38952上调表达,而DlSAUR64下调表达,推测它们之间可能存在负调控模式,从而参与干旱胁迫的信号通路的调控。
不同温度(15、25和35 ℃)处理下,DlSAUR63、DlSAUR64、lnc38949和lnc38950均在35 ℃处理下表达上调,仅lnc38952在35 ℃处理下表达下调,提示温度对龙眼DlSAUR63、DlSAUR64、lnc38949和lnc38950基因的表达存在显著影响。
2.7 DlSAUR63与lnc38949荧光原位杂交
通过预实验结果发现,利用石蜡切片技术研究基因定位和表达很难获得完整的体胚结构。相反,合子胚可以作为获得完整胚胎结构的理想材料。由于体细胞胚和合子胚的发育过程非常相似,使用RNA荧光原位杂交技术检测龙眼合子胚富集簇标记基因DlSAUR63与lnc38949的定位和表达(图7)。结果表明,DlSAUR63与lnc38949在合子胚内部或表皮富集部位相同,定位一致,且lnc38949的表达均高于DlSAUR63的表达。DlSAUR63与lnc38949在龙眼合子胚细胞中的非特异性定位和表达与大多数内皮细胞簇中富含簇的标记基因的非特异性表达高度相似,表明标记基因不仅存在于体胚中,且在合子胚中可能具有功能多样性。

图7 荧光原位杂交检测lnc38949及靶基因DlSAUR63 在合子胚中的亚细胞定位Fig.7 Subcellular localization of lnc38949 and target gene DlSAUR63 in zygotic embryos
3 讨 论
3.1 DlSAUR63/64进化特性分析

3.2 DlSAUR63/64及lncRNAs可能通过响应激素信号调控龙眼早期体胚发生过程
目前关于SAUR基因作为lncRNA的靶基因参与植物体胚发生还未见报道。对于SAUR基因在植物体胚发生中的研究报道也相对较少。椰子(CocosnuciferaL.)SAUR基因在胚性愈伤组织(90~120 d)中的表达高于初始培养(30~60 d)和体细胞胚阶段(150~180 d)[34];咖啡(CoffeaL.)CaSAUR12和CaSAUR18是在体细胞胚胎发育的各个时期均高表达的成员,且CaSAUR12是唯一一个在非胚性细胞和胚胎发育阶段都显示出上调表达的成员,推测该基因在某种程度上与生长素诱导的细胞生长和扩张有关[35]。本研究通过转录组数据分析及qRT-PCR检测发现DlSAUR63、DlSAUR64、lnc38949、lnc38950和lnc38952均在ICpEC阶段高表达,表明lncRNA可能通过正调控SAUR基因的表达在球形胚早期分化中发挥功能。
植物生长发育过程中受到众多激素的调控,各种基因可能通过响应激素的应答参与植物生长发育过程,如胚胎发生过程。赤霉素(GA3)作为一种常见的植物激素,参与高等植物生长发育的各个阶段且具有重要的调控作用[36]。研究表明,10 μmol·L-1的GA3可以显著提高印度娃儿藤(TylophorafloribundaMiquel)体细胞胚的发生率[37]。在棉花(Gossypiumspp)体外培养的胚珠上外源添加GA3,可以促进棉花纤维的伸长和促进棉花胚珠的膨大[38-39]。水杨酸(SA)是一种与植物抗逆相关的激素,在植物生长和发育中也发挥较为重要作用[40]。添加适量浓度的SA可以促进姜花(HedychiumcoronariumKoen)和胡萝卜(Daucuscarotavar.sativaHoffm.)体胚发生[41-42]。茉莉酸甲酯(MeJA)广泛分布在植物中,影响根的生长、果实成熟和非生物胁迫的反应等过程[43]。研究发现,MeJA 浓度为1 μmol·L-1左右时能促进杂交鹅掌楸(LiriodendronL.)体胚发生和体胚成熟[44];MeJA作为花青素诱导剂可以有效诱导橡胶树(Heveabrasiliensis)在体胚中的花青素积累[45]。以上结果表明,GA3、SA和MeJA等激素信号能够调控植物体胚发生过程[46]。本研究通过qRT-PCR结果显示GA3处理下3个lncRNAs及其靶基因表达量上调;SA处理下除lnc38950表达量上调外,lnc38949、lnc38952及靶基因DlSAUR63与DlSAUR64表达量下调。MeJA处理下lnc38949、lnc38950及靶基因DlSAUR64表达量上调。该结果提示DlSAUR63、DlSAUR64作为lnc38949、lnc38950、lnc38952的靶基因可能通过响应GA3、SA和MeJA等激素信号,进而在龙眼体胚发生早期的过程中发挥功能。
3.3 DlSAUR63/64及lncRNAs可能响应盐、干旱和温度胁迫过程
SAUR基因通过多种调控机制在植物响应胁迫的过程中发挥重要作用。小麦(TriticumaestivumL.)TaSAUR75和TaSAUR78通过调控离子通道蛋白基因的表达,提高转基因植株中与抗逆相关基因的表达,有效地增强了转基因植株对旱、盐和低温胁迫的抗性[47-48]。拟南芥AtSAUR19基因可提高植物对干旱胁迫的敏感性[49]。过表达Mul-SAUR15基因后拟南芥对PEG胁迫和NaCl胁迫的敏感性增强[27]。本研究发现,在NaCl处理下,除lnc38950表达为上调趋势外,DlSAUR63、DlSAUR64与lnc38949、lnc38952总体呈现下调表达趋势。在PEG4000处理下lnc38949、lnc38950、lnc38952的上调表达,DlSAUR64下调表达。在温度胁迫下,除lnc38952下调表达外,lnc38949、lnc38950及靶基因DlSAUR63与DlSAUR64总体呈现上调表达趋势。该结果表明,DlSAUR63、DlSAUR64和3个lncRNAs能响应盐、干旱及温度等非生物胁迫过程。但lncRNAs对其调控的机制可能不同,其具体的响应机制有待进一步研究。
SAUR基因是生长素早期响应基因,对植物的生长发育至关重要。本研究通过克隆DlSAUR63、DlSAUR64的CDS序列并分析DlSAUR63、DSAUR64的进化特性,发现其与拟南芥SAUR亲缘关系较近。此外,DlSAUR63、DlSAUR64作为3个lncRNAs的潜在靶基因,可能在球形胚形成早期发挥功能,且可能通过响应GA3、SA、MeJA、盐、干旱及温度等非生物胁迫在龙眼体胚发生过程中发挥功能。该研究结果为后续解析DlSAUR63、DlSAUR64作为lncRNAs的靶基因通过参与生长素生物合成途径在龙眼体胚发生过程的作用机制提供理论基础。

