双坐标系虚拟穿刺定位在自发性脑干出血微创治疗中的应用
赵端允,李进军,朱明启,李光宏,王洪波
菏泽市立医院神经外科,山东菏泽 274000
原发性脑干出血最易发生于40~60 岁,多位于脑干的桥脑部,脑干内密集分布着重要的神经核团和传导束,因此脑干出血时,由血肿撕裂、破坏和占位所致的神经功能障碍远较其他部位的脑出血更严重,致死致残率更高。虽然对于脑干出血的治疗,目前国内外尚无统一的标准,但近年来研究认为对于<3 mL 的少量的脑干出血可以采取保守治疗,如血肿量≥3 mL,则倾向于手术治疗。其中基于微侵袭理念的颅内血肿穿刺引流具有创伤小、耗时短、恢复快等优点,已成为治疗脑干出血的研究热点[1-2]。但既往研究多利用立体定向、神经导航或3D 打印等技术,上述设备价格高昂,基层医院普及率低,因此基层医院可能由于缺乏相关的设备而无法开展,但脑干出血患者又往往在基层医院首诊,因此精准而又易于普及的脑干出血微创穿刺定位技术是近年来研究热点。菏泽市立医院神经外科在2019年4月—2021年6月将36 例脑干出血患者入组进行研究,其中手术组17 例利用双坐标系虚拟穿刺定位技术进行微创软通道穿刺治疗,穿刺成功率高,且预后优于保守治疗组,现报道如下。
1 资料与方法
1.1 一般资料
经筛查共病例36 例入选,男26 例,女10 例,年龄30~70 岁,平均(53.7±11.2)岁;出血量3.3~13.3 mL,平均(6.5±3.0)mL;手术治疗17,保守治疗19 例。同时本研究经医院医学伦理委员会审核批准。
1.2 纳入与排除标准
手术组纳入标准:①均符合自发性脑出血的诊断标准,即脑实质内自发性、非创伤性血管破裂,导致血液在脑实质内聚集[3];②根据颅脑CT 或MRI 等影像学检查证实出血解剖定位于中脑、桥脑、延髓;③血肿量≥3 mL;④患者家属同意手术治疗,并签署手术知情同意书。非手术组纳入标准:符合上述标准的①~③,但患者家属放弃手术治疗。
排除标准:①外伤所致的出血及已经明确诊断的肿瘤卒中、颅内动脉瘤、血管畸形及海绵状血管瘤所致的出血;②严重的心、肺、肝、肾等重要器官的功能障碍或凝血功能障碍;③出血量≤3 mL。
1.3 影像资料
所有患者术前均行颅脑薄层CT 检查,36 例患者中,25 例血肿位于桥脑,9 例为桥脑合并中脑出血,2 例为桥脑合并丘脑出血。由于脑干体积较小,用于在CT扫描中计算血肿体积的传统多田公式宽径×横径×层数/2 可能会高估出血量,而应用三维影像数据重建是一种目前更为精确计算脑出血体积的方法[4],因此对所有患者均应用3Dslicer 软件将血肿的CT 薄层扫描数据进行了三维重建计算血肿体积。既往研究证明,根据血肿及桥脑的相互位置关系,可将血肿分为不同的类型,不同分型可能对患者的预后有一定的影响[1,4-7],但由于分型方法没有统一的标准,且我们的样本量偏少,不适合将样本分型太多,所以本研究选择了相对简单且国际上使用较多的四分法即:巨大型、基底被盖型、双侧被盖型、单侧被盖型[4],其中巨大型6 例,基底被盖型12 例,双侧被盖型7 例,单侧被盖型11 例,见图1。

图1 脑干出血的四种分型:A 巨大型:血肿量横断整个脑干截面;B 基底型:血肿主要位于脑干腹侧基底部;C 双侧被盖型:血肿位于脑干双侧被盖区域;D 单侧被盖型:血肿位于单侧被盖区Figure 1 Four subtypes of brainstem hemorrhage: A giant type: the amount of hematoma crosses the entire brainstem section; B basal type:the hematoma is mainly located at the ventral base of the brainstem; C bilateral covered type: the hematoma is located in the bilateral covered area of the brainstem; D unilateral covered type: the hematoma is located in the unilateral covered area.
1.4 手术方法
所有手术患者均应用双坐标系虚拟穿刺定位后微创软通道穿刺引流,具体步骤如下:①患者行CT 检查前于血肿同侧后枕部中线旁4 cm 左右放置坐标系定位贴(威海,博影医疗),做为穿刺入点大致范围,然后于对侧眶上外侧部位,即穿刺路径延长线出颅点大致范围放置另外一张坐标系定位贴,穿刺入点范围与穿刺出点范围形成对应的双坐标系。②进行薄层颅脑CT扫描,将所得到的原始DICOM 格式图像资料,通过3DSlicer 软件,完成头颅、坐标贴及血肿的三维图像重建(图2A、2B),将头颅及坐标贴模型半透明化处理,并根据定位贴不同穿入坐标点、穿出坐标点及血肿的相对位置进行虚拟穿刺形成不同的预穿刺道,理论上预穿刺道总数量为前后两个坐标系坐标点数量的乘积,然后选择能避开重要结构且到达血肿理想位置的最佳预穿刺道,本例图中仅示范了3 条较佳穿刺道,并在坐标系定位贴中标记相应的穿入及穿出点位置(图2C-I)。③根据模拟结果,在患者头部定位贴中标记出真实的穿刺入点及出点坐标点(图3A、3B),然后患者侧卧,在不平行的两个平面将入点及出点相连,两平面相交的轴线,即真实穿刺方向。术区消毒并局部麻醉后手动锥颅,沿轴线方向将10F 软通道置入血肿腔,此时可用直线形激光等工具进行辅助指引(图3C),回抽见暗红色血块流出即穿刺成功。术后复查颅脑CT,并根据血肿残余量于术后6 h 注入尿激酶液化血肿,剂量为1~2万U 溶于2 mL 生理盐水中,注入血肿腔后关闭引流管2 h,然后开放引流,3 次/d,复查CT 血肿残留少于3 mL时拔除引流管。
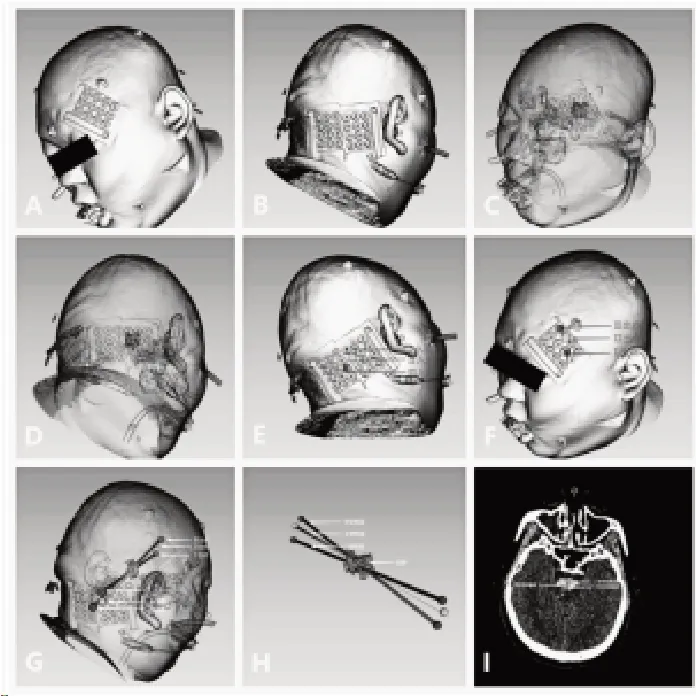
图2 三维图像重建Figure 2 3D image reconstruction

图3 本例选择图2 中的Ⅱ穿刺道为真实穿刺路径:A-B 箭头所示分别为选定的穿刺入点及对应的出点坐标点;C 箭头所示为入点及出点所共面的不平行的两个平面,相交的轴线,即穿刺方向;D 术后首次复查CT,见引流管位置理想,血肿较术前减少Figure 3 In this example, the puncture path Ⅱ in Figure 2 is selected as the real puncture path: the A-B arrows show the selected puncture entry point and the corresponding exit point coordinate points; C The arrow shows the two non-parallel planes that are coplanar with the entry point and the exit point, and the intersecting axis is the puncture direction; D After the operation, CT was re-examined for the first time, and it was found that the position of drainage tube was ideal, and hematoma was less than that before the operation
1.5 保守治疗
对于符合手术条件但家属放弃手术治疗的患者给予抗脑水肿、脑神经元保护、呼吸支持等综合治疗。
1.6 统计方法
采用SPSS 18.0 统计学软件进行数据分析,计量资料采用(±s)表示,符合正态分布的组间比较采用t检验或方差分析,非正态分布资料采用秩和检验;计数资料采用例数或百分率表示,组间比较用卡方检验或Fisher 精确概率法,P<0.05 为差异有统计学意义。
2 结果
①手术组与保守治疗组在年龄、性别、入院GCS 评分、血肿量、入院体温、血肿分型等方面差异无统计学意义(P>0.05),见表1、表2。手术组所有患者均一次性穿刺成功,无术中死亡病例,术后首次复查CT 血肿残余血肿量为(1.9±1.4)mL,血肿清除率为(71.0±1.1)%,术后再出血2 例,发病后30 d 生存14 例,死亡3 例,生存率为82.4%,生存患者改良mRS 评分(3.3±1.0)分。保守组发病后30 d 生存9 例,死亡10 例,生存率为47.4%,生存患者改良mRS 评分(4.3±0.7)分。两组生存率与生存患者改良mRS 评分比较,手术组优于保守组,差异有统计学意义(P<0.05),见表3、表4。

表1 两组一般资料比较Table 1 Comparison of general information between the two groups

表2 两组性别与血肿分型比较Table 2 Comparison of gender and hematoma typing between thetwo groups

表3 两组结局比较Table 3 Comparison of outcomes between the two groups

表4 两组生存患者的改良mRS 评分比较Table 4 Comparison of modified mRS scores between two groups of surviving patients
②按照血肿4 类分型标准,对手术组进一步分析表明,单侧被盖型的发病后30 d 生存率为100%,改良mRS 评分为(2.6±0.5)分,均为最优,而巨大型最差,生存率为0%,见表5。

表5 手术组不同血肿分型的预后比较Table 5 Prognosis comparison of different hematoma types in surgical group
3 讨论
自发性脑干出血是自发性脑出血的一种特殊类型,约占脑出血病例总数的10%,常见于桥脑,在东亚人群中每10 万人年发病率约为2%~4%,原因通常为高血压所致[8]。由于脑干为维持机体生命运作的中枢,其出血致死率可达79.6%,对于出血量≥5 mL,且GCS 评分≤8 分的患者,30 d 死亡率高达100%,致死致残率为各种脑出血之首[9]。脑干出血后,血肿会直接致使脑干的解剖结构受到破坏,对脑干功能造成不可逆的损伤[2,10],其次血肿在吸收降解过程中,红细胞的降解衍生物所引起的氧化级联反应会在数小时至数周内对脑组织造成继发性损伤,导致脑组织水肿、血脑屏障破坏及脑细胞的死亡[11]。由于脑干中缺乏吸收血肿的胶质细胞,血肿降解缓慢[10],所以与其他部位的脑出血相比,这种继发性损伤持续时间可能会更长。因此虽然目前国内外对于脑干出血的治疗无明确的指南或规范[1,4],但尽早将脑干内的血肿排空可能会使患者获益,并且许多最新的研究发现,一些脑干出血患者确实受益于外科干预,可以降低病死率及改善预后[2,5]。
目前手术治疗主要分为两类:微创软通道穿刺及开颅手术。虽然有人认为非直视下穿刺抽吸有无法止血、可能损伤周围的重要结构及血肿清除不彻底等缺点[12-13],但与开颅手术相比,微创穿刺具有创伤小、手术时间短、可局麻操作、术后恢复快等明显的优势,非常适合脑干等这类颅内深部的出血,尤其那些已经不能承受全麻开颅手术的患者[1-2,14],并且目前已经在动物实验及临床研究证明了微创穿刺后加用纤溶酶原激活剂是安全且成效明显效果的[13,15],这使得微创穿刺术后血肿排空更快,治疗效率更高。
对于微创手术如何做到精准穿刺已经由诸多学者进行了研究,但既往研究多基于立体定向仪、神经导航或3D 打印等方式,由于目前上述设备在基层医院普及率仍较低,限制了上述技术的推广,因此在没有上述设备的情况下如何做到对血肿的精准穿刺成为一个亟待解决的问题。本研究方法利用双坐标系虚拟穿刺定位技术进行微创软通道穿刺具有以下优点:①易于推广:本方法不需要额外的大型设备,只需要3Dslicer 软件和定位贴即可,3Dslicer 软件属于免费的开源软件,目前在国内及国际普及率已较高,而坐标系定位贴也易于购买或自制,因此易于推广。②定位精度高:三维建模后,医生可对血肿体积有更深刻的立体认识,有助于寻找经过血肿的最佳穿路径,配合虚拟穿刺,可精确地找到理想的穿入点及与之对应的穿出点坐标,为真实的穿刺提供指引。③操作简单快捷:相对于立体定向框架的安装,患者不需要严格的特定姿势与体位,对气管插管的患者也易于操作,而与3D 打印穿刺导板相比则更快捷。④患者创伤小:脑干出血患者往往伴有呼吸、循环等系统的功能障碍,对全麻手术耐受性差,局部麻醉下血肿穿刺引流,与开颅术相比,不仅缩短了手术时间和减少了手术创伤,而且避免了全身麻醉对心、肺、脑功能的不良影响。
本研究组17 例手术患者均一次性穿刺成功,证明了双坐标系虚拟穿刺定位具有较高的精准性。手术组与保守组相比,无论在生存率及生存患者的改良mRS评分方面均优于保守组,且差异有统计学意义,这证明自发性脑干出血患者可能从手术中获益。
脑干出血患者预后的评估对治疗决策的制定有着至关重要的影响,相对准确的预后预测也是向患者家属沟通病情信息的关键[6],这也是治疗过程中取得患者家属信任与配合的重要影响因素。既往研究表明,患者的性别、年龄、血肿类型、入院GCS 评分、入院体温等因素均对预后有着不同的影响,其中血肿类型的影响尤为明显,多位学者研究认为其为独立影响因素[1,5,7,16],但对血肿分型研究多为针对入院患者整体的研究,而其对手术的影响分析研究较少,因此我们对手术组患者进行了回顾性分析,发现血肿分型对手术预后亦有显著影响,巨大型预后最差,发病后30 d 病死率100%,而单侧被盖型预后最好,术后30 d 死亡率为0%,改良mRS 评分为(2.6±0.5)分,与其他类型相比均处于最优水平,这与Behrouz 等[4]的研究一致,该研究中巨大型脑干出血短期生存率最低,为7.1%,单侧被盖型最高,为94.1%。因此血肿分型可作为术前与患者家属沟通时的重要参考依据之一。
但本研究也有一定的局限性,如样本含量偏少,同时还受制于临床伦理,手术组与保守组无法做到随机分组,上述因素可能对研究结果造成一定的偏倚,未来需要更充足的样本量及更合理地分组来进一步研究。
综上所述,双坐标系虚拟穿刺定位技术治疗脑干出血具有穿刺准确性高,操作便捷等优点,其中单侧被盖型脑干出血手术预后较好,应对手术采取积极的态度,但对于巨大型脑干血肿,即使行手术治疗,预后依旧极差,此类患者应慎重手术治疗。

