鮟鱇鱼子低分子质量肽的制备及其抗氧化活性评价
任哲昕,姚思佳,叶韩薇,陈媛媛,唐云平
(浙江海洋大学食品与药学学院/浙江省海洋生物医用制品工程技术研究中心,浙江 舟山 316022)
氧化是许多生物体产生能量的一种基本反应过程,是所有生物体不能避免的。然而,在生物体内氧化反应中产生过量的氧自由基,如过氧化氢(H2O2)、超氧化物阴离子(O2-)、羟自由基(·OH)和过氧化自由基(-ROO)等[1]。氧自由基是人体代谢产物,化学性质活跃,不仅与脂质过氧化物密切相关,而且可以造成机体中细胞膜、DNA 和蛋白质的活性损伤,能引起人体疾病、衰老和死亡,对人体的健康和长寿危害非常大[2,3]。因此,研究者们对抗氧化物活性物质的研究产生了很大的兴趣。
目前,来源于植物和动物的抗氧化活性肽方面的研究已有大量报道。植物蛋白源的酶解产物活性肽需经蛋白酶消化后才能发挥其功能活性[4]。中国水产加工业发达,加工生产的水产下脚料可作为活性肽制备的原材料。水生动物抗氧化肽主要来源于鱼类、贝类、虾和海参等,而鱼类蛋白是最丰富的,鱼肉[5]、鱼皮[6]、鱼骨[7]和鱼鳔[8]等都有关于活性肽制备和其功能研究的相关报道。
鱼子是鱼类加工过程中产生较多的一种加工副产物,鱼子中富含矿物质盐、蛋白质、氨基酸、维生素、不饱和脂肪酸和磷脂等,具有珍膳海味的美称[9]。目前,鱼子主要用于加工鱼子酱,但鱼子酱的加工对鱼子原料要求非常苛刻,如鱼子颗粒要求圆润饱满、颜色剔透,许多鱼子不具有这些加工特性[10]。鮟鱇鱼(Lophius litulon)属软骨鱼类,归类于鮟鱇目鮟鱇科,具有头大、口大与肚大3 个明显特征,是世界及中国重要经济鱼种之一。鮟鱇鱼子由于不满足鱼子酱的加工要求,绝大部分的鮟鱇鱼子在加工过程中无法得到有效的加工和利用而被丢弃,造成资源浪费并污染环境[11]。为进一步利用鮟鱇鱼鱼子,本研究利用胃蛋白酶和胰蛋白酶对鮟鱇鱼子进行复合酶解,超滤后得到分子质量小于1 kDa的活性肽(命名为MRP),并对其体外抗氧化能力进行测定。此外,通过测定细胞活性和抗氧化能力评价MRP 对H2O2诱导的RAW 264.7 细胞损伤的保护作用,以期为鮟鱇鱼子的高值化利用提供借鉴。
1 材料与方法
1.1 材料、试剂与仪器
鮟鱇鱼子,浙江省舟山市国际水产城;胃蛋白酶、胰蛋白酶,北京亚太恒信生物科技有限公司;还原型谷胱甘肽(GSH)、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS),上海阿拉丁生化科技股份有限公司;胎牛血清,浙江天杭生物科技有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT),上海碧云天生物技术公司;二甲亚砜(DMSO),美国Sigma公司;总蛋白定量测定试剂盒(BCA 法)、乳酸脱氢酶(LDH)试剂盒、过氧化氢酶(CAT)试剂盒、超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、丙二醛(MDA)试剂盒,南京建成科技有限公司;其他化学试剂均为分析纯级。
JJ-2 型组织搅碎机,上海比朗仪器有限公司;DK-S24 型电热恒温水浴锅,上海森信实验仪器有限公司;CF16RXII 型高速低温离心机,日本HITACHI 公司;GM-18 型超滤机,济南博纳生物技术有限公司;ALPHA 1-4/LDplus 型冷冻干燥机,德国CHRIST 公司;SpectraMax2 型酶标仪,美国Bio-Rad公司。
1.2 MRP 的制备
参照Jiang 等[12]的方法并稍作修改,采用复合酶酶解法制备鮟鱇鱼子肽。首先,将鱼子匀浆,用95%乙醇脱脂,用纯水洗净。在鱼子匀浆制备反应体系(m∶m=1∶10)中加入胃蛋白酶(1 500 U/g),调节pH至2.0,在37 ℃中水解反应4 h,然后用0.1 mol/L NaOH 将反应体系的pH 调节到8.0,使胃蛋白酶失活,同时将胰蛋白酶(1 500 U/g)加入到反应体系中,继续水解反应4 h。随后,加热使酶失活、冷却并调节pH 为7.0,在10 000 r/min 下离心10 min,取上清液用滤膜(0.22 μm)抽滤,最后用1 kDa 膜进行超滤,收集酶解液(<1 kDa)并冻干,于-20 ℃备用。
1.3 MRP 体外抗氧化能力的测定
参考Jiang 等[13]方法,分析MRP 对DPPH、ABTS和·OH 羟自由基的清除能力。
1.4 MRP 对H2O2氧化损伤RAW 264.7 巨噬细胞的保护作用
1.4.1 细胞培养 RAW 264.7 细胞用含10%胎牛血清(FBS)的DMEM 完全营养液,温度37 ℃、5% CO2的培养箱中培养24~48 h,换液1 次。培养瓶中细胞生长密度达80%~90%时,用弯头吸管轻轻吹打贴壁细胞,按1∶3~1∶5 的比例加入新鲜培养液,放入培养箱中继续培养。
1.4.2 H2O2氧化损伤RAW 264.7 细胞模型的建立参照Li 等[14]的方法,在细胞中加入用DMEM 完全培养液配制的不同浓度H2O2溶液(0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 和0.9 mmol/L),培养一定时间(1、2、3、4 h)后计算细胞活性。
1.4.3 MRP 对受H2O2损伤细胞活性的影响 参照Zheng 等[15]的方法,细胞用不同浓度MRP 5、10、25、50、100、200、500、1 000 μg/mL 孵育24 h 后,弃上清液后加入浓度为0.8 mmol/L H2O2溶液(DMEM 完全培养液)孵育2 h,计算细胞活性。收集细胞培养上清液,参照试剂盒说明书测定LDH 含量。
1.4.4 MRP 对受H2O2损伤细胞形态的影响 取对数生长期的细胞,调整RAW 264.7 细胞密度,每孔加入细胞悬液2 mL 于6 孔板,用50、100、200 μg/mL MRP 培养液孵育24 h 后,弃培养液,加入浓度为0.8 mmol/L H2O2溶液(DMEM 完全培养液)孵育2 h,利用倒置显微镜观察细胞形态变化。
1.4.5 细胞中CAT、GSH-PX、SOD 和MDA 含量的测定 同“1.4.4”的方法培养细胞后,用2 mL PBS 清洗孔内细胞,按每孔200 μL 细胞蛋白裂解液。将培养板置于冰浴中裂解,低温超声破碎,离心取上清液,参照试剂盒说明书测定细胞中CAT、GSH-PX、SOD和MDA 含量。
1.5 数据分析
数据应用GraphPad Prism 8.0.2 软件进行统计学分析,数据均用平均值±标准差表示,采用单因素方差(One-way ANOVA)多重比较进行差异显著性检验。
2 结果与分析
2.1 MRP 体外抗氧化能力
自由基清除活性与防止光老化和紫外线损害密切相关,对于开发药妆产品具有重要意义。为了评估鮟鱇鱼子活性肽MRP 的抗氧化活性,测定了其对DPPH、ABTS 和·OH 羟自由基的清除能力,并用谷胱甘肽(GSH)作为阳性对照。如图1 所示,MRP 对这3种自由基的清除能力呈剂量依赖性,且对ABTS 和羟自由基的清除能力接近GSH。

图1 MRP 对DPPH(A)、ABTS(B)和羟自由基(C)清除能力
2.2 MRP 对H2O2诱导RAW 264.7 巨噬细胞氧化损伤的保护作用
2.2.1 H2O2对RAW 264.7 细胞活性的影响 活性氧可能通过生物分子(脂质、蛋白质或DNA)的直接氧化或触发细胞内途径来破坏甚至杀死细胞[16]。巨噬细胞对于鉴定和消除宿主防御系统中的微生物病原体至关重要,且是促氧化剂的主要目标。因此,巨噬细胞常被用于细胞凋亡或氧化应激介导的细胞损伤研究[17,18]。如图2 所示,随着H2O2浓度的增加和处理时间的延长,RAW 264.7 细胞的活力明显下降。用0.8 mmol/L H2O2处理细胞2 h 后的细胞活力为对照组的50.09%。用H2O2处理细胞时,浓度过低对细胞损伤能力较弱,浓度过高则会导致对细胞损伤程度过高,均不利于后续试验。因此,利用0.8 mmol/L H2O2处理RAW 264.7 细胞2 h 为氧化损伤模型,研究MRP 对H2O2诱导的损伤影响。

图2 H2O2对RAW 264.7 细胞活性的影响
2.2.2 MRP 对H2O2诱导RAW 264.7细胞活性及LDH释放率的影响 MRP 对H2O2诱导RAW 264.7
细胞活性的影响结果如图3A 所示,H2O2诱导的模型组细胞活性仅为正常组的(52.97±1.42)%。与模型组相比,用不同浓度MRP 处理可以缓解H2O2引起RAW 264.7 细胞的增殖抑制,且呈现剂量依赖性。当MRP 浓度为25、50、100、200、500 μg/mL 时,MRP能显著提高H2O2诱导的氧化应激模型的细胞活性(P<0.01);当MRP 浓度达200 μg/mL 时,氧化受损细胞的活性最大。因此,选择3 个具有组间差异(P<0.01)的MRP 浓度(50、100、200 μg/mL)开展后续试验。
LDH 是一种广泛存在于细胞质中的糖酵解酶,正常情况下仅存在于细胞质中,能反映细胞膜的受损程度和结构完整性。因此,测定细胞培养上清液中LDH 水平是细胞损伤程度的关键指标[19]。如图3B 所示,与正常组相比,模型组细胞培养上清液的LDH 含量极显著升高(P<0.01),表明H2O2损伤了细胞并导致LDH 外漏。与模型组相比,50 μg/mL MRP 可显著降低LDH 活力(P<0.05),表明MRP 可以有效缓解细胞膜氧化受损程度,防止细胞内LDH外漏。
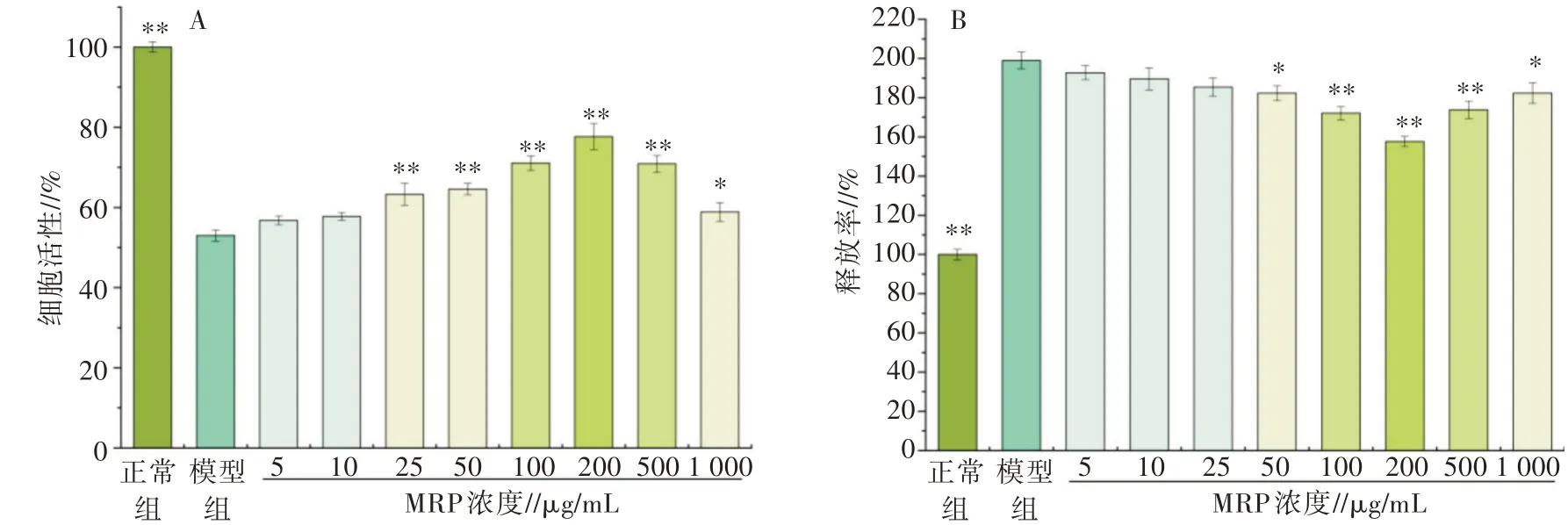
图3 MRP 对H2O2损伤RAW 264.7 细胞活性(A)及LDH 释放率(B)的影响
2.2.3 MRP 对H2O2诱导氧化受损的RAW 264.7 细胞形态的影响 H2O2损伤是目前使用最广泛的细胞氧化损伤模型。如图4A 所示,正常RAW 264.7巨噬细胞的形状呈圆形,且细胞边界明显。然而,用0.8 mmol/L H2O2处理RAW 264.7巨噬细胞2 h 后(图4B),细胞明显出现形态学变化,如细胞膜受损不清晰,细胞破碎,鼓胀坏死,甚至胞浆凝结,这表明H2O2导致了细胞的氧化损伤。在0.8 mmol/L H2O2处理后,不同浓度MRP(50、100、200 μg/mL)处理的细胞形态明显改善(图4C-E),可观察到碎片细胞和胀大坏死细胞的数量减少,且200 μg/mL 剂量组细胞形态与正常组接近。因此,结果表明,MRP 能够有效改善H2O2导致的细胞毒性。
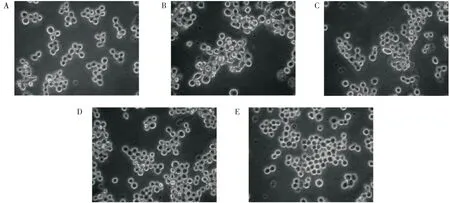
图4 MRP 对H2O2氧化损伤RAW 264.7 细胞形态的影响(×400)
2.2.4 MRP 对H2O2诱导氧化受损的RAW 264.7 细胞中抗氧化标志物的影响 H2O2可触发脂质过氧化反应从而破坏生物膜的完整性,还能降低细胞中抗氧化酶的活性[20,21]。CAT、SOD 和GSH-Px 都是细胞抗氧化防御系统中的关键物质,它们对人体的氧化和抗氧化稳态具有非常重要的影响[22]。CAT 可以将H2O2分解为水和氧气。GSH-Px 可以促进H2O2和GSH 的还原反应,产生水和氧化型谷胱甘肽(GSSG)。SOD 可清除超氧阴离子自由基并防止细胞损伤。如图5A-C 所示,与正常组相比,H2O2处理极显著降低了细胞中抗氧化酶(CAT、GSH-Px 和SOD)的活性(P<0.01)。与模型组相比,200 μg/mL MRP 预处理组可极显著提高CAT、GSH-Px 和SOD的水平(P<0.01)。
丙二醛(MDA)是自由基与体内脂质反应的主要产物之一,其含量间接反映自由基对细胞攻击的严重程度[23]。H2O2诱导的模型组中MDA 水平极显著高于对照组(P<0.01),表明细胞受到H2O2刺激损伤严重(图5D)。与模型组相比,MRP 预处理组中MDA 含量显著降低并呈剂量效应关系。由此,MRP在一定程度上抑制了细胞内脂质的过氧化,增强了细胞的抗氧化能力。

图5 MRP 对RAW 264.7 细胞损伤模型中CAT(A)、GSH-Px(B)、SOD(C)和MDA(D)水平的影响
3 小结
本研究利用胃蛋白酶和胰蛋白酶对鮟鱇鱼子进行复合酶酶解,并收集小于1 kDa 部分进行研究。鮟鱇鱼子肽(MRP)对DPPH、ABTS 和羟自由基的清除作用呈良好的剂量依赖性。MRP 对H2O2诱导RAW 264.7 细胞氧化损伤具有一定的保护作用,可极显著提高H2O2诱导的氧化应激模型的细胞活性,缓解细胞膜氧化受损程度从而防止细胞内LDH 外漏。此外,MRP 可提高细胞中CAT、SOD 和GSH-Px活力水平,降低MDA 含量。综上所述,MRP 具有较好的抗氧化能力,可作为添加剂用于抗氧化相关产品研发。

