海岸黑松和紫穗槐对间歇强净风和风沙流吹袭的生理响应机制
周瑞莲,逄金强,宋 玉
鲁东大学生命科学学院, 烟台 264025
陆、海、风三种介质相互作用形成了海岸风沙环境,其大风及强海风常常使植株遭受机械损伤,尤其是携带高能沙粒的风沙流气流[1],其对植物的损害程度要比净风强数倍到数十倍[2]。风沙流吹袭在引发植物机械损伤和磨蚀危害外,还可引发组织脱水并迅速导致那些耐受力较弱植物的生长衰退直至死亡[1—3]。因此,风沙环境与干旱、盐碱、高温环境一样,都属于极端环境,风沙流吹袭也是一种环境胁迫[1]。然而在海岸风沙环境却生活着一些可抵御海风和风沙流胁迫的防风固沙树种。关于防风树种是如何忍受风沙流吹袭而生存、其生存对策及抗风生长生理机制、风沙流吹袭后恢复生长的自愈修复生理调节,目前尚不清楚。
关于植物对逆境胁迫的生理适应机制研究发现,低温[4]、干旱[5—7]、盐碱[8—9]、沙埋[10—11]等环境胁迫均引发植物叶片细胞失水而导致渗透胁迫。一方面,渗透胁迫引发活性氧自由基积累并破坏氧自由基代谢平衡,引起细胞膜脂过氧化,但同时积累的活性氧自由基可激活体内抗氧化防御系统,增强抗氧化酶活力(SOD、CAT、POD等)、抑制氧自由基积累、防止膜脂过氧化并及时修复受损细胞[4—5]。另一方面,渗透胁迫会使植物快速积累一些小分子渗透调节物质(可溶性糖、脯氨酸、甜菜碱)降低水势,维护膨压,进行渗透调节[12—14]。 因此,低温、干旱、盐碱和沙埋胁迫下,植物渗透调节功能和抗氧化酶防御功能在植物抗逆生理中起重要作用。另外,植物不仅对逆境胁迫具有较强的生理适应调控作用, 而且在胁迫解除后还具有较强的生理调控可塑性。研究发现,在反复干旱复水处理中,差巴嘎蒿[14—15]、节节麦[16]、小冠花[17]叶片含水量在干旱胁迫时下降,恢复供水后上升,同时其叶片MDA和脯氨酸含量及SOD、POD、CAT活力在干旱胁迫中增加,在复水后下降并恢复到对照。研究认为,植物对缺水有很强的补偿性,对干旱胁迫造成的损伤具有较高的自愈修复能力[10,16]和抗逆生理可塑性。但目前尚不清楚防风固沙植物是如何面对自然强阵风吹袭, 其抗氧化酶保护系统和渗透调节物是否参与其强风吹袭后细胞的自愈修复。
目前关于植物对风和风沙流吹袭的响应机制已有一些报道。人们研究发现,风沙吹袭不仅影响地上部枝系构型、枝叶形态与组织[18—19],而且还通过影响大气温湿度和空气流动,影响植物气孔调节作用[20—21],以及抗逆生理代谢[22—23]。研究发现,强风沙流吹袭造成霸王[22]、樟子松[23]、玉米[24]叶片RWC下降、膜脂过氧化加剧和细胞膜受损。同时风吹袭还引发植物POD活力和可溶性糖、脯氨酸含量的增加以减轻细胞膜伤害,维持细胞正常膨压[22—24]。而目前就风和风沙流的研究内容,则主要集中在对植物的伤害结果及单次风和风沙流吹袭过程中引发的生理变化及适应机制,而对多次风沙流吹袭对植物抗逆生理的影响、及风后植物修复机制尚未研究。就研究方法,人们利用野外调查法获得风沙流吹袭对植物形态和植被物种丰富度、植被盖度影响的结果[9,25];或通过风扇和鼓风机吹袭处理获得风伤害结果[19,26];或通过风沙洞法定量研究风速大小与植物生理代谢变化的关系[20—24]。由于风沙洞法能定量控制风速可真实模拟自然风环境而被应用[20—24]。但目前用风沙洞法对植物的研究仅限于揭示不同风速风和风沙流吹袭过程中植物生理变化与其抗风力关系,而尚不了解风沙流处理后植物恢复生长的修复机制。
紫穗槐(AmorphafruticosaLinn.豆科落叶灌木)和黑松(PinusthunbergiiParl.常绿乔木)为两个不同科属树种。但均抗海风、耐干旱、抗风沙流是海岸防风林带建设的重要首选树种[27]。对两防风树种抗逆生理机制研究发现,黑松幼苗在一定海水浓度范围和胁迫时间内MDA含量、SOD和POD活力增高[28—29]。紫穗槐在干旱胁迫下,随干旱胁迫强度的增加,其叶片脯氨酸、 MDA含量和相对电导率增大[30—31]。可见渗透调节作用和抗氧化酶保护系统参与了两树种抗盐、抗旱生理调控作用。由于不同胁迫环境作用于植物时都会发生渗透胁迫[32], 而风沙流胁迫常引发叶片大量失水[23—24,32],目前尚不清楚在风吹袭中抗氧化酶保护系统和渗透调节是否参与了防风固沙植物抗脱水和抗风生长的生理调节,以及风后恢复生长的自愈修复生理调节。
本研究以黑松和紫穗槐为材料,利用野外便携式沙风洞用间歇风吹模拟自然阵风,通过测定在强风(18m/s)净风吹袭和风沙流吹袭过程中及吹袭后24h恢复期两树种叶片RWC、膜脂过氧化产物含量(MDA)、渗透调节物含量(脯氨酸、可溶性糖)、抗氧化保护酶(CAT、POD、SOD)活力等指标的变化,以探讨两树种对自然强阵风吹袭的生理响应规律,探讨生理可塑性在自愈修复和适应自然阵风吹袭中作用。通过对比两不同科属植物形态、生物学特性、抗逆生理指标变化的差异揭示植株形态与生理变化在抗风中作用。该研究不仅可以拓展极端环境植物逆境生理生态学研究领域,而且研究成果可极大地丰富沙漠生态学和沙漠化防治学的理论,而且对于抗风和耐风沙流植物的筛选和培育具有一定理论指导意义。
1 材料与方法
1.1 试验地概况:
烟台市地处山东半岛中部,位于东经119°34′—121°57′,北纬36°16′—38°23′。该地区属于温带季风气候,空气湿润,气候温和。年平均降水量为651.9mm,主要集中在7—8月;年平均气温11.8℃,最热月为8月(24.6℃);年平均相对湿度68%;年平均风速内陆地区3—4m/s,沿海地区4—6m/s。烟台沿海防护林自然保护区是我国第一个以沿海基干林带为主要森林生态系统,黑松和紫穗槐是烟台地区沙质海岸基干林带的主要造林树种。
1.2 材料培养:
黑松苗购置于山东乳山市桑行埠村黑松苗圃。紫穗槐苗购置于烟台苗圃。所需试验材料在试验前一年秋季(2017年11月)从苗圃公司购买。购买的株高40cm黑松(主茎粗2cm)和紫穗槐(主茎粗1.5cm)幼苗用盆栽法培养在鲁东大学生命科学学院生物园中越冬以排除移栽带来的伤害并获得生长健壮的幼苗。
具体操作为,将幼苗分别移栽在30cm×30cm×25cm(直径×直径×高)的花盆中。花盆中土取自生物园土壤表土和西泊子海岸沙地的沙子,并按2∶1比例混匀成沙土装入各盆中,以保证各盆中土质一致和接近黑松和紫穗槐原生长地的沙质土壤。在生物园试验地平行挖四行宽30cm深度25cm的沟,将花盆摆放在深沟中,用周围的土填充盆间隙,并拍实盆周围的土。移栽后马上给花盆注满水,在冬季和春季定时给花盆浇水,并清除盆内外杂草。
1.3 风吹试验设计
为了适应70cm 高风沙洞风吹装置,在风吹处理前一晚,从试验地中挑选生长势,株高基本一致(约50cm)的盆栽黑松和紫穗槐幼苗,将其从试验地各挖出12盆(对照、净风处理组、风沙流处理组各4盆)搬到实验室,各盆浇等量水。同时对花盆做标记,以利于同盆植物进行连续间歇风吹试验。另外,对植株做标记,在植株茎秆4/5和2/5处进行标记作为取样区域。
风吹处理分为净风吹袭和风沙流吹袭,净风吹即风吹袭中没有沙粒,风沙流吹袭即在风吹袭中加入了沙粒。 风吹强度设为大风(18 m/s)相当于8 级风,18m/s风沙流强度为172.93g cm-1min-1。风吹设备为野外便携式沙风洞(专利号:ZL 2008 10182207X)。间歇风吹袭处理,由于植物对胁迫的生理响应较快,同时日间不同时间植物生理代谢不同,故间歇风吹袭采用在每天同一时间进行以排除植物生理影响。风吹袭时将标记的花盆放入风沙洞中,在第一天早8:00用净风或风沙流(18m/s)吹袭20min后,将花盆从风沙洞中取出、浇水、置生物园自然环境下恢复24h,在第二天、第三天早8:00重复该过程。每个处理4个重复,每个重复为一盆幼株,每盆含2株幼树。
1.4 试验取材及试验方法
取样时间和顺序, 第一天早7:00从不同处理组植株上取样记为处理前,在8:00进行净风和风沙流吹袭20min后取样记为第一次风吹;在随后的第二天、第三天、第四天早7:00点取样分别记为恢复期1、恢复期2、恢复期3;在早8:00进行净风和风沙流吹袭20min后取样分别记为第二次风吹和第三次风吹。试验取材均在风吹袭处理前(7:00)、处理后(8:20),在植株采集样品区域用剪刀剪取叶片。一部分叶片快速包裹放到液氮中固定,带回实验室保存在超低温冰箱中,用于抗氧化酶活力、渗透调节物含量、丙二醛含量的测定;另一部分立刻测定叶片RWC。各生理指标的测定重复5次以上。
酶液提取是在4 ℃条件下进行的,准确称取1.5 g液氮固定的叶片于预冷研钵中,加入酶提取液(pH值=7.8磷酸缓冲液),冰浴上研磨成匀浆,在15000 r/min 4 ℃条件下离心15 min,上清液用于抗氧化酶活力和脯氨酸、可溶性糖和MDA含量的测定。
采用愈创木酚法测定POD活性[33];采用氮蓝四唑(NBT)光还原法测定SOD活性[34];采用过氧化氢-碘量法测定CAT活力[35]。采用茚三酮比色法测定游离脯氨酸含量[33]、采用蒽酮法测定可溶性糖含量[33]、采用硫代巴比妥酸法测定MDA含量[33]、采用称重法测定相对含水量[33]。
1.5 数据处理
实验数据采用3个以上重复的平均值±标准差(mean±SD)。应用SPSS 20 软件进行数据的统计分析。采用单因素方差分析(One-Way ANOVA)和最小显著差异法(LSD)比较不同处理间的差异显著性。
2 结果与分析
2.1 间歇风吹对黑松和紫穗槐叶片RWC的影响
自然状态下,紫穗槐和黑松叶片RWC差异不显著,但在间歇风吹袭处理中,叶片RWC差异显著(P<0.05),尤其在第三次风沙流吹袭后,黑松叶片RWC较紫穗槐高63.8%。
两树种在间歇风吹袭处理中叶片RWC变化不同(图1)。黑松叶片RWC随着净风吹袭次数的增多变化较小,随风沙流吹袭次数增多呈小幅下降趋势,并且风吹袭和恢复期叶片RWC差异不明显,但风沙流吹袭组叶片RWC与对照差异显著(P<0.05)(图1)。随着净风和风沙流吹袭次数的增多,紫穗槐叶片RWC显著下降,并均与对照差异显著(P<0.05),其中风沙流吹袭叶片RWC下降幅度显著大于净风吹袭,而且叶片RWC在风吹袭时下降,在恢复期上升,且两者叶片RWC差异显著(P<0.05)(图1)。如,在第二、第三次净风吹袭中叶片RWC较之前处理分别降低9.1%和16.5%、恢复期增加9.6%和15.3%;在第二、第三次风沙流吹袭中叶片RWC较之前处理降低30.5%和38.2%、恢复期增加41.6%和57.2%。
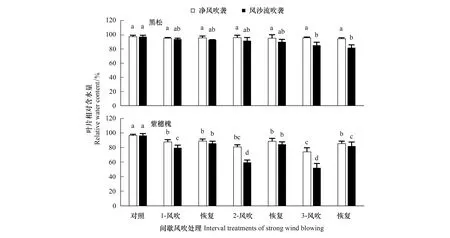
图1 间歇风吹处理中黑松和紫穗槐叶片RWC变化Fig.1 Changes of the relative water content in the leaves of A.fruticosa and P. thunbergii under interval treatments of strong wind blowing or wind-drift blowing 不同小写字母表示同一种风吹袭下,间歇风吹处理间之间差异显著(P<0.05)
2.2 间歇风吹对黑松和紫穗槐叶片膜脂过氧化的影响
自然状态和间歇风吹袭后,紫穗槐叶片MDA含量均高于黑松,且两者差异显著(P<0.05)(图2)。自然状况下,紫穗槐叶片MDA含量较黑松高93.3%,在间歇风吹袭后紫穗槐叶片MDA含量较黑松高78.43%。
两树种在间歇风吹袭中叶片 MDA含量变化趋势相同,均表现为在第一次风吹袭时增高,并与对照差异显著(P<0.05),在随后风吹袭中趋于下降。在间歇净风和风沙流吹袭中,叶片MDA含量在风吹袭时上升,在恢复期下降(图2)。如,在第二、第三次间歇风沙流处理时,黑松叶片MDA含量在风吹袭中分别增加15.1%、36.1%,在恢复期分别下降37.7%、26.9%;紫穗槐叶片MDA含量在风吹袭中分别增加16.7%、13.9%,在恢复期分别下降28.2%、22.4%。而且,风吹袭和恢复期叶片MDA差异显著(P<0.05)。所不同的是,黑松风沙流吹袭组叶片MDA含量高于净风吹袭,而紫穗槐风沙流吹袭组叶片MDA含量低于净风吹袭组。该结果与对玉米[24]和霸王[22]的研究一致,研究发现,随着风沙流吹袭强度的增大,叶片MDA含量趋于下降[12,15]。

图2 间歇风吹处理中黑松和紫穗槐叶片MDA含量的变化Fig. 2 Changes of the MDA content in the leaves of A. fruticosa and P. thunbergii under interval treatments of strong wind blowing or wind-drift blowing
2.3 间歇风吹对黑松和紫穗槐叶片渗透调节物含量的影响
自然状态和间歇风吹袭后,黑松叶片可溶性糖含量均高于紫穗槐,且两者差异显著(P<0.05)。自然状态下黑松叶片可溶性糖含量较紫穗槐高111.5%,净风吹袭下黑松叶片平均可溶性糖含量较紫穗槐高76.1%,风沙流吹袭下高94.8%(图3)。
两树种在间歇风吹袭中叶片可溶性糖含量变化趋势略相似。随净风和风沙流吹袭次数增多,黑松叶片可溶性糖含量呈波动式变化,并在风吹袭时上升,在恢复期下降,但可溶性糖含量一直维持较高(图3)。而紫穗槐叶片可溶性糖含量随净风和风沙流吹袭次数增多呈小幅增加,并在风吹袭时上升,在恢复期下降,但可溶性糖含量一直较低。如,第二、第三次间歇净风吹袭中,黑松叶片可溶性糖在风吹袭中分别增加3.9%、8.2%,在恢复期分别下降3.2%、14.2%;紫穗槐叶片可溶性糖在风吹袭中分别增加28.9%、32.2%,在恢复期分别下降20.3%、24.6%。而且净风处理组和风沙流处理组叶片可溶性糖含量差异明显(P<0.05)。

图3 间歇风吹处理中黑松和紫穗槐叶片可溶性糖含量的变化Fig.3 Changes of soluble sugar content in the leaves of A. fruticosa and P. thunbergii under interval treatments of strong wind blowing or wind-drift blowing
在自然状态和间歇吹袭后,紫穗槐和黑松叶片脯氨酸含量差异显著(P<0.05)。自然状况下,紫穗槐叶片脯氨酸含量较黑松高78.6%,在间歇风吹袭中,紫穗槐叶片平均脯氨酸含量在净风吹袭后较黑松高249.3%,在风沙流吹袭后较黑松高189.5%(图4)。
两树种在间歇风吹袭中叶片脯氨酸含量变化趋势明显不同。随净风和风沙流吹袭次数增多,黑松叶片脯氨酸含量先小幅降低而后平稳,其中净风和风沙流吹袭导致叶片平均脯氨酸含量较对照分别下降40.5%、28.6%,并与对照差异显著(P<0.05),其叶片脯氨酸含量仅在净风吹袭时上升,在恢复期略下降(图4)。而紫穗槐叶片脯氨酸含量随净风和风沙流吹袭次数增多呈增加趋势,并与对照差异显著(P<0.05),叶片脯氨酸含量在风吹袭中增加,在恢复期下降,且两者间差异显著(P<0.05)。如,在第二次间隙净风吹袭中,黑松叶片脯氨酸在风吹袭中增加16.0%,在恢复期下降33.6%;紫穗槐叶片脯氨酸在风吹袭中增加49.9%,在恢复期下降28.5%。但值得注意,在第三次净风和风沙流处理后的恢复期黑松和紫穗槐叶片脯氨酸均增高。

图4 间歇风吹下黑松和紫穗槐叶片脯氨酸含量的变化Fig.4 Changes of proline content in the leaves of A. fruticosa and P. thunbergii under interval treatments of strong wind blowing or wind-drift blowing
2.4 间歇风吹对黑松和紫穗槐叶片抗氧化酶活力的影响
自然状态下,紫穗槐和黑松叶片POD活力差异显著,紫穗槐叶片POD活力较黑松高6.5倍(P<0.05)(图5)。间歇风吹后两树种叶片平均POD活力差异加大,如,在净风和风沙流吹袭后紫穗槐叶片平均POD活力较黑松高20倍、11倍(图5)。
两树种在间歇风吹袭中叶片POD活力变化趋势明显不同。随净风和风沙流吹袭次数增多,黑松叶片POD活力呈现出波动式变化,且低于对照(净风吹袭),其POD活力在风吹袭中下降,在恢复期升高。而紫穗槐随净风和风沙流吹袭次数增多,其叶片POD活力呈增加趋势(尤其是净风吹袭),高于对照,且与对照差异显著(P<0.05),叶片POD活力在风吹袭和恢复期均增高(图5)。如,在第二、第三次间隙净风吹袭中,黑松叶片POD活力在风吹袭中下降4.5%和20.3%,在恢复期增加11.1%和6.9%;紫穗槐叶片POD活力在风吹袭中增加3.9%和23.9%,在恢复期增加13.1%和22.2%。

图5 间歇风吹处理中黑松和紫穗槐叶片过氧化物酶活力的变化Fig.5 Changes of peroxidase activity in the leaves of A. fruticosa and P. thunbergii under interval treatments of strong wind blowing or wind-drift blowing
自然状态下,紫穗槐叶片CAT活力较黑松高118.8%,间歇风吹袭中,两树种叶片CAT活力差异加大,两者差异显著(P<0.05)(图6)。经间歇净风和风沙流吹袭的紫穗槐叶片平均CAT活力较黑松高580.7% 和346.4%。

图6 间歇风吹处理中黑松和紫穗槐叶片过氧化氢酶活力的变化Fig.6 Changes of catalase activity in the leaves of A. fruticosa. and P. thunbergii under interval treatments of strong wind blowing or wind-drift blowing
两树种在间歇风吹袭中叶片CAT活力变化趋势明显不同。随净风和风沙流吹袭次数增多,黑松叶片CAT活力呈现先大幅增高(107.7%, 193.76%),随后趋于下降,且在第一、第二风吹袭中叶片CAT活力与对照差异显著(P<0.05),而且黑松叶片CAT活力在风吹袭时增加,在恢复期下降,风处理与恢复期叶片CAT活力差异显著(P<0.05)(图6)。随净风和风沙流吹袭次数增多,紫穗槐叶片CAT活力呈持续大幅增高趋势,且高于对照,并与对照差异显著(P<0.05)(图6),并且,叶片CAT活力在风吹袭和恢复期均增高。如,在第二、第三次净风吹袭中,黑松叶片CAT活力在风吹袭中增高42.2%和33.8%,在恢复期下降230.9%和74.1%;紫穗槐叶片CAT活力在风吹袭中增加13.8%和10.6%,在恢复期增加18.9%和10.3%。紫穗槐在间歇净风吹袭处理中叶片CAT活力较风沙流处理高。
自然状态下,紫穗槐和黑松叶片SOD活力差异显著(P<0.05)(图7),黑松叶片SOD活力较紫穗槐高28.2%,差异显著,但在间歇净风和风沙流处理后两者差异减小,SOD活力差异不显著。
两树种在间歇风吹袭中叶片SOD活力变化趋势明显不同。随净风和风沙流吹袭次数增多,黑松叶片SOD活力虽有波动,但风吹袭和恢复期叶片SOD活力(除第三次风吹袭)变化不明显,而且在净风和风沙流吹袭下的黑松叶片SOD活力差异不显著(图7)。随净风和风沙流吹袭次数增多,紫穗槐叶片SOD活力呈先下降后大幅增高趋势,并与对照差异显著(P<0.05),并SOD活力在风吹袭中下降,在恢复期增加(图7)。如,在第二、第三次间歇净风吹袭中,紫穗槐叶片SOD活力在风吹袭中下降7.5% 、14.6%,在恢复期增高16.6%、9.3%,且两者间叶片SOD活力差异显著(P<0.05)。另外,间歇净风吹袭的叶片SOD活力高于间歇风沙流吹袭的。

图7 间歇风吹处理中黑松和紫穗槐叶片过氧化物歧化酶活力的变化Fig.7 Changes of superoxide dismutase activity in the leaves of A. fruticosa and P. thunbergii under interval treatments of strong wind blowing or wind-drift blowing
3 讨论与结论
自然状况下,海岸带植物常受季节性强海风及风沙流吹袭的影响,忍受间断性和季节性强海风及风沙流吹袭,以及风吹袭后快速恢复生长可能是其在海岸带生存的关键。然而关于它们如何抵御强海风吹袭及风后恢复生长的生理调控机理目前尚不清晰。
3.1 持水力在植物抗风生长中作用
Levitt曾指出,不同胁迫环境作用于植物时都会发生水胁迫(渗透胁迫),渗透胁迫导致细胞失水、膨压丧失,最终造成细胞死亡[32]。本研究结果表明,两科属不同的树种在自然状况下叶片RWC差异不显著,但在间歇净风和风沙流处理中,两树种叶片RWC不仅在风吹袭时差异较大, 而且在恢复期变化也不同(图1)。在风吹袭中,黑松叶片RWC下降幅度较小而RWC较高,紫穗槐叶片RWC下降幅度大而RWC较低;在恢复期,黑松叶片RWC无明显回升,而紫穗槐叶片RWC回升明显。一些研究也发现,风不仅对植物外部直接造成机械损伤,还间接通过改变植物周围的空气环境,导致植物内部叶片失水形成生理干旱[24]。沙生植物在中强度风沙流吹袭下,叶片净光合速率和日均蒸腾速率增加,并指出风吹袭引发蒸腾速率加大是叶片水分丢失和水分胁迫产生的原因[20—21, 26]。本研究一方面说明,强风吹袭引发空气流动加大和空气蒸气压增加,而使叶内外蒸气压差增大导致叶片蒸腾速率增高而引发叶片失水,同时风沙流吹袭对叶片的磨蚀造成叶片表皮受损引发角质层蒸腾更加剧了叶片水分丢失[36]。而风沙流吹袭引发的植株剧烈摇摆阻碍水分运输,这可能是造成叶片失水和水分亏缺的另一原因。另一方面说明,两树种叶片持水力和维护水分平衡策略不同,这可能与其叶片特性差异相关。黑松披针形叶,不仅叶面积小,日间叶片受光辐射少,叶片升温慢,而且疏风也会降低叶温,从而降低叶片蒸腾速率,减少叶片水分丢失。加之黑松针叶表面附有油脂层可防蒸发,使其持水力较强。相比之下,紫穗槐叶片大而薄,但由于植株枝叶茂密且层层叠加交互遮阴,降低了叶片水分丢失而使其叶片持水力较高,但在风吹袭时,较大的叶片不仅易形成空气阻力加大风对植物的机械损害,而且较大的叶面积也易引发叶片蒸腾速率增高和水分流失,而降低其持水力[20—21,26]。有研究发现,差巴嘎蒿在反复干旱复水处理中叶片含水量会在干旱胁迫中下降,在复水时上升[14—15]。紫穗槐在干旱胁迫下叶片水分下降,在复水时上升[31]。并认为植物对干旱胁迫造成的损伤具有较高的修复能力,植物对缺水有很强的补偿性[14—16]。因此,尽管紫穗槐叶片较大,易受风吹影响而导致蒸腾失水和细胞生理干旱,但较大的叶片生理代谢活动也强,在风后恢复供水时细胞能快速启动对缺水的补偿作用,使其叶片RWC增高。可见,紫穗槐风后对缺水的补偿性可能是一种自我修复机制,它在维护叶片水分平衡上起重要生理调控作用,也是紫穗槐能成为防风固沙植物的关键。研究表明,黑松叶片较强的持水力和紫穗槐叶片对缺水的补偿力可能是其适应强海风吹袭而生存的关键。尽管不同科属树种维护叶片水分平衡策略不同,但防止细胞水分亏缺在植物抗风生长和生存中起重要作用。
3.2 渗透调节物在植物缺水补偿中作用及与抗风生长关系
本研究结果表明,在自然状况下,黑松叶片中可溶性糖含量较紫穗槐高111.5%(图3),而紫穗槐脯氨酸含量则较黑松高78.6%(图4)。在间歇净风和风沙流处理中,黑松在风吹袭中伴随叶片RWC下降,可溶性糖含量的上升,在恢复期伴随叶片RWC稳定而可溶性糖的下降;而紫穗槐在风吹袭中伴随叶片RWC大幅度下降,脯氨酸和可溶性糖含量上升,在恢复期伴随着叶片RWC回升,而脯氨酸和可溶性糖含量下降。大量研究发现,植物对于环境水分状况的敏感性很高,在生理和细胞及分子水平上都有很快的响应变化[7—8]。差巴嘎蒿[14]、节节麦[16]在干旱胁迫中,不仅叶片水分下降,而且脯氨酸含量呈持续增加;在复水后,叶片含水量上升、脯氨酸下降回到正常水平。植物可通过渗透调节可塑性变化适应干旱生境[16]。本研究结果表明,(1)自然状况下和间歇风吹袭处理中参与维护两树种水分平衡的渗透调节物种类是不同的,黑松依赖可溶性糖,而紫穗槐依赖脯氨酸。对沙生植物的研究发现,自然状况下,扁蓿豆叶片日均脯氨酸含量最高,较黄柳、差巴嘎蒿、猪毛菜高1—7倍。黄柳叶片日均可溶性糖含量最高,较差巴嘎蒿、猪毛菜、扁蓿豆高2—5倍。差巴嘎蒿和猪毛菜叶片脯氨酸和可溶性糖含量均最低[37—38]。并指出不同科属沙生植物渗透调节物种类的差异可能与其科属间植物基础代谢不同有关。豆科植物主要将光合产物用于蛋白质合成,日间光照和气温变化引发叶片蛋白质代谢受阻导致脯氨酸氧化受抑而积累[37]。相反,黄柳和冰草主要将光合产物用于淀粉合成,日间光照和气温增高引发叶片缺水导致代谢受阻使可溶性糖积累[37—38]。因此,尽管基础代谢的差异导致两树种具有不同的渗透调节物种类维护细胞水分平衡,但这也表明维护细胞水分平衡在植物适应风吹袭和抗风生长中是至关重要的。(2)间歇风吹处理中,两树种叶片渗透调节物含量的变化与其水分变化相关。如,在间歇风沙流处理中,黑松叶片平均RWC下降14.5%,可溶糖含量增加15.9%;而紫穗槐叶片平均RWC下降45.9%,可溶性糖含量增加25.9%,脯氨酸含量增加32.4%。可见,风吹袭引发叶片失水促进了叶片渗透调节物的积累,而叶中积累的可溶性糖和脯氨酸在维护黑松和紫穗槐叶片水分平衡中起重要作用。(3)在恢复期,紫穗槐叶片水分对亏缺的补偿作用与风吹袭中脯氨酸和可溶性糖的积累密切相关。如,在第三次间歇净风和风沙流吹袭中,黑松可溶性糖提高8.9%和11.7%,在恢复期叶片RWC稳定。在第二和三次间歇净风吹袭中,紫穗槐可溶性糖含量提高了28.9%、32.3%;脯氨酸含量提高49.8%、47.0%;风后相应恢复期叶片RWC分别较风吹袭增加9.6% 和15.3%。由于这些有机渗透调节物可通过提高细胞液浓度、降低渗透势而增加细胞吸水力,使其在风后恢复期叶片RWC增高和水分平衡得以修复。可见,渗透调节物是植物对缺水补偿性作用的物质基础。尽管科属不同的两树种具有不同的渗透调节物种类,但它们在间歇风吹袭中随水分多寡的变化显示了两树种具有较强的渗透调节可塑性。渗透调节可塑性通过维护水分平衡而在两树种抗风生长中起重要生理保护作用。
3.3 抗氧化酶在植物缺水补偿中作用及与抗风生长关系
对黑松和紫穗槐在自然状况下和间歇净风和风沙流处理中叶片膜脂过氧化程度和抗氧化酶活力变化对比研究发现,首先,自然状况下紫穗槐叶片MDA含量,CAT、POD活力分别较黑松高93.3%、118.8%、6.5倍,而黑松叶片SOD活力较紫穗槐高28.2% 。MDA是膜脂过氧化作用的最终产物,它的水平表征了膜脂过氧化的程度[4—5]。逆境条件下,细胞内 MDA 含量与植物存活和抗逆性成负相关[4—7]。该结果表明,在自然风沙环境中,黑松依赖SOD抑制膜脂过氧化作用,维护较低膜脂过氧化水平而适应风沙环境,而紫穗槐主要依赖CAT和POD清除氧自由基、抑制膜脂过氧化、维护氧自由基代谢平衡而适应风沙环境。有研究发现,生活在呼伦贝尔沙漠的7种不同科属沙生植物日间膜脂过氧化程度和抗氧化酶活力差异显著,其中日间MDA含量最高的豆科植物(扁蓄豆、小叶锦鸡儿),叶片POD和CAT 活力也最高;日间MDA含量较低的差巴嘎蒿和猪毛菜,其POD、CAT、和SOD活力也较低。可见,尽管不同科属树种参与抗风的抗氧化酶种类不同, 但抑制膜脂过氧化、维护氧自由基代谢平衡和维护膜的完整性可能在黑松和紫穗槐适应风沙环境起重要生理保护作用。而同一环境下不同科属植物参与抗逆的抗氧化酶种类不同,可能与其控制膜脂过氧化机理发生分异有关[37—38]。
其次,风吹袭中,两树种叶片RWC与抗氧化酶活力变化与呈负相关,与膜脂过氧化程度呈正相关。紫穗槐随净风吹袭次数增多叶片RWC下降(23.3%),POD和CAT活力大幅增高(图5、6、7),而MDA含量下降;随风沙流吹袭次数增多,RWC下降幅度增大(45.5%),POD、CAT、SOD活力小幅增高,而MDA含量下降。而黑松在间歇净风处理中,叶片RWC稳定,MDA含量、POD、CAT、SOD活力无明显变化,在间歇风沙流处理中,RWC下降,MDA含量、POD、CAT、SOD活力略有增高。研究表明,风吹袭引发叶片失水导致的细胞水分亏缺是细胞抗氧化防御系统激活的诱因。因为植物细胞在水分亏缺时会产生活性氧自由基[8—9]。积累的活性氧自由基会破坏活性氧自由代谢平衡,引起细胞膜脂过氧化。但同时积累的氧自由基又激活抗氧化保护酶系统,提高抗氧化酶活力、清除氧自由基、抑制膜脂过氧化、保护细胞膜。因此,在风吹袭过程中,抗氧化酶通过抑制膜脂过氧化、维护氧自由基代谢平衡而在黑松和紫穗槐适应风和风沙流吹袭中起重要生理保护作用。另外,强风沙流吹袭引发沙粒对叶片击打磨蚀使叶组织结构破坏,导致叶片过度失水和细胞代谢紊乱而破坏了抗氧化酶保护系统,这可能是紫穗槐在风沙流处理中叶片抗氧化酶活增幅下降的诱因。
此外,在恢复期,两树种叶片MDA含量降低和叶片RWC的恢复均与叶片维护较高抗氧化酶活力相关。在第二和第三次净风吹袭后的恢复期,伴随着紫穗槐叶片RWC增高9.6%和15.3%(图1),叶片MDA含量下降28.2% 和22.4%(图2), 而POD活力增高13.1%和22.2%(图5)、CAT活力增高18.9%和10.3%(图6)、SOD活力增高16.6% 和9.3%(图7)。黑松在恢复期中,伴随着叶片RWC增加,POD和SOD活力增高。研究表明,恢复期细胞抗氧化酶活力的增高和膜脂过氧化产物的降低成负相关。尽管恢复期叶片RWC增加,细胞水分亏缺度下降,但恢复期叶片维持较高的抗氧化酶活力可抑制氧自由基积累、防止膜脂过氧化、维护膜的弹性和完整性,这不仅在维护细胞吸水和体积增大上起生理保护作用,而且在缺水补偿和自愈修复过程中起重要生理保护作用。
综上所述,在漫长的风沙环境中,黑松依赖疏风的针叶及叶片油脂物质维护持水力,而且通过维护较高可溶性糖和SOD活力维持水分平衡和较低的膜脂过氧化水平,而紫穗槐大而薄的叶片持水力差,但叶片通过维护较高脯氨酸和CAT、POD活力抑制膜脂过氧化适应风吹袭。在间歇净风和风沙流处理中,风吹袭引发叶片水分亏缺而激活植物对缺水的补偿机制(自愈修复),通过提高渗透调节物含量增高细胞吸水力为风后的自愈修复提供物质基础,同时通过提高抗氧化酶活力抑制膜脂过氧化、维护膜的完整性和弹性为自愈修复提供生理保护。因此,自愈修复是两树种适应海岸强海风吹袭的关键和生理适应机制,而渗透调节和抗氧化酶通过维护水分平衡和氧自由基代谢平衡而在自愈修复和抗风生长中起重要生理保护作用。

