银杏内酯B通过MMP9/STAT3信号通路对肺癌细胞A549增殖、迁移、侵袭和凋亡的影响
靳彩玲,赵树鹏,姬颖华,王荦楠,杨军,张清琴,牛红蕊
(新乡医学院第一附属医院,河南 新乡 453000)
肺癌是全世界最常见的恶性肿瘤,发病率和病死率高,每年约有180 万新发病例,约有160 万患者死于肺癌,占所有患癌症死亡病例的19%[1]。根据组织学特征可将肺癌分为非小细胞肺癌和小细胞肺癌,非小细胞肺癌约占所有肺癌病例的80%,在诊断时,近70%的非小细胞肺癌患者已处于晚期,5年存活率极低[2]。手术、化疗和放疗是肺癌的主要治疗策略,尽管近年来治疗方式有了很大的进步,但大多数肺癌患者由于局部浸润和远处转移,预后仍不理想。因此,迫切需要开发新的抗癌药。
银杏内酯B(ginkgolide B,GB)是提取自银杏叶的银杏二萜内酯类化合物,是迄今发现的最强的血小板活化因子拮抗剂,具有抗氧化、抗炎、抗肿瘤、抗休克和清除自由基等药理作用,临床上多用于治疗血栓形成、急性胰腺炎和心血管疾病等[3−4]。已有研究表明,银杏内酯B 可以对肺腺癌A549 细胞产生抗肿瘤细胞毒性作用[5],但银杏内酯B 对肺癌的具体作用机制仍不清楚。本文旨在探究银杏内酯B 对肺癌细胞A549 恶性生物学行为的影响。
1 材料和方法
1.1 试验药物和主要试剂
银杏内酯B(批号:110863-201611,中国食品药品检定研究院,化学式:C20H24O10,分子量:424.40,纯度≥95.6%);人非小细胞肺癌株A549(美国典型培养物保藏中心);RRPMI 1640 培养基、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶和青-链霉素(美国赛默飞世尔科技公司);MTT 细胞增殖及细胞毒性检测试剂盒(批号:C0009M)、Annexin V-FITC 细胞凋亡检测试剂盒(批号:C1062L)、BCA 试剂盒(批号:P0012)、辣根过氧化物酶标记山羊抗兔IgG(批号:A0208)(上海碧云天生物技术研究所);Transwell(批号:3450,美国Corning Costar 公司);一抗Ki67(批号:ab15580)、PCNA(批号:ab18197)、Bax(批号:ab104156)、Bcl-2(批号:ab194583)、Caspase-3(批号:ab4051)、Cleaved Caspase-3(批号:ab2302)、MMP-9(批号:ab38898)、STAT3(批号:ab31370)、p-STAT3(批号:ab76315)和β-actin(批号:ab8227)(英国Abcam 公司)。
1.2 细胞培养
A549 细胞于37 ℃,5% CO2恒温培养箱用高糖RMPI 1640 培养基(含10% FBS 和1%青-链霉素)培养,取对数生长期细胞用于实验,0.25%胰蛋白酶消化。
1.3 细胞处理及分组
将A549 细胞随机分为对照组、银杏内酯B 低剂量组、银杏内酯B 中剂量组和银杏内酯B 高剂量组,共4 组,分别采用25、50、100 μmol/L 剂量的银杏内酯B 处理银杏内酯B 低、中、高剂量组的A549细胞。
1.4 MTT法检测细胞增殖
取对数生长期的A549 细胞,接种于96 孔板(5 000 个/孔)培养24 h 后,按方法“1.3”项下分组处理后,每孔加入100 μL MTT溶液,孵育4 h后弃去MTT溶液,每孔加入100 μL 二甲基亚砜室温避光振荡10 min,于酶联免疫检测仪下测定各孔波长为570 nm处的吸收值。
1.5 Transwell法检测细胞侵袭
Transwell上室加入无血清培养基稀释的人工基底膜后,取转染后的各组A549 细胞,上室中加入100 μL的细胞悬液,下室中加入600 μL 的含FBS 的RMPI 1640 培养液。培养24 h 后用脱脂棉花擦掉基质胶和上室细胞,4%多聚甲醛溶液固定20 min,0.1%结晶紫染色。于光学显微镜下计数并拍照,每个样本随机选取5个视野。
1.6 划痕愈合实验检测细胞迁移情况
将细胞接种于6 孔板,按“1.3”项下的方法分组处理A549细胞后,当细胞长满约80%时用中枪头垂直于6 孔板水平划线,PBS 缓冲液清洗3 次后,于培养箱中培养24 h后取样拍照。
划痕愈合率(%)=(0 h 划痕宽度-24 h 划痕宽度)/0 h划痕宽度
1.7 流式细胞仪检测细胞凋亡情况
取转染后的各组A549 细胞接种于6 孔板,培养48 h 后,室温下加入5 μL Annexin V FITC 混匀,最后加入碘化丙啶(propidium iodide,PI)10 μL 避光孵育15 min,流式细胞仪上机检测。
1.8 Western Blot法检测各项细胞因子水平
各组A549 细胞加入含蛋白酶抑制剂的细胞裂解液提取总蛋白,BCA 试剂盒检测蛋白含量。10%SDS-PAGE凝胶电泳分离蛋白,200 mA恒流点转移至PVDF 膜。加入一抗Ki67(1∶1 000)、PCNA(1∶1 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)、Caspase-3(1∶1 000)、MMP-9(1∶1 000)、STAT3(1∶1 000)和p-STAT3(1∶1 000)4 ℃孵育过夜,TBST 缓冲液清洗后加入辣根过氧化物酶标记的IgG(1∶10 000),膜上滴加电化学发光显影液显色。ImageJ V 软件分析各组A549 细胞目的蛋白与β-actin比值。
1.9 统计学分析
采用SPSS 20.0 统计软件进行数据分析,计量资料以均数±标准差(±s)表示。多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05代表差异具有统计学意义。
2 结果
2.1 银杏内酯B对A549细胞活力的影响
与对照组相比较,银杏内酯B中、高剂量组细胞活力显著降低(P<0.05),说明银杏内酯B 可以降低A549细胞活力。见表1。
表1 各组A549细胞活力的比较(±s)
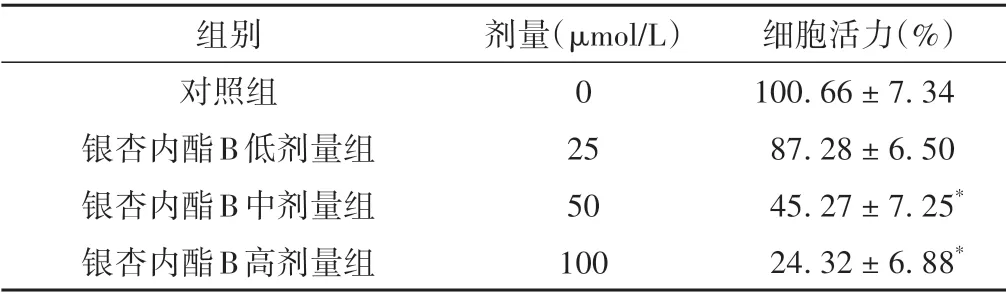
表1 各组A549细胞活力的比较(±s)
注:与对照组比较,*P <0.05。
细胞活力(%)100.66±7.34 87.28±6.50 45.27±7.25*24.32±6.88*组别对照组银杏内酯B低剂量组银杏内酯B中剂量组银杏内酯B高剂量组剂量(μmol/L)0 25 50 100
2.2 银杏内酯B对A549细胞Ki67、PCNA蛋白表达水平的影响
与对照组相比较,银杏内酯B 中、高剂量组Ki67、PCNA 蛋白水平显著降低(P<0.05),说明银杏内酯B能够下调A549 细胞Ki67、PCNA 蛋白表达水平。见图1、表2。
表2 各组A549细胞Ki67、PCNA蛋白表达水平的比较(±s)
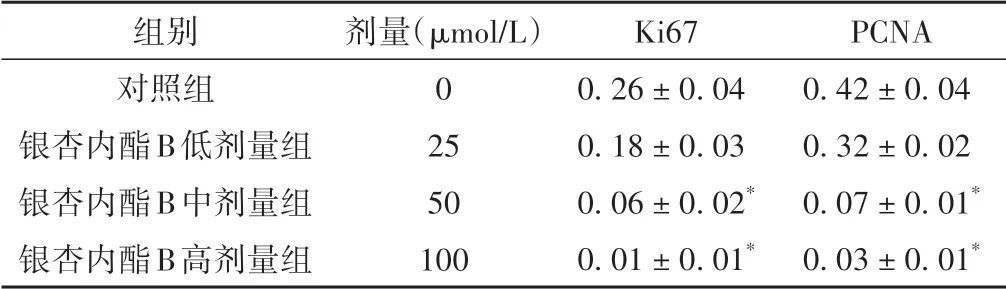
表2 各组A549细胞Ki67、PCNA蛋白表达水平的比较(±s)
注:与对照组比较,*P <0.05。
组别对照组银杏内酯B低剂量组银杏内酯B中剂量组银杏内酯B高剂量组PCNA 0.42±0.04 0.32±0.02 0.07±0.01*0.03±0.01*剂量(μmol/L)0 25 50 100 Ki67 0.26±0.04 0.18±0.03 0.06±0.02*0.01±0.01*
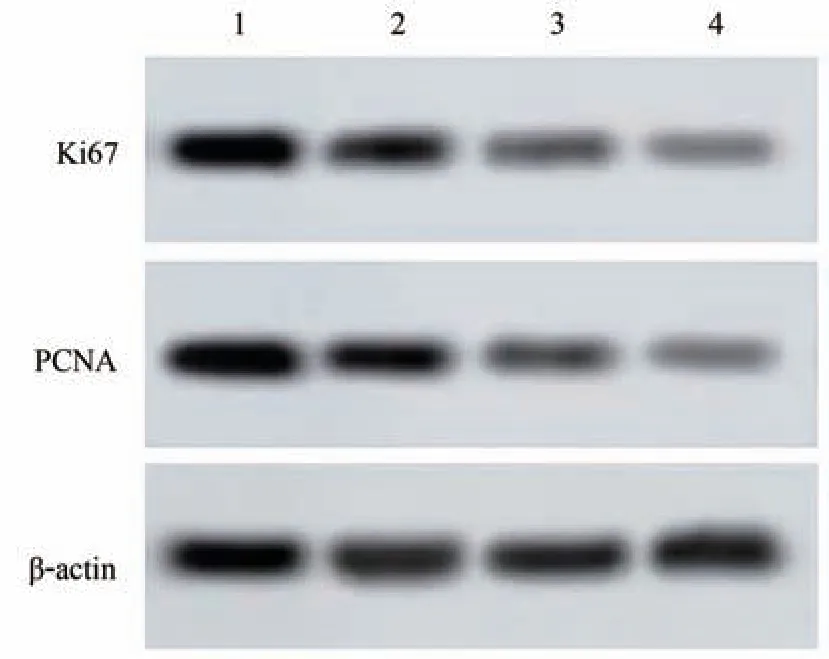
图1 各组A549细胞Ki67、PCNA蛋白表达水平的比较
2.3 银杏内酯B对A549细胞侵袭情况的影响
与对照组相比较,银杏内酯B中、高剂量组侵袭细胞数显著降低(P<0.05),说明银杏内酯B能够抑制细胞侵袭。见图2、表3。
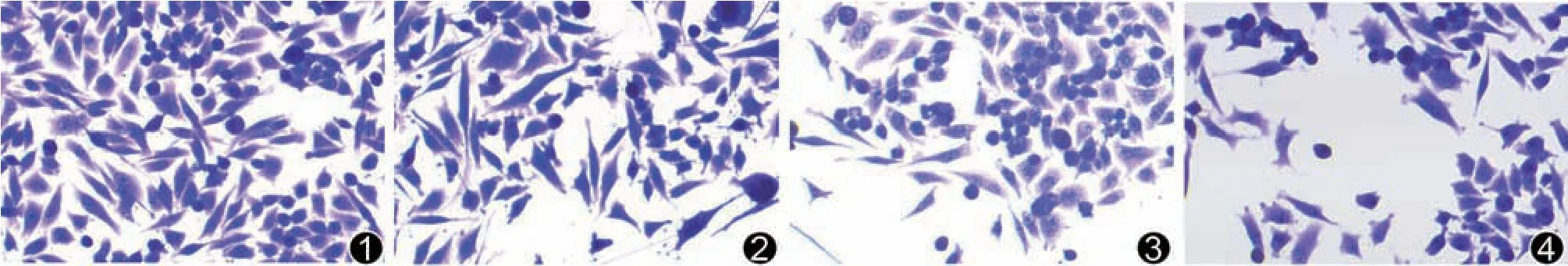
图2 各组A549细胞侵袭细胞数比较(×200)
表3 各组A549细胞侵袭细胞数的比较(±s)
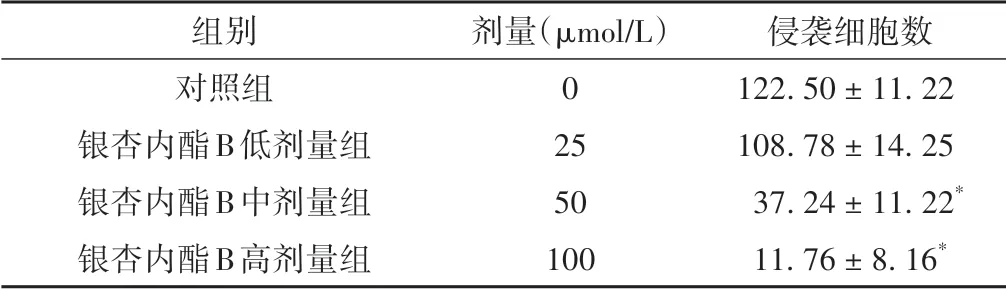
表3 各组A549细胞侵袭细胞数的比较(±s)
注:与对照组比较,*P <0.05。
侵袭细胞数122.50±11.22 108.78±14.25 37.24±11.22*11.76±8.16*组别对照组银杏内酯B低剂量组银杏内酯B中剂量组银杏内酯B高剂量组剂量(μmol/L)0 25 50 100
2.4 银杏内酯B对A549细胞迁移情况的影响
与对照组相比较,银杏内酯B中、高剂量组划痕愈合率显著降低(P<0.05),说明银杏内酯B 能够抑制A549细胞迁移。见图3、表4。

图3 各组A549细胞划痕愈合情况比较(×200)
表4 各组A549细胞划痕愈合率比较(±s)

表4 各组A549细胞划痕愈合率比较(±s)
注:与对照组比较,*P <0.05。
划痕愈合率(%)84.78±3.98 72.25±3.03 46.35±2.11*22.57±2.24*组别对照组银杏内酯B低剂量组银杏内酯B中剂量组银杏内酯B高剂量组剂量(μmol/L)0 25 50 100
2.5 银杏内酯B对A549细胞凋亡情况的影响
与对照组相比较,银杏内酯B中、高剂量组细胞凋亡率显著升高(P<0.05),说明银杏内酯B 能够促进A549细胞凋亡。见图4、表5。
表5 各组A549细胞的细胞凋亡率比较(±s)

表5 各组A549细胞的细胞凋亡率比较(±s)
注:与对照组比较,*P <0.05。
细胞凋亡率(%)5.78±1.98 12.36±3.64 22.23±6.94*38.77±5.11*组别对照组银杏内酯B低剂量组银杏内酯B中剂量组银杏内酯B高剂量组剂量(μmol/L)0 25 50 100
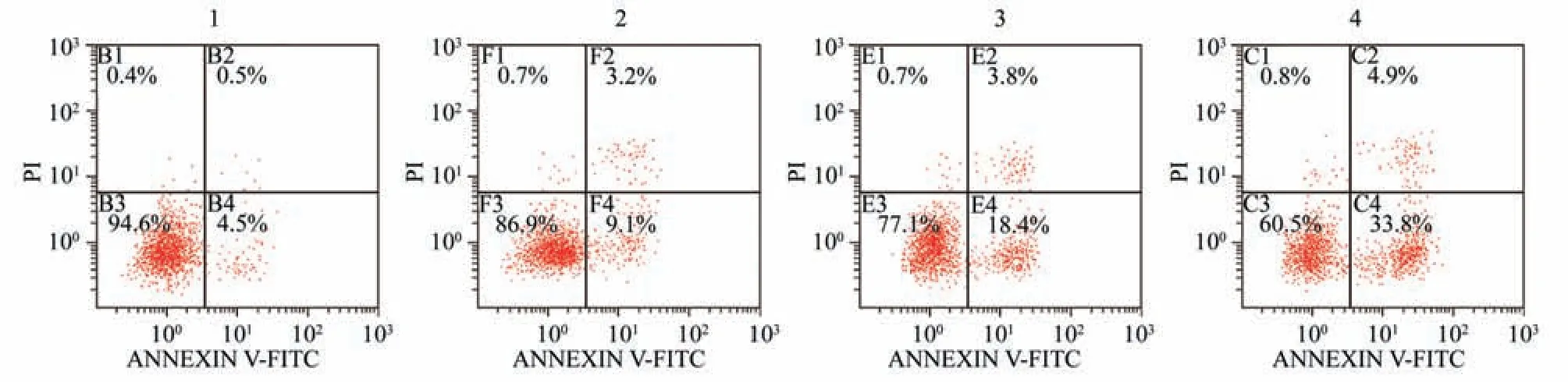
图4 各组A549细胞细胞凋亡情况比较
2.6 银杏内酯B 对A549 细胞Bax/Bcl-2、Cleaved Caspase/Caspase-3比值的影响
与对照组相比较,银杏内酯B 中、高剂量组的Bax/Bcl-2、Cleaved Caspase/Caspase-3 比值显著升高(P<0.05)。见图5、表6。
表6 各组A549细胞Bax、Bcl-2、Caspase-3蛋白表达水平变化比较(±s)
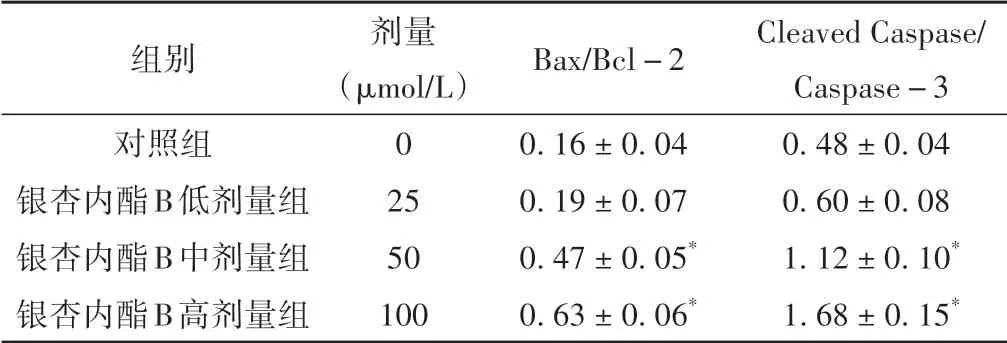
表6 各组A549细胞Bax、Bcl-2、Caspase-3蛋白表达水平变化比较(±s)
注:与对照组比较,*P <0.05。
组别对照组银杏内酯B低剂量组银杏内酯B中剂量组银杏内酯B高剂量组Cleaved Caspase/Caspase-3 0.48±0.04 0.60±0.08 1.12±0.10*1.68±0.15*剂量(μmol/L)0 25 50 100 Bax/Bcl-2 0.16±0.04 0.19±0.07 0.47±0.05*0.63±0.06*
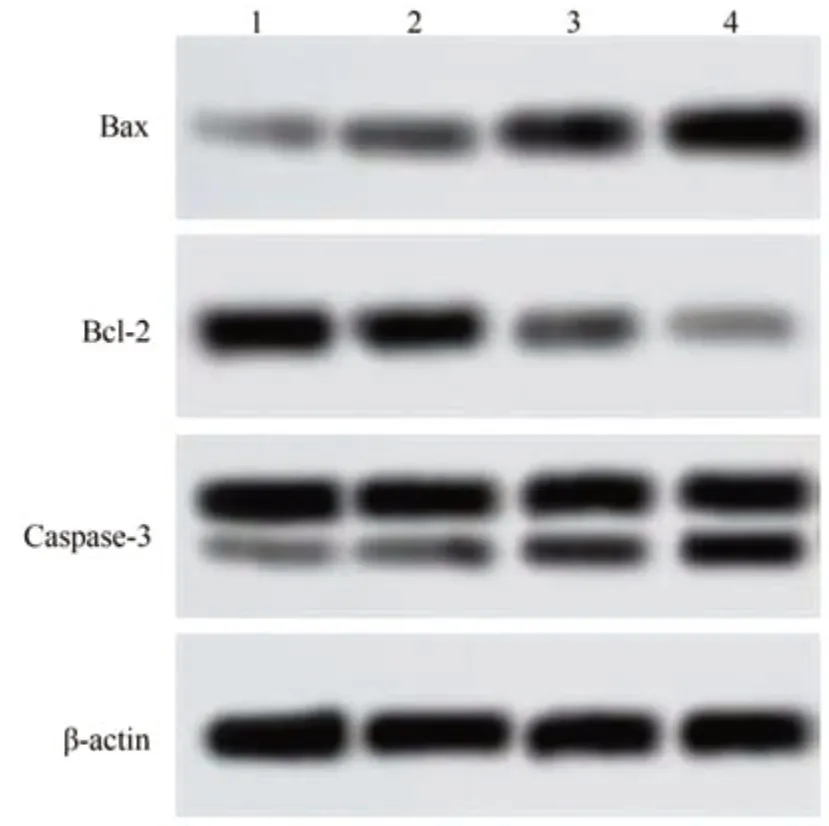
图5 各组A549细胞Bax、Bcl-2、Caspase-3蛋白表达水平比较
2.7 银杏内酯B 对A549 细胞MMP-9 蛋白水平和p-STAT3/STAT3比值的影响
与对照组相比较,银杏内酯B 中剂量组和银杏内酯B 高剂量组MMP-9 蛋白表达水平、p-STAT3/STAT3 比值显著降低(P<0. 05)。见图6、表7。
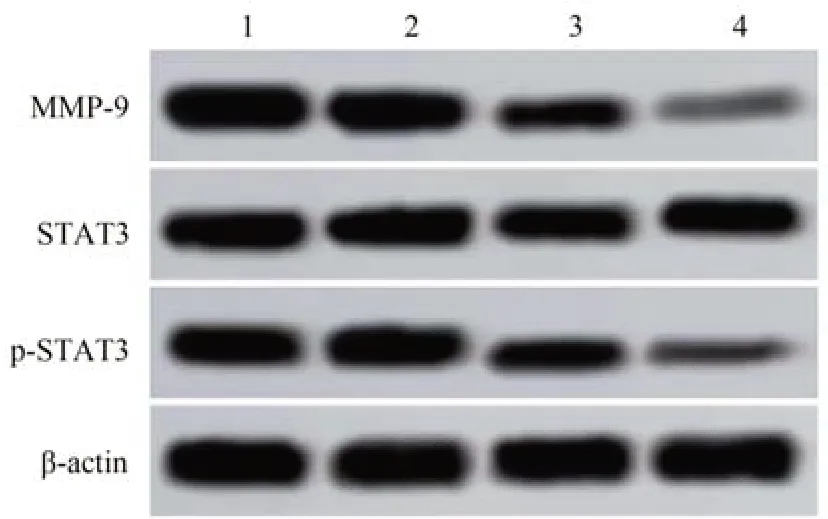
图6 各组A549细胞MMP-9、STAT3、p-STAT3蛋白表达水平比较
表7 各组A549细胞MMP-9、STAT3、p-STAT3蛋白表达水平变化比较(±s)
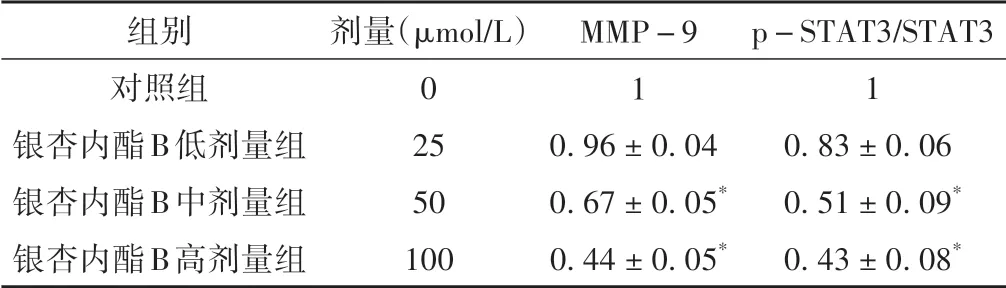
表7 各组A549细胞MMP-9、STAT3、p-STAT3蛋白表达水平变化比较(±s)
注:与对照组比较,*P <0.05。
组别对照组银杏内酯B低剂量组银杏内酯B中剂量组银杏内酯B高剂量组p-STAT3/STAT3 1 0.83±0.06 0.51±0.09*0.43±0.08*剂量(μmol/L)0 25 50 100 MMP-9 1 0.96±0.04 0.67±0.05*0.44±0.05*
3 讨论
由于西医治疗肺癌的预后较差,许多患者选择通过替代疗法来提高治疗效果、减少不良反应和改善生活质量。运用中药及其提取物治疗已经成为肺癌的一种流行替代疗法,尤其是在治疗晚期非小细胞肺癌的老年患者中[6]。
癌细胞的过度增殖是肿瘤发生与发展的重要因素之一。PCNA和Ki67是与细胞增殖相关的核抗原,近年来被广泛应用于检测细胞增殖,PCNA为DNA聚合酶辅助蛋白,与细胞增殖密切相关[7−8]。JIANG 等[9]研究发现,银杏内酯B可通过抑制细胞增殖增加耐药卵巢癌细胞对顺铂的敏感性。本文研究发现,经银杏内酯B处理后,A549细胞的细胞活力和Ki67、PCNA蛋白表达水平降低。提示银杏内酯B可抑制A549细胞增殖。
肿瘤细胞的侵袭及迁移能力是直接决定恶性肿瘤是否发生转移的关键因素,肺癌细胞多呈侵袭性生长,这是肺癌转移和复发的主要原因。研究发现银杏内酯B 可通过上调miR-223-3p 表达抑制膀胱癌细胞的侵袭和迁移。本文研究发现,银杏内酯B 具有减少A549 细胞侵袭细胞数和降低划痕愈合率的作用。提示银杏内酯B能够抑制A549细胞侵袭和迁移。
细胞凋亡属于程序性细胞死亡,可通过消除旧的及受损的细胞维持生物机体内生理平衡。Caspase-3属于凋亡蛋白,抑制Caspase-3 蛋白活性可阻断凋亡途径,起到抑制凋亡的作用[10]。与细胞凋亡相关的基因Bax 升高能够诱导细胞凋亡,Bcl−2 则能抑制细胞凋亡,Bax/Bcl-2 的比值能反应细胞凋亡状况[11]。杨彬等[12]研究发现,银杏内酯B 可能通过抑制Mfn1 的表达,调节促凋亡蛋白Bax 活性,降低抗凋亡蛋白Bcl-2 的表达,促进结直肠癌细胞的凋亡。CHAN 等[13]研究发现银杏内酯B 可诱导乳腺癌细胞MCF-7 凋亡。本文研究发现,经银杏内酯B 处理后,A549 细胞细胞凋亡率和Bax/Bcl-2、Cleaved Caspase/Caspase-3比值升高。提示银杏内酯B能够促进A549细胞凋亡。
基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)与肿瘤血管生成和侵袭转移能力有关,相关研究表明MMP-9过表达会促进各种癌细胞包括肺癌细胞的转移扩散,MMP-9 表达与肺癌恶性程度呈正相关[14]。STAT3 是一种致癌转录因子,其过度激活可导致肺癌细胞异常增殖和恶性转移,并抑制细胞凋亡[15−16]。LI 等[17]研究发现中药扶正抗癌方可通过STAT3/MMP-9 途径抑制肺癌细胞的转移。本文研究发现,银杏内酯B 具有降低A549 细胞MMP-9 蛋白水平和p-STAT3/STAT3 比值的作用。提示银杏内酯B可能通过MMP9/STAT3 通路调控肺癌细胞A549 恶性生物学行为。
综上所述,银杏内酯B 能够抑制A549 细胞增殖、侵袭和迁移,并促进其细胞凋亡过程。本文为临床应用银杏内酯B治疗肺癌提供了一定实验依据。

