阻塞性睡眠呼吸暂停对中国脑卒中患者预后影响的Meta分析
仲 琳,苏小凤,何子君,刘 霖 ,韩继明
我国现存脑卒中患者多达1 300万,居于血管性疾病之首,脑卒中死亡率是欧美国家的4倍,并以每年9%的速度持续攀升,全球疾病负担研究(Global Burden of Disease Study,GBD)报告显示,我国总体脑卒中终生发病风险约为40%,脑卒中患者的预后已成为影响中国居民全生命周期健康的重大公共卫生问题[1-2]。阻塞性睡眠呼吸暂停(Ostructive Sleep Apnea,OSA)是指在睡眠期间反复出现部分或完全的上呼吸道阻塞,导致呼吸停止(呼吸暂停)或低通气(呼吸不足),从而引起周期性的氧饱和度降低、觉醒频繁和睡眠碎片化,是睡眠呼吸障碍(Sleep Disordered Breathing,SDB)的最常见形式,在普通人群中的患病率为4~7%,但在脑卒中患者中高达60%[3]。一项元分析显示,在脑卒中患者暴露的SDB相关风险因素中,OSA占比90%[4]。现有研究证实,并发OSA与心脑血管疾病尤其是脑卒中预后密切相关,可导致脑卒中患者早期神经系统功能恶化,损害其日常生活活动能力,进而阻碍患者的预后康复[5]。目前,虽已有一定数量的OSA与中国脑卒中患者预后相关性的观察性研究,但各研究结果间针对脑卒中患者预后的评定工具和随访时间不一,且以OSA为暴露因素随访脑卒中患者预后的Meta分析甚少。因而,本研究通过全面检索国内外有OSA对中国脑卒中患者预后影响的队列研究,旨在明确OSA在脑卒中患者预后评定中的重要性,以期为中国脑卒中患者短期预后的早期风险筛查及后续的针对性临床医疗决策提供循证依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型队列研究。
1.1.2 研究对象经临床诊断标准同时排除血管性病因,并经MRI或CT确诊的中国脑卒中患者;年龄≥18岁。
1.1.3 暴露因素暴露组:脑卒中合并OSA;对照组:单纯脑卒中,OSA的诊断标准及分类标准参考《成人阻塞性睡眠呼吸暂停多学科诊疗指南》[6]。
1.1.4 结局指标脑卒中预后,主要结局:神经功能缺损,使用的评定量表包括美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)、改良爱丁堡-斯堪的纳维亚评分(Modified Edinburgh-Scandinavian Stroke Scale,MESSS)、改良Rankin量表(modified Rankin Scale,mRS)、中国脑卒中临床神经功能缺损程度评分量表;次要结局:功能依赖,使用Barthel指数评定。
1.1.4 排除标准(1)非中、英文文献;(2)综述、会议论文、动物实验类研究;(3)重复文献;(4)无法获取全文、数据无法提取的研究;(5)文献质量过低[纽卡斯尔-渥太华量表(The Newcastle-Ottawa Scale,NOS)评分<4分];(6)研究对象非中国人群。
1.2 文献检索策略计算机检索Embase、PubMed、The Cochrane Library、Sinomed、CNKI、Wang Fang Data和VIP数据库,搜集OSA对中国脑卒中患者预后影响的队列研究,检索时限均从建库至2021-07。此外,追溯纳入文献的参考文献,以补充获取相关文献。中文检索词包括:“阻塞性睡眠呼吸暂停”“睡眠呼吸暂停综合征”“睡眠呼吸障碍”“阻塞性呼吸暂停综合征”“睡眠呼吸暂停”“脑卒中”“脑梗死”“脑出血”“脑梗塞”“脑血管事件”“预后”“生存期”等。英文检索词包括:“sleep apnea, obstructive”“sleep apnea syndrome”“sleep disordered breathing”“obstructive sleep apnea syndrome”“sleep apnea hypopnea syndrome”“sleep apnea”“OSA”“obstructive sleep apnea”“urvival”“prognosis”等。以PubMed数据库为例,其具体检索策略见图1。

图1 PubMed检索策略
1.3 文献筛选与资料提取由2名研究者独立筛选文献、提取资料并交叉核对。如有分歧,则通过讨论或与第三方协商解决。文献筛选时首先阅读问题,在排除明显不相关的文献后,进一步阅读摘要和全文以确定是否纳入。如有需要,通过邮件、电话联系原始研究作者获取未确定但对本研究非常重要的信息。资料提取内容包括:(1)纳入研究的基本信息:研究题目、第一作者、发表年份等;(2)研究对象的基线特征和暴露因素;(3)偏倚风险评价的关键要素;(4)所关注的结局指标和结果测量数据。
1.4 纳入研究的偏倚风险评价由2名评价员独立评价纳入研究的偏倚风险,并交叉核对结果。队列研究的质量评价采用纽卡斯尔-渥太华量表(The Newcastle-Ottawa Scale,NOS)。
1.5 统计分析采用Rev Man 5.3及Stata 16.0软件进行Meta分析。计量资料采用均数差(MD)或标准化均数差(SMD)为效应指标,各效应量均给出其点估计值和95%CI。纳入研究结果间的异质性采用χ2检验进行分析(检验水准为α=0.1),同时结合I2定量判断异质性大小。若各研究结果间无统计学异质性,则采用固定效应模型进行Meta分析;若各研究结果间存在统计学异质性,则进一步分析异质性来源,在排除明显临床异质性的影响后,采用随机效应模型进行Meta分析。本文通过逐一剔除单个研究或改变效应模型对纳入研究进行敏感性分析,若改变后效应量差别小,表明敏感性低,结果稳健可靠;反之,则表明稳健性差。最后应用Egger's检验定量分析纳入文献是否存在发表偏倚。检验水准α=0.05。
2 结 果
2.1 文献筛选流程及结果初检共获得相关文献186篇,经逐层筛选,最终纳入研究9篇[7-15],文献筛选流程及结果见图2。
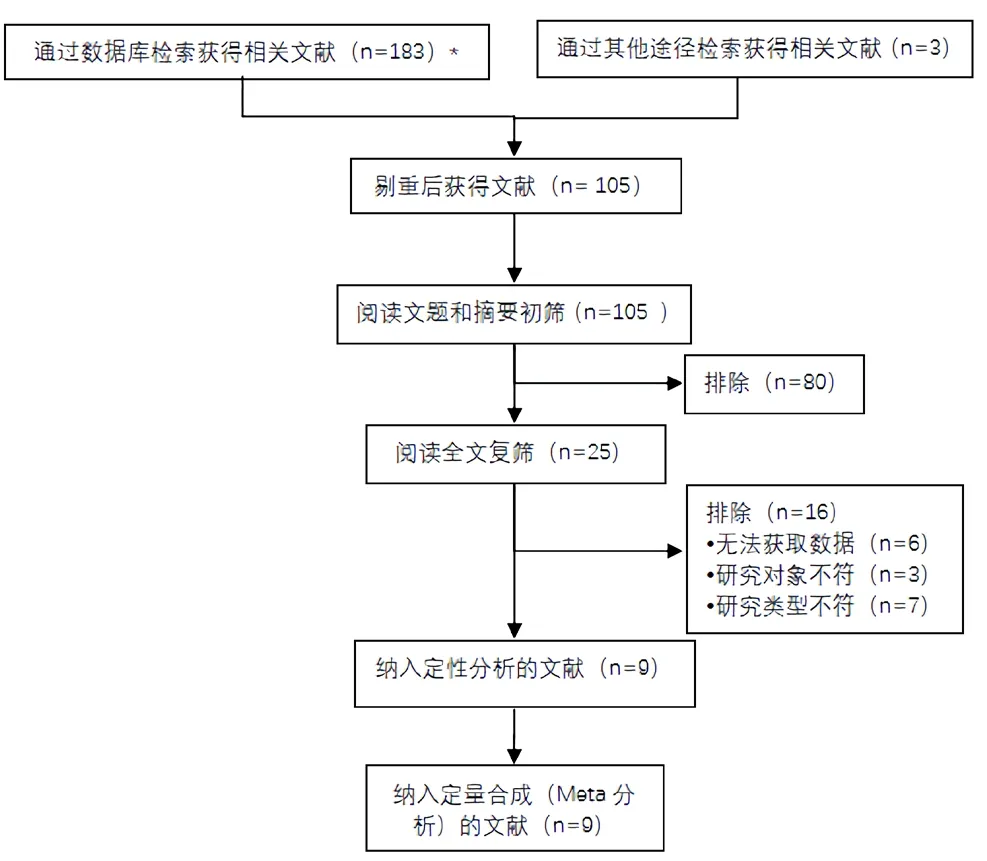
图2 文献筛选流程及结果
2.2 纳入研究的基本特征与偏倚风险评价结果共纳入9项回顾性队列研究[7-15],包括683例患者,均为单中心研究。这些研究发表于2006-2020年,样本量来自我国7个省、市地区,4项研究未明确暴露与非暴露的选择标准[8-11],3项研究未提及研究对象可比性[12,14-15],3项研究未充分描述随访结局[7,9,13],所有纳入的研究NOS评分在7~8分之间,提示研究质量均在中等以上。纳入研究的基本特征,见表1,偏倚风险评价结果,见表2。
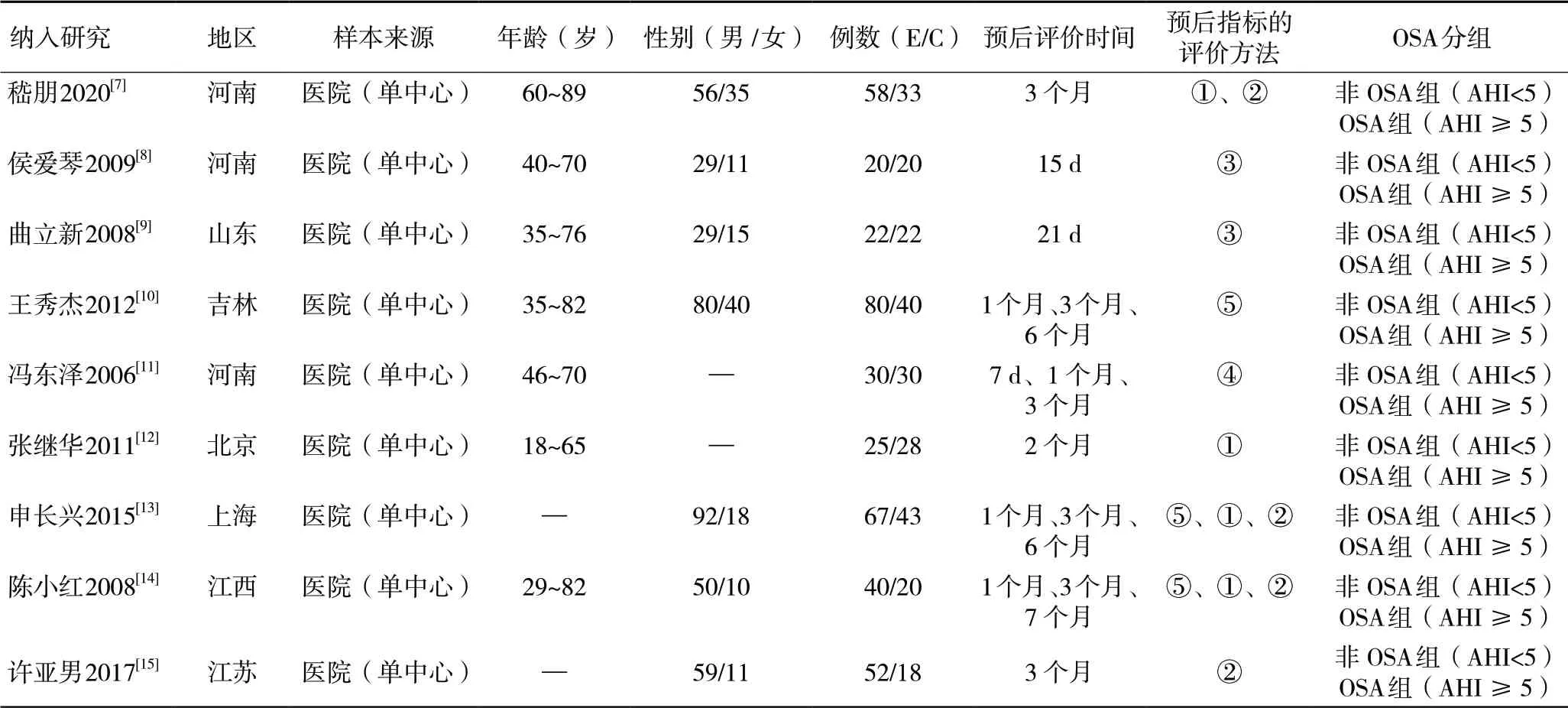
表1 纳入研究的基本特征
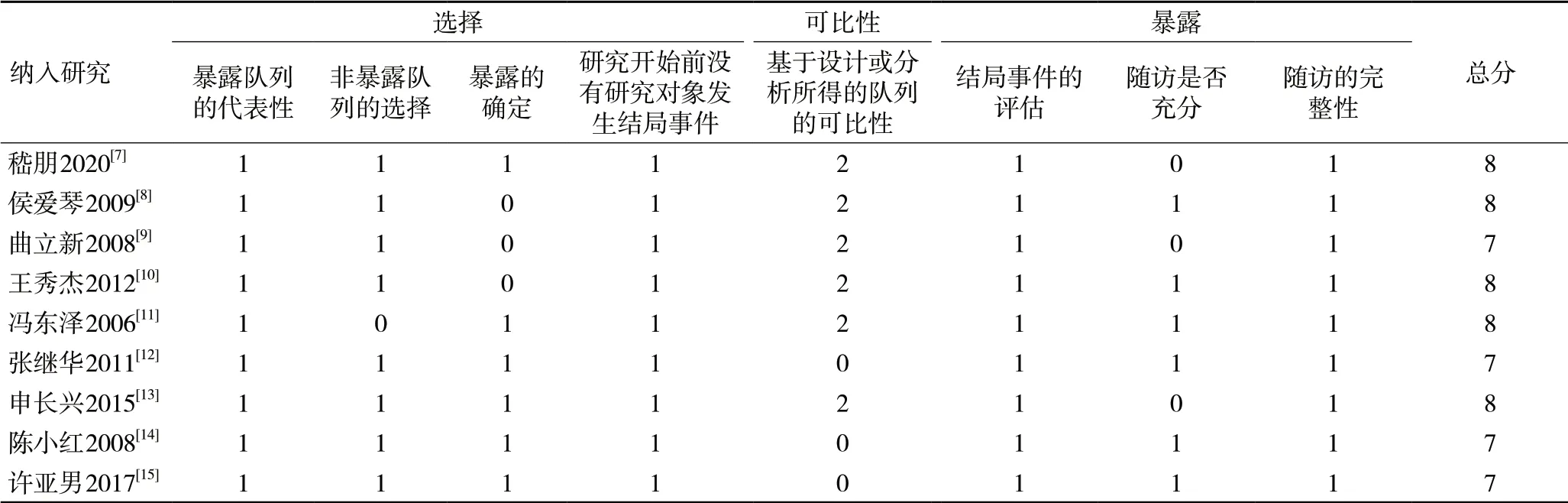
表2 纳入研究的偏倚风险评价结果(分)
2.3 Meta分析结果
2.3.1 主要结局神经功能缺损:(1)NIHSS评分,共3个[10,13-14]队列研究采用NIHSS评分评定了合并OSA的中国脑卒中患者随访1个月、3个月和6个月后的神经功能缺损状况,随机效应模型Meta分析结果显示,合并OSA的中国脑卒中患者1个月[MD=3.11,95%CI(2.46,3.77),P<0.001]、3个月[MD=2.08,95%CI(1.64,2.51),P<0.001]和6个月后的NIHSS评分[MD=1.38,95%CI(0.49,2.28),P=0.002]均高于对照组,差异均有统计学意义,见表3及图3。(2)mRS评分共2项[13-14]队列研究采用mRS评分评定了合并OSA的中国脑卒中患者随访1个月和6个月后的神经功能缺损状况,固定效应模型Meta分析结果显示,合并OSA的中国脑卒中患者随访1个月[MD=0.6,95%CI(0.27,0.93),P<0.001]和6个月后的mRS评分[MD=0.7,95%CI(0.51,0.89),P<0.001]差异均有统计学意义。4项[7,13-15]研究采用mRS评分评定了合并OSA的中国脑卒中患者随访3个月后的神经功能缺损状况,固定效应模型Meta分析结果显示,与对照组相比,差异有统计学意义,合并OSA的中国脑卒中患者3个月后的mRS评分[MD=0.7,95%CI(0.53,0.87),P<0.001]更高,见表3及图4。
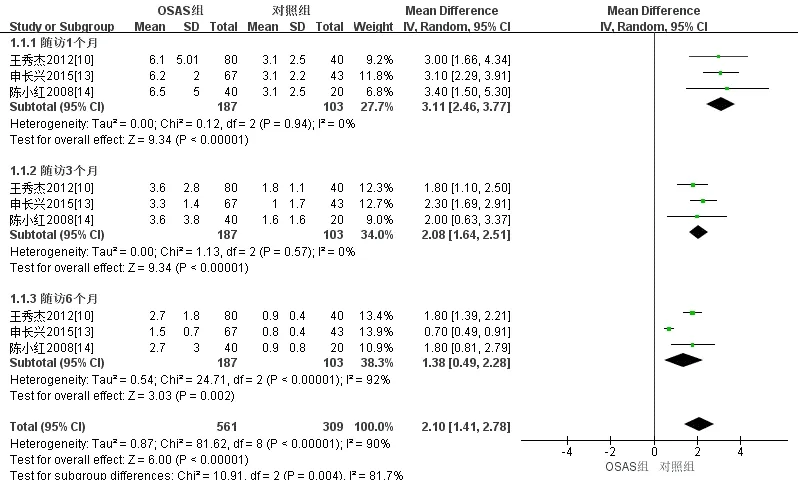
图3 NIHSS评分评定合并OSA的中国脑卒中患者随访情况的森林图

图4 mRS评分评定合并OSA的中国脑卒中患者随访情况的森林图
2.3.2 次要结局功能依赖:共3项队列研究[7,13-14]采用Barthel指数评定了合并OSA的中国脑卒中患者随访3个月后的功能依赖。固定效应模型Meta分析结果显示,合并OSA的中国脑卒中患者3个月[MD=-7.42, 95%CI(-9.71,-5.13),P<0.001]后的Barthel指数评分低于对照组。2个研究[13-14]采用Barthel指数评定了合并OSA的中国脑卒中患者随访1个月和6个月后的功能依赖,固定效应模型Meta分析结果显示,合并OSA的中国脑卒中患者1个月[MD=-9.73, 95%CI(-14.54,-4.92), P<0.001]和6个 月[MD=-6.43, 95%CI(-9.58, -3.09),P<0.001]后的Barthel指数评分均低于对照组,见表3及图5。
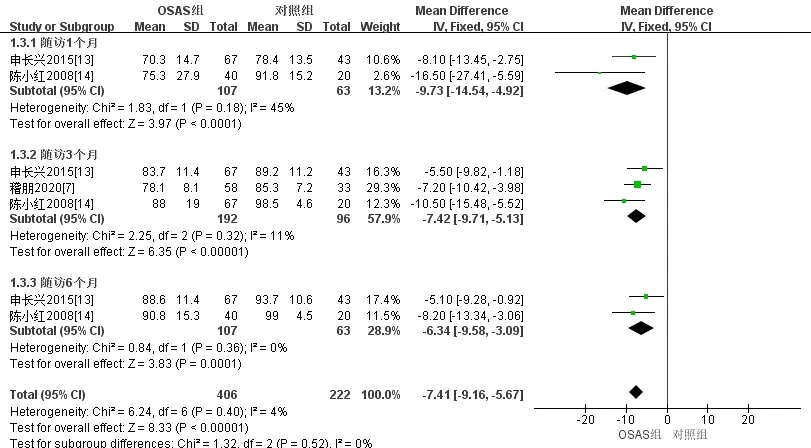
图5 Barthel评分评定合并OSA的中国脑卒中患者随访情况的森林图
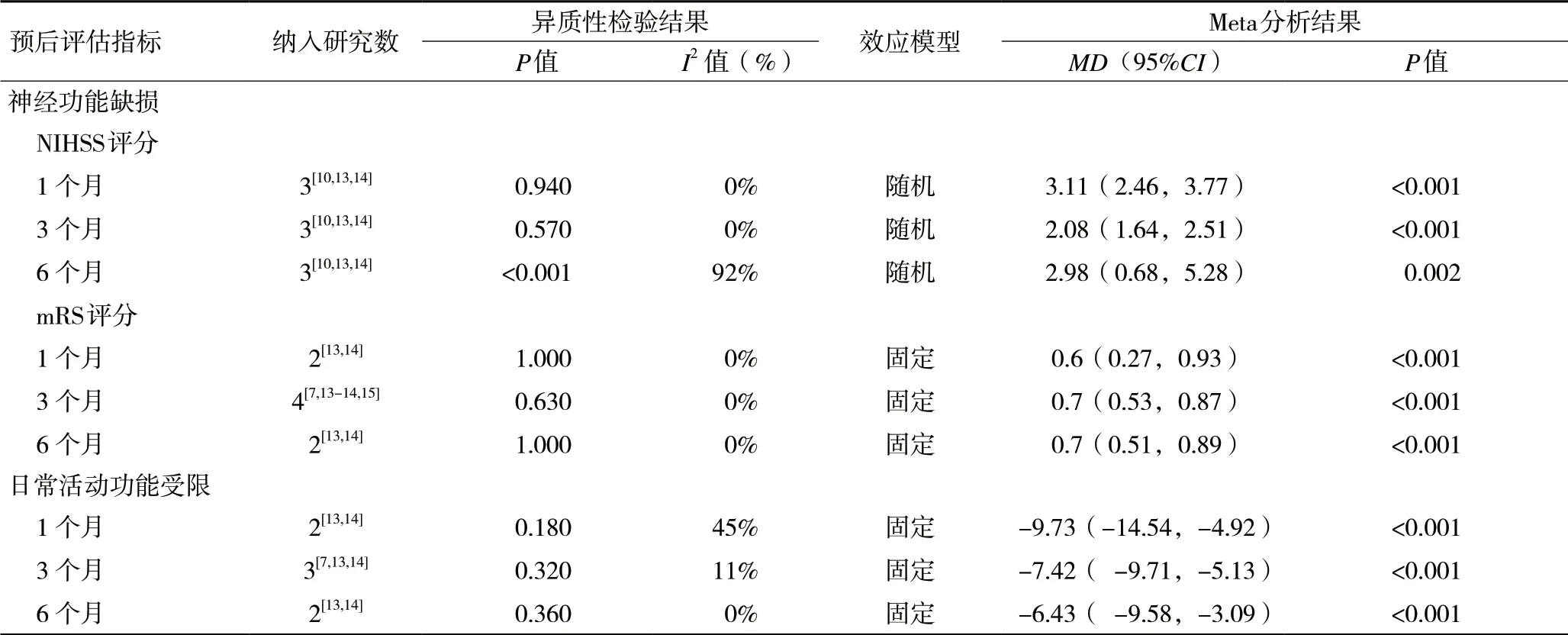
表3 OSA对中国脑卒中患者预后影响的Meta分析结果
2.4 描述性分析由于纳入研究的评价方法及干预时间差异较大,故未能对全部结局指标进行Meta分析,仅描述性分析如下。
2.4.1 主要结局指标冯东泽等[11]的研究显示,中国脑卒中患者随访7 d、1个月和3个月后,OSA组(暴露组)的临床神经功能缺失评分均更高。侯爱琴等[9]的研究显示,随访15 d后,OSA组的MESSS评分更高。曲立新等[10]的研究显示,随访21 d时,OSA组的MESSS评分更高。
2.4.2 次要结局指标张继华等[12]的研究显示,随访2个月时,合并OSA的中国脑卒中患者有更高功能依赖。
2.5 敏感性分析通过排除NIHSS评分随访6个月中申长兴[13]等研究后,发现异质性大幅下降(I2=0%,P=1),且仍能发现合并OSA的中国脑卒中患者随访6个月后的NIHSS评分[MD=1.8,95%CI(1.42,2.18),P<0.001]高于对照组,差异有统计学意义。对其他预后评估指标进行随机与固定效应模型转换的方法进行敏感性分析,分析更换模型前后MD值与95%CI基本一致,其敏感性较低,表明Meta分析结果较为稳定可靠。见表4。
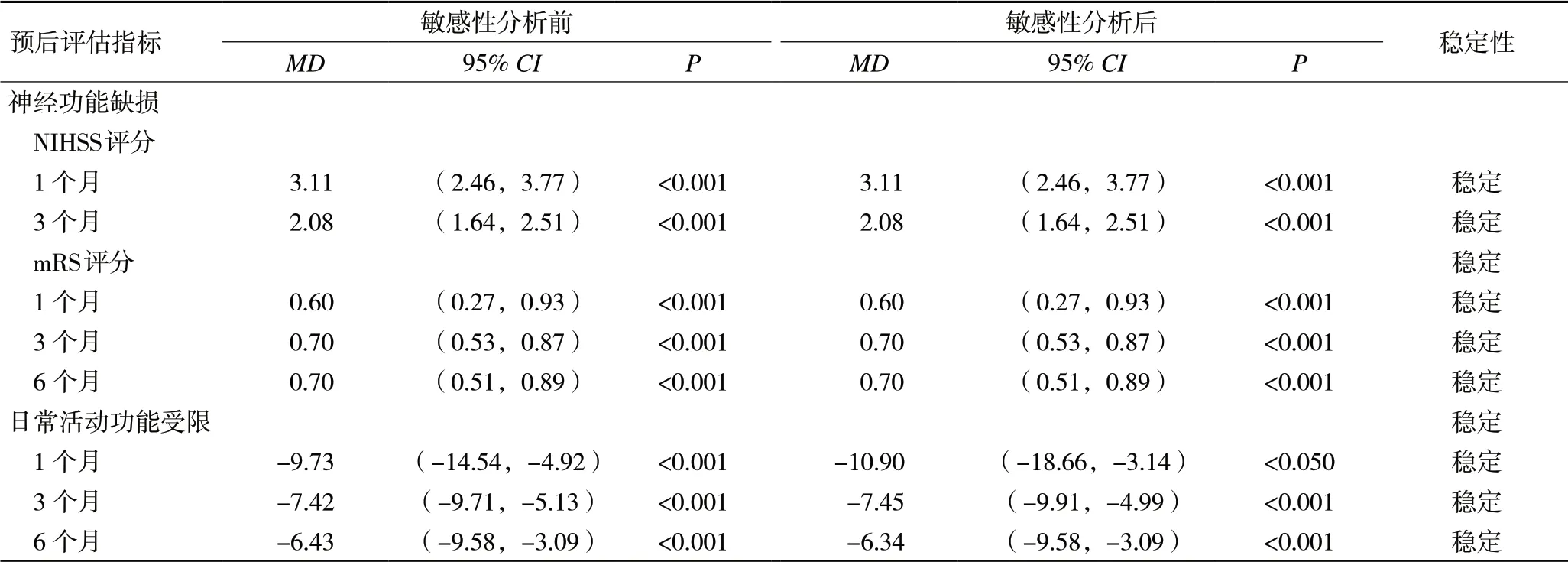
表4 敏感性分析结果
2.6 发表偏倚分析使用Egger's线性回归法对各预后评估指标的发表偏倚进行定量检测,P值均>0.05,表明纳入研究不存在发表偏倚。
3 讨 论
本Meta分析纳入9项队列研究,共683例患者。研究结果显示:与对照相比,合并OSA的中国脑卒中患者预后更差,随访1个月、3个月和6个月后的神经功能缺损均更严重,其NIHSS评分和mRS评分均高于对照组;同时合并OSA的脑卒中患者1个月、3个月和6个月后的功能依赖也更高,基于Barthel指数的日常活动能力评分均低于非OSA组。
OSA是一种普遍但未被充分认识的疾病,临床和流行病学证据表明,OSA与脑卒中之间有很强的因果关系[16-18]。一项元分析显示,72%的脑卒中患者存在OSA,且脑卒中后OSA的高患病率会随着时间的推移而持续存在[4]。活动依赖(基于Barthel指数评估日常生活活动能力)和神经功能缺损(基于mRS评分、NHISS评分等)是评定脑卒中患者临床预后的重要指标。研究发现,OSA引起的呼吸暂停和低通气与脑卒中患者的早期神经功能恶化具有显著相关性,其睡眠呼吸暂停低通气指数(Sleep-related Apnea-hypopnea Index,AHI)对脑卒中患者的功能依赖和因神经功能缺损而促发的不良结局也均有一定的预测作用[19]。OSA干扰脑卒中患者预后的病理生理机制多为间歇性低氧、氧化应激等对于脑部神经功能的刺激,神经功能的缺损可能致肢体出现不同程度的瘫痪,进而增加了患者日常活动的功能依赖[5]。相比之下,Lefevre-Dognin等的研究[20]表明,未显示OSA对脑卒中后患者的预后有显著影响。因而,我们的Meta分析基于当前的研究基础,在中国人群中,进一步分析OSA对于脑卒中患者预后的影响,以期为中国脑卒中患者预后的早期风险筛查及之后的针对性医疗决策提供依据。
当前有研究[21]发现,OSA也可能对脑卒中患者的大脑功能有一定的保护作用,但相对于正常对照组,其与脑卒中患者的神经功能不良预后和因此导致的活动能力受限仍然有关。一项神经影像学研究调查证实,大脑中存在与OSA相关的结构(总灰质体积)变化,该研究报告大脑区域的总灰质体积出现与OSA相关的减少[22]。先前的研究还表明,OSA患者对高碳酸血症的脑血管舒张反应减弱。且基于OSA人群和动物实验模型的研究结果发现,OSA的相关间歇性缺氧未得到及时的处理将诱发氧化应激,炎症,动脉粥样硬化,内皮功能障碍从而引起脑循环调节机制的改变及脑灌注的病理变化,最终导致脑血管疾病尤其是脑卒中[23-25]。故本研究采用Meta分析,在中国人群中,以功能依赖和神经功能缺损为指标评估了脑卒中患者合并OSA后1个月、3个月和6个月的短期预后,相较于对照组而言,OSA对脑卒中患者的短期预后产生了一定的负向影响,与国外部分研究结果相符[22-25],但受限于随访时间,加之纳入的相关原始研究多为单中心、小样本,故尚不能明确OSA与中国脑卒中患者长期预后的相关性。且另有研究表明,OSA患者与健康人群对因CO2逐步升高而促发的脑血管舒张反应差异无统计学意义,在长时间的间歇性低氧暴露后,患者的脑血流灌注量有所减少,但机体因缺氧产生的耐受性可通过缺血预处理和可能存在神经保护机制维持脑组织氧合的良好稳态[26],故今后的研究可进一步推论OSA所致的间歇性低氧暴露时长对于中国脑卒中患者长期预后的影响。
本研究局限性及展望:(1)本研究部分预后评定指标涉及的文献数量较少,且所有研究对象均来自单中心,无法进行深入分析,可能影响结果的准确性;(2)纳入研究的最长随访时间仅6个月,因而无法评定OSA对中国脑卒中患者长期预后的影响,加之样本量较小,样本尚不能代表整体人群的预后水平;(3)纳入研究的结局指标在评定工具不一,可能存在测量偏倚。为此,今后仍需开展大样本多中心的前瞻性队列研究以进一步验证OSA对中国脑卒中患者预后尤其是长期预后的的影响。
综上所述,当前证据显示,相比于对照组,OSA对中国脑卒中患者的短期预后(神经功能缺损和功能依赖)有一定的影响。受纳入研究数量和随访时长的限制,上述结论尚需开展更多高质量研究予以验证。另外,今后的研究也应更多关注脑卒中患者其它不同层面的预后评定指标。

