黄连根腐病发生与根际土壤、根茎内生、叶内生细菌群落结构变化关系
唐涛 袁斌 王帆帆 郭杰 郭晓亮 段媛媛 游景茂



摘要
為了探讨细菌群落结构与黄连根腐病发生的关系,本文分析了两个不同地点健康和染病黄连的根茎、叶内生细菌和根际土壤细菌的组成和差异。结果显示,黄连根茎、叶片和根际土壤样品中根际土壤细菌群落多样性最丰富,根茎内生菌次之。在所有样品中,主要的优势菌门为变形菌门Proteobacteria、放线菌门Actinobacteria、拟杆菌门Bacteroidetes和绿弯菌门Chloroflexi。相较于健康黄连组样品,染病黄连根际土壤、根茎和叶片样品中多个菌属细菌相对丰度发生显著改变,如Vibrionimonas,乳杆菌属Lactobacillus和鞘氨醇单胞菌属Sphingomonas等,表明可能与黄连根腐病的发生有一定关联。此外,RDA分析表明,伯克氏菌属Burkholderia、全噬菌属Holophaga和雷尔氏菌属Ralstonia与黄连根际土壤有机质、有效氮、pH有显著相关性。本研究分析了两个不同地点的健康和染病黄连根际、叶片内生细菌和根际土壤细菌群落结构差异,为综合分析黄连根腐病的成因和机制提供了参考。
关键词
黄连;根腐病;细菌群落结构;高通量测序;多样性
中图分类号:
S435.675
文献标识码:A
DOI:10.16688/j.zwbh.2020648
Relationships between the occurrence of rootrot and the change in the community structure of rhizosphere soil bacteria, rhizome and leaf endophytic bacteria of Coptis chinensis
TANG Tao1,YUAN Bin2,WANG Fanfan1,GUO Jie1,GUO Xiaoliang1,
DUAN Yuanyuan1,YOU Jingmao1*
(1. Institute of Chinese Herbal Medicines, Hubei Academy of Agricultural Sciences, Enshi445000, China;
2. Institute of Plant Protection, Soil and Fertilizer, Hubei Academy of Agricultural Sciences, Wuhan430064, China)
Abstract
To explore the relationships between the bacterial community structure and the occurrence of Coptis chinensis root rot, the composition and diversity of endophytic bacteria in rhizomes, leaves and rhizosphere soils bacteria of healthy and infected Coptis chinensis in two different locations were analyzed. The results showed that the rhizosphere soil bacterial communities had the greatest diversity, followed by endophytic bacteria in rhizomes. Overall, the dominant phyla were Proteobacteria, Actinobacteria, Bacteroidetes and Chloroflexi. Compared with bacteria from the healthy C.chinensis samples, the relative abundance of bacteria of multiple genera detected in rhizosphere soil, rhizome and leaf samples from infected C.chinensis changed significantly, for example Vibrionimonas, Lactobacillus, Sphingomonas, etc., suggested that these bacteria might be related to the occurrence of C.chinensis root rot. In addition, the RDA analysis showed that Burkholderia, Holophaga, Ralstonia, etc. were significantly correlated with organic matter, available nitrogen and pH value of rhizosphere soil. This study analyzed the composition and diversity of endophytic bacteria in rhizomes, leaves, and bacteria in rhizosphere soil of C.chinensis from two different locations, and provided a theoretical basis for the comprehensive analysis of the causes and mechanisms of C.chinensis root rot.
Key words
Coptis chinensis;rootrot;bacterial community structure;highthroughput sequencing;diversity
黄连Coptis chinensis为毛茛科Ranunculaceae黄连属Coptis多年生草本植物,以根茎入药,具有广泛抗菌、抗病毒和抗氧化作用[1]。此外,黄连常用作糖尿病降糖和抗肿瘤的药物[2]。最新研究表明,黄连解毒汤中的活性物质能通过多靶点、多通路治疗新型冠状病毒肺炎[3]。恩施土家族苗族自治州是黄连的主产区之一,总种植面积在5 000 hm2左右,总产量2 600 t[4]。然而,随着种植规模的不断扩大和连续多年栽培导致利川等地黄连不明原因根腐病发生严重,造成大面积减产甚至绝收,严重影响了黄连的产量、质量和农户的种植热情。有报道称镰刀菌 Fusarium spp.是黄连根腐病病原真菌之一[5],本文前期研究分离到耧斗菜茎点霉 Phoma aquilegiicola为病原真菌之一。黄连根腐病病原菌种类多,具体病因复杂,防控难度较大。
近年来,众多研究表明根际土壤微生物区系变化是影响中药材种植连作障碍的重要因素[6],微生物在土壤 根际 植物之间形成了一个植物与环境相联系的动态组合,而根际微生物组成和多样性的改变会影响土壤微生态功能,破坏土壤 根际 植物之间的微生物动态平衡,间接影响作物生长[7]。相关研究表明,植物在受到病原菌侵染后,植物根际土壤、茎秆以及叶际微生物群落结构都会发生变化。刘海洋等[8]对黄萎病棉田土壤真菌群落结构分析发现,重病棉田土壤真菌OTU数量、丰度均高于轻病或无病田,而真菌多样性降低。罗路云等[9]报道,南瓜叶际细菌群落α多样性随着叶片白粉病病情等级的增加呈现出先降低后升高的趋势。 本研究采用Illumina Miseq高通量测序技术对两个不同地点的健康、染病黄连的根茎、叶片内生细菌和根际土壤细菌的组成及多样性进行分析,为进一步分析黄连根腐病成因和发生机制提供理论依据,这对黄连产业的健康可持续发展具有十分重要的意义。
1材料与方法
1.1样品采集
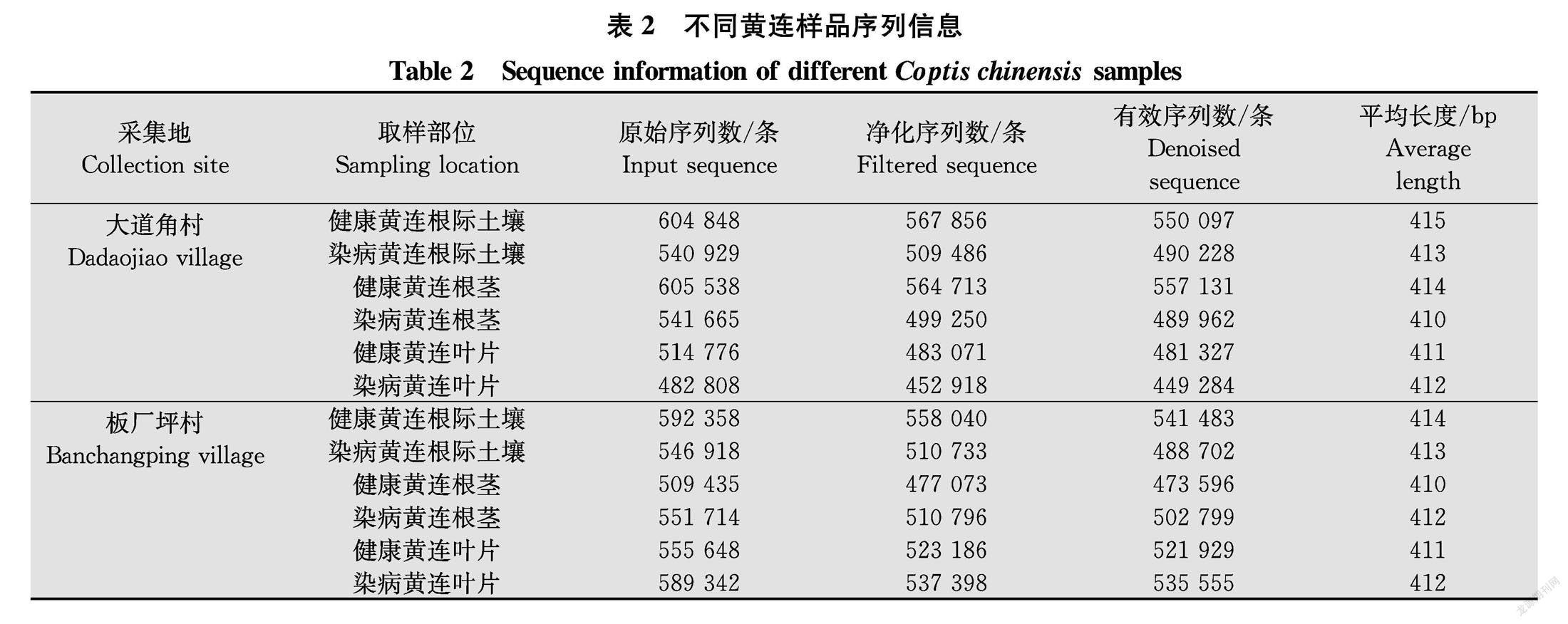
所有样品于2019年10月采集于恩施州利川市箭竹溪镇黄连种植基地(30°22′N,108°35′E,海拔1 300 m)。样品采集自两个不同地点,两地距离在3 km以上。共分为12组:1)大道角村健康黄连根际土壤组,编号DJT;2)大道角村根腐病黄连根际土壤组,编号DBT;3)大道角村健康黄连根茎组,编号DJG;4)大道角村根腐病黄连根茎组,编号DBG;5)大道角村健康黄连叶片组,编号DJY;6)大道角村根腐病黃连叶片组,编号DBY;7)板厂坪村健康黄连根际土壤组,编号BJT;8)板厂坪村根腐病黄连根际土壤组,编号BBT;9)板厂坪村健康黄连根茎组,编号BJG; 10)板厂坪村根腐病黄连根茎组,编号BBG;11)板厂坪村健康黄连叶片组,编号BJY;12)板 厂坪村根腐病黄连叶片组,编号BBY。分别在同一垄的5个不同位置取样混合均匀为一个样品,取地下5~10 cm左右的根际土壤,根茎样品和叶片样品在取样之后立即用75%乙醇进行表面消毒,每组样品分别在不同位置采集3个样品为试验重复。样品装入无菌50 mL离心管中,低温运输至实验室,在4℃条件下储藏备用。
1.2土壤养分检测
速效氮测定采用凯氏定氮仪法[10],速效磷测定采用Bray法[11],速效钾测定采用醋酸铵 原子吸收光谱仪法[12],pH测定采用点位法[13],全氮采用凯氏法[14],全磷采用碱熔法[15],全钾采用火焰原子吸收法[16]。
1.3样品总DNA提取和PCR扩增
采用PowerSoil DNA Isolation Kit(MOBIO,美国)提取根际土壤样品微生物总DNA。 根茎和叶片剪碎液氮处理磨碎后,采用PowerSoil DNA Isolation Kit提取总DNA。同时采用Nanodrop对DNA进行定量,并通过1.2%琼脂糖凝胶电泳检测DNA质量。采用通用引物338 F(5′ACTCCTACGGGAGGCAGCA3′)和806 R(5′GGACTACHVGGGTWTCTAAT3′)对16S rDNA的V3~V4区进行PCR扩增。PCR扩增采用全式金公司的Pfu高保真DNA聚合酶,并严格控制扩增循环数,使循环数尽可能低的同时,也保证同一批样本的扩增条件一致。PCR产物采用Vazyme VAHTSTM DNA Clean Beads试剂盒进行磁珠纯化回收。
1.4文库制备与上机测序
采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库。构建好的文库经检测合格后,使用 Illumina Miseq 平台测序,委托上海派森诺生物科技股份有限公司完成。
1.5测序数据处理和OTU聚类分析
采用 Illumina MiSeq 平台对群落DNA片段进行双端(pairedend)测序,运用 QIIME软件(Quantitative Insights Into Microbial Ecology,v1.8.0,http:∥qiime.org/)识别疑问序列, 采用USEARCH(v5.2.236,http:∥www.drive5.com/usearch/)检查并剔除嵌合体序列,获得每个样品的有效序列。采用 UCLUST 序列比对工具对前述获得的序列按97%的序列一致性进行归并和 OTU(operational taxonomic unit)划分,并选取每个 OTU 中丰度最高的序列作为该 OTU 的代表序列。将丰度值低于全体样本测序总量 0.001%(十万分之一)的 OTU 去除,并将去除了稀有OTU 的丰度矩阵用于后续的一系列分析。
1.6菌群组成及差异分析
使用 QIIME 软件和 R 软件,获取每个样本在门和属水平的物种组成和丰度分布情况,并绘制成柱状图。根据所有样本在属水平的物种组成及丰度信息,选取丰度排名前50 的属,根据其在每个样本中的丰度信息,从物种和样本2个层面进行聚类,采用 R 软件制作热图。通过 R 软件,对属水平的群落组成结构进行主成分分析(PCA),并且以二维图像描述样本间的自然分布特征。使用 Mothur 软件,调用 Metastats的统计学算法,对门和属水平的各个分类单元在組之间的序列量(即绝对丰度)差异进行两两比较检验。
1.7不同样品细菌组成的NMDS分析
非量度多维尺度分析(NMDS)是通过对样本距离矩阵作降维分解,简化数据结构,从而在特定距离尺度下描述样本的分布特征。与PCA分析不同,NMDS分析不依赖于特征根和特征向量的计算,而是通过对样本距离进行等级排序,使样本在低维空间中的排序尽可能符合彼此之间的相似距离的远近关系(而非确切的距离数值)。因此,NMDS分析不受样本相似距离数值的影响,仅考虑彼此之间的大小关系,对于结构复杂的数据,排序结果可能更稳定。NMDS是距离值的秩次(数据排名)信息的评估,图形上样本信息仅反映样本间数据秩次信息的远近,而不反映真实的数值差异,横纵坐标轴并无权重意义,横轴不一定比纵轴更加重要。NMDS整体降维效果由 (Stress)进行判断。NMDS结果的应力值越小越好,一般认为当该值小于0.2时,NMDS分析的结果较可靠。
1.8细菌多样性和群落结构与环境因子的关系分析
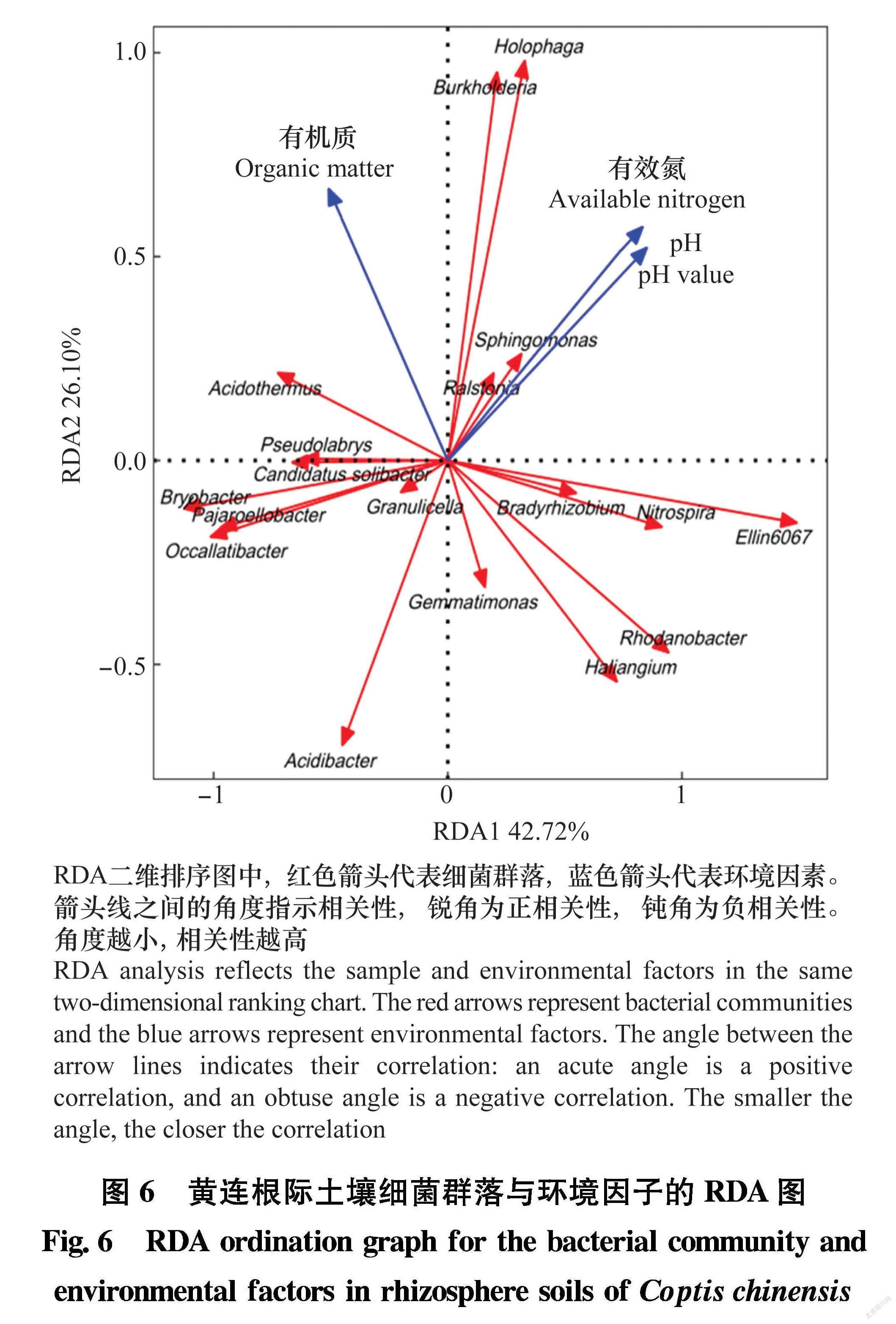
细菌群落结构和环境因子的关联性采用R软件包进行冗余分析(redundancy analysis, RDA)。RDA分析是将样本和环境因子反映在同一个二维排序图上,箭头连线之间的夹角表示相关性,锐角为正相关,钝角为负相关。夹角越小,相关性越高。
1.9数据统计与分析
采用Excel 2019和Prism 6.0对数据进行统计分析和差异显著性检验(ttest, P<0.05)。
2结果与分析
2.1健康黄连和根腐病黄连根际土壤养分变化
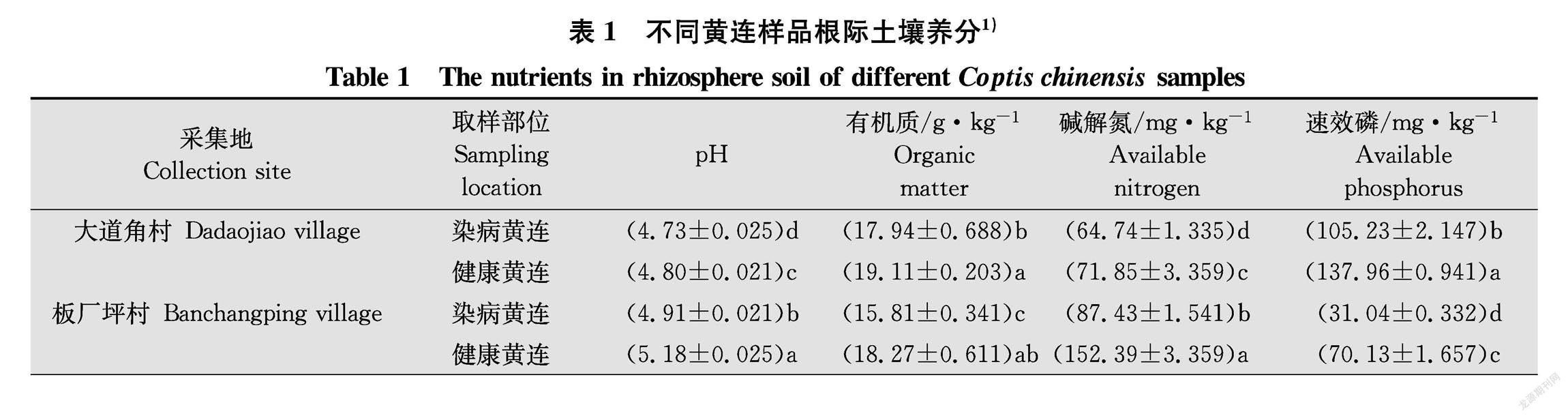
如表1所示,2个不同地点健康黄连根际土壤pH显著高于根腐病黄连根际土壤(P <0.05),此外,健康黄连根际土壤有机质、碱解氮、速效磷、全磷、全氮均显著高于根腐病黄连根际土壤(P<0.05)。但是速效钾和全钾含量在2个不同地点表现不一致,在大道角村样品中根腐病黄连根际土壤速效钾含量显著高于健康黄连根际土壤(P<0.05),全钾含量没有显著差异。板厂坪村样品中根腐病黄连根际土壤速效钾含量和全钾含量均显著低于健康黄连根际土壤(P<0.05)。这表明土壤pH、有机质、碱解氮、速效磷、全磷、全氮含量可能与黄连根腐病发生有一定联系。
2.2健康黄连和根腐病黄连根际土壤、根茎、叶片样品的α多样性分析
对健康黄连和根腐病黄连根际土壤、根茎、叶片样品采用Illumina MiSeq平台进行高通量测序,去噪后用于后续分析的有效序列共6 082 093条,各样品序列信息详见表2。
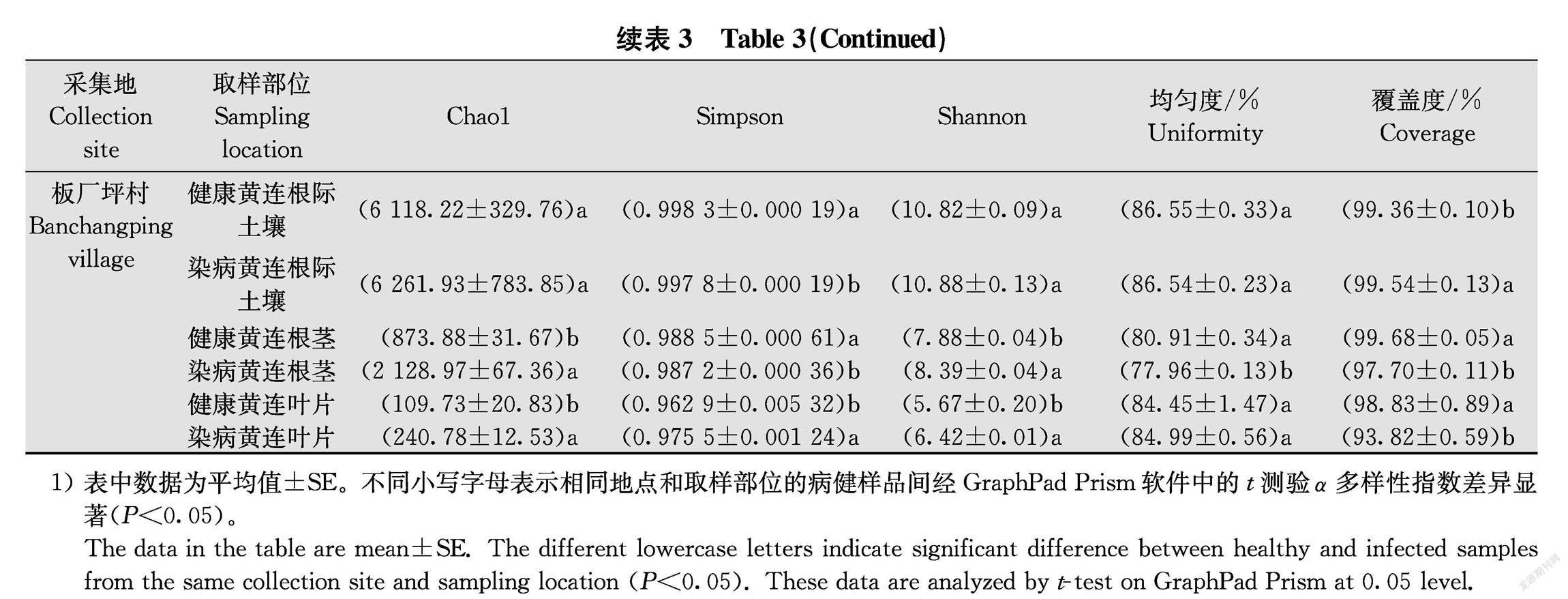
对所有样品细菌α多样性指数进行分析表明,根腐病黄连根际土壤、根茎、叶片样品的丰富度指数(observedspecies, Chao1)普遍高于对应的健康黄连样品,仅根际土壤样品无显著差异,这表明根腐病黄连根茎、叶片样品的丰富度高于对应的健康黄连样品。从种群多样性指数(Shannon和Simpson)的差异可以看出,根腐病黄连根际土壤、根茎、叶片样品与对应的健康黄连样品细菌种群多样性指数差异并不明显,有病样高于健康样品,也有健康样品高于根腐病样,多数没有显著差异(表3)。总体上看,根际土壤样品种群丰富度和多样性大于根茎样品,根茎样品种群丰富度和多样性大于叶片样品。
2.3测序深度和OTU聚类分析
测序结果经稀释曲线(rarefaction curve)检查显示合理,12组共36个样品测序结果中包含了大多数细菌类群,测序深度覆盖了试验样品中所有测序对象,基本可以反映样品中绝大多数的细菌多样性信息。从花瓣图可以看出,黄连根际土壤细菌群落丰富度最高,均在800~1 000个OTUs,其次是根茎样品,约有300~600个OTUs,黄连叶片样品细菌群落丰富度最低,均在100~300个OTUs(图1)。此外,12组样品共有的OTU只有4个,这说明各个样品间细菌群落组成相差较大。
2.4不同样品的细菌物种组成
如图2所示,根际土壤、根茎和叶片样品细菌组成在门水平上的丰富度差异较大, 根际土壤样品相对丰度前5的菌群依次为变形菌门Proteobacteria(27.94%~48.43%)、酸杆菌门Acidobacteria(11.45%~26.78%)、放线菌门Actinobacteria(8.08%~13.17%)、绿弯菌门Chloroflexi(4.14%~16.52%)、 拟杆菌门Bacteroidetes(4.44%~7.71%);根茎样品相对丰度前5的菌群依次为变形菌门(62.66%~74.18%)、放线菌门(10.43%~18.47%)、拟杆菌门(4.20%~9.90%)、酸杆菌门(1.75%~3.05%)、绿弯菌门(0.26%~1.29%);叶片样品相对丰度前5的菌群依次为变形菌门(64.15%~88.05%)、放线菌门(0.73%~21.12%)、拟杆菌门(6.49%~21.12%)、绿弯菌门(0.26%~1.29%)、厚壁菌门Firmicutes(0.23%~7.02%)。相同地点相同部位根腐病和健康黄连样品相比较,细菌菌群组成差异不明显,但各菌门相对丰度差异明显,如大道角村根腐病黄连根际土壤样品较健康黄连根际土壤样品变形菌门丰度显著上升,酸杆菌门和绿弯菌门丰度显著下降(P<0.05)。
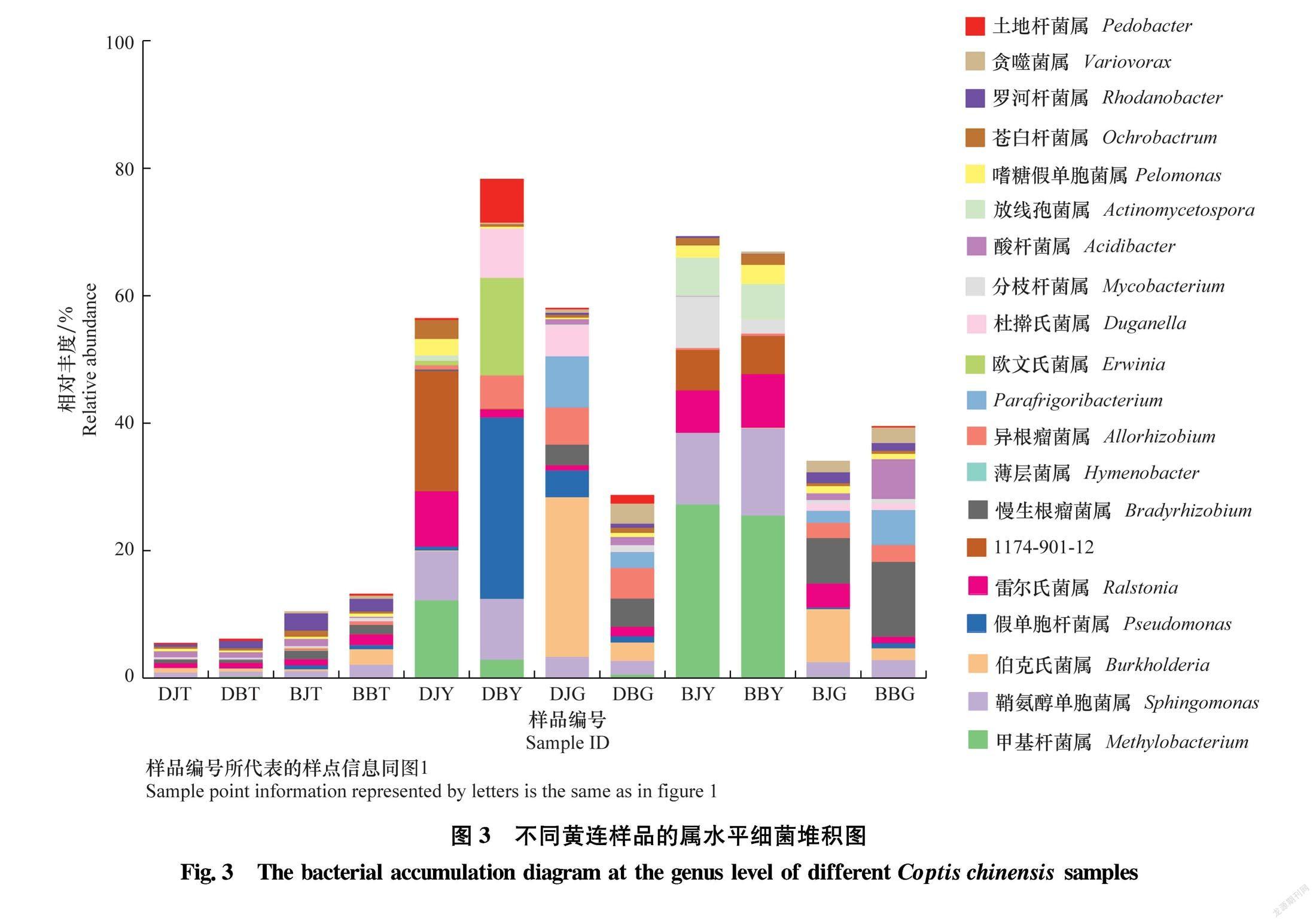
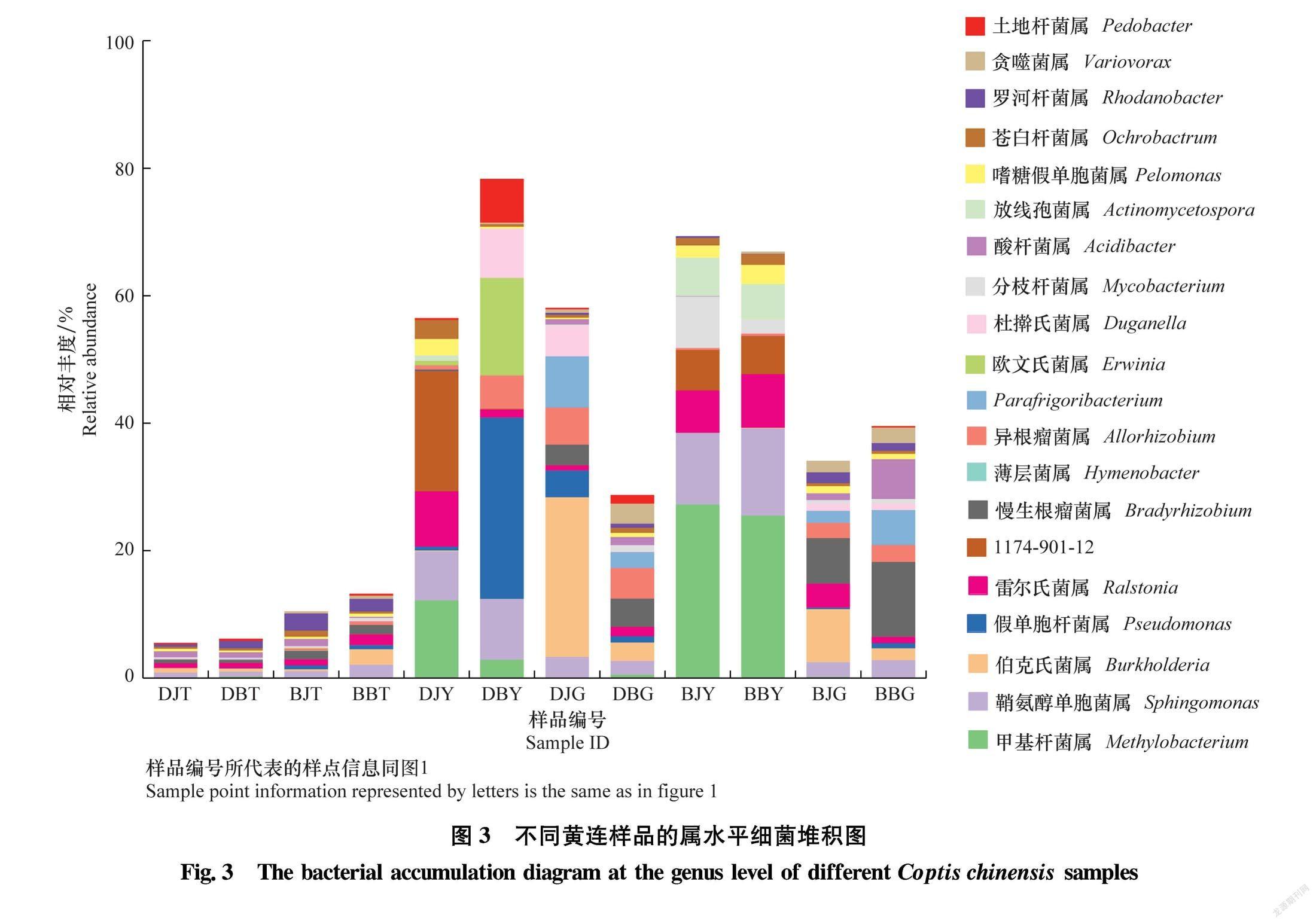
为了更直观地展示所有根腐病和健康黄连样品细菌群落结构的差异,根据所有样品在属水平上细菌群落结构差异,绘制了相对丰度前20属的相对丰度堆积图。如图3所示,各样品属水平细菌组成差异较大,其中土壤样品细菌多样性更丰富,前20属细菌相对丰度仅占10%左右。其次为黄连根茎样品,前20属细菌相对丰度占40%左右。黄连叶片样品细菌多样性最差,前20属细菌相对丰度占70%左右。土壤样品、根茎样品和叶片样品之间细菌组成差异明显,而土壤样品、根茎样品和叶片样品内部差异较小。黄连根际土壤样品细菌组成复杂多样,相对丰度较高的属为全噬菌属Holophaga、嗜酸栖热菌属Acidothermus、Pseudolabrys和鞘氨醇单胞菌属Sphingomonas等。黄连叶片样品细菌组成最简单,相对丰度较高的属为甲基杆菌属 Methylobacterium、鞘氨醇单胞菌属、雷尔氏菌属Ralstonia和薄层菌属Hymenobacter等。黄连根茎样品细菌组成与叶片样品比较相似,相对丰度较高的属为鞘氨醇单胞菌属、伯克氏菌属Burkholderia、慢生根瘤菌属Bradyrhizobium和异根瘤菌属Allorhizobium。
2.5不同样品细菌组成差异性及与根腐病发生关联性分析
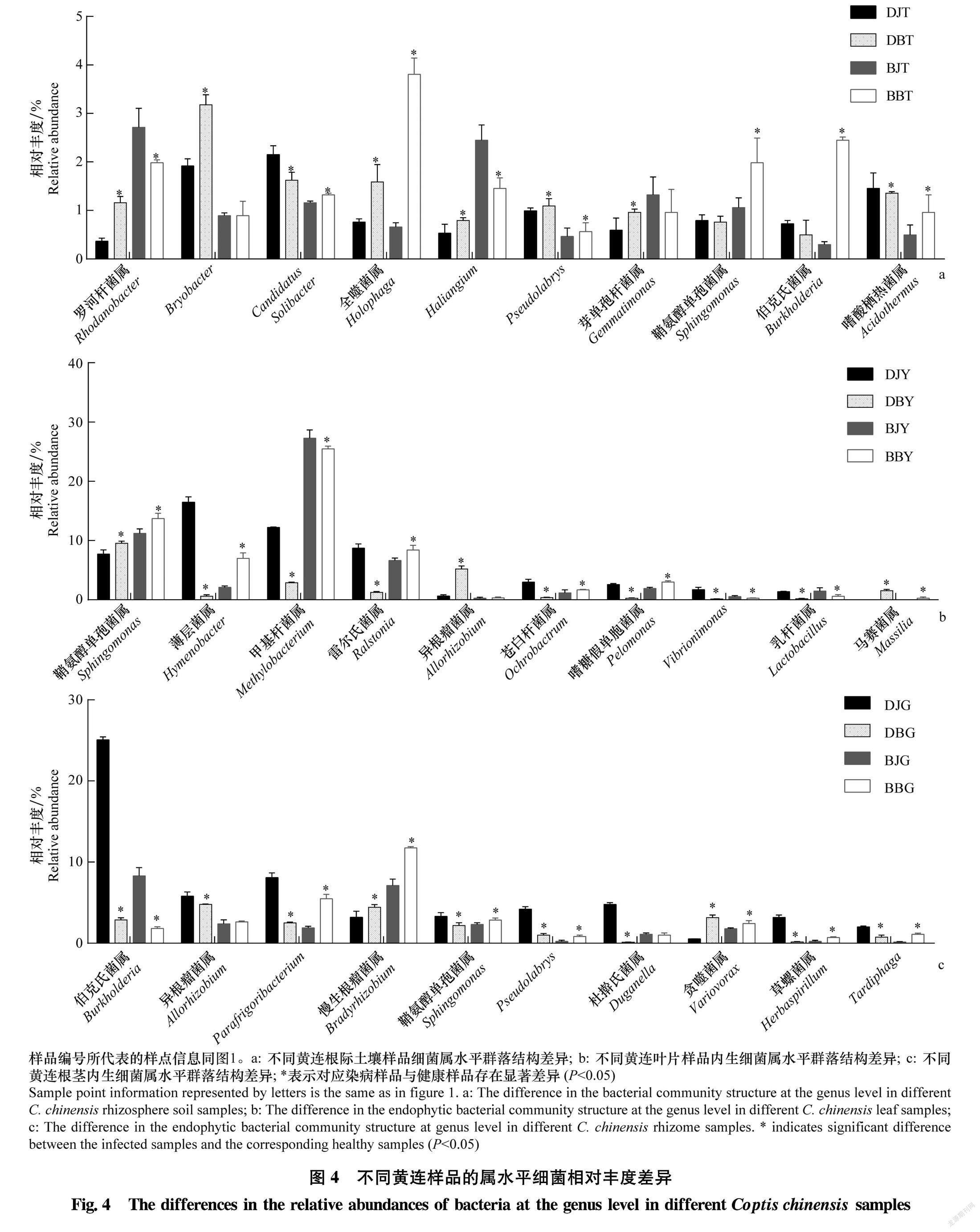
为进一步分析各细菌群落与黄连根腐病发生的关系,选取相对丰度前10的细菌群落分析各处理间细菌群落的差异与黄连根腐病发生的关联。如图4 所示,健康黄连样品与染病黄连样品的部分细菌菌群相对丰度差异明显。在两个不同地点根际土壤样品中,全噬菌属和Pseudolabrys的相对丰度均为染病黄连根际土壤样品高于健康黄连根际土壤样品(图4a);在两个不同地点黄连叶片样品中,Vibrionimonas和乳桿菌属Lactobacillus的相对丰度均为染病黄连叶片样品低于健康黄连叶片样品,鞘氨醇单胞菌属的相对丰度均为染病黄连叶片样品高于健康黄连叶片样品(图4b);在两个不同地点黄连根茎样品中,伯克氏菌属的相对丰度均为染病黄连根茎样品低于健康黄连根茎样品,慢生根瘤菌属和贪噬菌属Variovorax的相对丰度均为染病黄连根茎样品高于健康黄连根茎样品(图4c)。而其他菌属在两地不同样品中的差异不一致。两组样品染病组症状相同,因此推测在大道角村和板厂坪村健康黄连根际土壤样品和染病黄连根际土壤样品中相对丰度变化趋势相同的菌群更有可能与黄连根腐病发生有一定关联。
2.6不同样品细菌组成的NMDS分析
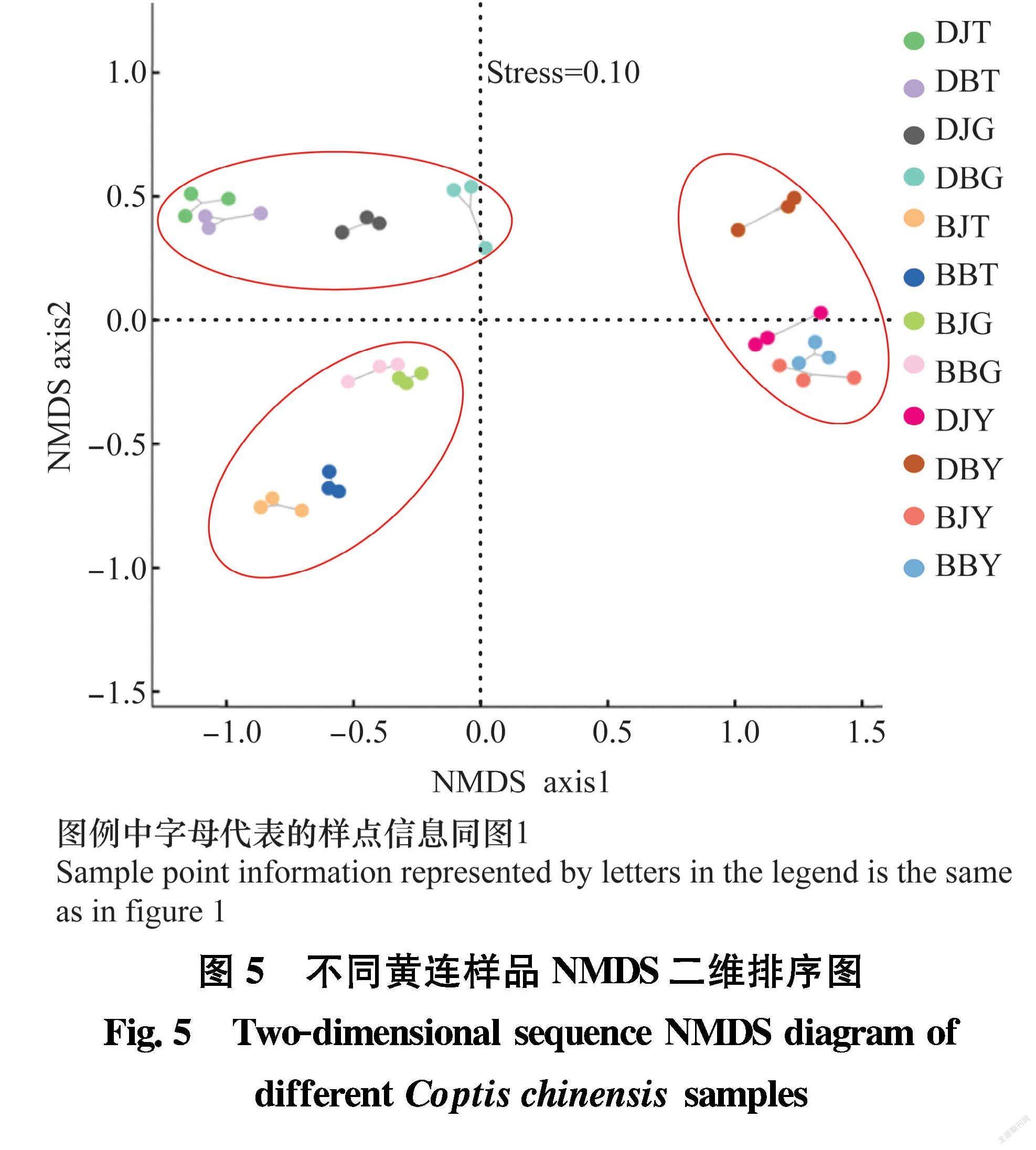
如图5所示, 总体上看所有样品大致聚集于3个区域,分别为大道角的根际土壤和根茎样品、板厂坪的根际土壤和根茎样品、两地的黄连叶片样品。两地黄连根际土壤和根茎样品分布较为集中,而与叶片样品距离较远,说明黄连根际土壤样品细菌群落与根茎样品细菌群落亲缘关系较近,根茎样品细菌群落中部分菌群可能直接来源于根际土壤。相同地点相同部位不同染病状态的样品区分不明显,而不同采样地点的样品区分明显,这表明地域因素对黄连细菌群落组成影响较大,是影响黄连各样品细菌群落组成的主要因素。而是否染病对样品细菌群落组成的影响相对较小。
2.7细菌多样性和群落结构与环境因子的关系
利用RDA分析不同地点健康黄连和染病黄连根际土壤细菌主要差异菌群与土壤环境因子之间的关系,结果如图6所示,黄连根际土壤中土壤有效氮和pH与伯克氏菌属Burkholderia、全噬菌属Holophaga、雷尔氏菌属Ralstonia和鞘氨醇单胞菌属Sphingomonas显著正相关。黄连根际土壤中有机质含量与嗜酸栖热菌属Acidothermus显著相关。
3讨论
黄连根际土壤样品中细菌群落主要为变形菌门、酸杆菌门、放线菌门和绿弯菌门,这一结果与前人关于土壤细菌群落结构的测序分析结果相同[17-18]。但与宋旭红等[19]所测石柱县黄连根际土壤微生物结果不尽相同,这可能是因为采样地点的差异造成的。微生物种群的丰富度和多样性在土壤质量、 功能和土壤生态系统的可持续发展中发挥着重要作用[20]。在一定程度上,土壤微生物群落结构的变化可以反映出土壤质量的变化。有研究表明,土壤微生物种群丰富度和多样性的降低可能与连作障碍[21]和植株抗病能力[18]有一定关系。本研究中,健康黄连根际土壤样品与感染根腐病黄连土壤样品细菌群落多样性并没有显著差异,但健康黄连根际土壤样品与感染根腐病黄连土壤样品的部分菌群的相对丰度存在明显差异。在门水平上,酸杆菌门和绿弯菌门在健康黄连根际土壤样品中相对丰度显著高于感染根腐病黄连土壤样品,变形菌门和拟杆菌门在健康黄连根际土壤样品中相对丰度显著低于感染根腐病黄连土壤样品。
从黄连根标土壤、根茎和叶片样品中相对丰度前10的属来看,全噬菌属、慢生根瘤菌属和贪噬菌属等的相对丰度与黄连根腐病的发生呈正相关。Vibrionimonas、乳杆菌属和伯克氏菌属等的相对丰度与黄连根腐病的发生呈负相关。鞘氨醇单胞菌属能提高植物抗逆性,常被视作植物益生菌[22]。在染病黄连叶片样品中鞘氨醇单胞菌属相对丰度高于健康黄连叶片样品,这可能是因为染病的逆环境因素刺激了其在叶片中的积累。这也提示我们,后续研究黄连根腐病生防菌筛选工作时,不仅要关注和黄连根腐病的发生呈负相关的相关菌群,也要重点关注部分染病样品中丰度较高的有益菌群。谢学文等就从番茄根际土壤中筛选出番茄疫霉 Phytophthora capsici Leonian的拮抗菌[23]。此外,α多样性分析表明相同地点相同部位健康样品和染病样品之间菌群结构差异表现为根茎样品和叶片样品差异大于根际土壤样品差异。相关菌群可能通过分泌物促使植物发病,也可能通过降解土壤中有机质,产生某种抑制病原生长的物质,从而减缓病害的发生[24]。此外,测序发现黄连根茎样品和叶片样品中细菌群落丰富度和多样性显著低于黄连根际土壤样品。这可能是由于黄连内部某些物质具有一定抑菌作用,因为黄连本身就有解毒抗菌的作用。李阳波等研究发现黄连根须浸提液对细菌有一定抑制作用[25],这应该也是相同原理。在分析染病根际土壤养分时发现,染病黄连根际土壤样品有机质、碱解氮、速效磷、全磷、全氮均显著高于健康黄连根际土壤。同时我们在调查过程中发现,农户在种植过程中大量使用化肥,这可能也是黄连根腐病严重的一个重要原因。在分析根茎样品细菌群落结构时发现,慢生根瘤菌属和异根瘤菌属相对丰度很高。 慢生根瘤菌属和异根瘤菌属能与植物互利共生通过生物固氮为植物提供养分[26]。在大豆等豆科植物中根瘤菌能寄生植物形成根瘤,在黄连种植过程中也发现在须根上有类似根瘤的存在。这是首次有关黄连根瘤菌的报道,当然慢生根瘤菌属和异根瘤菌属是否发挥固氮作用需要进一步研究。
此外,本研究仅分析了染病后黄连根际土壤、根茎和叶片样本中细菌群落结构的变化,对于染病样本真菌群落结构的变化需要进一步研究。宋旭红等[19]研究发现黄连根腐病植株土壤中子囊菌门、担子菌门和壶菌门相对丰度显著高于健康黄连植株,而接合菌门、囊球菌门的相对丰度显著低于健康黄连植株。丹参红叶病病株根区土细菌数量较健株减少41.3%,真菌和放线菌数量分别较健株增156.6%和189.5%[27]。也有研究表明真菌与豆科植物根部病害的发生关系密切,是潜在的土壤生物指示因子[28]。这些都说明根际土壤和植物体内真菌和细菌都与植物病害的发生有一定关系。
总之,本研究通过对两个不同地点黄连根际土壤、根茎、叶片样品细菌群落结构多样性分析表明:在细菌多样性上,黄连根际土壤样品>根茎样品>叶片样品。在所有样品中,主要的优势菌门为变形菌门、放线菌门、拟杆菌门和绿弯菌门。相较于健康黄连组样品,染病黄连根际土壤、根茎和叶片样品中多个菌属细菌相对丰度发生显著改变,如Vibrionimonas、乳杆菌属和鞘氨醇单胞菌属等可能与黄连根腐病的发生有一定关联。此外,RDA分析表明,伯克氏菌属、全噬菌属和雷尔氏菌属与黄连根际土壤有机质、有效氮、pH有显著相关性。这些都为黄连根腐病防治提供了理论依据,同时也为黄连根腐病生物防治等提供了研究基础。
参考文献
[1]马伯艳, 李寒, 李云凤, 等. 黄连及其有效成分降糖作用的研究进展及量效关系[J]. 中成药, 2019, 41(12): 2970- 2973.
[2]馬国琴, 刘东玲. 黄连药理研究进展[J]. 甘肃农业, 2019(10): 97- 99.
[3]黄浪浪, 王建安, 徐驲, 等. 基于网络药理学的黄连解毒汤治疗新型冠状病毒肺炎机制研究[J]. 中药材, 2020, 43(3): 779 -785.
[4]唐春梓, 刘海华, 廖朝林, 等. 湖北恩施地道药材黄连的发展历史与开发前景[J]. 宁夏农林科技, 2011, 52(12): 191- 192.
[5]伍晓丽, 王钰, 刘飞, 等. 黄连根腐病镰刀菌属病原真菌鉴定[J]. 中国中药杂志, 2020, 45(6): 1323-1328.
[6]余妙, 蒋景龙, 任绪明, 等. 西洋参根腐病发生与根际真菌群落变化关系研究[J]. 中国中药杂志, 2018, 43(10): 2038-2047.
[7]张淑婷, 周利华, 赵文卓. 植物内生细菌对植物健康的作用[J]. 植物医生, 2020, 33(1): 6 -11.
[8]刘海洋, 王伟, 张仁福, 等. 黄萎病不同发生程度棉田土壤中的真菌群落特征分析[J]. 中国农业科学, 2019, 52(3): 455- 465.
[9]罗路云, 张卓, 金德才, 等. 南瓜白粉病不同病情等级下叶际细菌群落结构和多样性[J]. 植物病理学报, 2017, 47(5): 688- 695.
[10] 莎娜, 张三粉, 骆洪, 等. 两种土壤碱解氮测定方法的比较[J]. 内蒙古农业科技, 2014(6): 25 -26.
[11] 宋涛, 朴世领, 陈旸, 等. 苹果梨园土壤pH和有效磷的变化[J]. 延边大学农学学报, 2018, 40(3): 9 -15.
[12] 安家琦, 范鹏志, 张钰, 等. 用原子吸收分光光度计测定土壤速效钾含量[J]. 农业工程技术, 2020, 40(11): 46 -47.
[13] 王瑞琨. 用电位法测定土壤pH值[J]. 山西化工, 2018, 38(3): 64 -65.
[14] 刘燕. 《土壤质量 全氮的测定 凯氏法》的方法改进[J]. 化工管理, 2020(14): 45-46.
[15] 郭鑫, 陈魏, 张及亮, 等. 土壤磷含量的测定方法[J]. 检验检疫学刊, 2019, 29(2): 108-110.
[16] 朱波, 倪俊, 高丽, 等. 土壤全磷全钾同时测定方法研究[J]. 安徽农业科学, 2018, 46(15): 110-111.
[17] HUANG Junsheng, HU Bin, QI Kainin, et al. Effects of phosphorus addition on soil microbial biomass and community composition in a subalpine spruce plantation [J]. European Journal of Soil Biology, 2016, 72: 35-41.
[18] TAN Yong, CUI Yinshan, LI Haoyu, et al. Rhizospheric soil and root endogenous fungal diversity and composition in response to continuous Panax notoginseng cropping practices [J]. Microbiological Research, 2017, 194: 10-19.
[19] 宋旭红, 王钰, 李隆云, 等. 石柱黄连根腐病根际土壤细菌微生态研究[J]. 中国中药杂志, 2017, 42(7): 1304-1311.
[20] KENNEDY A C, SMITH K L. Soil microbial diversity and the sustainability of agricultural soils [J]. Plant Soil, 1995, 170(1): 75-86.
[21] WU Xiong, LI Zhigang, LIU Hongjun, et al. The effective of longterm continuous cropping of black pepper on soil bacterial communities as determined by 454 pyrosequencing [J/OL]. PLoS ONE, 2015, 10(8): e0136946. DOI: 10.1371/journal.pone.0136946.
[22] 缪作清, 李世东, 刘杏忠, 等. 三七根腐病病原研究[J]. 中国农业科学, 2006, 39(7): 1371-1378.
[23] 谢学文, 赵昱榕, 孙雪莹, 等. 番茄疫霉根腐病生防菌的分离鉴定及其防治效果[J].植物病理学报, 2020, 50(5): 610-617.
[24] 朱菲莹, 张屹, 肖姬玲, 等. 生物有机肥对土壤微生物群落结构变化及西瓜枯萎病的调控[J]. 微生物学报, 2019, 59(12): 2323-2333.
[25] 李阳波, 何林卫, 张薇, 等. 黄连须根浸提液对土壤微生物及酶活性的影响[J]. 中国中药杂志, 2014, 39(11): 4205-4210.
[26] FERNANDO S G, EDSON C S, PAULO H P, et al. Nitrogen recovery from fertilizer and use efficiency response to Bradyrhizobium sp. and Azospirillum brasilense combined with N rates in cowpeawheat crop sequence [J/OL]. Applied Soil Ecology, 2021, 157: 103764. DOI: 10.1016/j.apsoil.2020.103764.
[27] 段佳丽, 舒志明, 薛泉宏, 等. 丹参红叶病发生的微生态机制[J].应用生态学报, 2013, 24(7): 1991-1999.
[28] 陆晓菊, 官会林, 张正芸, 等.三七连作根际土壤微生物区系的16S rRNA系统遗传多样性[J]. 微生物学报, 2015, 55(2): 205-213.
收稿日期:2020-12-06修订日期:2021-01-04
基金项目:
农业农村部华中作物有害生物综合防治重点实验室/农作物重大病虫草害防控湖北省重点实验室开放基金(2020ZTSJJ6);湖北省农业科技創新中心项目(2020-620-003-001);恩施州研发计划(D20190015);湖北省农业科学院中药材研究所青年基金(2020ZYCJJ03)
* 通信作者
Email:jingmaoyou@126.com

