新高考化学题对平衡常数的考查
孟凡盛


化学平衡常数(K)是重要的物理量,常见的平衡常数有浓度平衡常数(Kc)、分压平衡常数(Kp)、电离平衡常数(Ka或Kb)、水解平衡常数(Kh)等。新高考化学题对平衡常数的全面考查,能很好地评价考生“变化观念与平衡思想”核心素养的发展状况和学业质量。2021年新高考湖北卷在选择题和非选择题中对多种平衡常数进行了全面的考查,希望能引起2022届高考生的重视。
一、利用新颖坐标图像考查电离平衡常数的计算
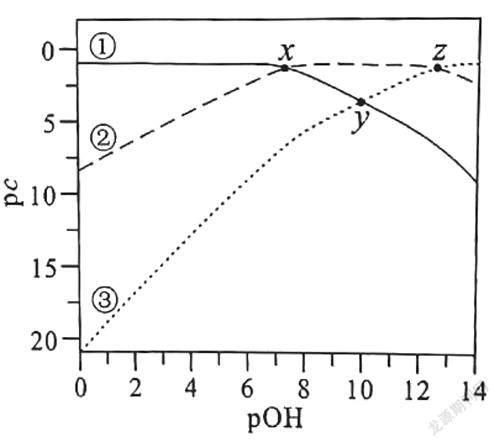
【例1】(2021年湖北卷第14题)常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1 mol/L,溶液中各含磷物种的pc-pOH关系如图1所示。图中pc表示各含磷物种的浓度负对数(pc=-lg c),pOH表示OH-的浓度负对数[pOH=-lg c(OH-)],x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是( )
A.曲线①表示pc(H3PO3)随pOH的变化
B. H3PO3的结构简式为
C. pH=4的溶液中:c(H2PO3-)<0.1 mol/L-2c(HPO32-)
D. H3PO3+HPO32-2H2PO3-的平衡常数K>1.0×105
【解析】本题考查考生快速准确获取图像中隐藏化学信息的能力。图像中含磷物种只有3种,说明H3PO3为二元弱酸。随着c(OH-)逐渐增大,pOH减小,根据H3PO3+OH-= H2PO3-+H2O、H2PO3-+OH-=HPO32-+H2O 知,c(H3PO3)逐渐减小,c(H2PO3-)先增大后减小,c(HPO32-)逐渐增大,pc=-lg c,则pc(H3PO3)逐渐增大,pc(H2PO3-)先减小后增大,pc(HPO32-)逐渐减小,故曲线③表示pc(H3PO3),曲线②表示pc(H2 PO3-),曲线①表示pc(HPO32-);x点的c(HPO32-)=c(H2PO3-),pOH=7.3,pH=14-7.3= 6.7,c(H+)=10-6.7mol/L,则H3PO3的Ka2== c(H+)=10-6.7;z点的c(H3PO3)=c(H2PO3-),pOH=12.6,pH=14-12.6=1.4,c(H+)=10-1.4mol/L,则H3PO3的Ka1== c(H+)=10-1.4。
隨着c(OH-)逐渐增大,c(H3PO3)逐渐减小,因此曲线③表示pc(H3PO3)随pOH的变化,故A错误。H3PO3是二元酸,结构中含有两个羟基:,故B错误。pH=4时溶液的pOH=10,此时c(HPO32-)=c(H3PO3),根据题干中“H3PO3溶液中含磷物种的浓度之和为0.1 mol/L”可得c(H2PO3-)+c(HPO32-)+c(H3PO3)=0.1 mol/L,整理这两个等式得到c(H2PO3-)=0.1 mol/L-2c(HPO32-),故C错误。将H3PO3的第一步电离方程式减去第二步电离方程式得到H3PO3+HPO32-2H2PO3-,则平衡常数K===105.3>1×105,故D正确。
【答案】D
二、利用多重平衡规则探究难溶电解质能否溶解
【例2】(2021年湖北卷第16题)废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成物质为CuIn0.5Ga0.5Se2。某探究小组回收处理流程如图2所示,回答下列问题:
(1)硒(Se)与硫为同族元素,Se的最外层电子数为 ;镓(Ga)和铟(In)位于元素周期表ⅢA族,CuIn0.5Ga0.5Se2中Cu的化合价为 。
(2)“酸浸氧化”发生的主要氧化还原反应的化学方程式为 。
(3)25℃时,已知Kb(NH3·H2O)≈2.0×10-5,Ksp[Ga(OH)3]≈ 1.0×10-35,Ksp[In(OH)3]≈1.0×10-33,Ksp[Cu(OH)2]≈1.0×10-20,“浸出液”中c(Cu2+)=0.01 mol·L-1。当金属阳离子浓度小于1.0×10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为 (保留一位小数);若继续加入6.0 mol·L-1氨水至过量,观察到的实验现象是先有蓝色沉淀,然后 ;为探究Ga(OH)3在氨水中能否溶解,计算反应Ga(OH)3+NH3·H2O[Ga(OH)4]-+NH4+的平衡常数K= 。(已知:Ga3++4OH-[Ga(OH)4]- K′=≈1.0×1034)
(4)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中SO42-是否洗净的试剂是 ;“回流过滤”中SOCl2的作用是将氢氧化物转化为氯化物和 。
(5)“高温气相沉积”过程中发生的化学反应方程式为 。
【解析】(1)硒(Se)与硫同为ⅥA族元素,最外层有6个电子,在该化合物中Se为-2价;Ga和In为ⅢA族元素,在化合物中为+3价,根据化合物中正负化合价代数和为0,设CuIn0.5Ga0.5Se2中Cu的化合价为x,则x+3×0.5+3×0.5-2×2=0,解得x=+1。
(2)CuIn0.5Ga0.5Se2与空气高温焙烧时生成更稳定的Cu2O(高温时氧化铜会分解为氧化亚铜),故酸浸氧化时发生的主要氧化还原反应为:Cu2O+H2O2+2H2SO4=2CuSO4+3H2O
(3)当In3+恰好完全沉淀时,即c(In3+)=1×10-5mol/L,根据Ksp[In(OH)3],计算得c(OH-)=mol/L=1×
mol/L,c(H+)=≈1×10-4.7mol/L,pH=4.7;继续加入6 mol/L的氨水与Cu2+反应,先生成Cu(OH)2蓝色沉淀,氨水过量,Cu(OH)2蓝色沉淀溶解生成深蓝色的[Cu(NH3)4]2+。
反应① Ga(OH)3Ga3++3OH- Ksp[Ga(OH)3]
反应② NH3·H2ONH4++OH- Kb(NH3·H2O)
反应③ Ga3++4OH-[Ga(OH)4]- K′
“①+②+③”得到目标反应:Ga(OH)3+NH3·H2O [Ga(OH)4]-+NH4+,根据多重平衡规则,目标反应的平衡常数K=Ksp[Ga(OH)3]×Kb(NH3·H2O)×K′=2.0×10-6。
(4)检验滤渣中的SO42-是否洗净,可加入盐酸和BaCl2溶液;得到的滤渣是In(OH)3和Ga(OH)3的混合物,加入SOCl2后它们分别转化为难溶的InCl3和易溶的GaCl3,难溶的InCl3作为滤渣被分离,易溶的GaCl3留在滤液中,所以SOCl2的另一作用为溶解GaCl3利于与InCl3分离(或作溶剂)。
(5)高温气相沉积时GaCl3和NH3反应生成GaN和HCl,化学方程式为GaCl3+NH3GaN+3HCl。
【答案】(1)6 +1 (2)Cu2O+H2O2+2H2SO4=2CuSO4+ 3H2O (3)4.7 蓝色沉淀溶解,溶液变为深蓝色 2.0×10-6 (4)盐酸和氯化钡溶液 作溶剂(或溶解GaCl3,利于与InCl3分离) (5)GaCl3+NH3GaN+3HCl
【提醒】多重平衡规则是指如果某一可逆反应可以由几个可逆反应相加(或相减)得到,则该可逆反应的平衡常数等于几个可逆反应的平衡常数的乘积(或商),同学们在复习时要熟练掌握利用多重平衡规则计算可逆反应的平衡常数。
三、利用科研探索情景考查分压平衡常数的计算
【例3】(2021年湖北卷第19题)丙烯是一种重要的化工原料,可以在催化剂作用下由丙烷直接脱氢或氧化脱氢制备。
反应Ⅰ(直接脱氢):C3H8(g)=C3H6(g)+H2(g) ΔH1= +125 kJ·mol-1
反应Ⅱ(氧化脱氢):C3H8(g)+O2(g)=C3H6(g)+ H2O(g) ΔH2=-118 kJ·mol-1
(1)已知键能:E(C—H)=416 kJ·mol-1,E(H—H)= 436 kJ·mol-1,由此计算生成1 mol碳碳π键放出的能量为
kJ。
(2)对于反应Ⅰ,总压恒定为100 kPa,在密闭容器中通入C3H8和N2的混合气体(N2不参与反应),从平衡移动的角度判断,达到平衡后通入N2的作用是 ;在温度为T1时,C3H8的平衡常数Kp= kPa(以分压表示,分压=总压×物质的量分数,保留一位小数)。
(3)在温度为T2时,通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=10∶5∶85的混合气体,各组分气体的分压随时间的变化关系如图3(b)所示。0~1.2 s生成C3H6的平均速率为 kPa·s-1;在反应一段时间后,C3H8和O2的消耗速率比小于2∶1的原因是 。
(4)恒温刚性密闭容器中通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=2∶13∶85的混合氣体,已知某反应条件下只能发生如下反应(k,k′为速率常数)。
反应Ⅲ:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g)k
反应Ⅳ:2C3H6(g)+9O2(g)=6CO2(g)+6H2O(g) k′
实验测得丙烯的净生成速率方程为v(C3H6)=kp(C3H8)- k′p(C3H6),可推测丙烯的浓度随时间变化的趋势为 ,其理由是 。
【解析】(1)由反应Ⅰ知,反应断裂2mol C—H键,形成1 mol碳碳π键和1 mol H—H键,416 kJ·mol-1×2-E(碳碳π键)-436 kJ·mol-1=+125 kJ·mol-1,E(碳碳π键)=271 kJ·mol-1,所以形成1 mol碳碳π键放出的能量为271 kJ。(2)达到平衡后,通入N2,由于总压恒定为100 kPa,则容器体积增大,平衡向气体分子数增大的正反应方向移动,C3H8的转化率增大;根据图3(a),C3H8的物质的量分数为0.4时,其平衡转化率为50%;假设混合气体为1 mol,则起始时C3H8为0.4 mol,N2为0.6 mol,运用三段式法计算:
C3H8H2(g) + C3H6(g)
开始量(mol) 0.40 00
变化量(mol) 0.20 0.20 0.20
平衡量(mol) 0.20 0.20 0.20
由于总压恒定为100 kPa,平衡时C3H8为0.2 mol,C3H6为0.2 mol,H2为0.2 mol,N2为0.6 mol,则C3H8(g)、C3H6(g)、H2(g)的分压均为:100 kPa×=kPa,故T1时反应Ⅰ的平衡常数KP==16.7 kPa。
(3)0~1.2s内C3H6的分压由0增大为2.4 kPa,则生成C3H6的平均速率为=2.0 kPa·s-1;若只发生反应Ⅰ、Ⅱ,C3H6的分压应大于H2和H2O的分压,但由图3(b)知,随着反应进行,分压p(H2O)>p(C3H6)>p(H2),且有CO2生成,H2分压降低,故体系中还发生副反应:C3H6+O2=3CO2+3H2O,H2+O2=H2O,消耗O2,因此C3H8和O2的消耗速率比小于2∶1。
(4)由“丙烯的净生成速率方程为v(C3H6)=kp(C3H8)- k′p(C3H6)”推知,反应Ⅲ生成丙烯的速率方程为v(C3H6)= kp(C3H8),反应Ⅳ消耗丙烯的速率方程为v(C3H6)= k′p(C3H6),反应开始时p(C3H8)大、p(C3H6)小,以反应Ⅲ生成丙烯为主;随着反应进行,p(C3H8)减小、p(C3H6)增大,以反应Ⅳ消耗丙烯为主,因此丙烯的浓度随时间的变化趋势为先增大后减小。
【答案】(1)271 (2)使平衡向气体分子数增大的正向移动,提高C3H8的转化率 16.7 (3)2.0 有消耗O2的副反应发生 (4)先增大后减小 先以反应Ⅲ为主,后以反应Ⅳ为主

