我国创新医疗器械产业发展布局与思考
邢文中 苏州工业园区药品管理中心 (江苏 苏州 215000)
内容提要: 通过对2014年~2021年底进入创新医疗器械特别审查通道的相关产品数据及获批上市的创新医疗器械数据进行统计与分析,从产业增长趋势、地域分布、产品种类细分领域等方面,重点分析了我国创新医疗器械产业发展的现状与特点,并从多个国家政策方面阐明了国家对创新医疗器械产业的扶持与鼓励,最后围绕目前创新医疗器械产业发展上存在的一些问题,例如基础器械的投入较少,各区域竞争大于合作,定量采购的冲击等多个方面提出了推动创新医疗器械发展的一些意见与建议。
为鼓励医疗器械的研究与创新,促进我国创新医疗器械的推广和应用,推动医疗器械产业发展,2014年原国家食药总局发布了《创新医疗器械特别审批程序(试行)》[1],于2014年3月1日起施行。由此我国创新医疗器械进入了一个高速发展的快车道。2017年中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[2]明确提出了鼓励创新医疗器械的研发,给予优先审评审批,再一次助推了创新医疗器械的发展。2018年国家药品监督管理局修订发布《创新医疗器械特别审查程序》[3]和《创新医疗器械特别审查申报资料编写指南》[4],至此完善了创新医疗器械审查机制。
本文通过对2014年~2021年底进入创新医疗器械特别审查通道的相关产品数据及获批上市的创新医疗器械数据进行统计与分析,从产业增长趋势、地域分布、产品种类细分领域等方面,重点分析了我国创新医疗器械产业发展的现状与特点,并从多个国家政策方面阐明了国家对创新医疗器械产业的扶持与鼓励,最后围绕目前创新医疗器械产业发展上存在的一些问题,例如基础器械的投入较少,各区域竞争大于合作,定量采购的冲击等多个方面提出了推动创新医疗器械发展的一些意见与建议。
1.产业发展现状
1.1 进入创新通道产品数量增长趋势
从国家药品监督管理局医疗器械审评中心发布的创新医疗器械特别审查申请审查结果公示来看,截止到2021年底,共有357个产品进入创新医疗器械特别审查程序通道[5]。其中2014年~2017年,每年进入创新医疗器械特别审查程序的产品数量都是一个快速增加的过程,复合年增长率在55%左右。2017年达到顶峰,当年通过数量达64个,接下来两年数据有所回落,2021年有60款产品通过创新医疗器械特别审查程序,总体上,近几年进入创新医疗器械特别审查程序的产品数量呈稳定增长趋势(具体见图1)。
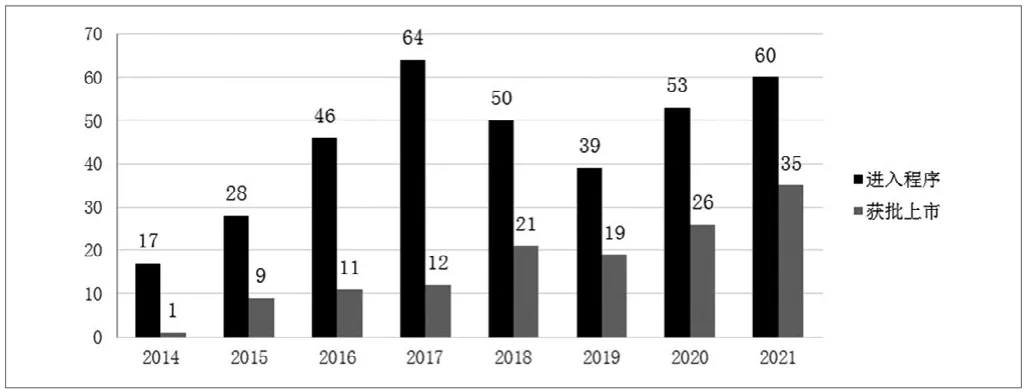
图1.进入与获批创新医疗器械特别审查程序的产品数量
由于进入特别审查程序的产品数量稳定增长的趋势,加上创新医疗器械特别审查程序中规定的一系列优先措施,早期介入、专人负责、专项交流等都加快了审评效率,因此每年获批上市的创新医疗器械数量也呈稳定增长的态势。另外,在2020年底,国家药品监督管理局挂牌成立了国家药品监督管理局医疗器械技术审评检查长三角分中心和大湾区分中心,并于2021年正式运行。得益于两个分中心的运行,2021年创新医疗器械获批的数量为历年之最,达到了35个之多,相比2020年增长了35%。
1.2 地域分布
从进入创新医疗器械特别审查程序的产品的地域分布来看,排除进口器械外,北京、上海、广东、江苏四个省(市)进入创新医疗器械特别程序的产品数量处于头部位置(具体见图2)。上海、北京由于人才聚集,资本投入,创新医疗器械发展尤为突出,再加上出台了各类创新医疗器械的扶持与奖励政策,优化了检验、审评、现场检查环节,加快了审评、审批时限,尽占天时地利人和。而广东省进入创新医疗器械特别程序的70%以上的产品均出自深圳,深圳的成果同样得益于人才与资本,多样的政策,由此吸引了大量医疗器械创新企业。

图2.进入与获批创新医疗器械特别审查程序的地域分布
创新医疗器械强省在产业服务方面,一直遥遥领先。例如上海市药监部门主动对接服务企业,设立专人专班,提供政策法规解读、优先现场检查、优先注册检验、优先审评、审批等方面的支持。由于医疗器械创业企业在建立质量管理体系方面不完善,北京市药监部门主动进行提前指导和规范,减少了现场检查的缺陷项,缩短现场检查整改时限。这些举措都大大吸引了创新医疗器械产业在此布局、发展,形成良性循环。
1.3 产品类别分布
从进入创新医疗器械特别审查程序的产品的类别来看(具体见图3),无源植入器械产品数量最多,占进入程序的三分之一左右,此类器械大多为高值耗材,对生物相容性、稳定的材料结构、耐腐蚀等特性上,除此之外还对制造工艺会有非常高的要求。此外体外诊断试剂、有源手术器械、医用成像器械的进入与获批的数量也占据前部位置,多数创新医疗器械在技术、资本、时间投入高,失败率高,一旦产品成功上市,易形成技术壁垒,不易复制,一定程度上具有议价主动权。

图3.进入与获批创新医疗器械特别审查程序产品类别分布
按照2017年发布的新的医疗器械分类目录中的23个子目录来对比,目前进入与获批的创新医疗器械产品类别中,共有16个子目录的产品进入或者获批创新医疗器械,还有7个未进入创新医疗器械特别审查程序,分别是骨科手术器械,呼吸、麻醉和急救器械,输血、透析和体外循环器械,医疗器械消毒灭菌器械,医用康复器械,患者承载器械,妇产科、辅助生殖和避孕器械,中医器械。
2.国家政策鼓励医疗器械创新
为解决医疗器械“卡脖子”问题,国家自2012年起便发布了一系列政策文件[6],除国家药品监督管理部门出台的政策文件外[7],国务院各部门也陆续出台了鼓励医疗器械创新的政策文件,加快推进医疗器械产业发展,实现国产替代。
2.1 中国制造2025
2015年5月,国务院印发《中国制造2025》[8],始终把创新作为制造业发展的核心地位。针对创新医疗器械这一块,目标是提高创新的能力以及整个产业的水平,尤其是在医用高值耗材、医用成像器械以及移动医疗设备等领域发力。
从上文进入与获批创新医疗器械特别审查程序产品类别分布上看,医用成像器械、无源植入器械、医用软件等产品均有产品进入创新审查通道,其中无源植入器械的数量更是位居前列。
2.2 关于促进医药产业健康发展的指导意见
2016年3月国务院办公厅发布《关于促进医药产业健康发展的指导意见》[9],意见指出重点开发包括高热容量X射线管在内的医疗器械设备的关键核心部件,以及手术精准定位与导航在内的各类先进技术。意见提到了22个品类或领域的医疗器械,几乎涵盖了医疗器械的所有门类的产品。这也标志着国家对创新医疗器械的全面支持。
意见提及的诸多品类医疗器械都或多或少有产品进入了创新医疗器械特别审查通道,但是例如超导磁体、生物三维(3D)打印等技术、远程医疗、高通量基因测序仪、人工耳蜗、中高端康复辅助器具、基于中医学理论的医疗器械目前均无相关产品进入创新特别审查程序通道,相关领域的企业可以持续研发,进入创新特别审查程序通道的概率将大大提高。
2.3 国家层面官方宣传创新产品
国家政府部门对创新医疗器械的宣传支持,国家药品监督管理局网站有专门的创新医疗器械专题栏目,每当一款创新医疗器械获批时,总会对其进行报道并详细地阐述其价值,例如达到了国际领先水平,国内首创,填补了国内空白,临床应用价值显著等。通过药监部门的官方宣传,各类医疗器械媒体也纷纷转载,大大增加了创新医疗器械的曝光度,也助推了创新医疗器械的市场占有率。由此可见,医疗器械行业对创新产品的关注与宣传也驱动着企业加大对创新医疗器械的投入与研发。
3.对目前创新医疗器械发展的建议
上文提到,目前还有部分品类的医疗器械还未进入创新医疗器械特别审查程序,这些品类或属于低值耗材,例如妇产科、辅助生殖和避孕器械,或适用患者群体单一,例如医用康复器械、中医器械。国家在加大对“卡脖子”的高精端的创新医疗器械投入的同时也应鼓励对基础常规医疗器械的创新投入,若此类基础器械的创新性研发成功,由于其使用基数大,全国患者获得的收益回报,将远远超过高值耗材。
目前全国绝大部分省市均把生物医疗产业作为重点产业,各省市在医疗器械产业方面竞争大于合作。例如湖南省药监局2020年第42号文,《湖南省药品监督管理局关于进一步深化“放管服”改革推动我省生物医药产业高质量发展的意见)(试行)》[10],第十三条提到以定制式服务支持承接省外产业转移,境内已注册二类医疗器械,首次注册时限压缩至10个工作日,较法规时限缩短了90%。此举吸引外省市医疗器械企业纷纷产业转移至湖南省,部分省市为招商也纷纷出台医疗器械产业高质量发展措施,相关医疗器械事项办理时限大大缩短,医疗器械产业竞争大于合作,内卷严重。建议以全国医疗器械产业布局发展的前提下,以自上而下的规划,加强顶层设计,强化区域之间的合作与交流。
自从国家医保局成立组织高值医用耗材联合采购办公室以来,各类高值耗材的医保价格不断刷新历史新低,医疗器械企业的利润空间大大压缩,而目前获批或者进入创新医疗器械通道的产品,高值耗材占了很大一部分。众所周知,一款创新医疗器械从产品立项到的获批上市,历经概念设计、多轮样品研制、第三方检验、临床试验、注册申报等多个阶段,期间耗费的人力,成本,时间都是巨大的。企业利润的减少势必导致企业对产品开发的谨慎,产品的数量及资金投入都将大打折扣。建议医保局联合药监局、卫健委等各大部门,完善创新医疗器械在经营使用环节的推广政策,加快推广医疗机构对创新医疗器械的认知与应用,以量换价。另外,科技部、工信部等部门以政策、投资基金、保险等形式鼓励创新医疗器械的开发,为创新型医疗器械企业兜底,推动其开发的决心,实现医疗器械企业、政府部门、患者多方共赢的局面。
4.小结
实现我国从制械大国到制械强国的转变,更好地保障公众用械需求,需要行业和政府部门的共同努力。我国各级政府部门包括医疗器械监管部门、使用部门、科技创新部门出台相关规章制度,推动鼓励创新医疗器械的上市,使我国自主研发生产的创新医疗器械代替进口产品,打破技术壁垒,降低公众使用成本,推动着国产医疗器械创新产业的良性发展。另外,创新医疗器械企业借助政策东风不断提升自身的研发能力,保证了国产创新医疗器械持续、快速的高质量发展。相信在不久的将来,在全国创新医疗器械产业一盘棋的指引下,我国创新医疗器械必将在国内和国外的市场扮演起着不可或缺的角色。

