低剂量超短波治疗对大鼠脊髓损伤后TGF-β1、HIF-1α和Nogo-NgR通路的影响
李鹏程 赵 伟 张 洋 王 勇 包晓赫 董 宇 王 楠
脊髓损伤(spinal cord injury, SCI)是世界上最严重的神经系统疾病之一,通常会导致严重的长期残疾,给社会带来了沉重的经济负担[1]。据世界卫生组织(WHO)估计,全球每年有超过25万人患有脊髓损伤,且发生率仍在上升[2]。SCI患者功能恢复的常规干预措施包括药物和手术等康复方法,但治疗效果仍然不尽如人意[3]。目前,许多物理方法也通过维持微环境的稳定性来加速神经再生的速度和质量。超短波(ultrashort wave,USW)通过刺激神经血管的形成和神经滋养来改善血液循环、抑制炎症状态、减轻肿胀、为轴突生长和施万细胞增殖提供氧气和营养,以及增强组织代谢和神经系统功能[4]。本研究评估低剂量 USW对SCI的治疗效果,以及转化生长因子-β1(transforming growth factor-β1,TGF-β1)、缺氧诱导因子1-α(hypoxia inducible factors 1-α,HIF-1α)和Nogo-NgR通路相关基因及蛋白表达的影响,为临床治疗SCI提供理论依据。
材料与方法
1.实验动物:雄性SD大鼠30只,体质量200~220g,购自辽宁长生生物技术有限公司,许可证号:SCXK(辽)2015-0001。饲养环境:12h昼夜交替、温度22~25℃、湿度45%~50%,环境清洁,通风良好,自由摄食、饮水。本研究通过沈阳医学院实验动物伦理学委员会审批[伦理审批号:研伦审第(2020)47号],实验期间各项操作符合《实验动物管理条例》。
2.试剂与仪器:TGF-β1抗体(sc-130348)购自美国Santa Cruz公司;HIF-1α抗体(sc-13515)购自美国Santa Cruz公司;Nogo-A抗体(13401S)购自美国Cell Signaling Technology公司;NgR抗体(ab172653)购自英国Abcam公司;GAPDH抗体(AF0003)、鼠单克隆抗体(AG019)购自中国Beyutime公司;蛋白提取试剂盒、总RNA提取试剂盒(DP419)购自中国TIANGEN公司;SYBR Premix Ex Taq试剂盒(DRR420A)购自大连TAKARA公司;USW装置[使用频率40.68MHz,最大输出功率40W,电流强度60mA左右(DL-CII,编号BB1404069)]购自汕头市医疗器械厂。
3.大鼠SCI模型建立及USW干预:30只大鼠随机分成对照组、模型组和USW组,每组10只。1%戊巴比妥钠50mg/kg腹腔注射麻醉大鼠,俯卧固定,备皮消毒,确定T10棘突位置,分离皮下组织和两侧肌肉,暴露T9~T11棘突。用咬骨钳分离T10棘突,暴露脊髓T9~T11平面(面积约4mm×6mm),对照组仅进行椎板咬除,脊髓无损伤,模型组和USW组采用改良的Allen撞击装置,5g 打击棒从5cm高度自由落体下落并对脊髓进行撞击。模型组不做任何治疗;USW组在损伤24h后,将大鼠置于固定器中,将一对直径为 4cm 的圆盘电极放置在大鼠脊髓伤口的两侧,距离皮肤2cm,每天接受7min的USW治疗,直至第4周末处死。末次USW治疗后,麻醉处死,获取2cm受损脊髓组织,一部分组织经磷酸盐缓冲液(PBS)洗涤后,置于-80℃保存。
4.行为学评分:在实验造模后的1周、2周、3周、4周,所有大鼠的神经运动功能由两名未参与本研究的技术人员使用运动评分量表(Basso-Beattie-Bresnahan,BBB)进行检查,观察时间为3分钟/只。BBB 评分量表的范围为0~21分,根据四肢运动的协调性、爪子的放置和尾部平衡等参数来判断。其中0分表示没有可观察到的后肢功能,21分表示正常步态和功能齐全的后肢。同时进行斜板试验:将大鼠身体轴线和斜板纵轴垂直后逐渐增大斜板坡度,当大鼠刚好能够在斜板上停留5s,记录此时坡度作为其肢体功能评分。
5.实时定量PCR检测:取各组大鼠冰冻脊髓组织,并根据试剂盒说明书提取总RNA。使用5×First Strand cDNA Synthesis Master Mix试剂盒合成第一链cDNA。最后应用Power SYBR Green PCR Master Mix试剂盒进行实时定量PCR。扩增条件如下:95℃ 10min,95℃ 15s,60℃ 60s,40个循环,72℃ 4min。3-磷酸甘油醛脱氢酶(GAPDH)作为内参,2-ΔΔCt法对基因表达进行定量分析。所用PCR引物由宝生物工程(大连)有限公司合成,具体序列详见表1。

表1 实时定量PCR的寡核苷酸引物列表
6.Western blot 法检测:切碎脊髓组织,添加RIPA蛋白裂解液提取总蛋白,BCA试剂盒检测蛋白含量后采用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离的等量蛋白质,转移到PVDF膜上,含5%脱脂奶粉的Tris 缓冲盐水中的封闭,分别加入稀释后的一抗(TGF-β1、HIF-1α、Nogo-A、NgR、GAPDH)4℃孵育过夜,洗膜后添加稀释后的二抗于室温下孵育1h,洗膜后采用电化学发光显影,并在凝胶成像仪获取图像。
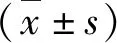
结 果
1.小剂量USW治疗对大鼠BBB评分影响:对照组大鼠各时间点的BBB评分均在20分以上,表示基本无后肢运动障碍。与对照组比较,模型组各时间点的BBB评分降低(P<0.05);与模型组比较,USW组各时间点的BBB评分升高(P<0.05),但低于对照组(P<0.05,表2)。
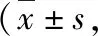
表2 各组大鼠BBB评分比较分)
2.小剂量USW治疗对大鼠斜板评分影响:对照组大鼠各时间点的斜板评分均在65分以上。与对照组比较,模型组大鼠各时间点的斜板评分降低(P<0.05);与模型组比较,各时间点USW组大鼠斜板评分升高(P<0.05),但低于对照组(P<0.05,表3)。
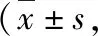
表3 各组大鼠斜板评分比较分)
3.小剂量USW治疗对大鼠TGF-β1、HIF-1α的影响:对照组TGF-β1和HIF-1α mRNA低水平表达。与对照组比较,模型组TGF-β1和HIF-1α mRNA表达较对照组升高(P<0.05);USW组TGF-β1和HIF-1α mRNA较模型组降低(P<0.05),但高于对照组(P<0.05)。TGF-β1和HIF-1α蛋白表达与mRNA结果一致,详见图1。
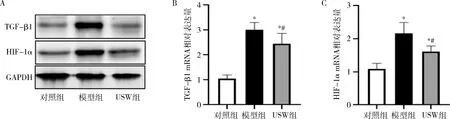
图1 各组TGF-β1和HIF-1α蛋白表达A.TGF-β1、HIF-1α蛋白表达水平;B.TGF-β1mRNA相对表达量;C.HIF-1α mRNA相对表达量。与对照组比较,*P<0.05;与模型组比较,#P<0.05
4.小剂量USW治疗对大鼠Nogo-NgR通路的影响:对照组Nogo-A和NgR mRNA低水平表达。模型组Nogo-A和NgR mRNA表达较对照组升高(P<0.05);USW组Nogo-A和NgR mRNA较模型组降低(P<0.05),但高于对照组(P<0.05)。Nogo-A和NgR蛋白表达与mRNA结果一致,详见图2。
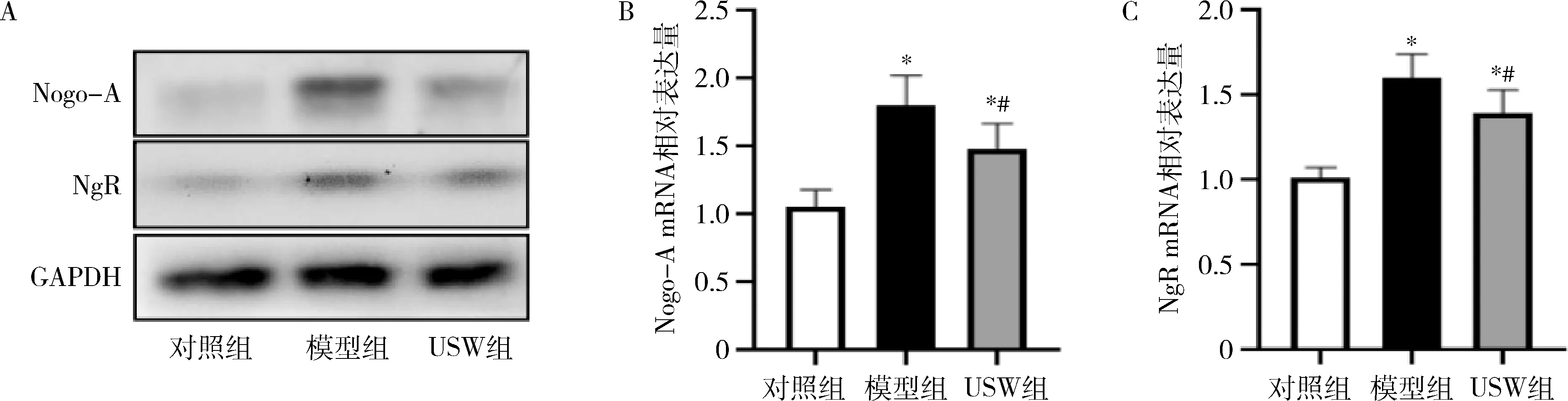
图2 各组Nogo-A和NgR蛋白表达A.Nogo-A、NgR蛋白表达水平;B.Nogo-A mRNA相对表达量;C.NgR mRNA相对表达量。与对照组比较, *P<0.05;与模型组比较, #P<0.05
讨 论
SCI是一种常见的临床疾病,常导致四肢瘫痪[5]。脊髓损伤后通常伴随着自发性和可塑性的轴突再生,有助于改善感觉和运动功能,但轴突再生是有限的[6]。脊髓损伤后的自然恢复需要持续数年,且恢复的效果不佳[7]。因此,开发可以加速恢复运动功能的新方法对于脊髓受损患者来说是重中之重。
超短波是一种高频电磁波,具有穿透性强、作用部位深的特点,产生明显的温热效应,目前作为一种治疗方法,广泛用于物理治疗、康复医学以及神经再生[8]。多项证据表明,超短波在脊髓损伤后修复发挥积极的促进作用。高琳等[9]研究表明,超短波可以调控大鼠脊髓损伤后巨噬细胞极化,继而抑制炎性反应并促进脊髓损伤。Yin等[10]研究发现,骨髓间充质干细胞移植联合USW辐射在促进 SCI 后功能恢复方面比单独治疗更有效,这可能是由于同时抑制炎症和脊髓水肿,进而并促进神经功能恢复。笔者既往研究发现,USW通过抑制MK2促进 SCI 恢复和减轻 SCI 后的炎性反应[11]。BBB评分以及斜板评分是用来评价SCI大鼠后肢功能恢复程度的指标[12,13]。本研究中,超短波治疗后能够明显提高脊髓损伤后大鼠的BBB评分以及斜板评分,表明USW疗法对脊髓损伤有效。
脊髓损伤会在原始损伤部位和外部引发复杂的炎性反应,并加重组织损伤[14]。生长转化因子β1(transforming growth factor-β1,TGF-β1)广泛参与体内各种病理生理过程,与炎症、创伤等多种疾病的发生、发展关系密切。研究表明,急性脊髓损伤后TGF-β1表达增加,可能与其具有免疫抑制、炎症抑制的作用相关,是身体对神经损伤的自我保护反应[15]。Lei[16]研究发现,杨梅苷能够部分通过TGF-β信号通路下调COX-2、TGF-β1、p53,从而发挥抗氧化和抗炎作用,促进SCI 大鼠的功能恢复。HIF-1α是一种转录因子,参与血管生成、细胞凋亡的生物学过程。研究报道,SCI 后的急性和慢性反应期,HIF-1α及其靶基因如血管生成分子的表达增加,在28天达到峰值,且HIF-1α mRNA及蛋白的表达情况与损伤情况和预后密切相关[17]。本实验中在脊髓损伤后的24h给予低剂量USW治疗,能够有效降低大鼠脊髓组织中HIF-1α和TGF-β1 mRNA及蛋白的表达,表明低剂量USW治疗能够有效改善改善血液循环、抑制炎症状态。
Nogo-A是在中枢神经系统髓鞘中发现的Nogo家族的一员,已被确定为限制轴突再生的关键分子。脊髓损伤后,少突胶质细胞和髓鞘将细胞内Nogo-A释放到细胞外基质中,并抑制轴突再生。研究表明,在体内应用的Nogo-A抗体不仅可以中和Nogo-A在少突胶质细胞和髓磷脂中表达的抑制功能,而且可以直接积极地增强神经元的再生[18]。NgR是Nogo-A的受体,在脊髓损伤后再生抑制信号转导中起重要作用,而NgR的表达与中枢神经细胞再生能力直接相关,因此NgR被认为是其中之一促进轴突再生的重要靶点。研究报道,内源性NgR拮抗剂的缺失导致SCI后功能恢复的显著延迟,而过表达内源性NgR拮抗剂显着促进视神经和脊髓损伤后的轴突再生[19]。此外,Nogo-A与NgR结合后,将信息传递给神经细胞,生成NgR/p75NTR/LINGO-1复合物,进一步介导轴突生长抑制[20]。因此,Nogo/NgR信号通路在SCI后中枢神经系统中神经元和轴突的再生中发挥关键作用。本研究检测了Nogo-A与NgR基因和蛋白的表达情况,结果显示,低剂量USW治疗显著降低损伤脊髓组织Nogo-A与NgR基因和蛋白的表达,表明USW可能通过负性调控Nogo-NgR通路对脊髓损伤起到修复作用。
综上所述,低剂量USW能够通过下调脊髓Nogo/NgR的信号通路中Nogo-A与NgR mRNA及蛋白的表达,减轻局部缺氧环境,降低炎性反应,进而加快脊髓损伤后神经功能恢复,为临床应用提供了较好的理论依据。

