常用组织修补材料体内转归分类以及生物材料在胃肠外科组织修复与重建中的应用*
苏丹,王晨曦,张恒△,任东林△
1中山大学附属第六医院肛肠外科 广东 广州 510655
2广东省结直肠疾病研究重点实验室 广东 广州 510655
3汕头市精准医学应用学会普通外科分会 广东 汕头 515000
临床中,当组织缺损、薄弱、移位时,需进行组织修补。在医学发展的历史中,人们曾尝试缝合修补、尸体组织替代、动物组织替代、金属修补等组织修补方式,相当一部分组织修补方式在临床实践检验中被淘汰,其中缝合修补和自体组织修补这两种组织修补方式在临床中被沿用下来。自20世纪中叶开始,工业合成材料(如,合成补片)被引入医学领域进行组织修补,自此组织修补的方式和修补的范围有了极大的丰富。然而,工业合成材料被临床广泛应用后,合成补片植入体内后的一些近期、远期并发症(如,补片感染,补片侵蚀,补片皱缩,慢性疼痛,局部僵硬,组织失能等)也越来越受到关注。临床组织修补的内涵与外延不断发展,对组织修补材料提出了更高的要求。在此背景下,自20世纪90年代后期开始,生物材料逐渐进入了临床应用,并且获得了快速的发展,成为了继合成补片(包括可吸收补片和不可吸收补片)之后的又一大类组织修补材料,并在多个临床专科得到了长期且广泛的应用。本文将概述目前临床常用组织修补材料的分类、修补机制与体内转归结果,在此基础上结合文献及临床实践,以实例具体阐述生物材料在胃肠外科组织修复与重建中的部分应用场景。
1 常用组织修补材料的分类、修补机制与体内转归
1.1 组织修补材料的分类
临床上通常按照以下几种方式粗略地区分组织修补材料:(1)按照材料的材质分为非动物源性组织修补材料和动物源性组织修补材料;(2)按照补片的吸收性能分为不可吸收补片和可吸收补片;(3)按照补片的单一特性分为防粘连补片和自粘补片等;(4)按照补片的物理性状或外形分为平片、网塞、3D补片等。除此之外,还有按照网孔大小,补片重量等进行区分。这些分类方式在临床中应用了多年,但大多只是关注组织修补材料产品本身植入体内之前的单一特点,或是用补片分类这个小分类来套用组织修补材料的大分类。
然而笔者认为就临床决策而言,更有价值的分类方式为根据组织修补材料植入体内后的转归结果来进行分类,因为组织修补材料最终的体内转归与临床治疗效果直接相关。有文献报道组织修补材料可分为两大类,即合成补片(Synthetic Mesh)和生物材料(Biologic ECM),这两类组织修补材料各有利弊[1]。也有文献将组织修补材料分为三类,即不可吸收合成补片(Permanent Synthetic)、可吸收合成补片(Resorbable Synthetic)和组织来源的生物材料(Biological Tissue-Derived)[2-3],或是将组织修补材料分为合成补片(Synthetic Mesh)、生物材料(Biologic Mesh)和可吸收合成补片【包括人工合成可吸收补片(Synthetic Absorbable Mesh)和生物合成可吸收补片(Biosynthetic Absorbable Mesh)】这几种类型。前述几种分类均为根据组织修补材料植入体内后不同的组织反应和体内转归来进行区分,并且都将生物材料作为合成补片之外的一个独立的分类。
临床中如果能够从组织修补材料在体内转归的角度将其进行分类,或将有助于从诊疗需求角度来选择合适的组织修补材料。根据体内转归分类原则,结合多种组织修补材料体内转归研究的文献数据,笔者提出组织修补材料的以下分类框架(图1)。
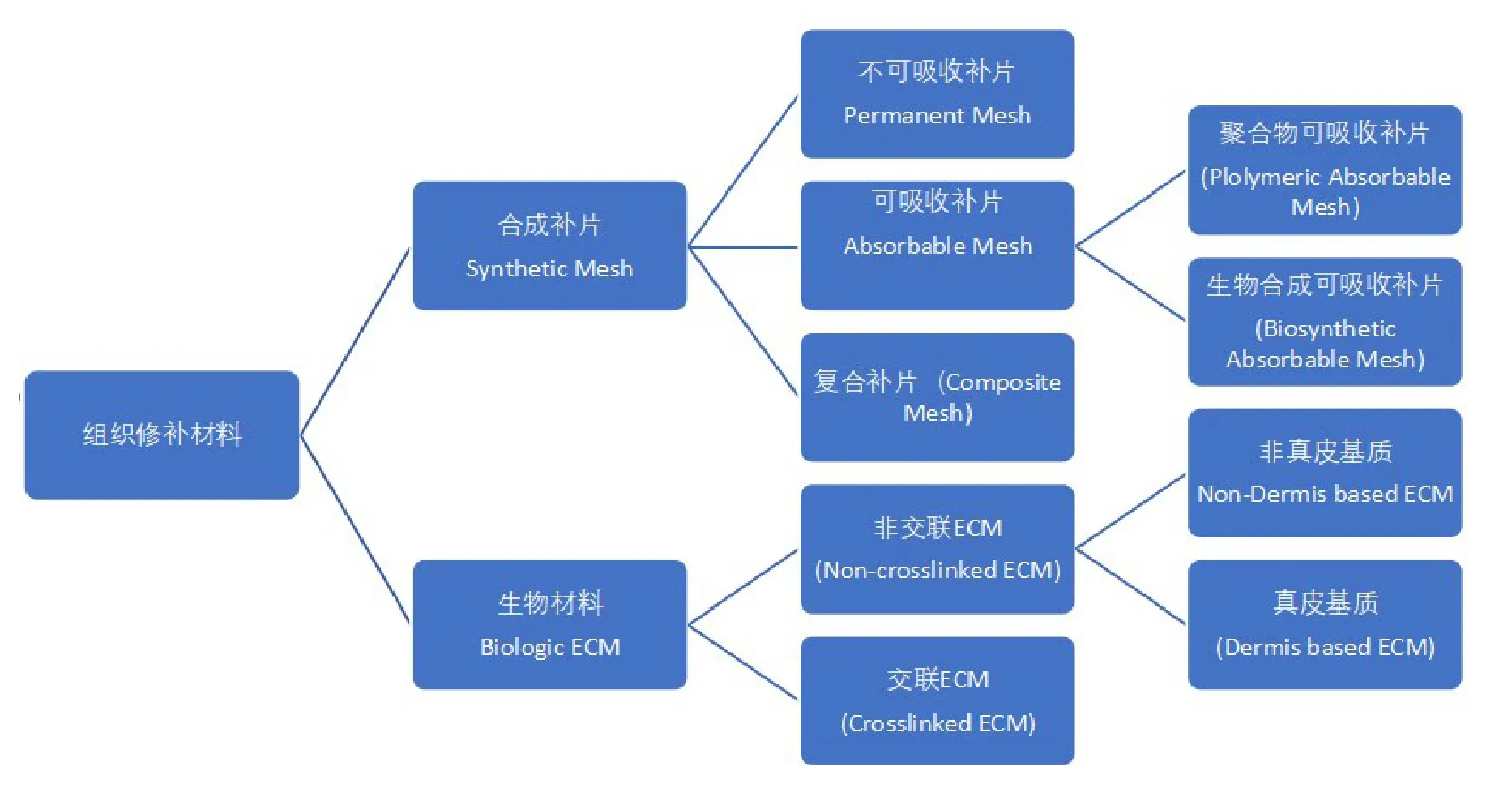
图1 组织修补材料分类框架
从组织修补和组织加固的需求出发,临床目前最常用的材料是合成补片,包括不可吸收补片(常用的是聚丙烯补片,或者以聚丙烯为骨架并添加其他成分制成的复合补片)和可吸收补片(常用的是以化学大分子或生物大分子为原材料,通过人工合成的可吸收补片)。在过去的约20年间,随着组织工程技术的发展而产生了一种新的组织修补材料——生物材料。这里所说的生物材料是指植入人体后以再生自身组织为体内转归目标,并且以这个转归结果来实现长期组织修复的一大类材料。其中研究较深入且循证医学依据较丰富的为生物体细胞外基质(extra cellular matrix,ECM)来源的生物材料。而生物材料又因其制作工艺的不同和组织来源的不同,植入体内后的转归结果也不同,因此生物材料中也有进一步的细分类别。生物材料的深入研究和多学科的临床应用在全球被广为关注。以下主要就合成补片和生物材料这两类不同的组织修补材料的修补机制与其在体内的转归进行概述。
1.2 组织修补材料的修补机制与体内转归概述
1.2.1 合成补片的修补机制与体内转归 (1)不可吸收补片:工业合成的不可吸收补片的原材料主要包括聚酯类,聚 烯类,膨化聚四氟乙烯(e-PTFE)类,以及聚偏氟乙烯(PVDF)类等。常用的不可吸收补片包括由上述原材料之一制成的补片,或是在聚丙烯的基础上添加其他成分制成的复合补片。目前临床应用最广泛的是聚丙烯类补片,在此以聚丙烯类补片为代表来概述这一类组织修补材料的体内转归。Soiderer等[3]的试验观察聚丙烯类补片植入生物体内4周和8周后的植入部位情况,结果发现补片皱缩,与周围组织融合不佳,补片的修补面积比植入时缩小了0.9 cm2。补片植入生物体内4周后的组织学检查结果提示,聚丙烯类补片引发了异物反应,在补片的周围可见炎性肉芽肿反应,补片周围间隙中可见疏松的脂肪组织填充,其中可见纤弱不成熟的胶原沉积(图2A)。补片植入生物体内8周后的组织学检查结果提示,聚丙烯类补片区域可见更加密集的炎症反应,补片区域遍布异物反应中标志性的多核巨细胞(即异物巨细胞),同时可见大量瘢痕组织形成(图2B)。

图2 聚丙烯类补片植入生物体内后不同时点的组织学检查图片(图片引用自参考文献[3])
不可吸收补片植入体内后引发异物反应,临床表现为持续的慢性炎症状态和瘢痕包裹补片。因此不可吸收补片在体内的转归,笔者将其概括为异物残留+瘢痕固定+慢性炎症。“异物残留+瘢痕固定+慢性炎症”的体内转归结果,既是不可吸收补片实现组织长期修补的核心方式,也是大部分不可吸收补片近期、远期并发症发生的根本原因。当然,前述几类不可吸收补片在植入体内后的慢性炎症反应的程度以及瘢痕形成的范围也许因聚丙烯的含量不同,或是编织工艺的不同而有所不同,但其在体内转归变化的规律基本一致。
值得一提的是,无论何种材质的组织修补材料,如果制作工艺中使用了交联工艺(Crosslink,又被称为蛋白质交联或蛋白质改性),均被归类于交联材料类。而交联材料植入体内的组织反应和体内转归与上述不可吸收补片极其相似,并发症发生情况也极其相似[4]。其原因是过度加工处理的生物材料失去了天然ECM的生物活性,交联材料植入体内后几乎没有细胞浸润和血管长入,无法实现组织再生,同时交联材料已经无法被胶原蛋白酶降解而导致异物残留。因此,交联材料在体内的转归同样是异物残留+瘢痕固定+慢性炎症。
(2)可吸收补片:可吸收补片通常是以化学大分子【如,聚乙醇酸(PGA)】或生物大分子(如,胶原蛋白)为原料,经过人工合成的补片,补片植入体内后通过水解或酶解作用逐渐被崩解吸收,被吸收的时间通常比较固定。可吸收补片通常不具备复杂的三维结构(图3),植入体内后主要作为一个逐步被吸收的临时支架发挥作用,通过植入区域所在周边组织的爬行覆盖或组织填充来实现组织修补。

图3 电镜下的可吸收补片(图片引用自参考文献[5],图片中描述的产品均未在国内临床应用)
可吸收补片植入体内后的转归过程如下[5]。
Bio-A(化学大分子):植入体内14天时材料所在部位见炎症细胞浸润,30天时见补片部分降解;90天时补片几乎完全被吸收,植入部位被结缔组织填充;180天时无任何残留补片成分,局部炎症细胞浸润,植入部位被大量脂肪组织和少许结缔组织填充(图4)。

图4 可吸收补片的体内转归(图片引用自参考文献[5])
Tutomesh(生物大分子):植入体内14天时见补片区域部分降解,局部炎症反应;30天时补片降解趋势和局部炎症反应更加明显;90天时炎症反应明显减轻,同时补片降解愈发显著,补片厚度变薄;180天时转归结果与Bio-A类似,局部没有补片残留或炎症反应,取而代之的是大量脂肪组织间以少许结缔组织(图4)。
因此,可吸收补片的修补机制可以概括为“补片被吸收之前无序的组织填充”。由于可吸收补片的吸收速度和无序的组织填充速度之间更像是赛跑的关系,而不是互补的关系,因此在临床中选择可吸收补片进行组织修补时,往往首先关注可吸收补片的吸收时间,医师们下意识地认为材料的吸收时间越长则周边组织的爬行填充越有保障。然而转归结果提示我们,比吸收时间更加关键的一个问题也许是可吸收补片体内转归后,留下的是什么样的组织?如果爬行填充的组织并不具有正常组织的强度,结构和功能,那么可吸收补片的吸收时间更长并不代表其组织修补结果更可靠。同理,以无序杂乱且血供不良的组织覆盖或填充来修补组织缺损,并不能够等同于有效的组织重建。因此,就组织修补材料的选择而言,与临床治疗效果更直接相关的要素应当是其植入体内后的综合转归结果,而不是组织修补材料的吸收时间这样的单一产品特性。
1.2.2 生物材料的修补机制与体内转归 生物材料并不是另一种可吸收补片。生物材料的组织修补目标是以植入的生物材料来主动诱导和促进人体组织的再生重建,也就是在植入部位再生出具有正常血供和有序结构的自体组织,从而实现组织结构和功能的长期修复。这个体内转归的结果又称为组织再生塑形[6-7]。基于这一目的设计的生物材料并非来自生物体的蛋白质的简单叠加,其真正的本质均为来自生物体的ECM。ECM是天然组织中由细胞分泌构建的结构,同时也是细胞生活的微环境。ECM是复杂的三维结构(图5),其中含有结构蛋白、功能蛋白等复杂的成分。ECM通过与细胞互动从而调节组织愈合的炎症期、组织愈合期和组织塑形期,从而实现组织再生塑形。ECM与宿主细胞之间通过动态交互作用而影响细胞粘附、细胞迁移、细胞增殖、细胞分化和细胞凋亡的各个阶段。ECM在胚胎发育,干细胞/祖细胞的分化中也扮演着重要的角色。迄今为止,关于ECM的成分,ECM的微观结构和详细的调节组织再生的过程仍未能完全被阐明,因此目前几乎不可能以人工合成的方式来设计和生产仿生ECM的生物材料,而人为的过度加工处理也很容易破坏天然ECM的结构与功能。也因为如此,生物材料并非人工合成的补片,而是以脱细胞等工艺尽可能保留生物体中的天然ECM微环境,将ECM植入宿主体内,与宿主细胞结合,促使宿主细胞在与这个微环境的动态交互作用中再生自体组织,实现长期的组织修复。

图5 Cook Biodesign百得塞 R生物材料(猪小肠黏膜下层ECM)(图片引用自参考文献[7])
迄今已有临床研究证明[8],ECM类生物材料植入体内后,会逐渐再生塑形成为宿主自身组织(图6),而组织学检查结果提示再生组织中的新生胶原蛋白致密有序排列,并按照局部生理张力方向排列(图7)。
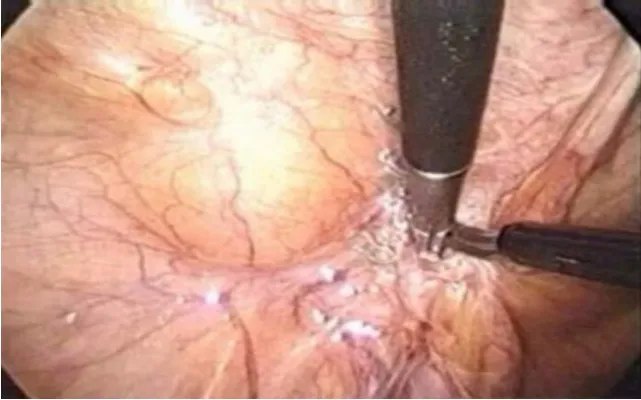
图6 Cook Biodesign百得塞 R生物材料(猪小肠黏膜下层ECM)在腹腔镜IPOM腹壁疝修补术后 5年的再生塑形效果(图片引用自参考文献[8])

图7 Cook Biodesign百得塞 R生物材料(猪小肠黏膜下层ECM)在盆底修补术后 8个月的组织学检查结果(图片引用自参考文献[7])
生物材料的本质是ECM,优质的生物材料应当以尽可能保留天然状态的ECM微环境(包括ECM的天然结构以及ECM中的丰富成分)为原则来进行设计和加工,而不是随意进行过度的人为加工处理改变天然ECM微环境。生物材料的组织修补机制和体内转归结果可以总结如下:ECM+宿主细胞+动态交互作用=组织再生塑形。即生物材料的转归机制是以植入的ECM微环境来积极诱导宿主细胞与这个微环境定向结合,并且在宿主细胞与ECM之间持续的动态交互作用下逐步实现宿主的内源性组织再生。因此,生物材料的转归结果并非外源性替代(Replacement),而是组织再生塑形(Remodeling),从第一个R到第二个R正是生物材料区别于合成补片的核心机制。
2 ECM类生物材料在胃肠外科中的应用思路探讨
ECM是再生医学中使用最多、最广泛的材料之一。ECM被认为是一种高度复杂的、具有组织来源特异性的蛋白库,它具有结构与功能的多维度属性。ECM既可以被驻留细胞重构,也可以诱导细胞行为、表型和存活。研究表明,ECM在干细胞表型的发育和维持中起着重要作用,并受到精细的调控[9-10]。简言之,ECM为细胞的活动和生长提供了一种高度保留了自然基质的框架底物,随着ECM在组织工程和再生医学中日渐广泛的应用,ECM的应用正朝着越来越复杂的组织结构重建,甚至整个器官的重建方向发展。迄今为止,虽然ECM实现这种复杂组织再生塑形结果的详细机制与过程尚未能被完全阐明,但ECM的作用机制显然不只是作为机械支架供组织爬行覆盖这么简单,而是以主动诱导的方式参与组织愈合、组织器官发育和组织稳态重建的多个过程。曾有研究试图用人工合成的方法重建这些细胞基础结构(如,静电纺丝)[11-12],实现了在ECM的纤维成分的近似规模上产生随机分布的纤维互连网络。然而,目前没有一种方法可以解释ECM纤维成分分布的变化,也不能替代天然ECM的生物活性成分。因此,目前ECM原材料的制备仍以哺乳动物的天然ECM为主。
目前,临床中有多种ECM类生物材料,它们在动物来源,选取部位和组织种类,脱细胞工艺,纯化灭菌方法,以及三维结构形状上各不相同。不同的ECM类生物材料的适应证也各不相同。ECM类生物材料作为组织修补材料在结直肠肛门外科的应用在本期专题中另有介绍(如LVMR手术、ELAPE术后盆底重建、肛瘘塞等)。本文拟介绍ECM类生物材料在胃肠外科中的应用,包括消化道黏膜重建及肌肉重建,或是二者的组合。
2.1 消化道黏膜重建
随着精准诊断技术、内镜技术及微创治疗技术的发展,消化道黏膜手术已经成为消化外科的重要治疗手段之一。某些消化道黏膜病变(如,不典型增生,异型上皮化生,息肉样变,错构瘤等),黏膜下病变(如,囊肿,间质瘤,神经内分泌瘤等)和原位癌等疾病通常需要进行较大范围的黏膜切除,以达到彻底去除病灶的目的。然而大范围黏膜切除后的黏膜缝合重建、消化道穿孔,以及创面愈合后的消化道瘢痕狭窄等问题,成为了降低手术成功率的重要因素。因此,学者们尝试使用ECM类生物材料进行消化道黏膜重建,从而减少了张力性缝合带来的相关并发症、微小瘘或是远期消化道瘢痕狭窄等不良事件的发生。新近的几项研究表明,ECM类生物材料是食管黏膜重建的有效材料(图8)[13-15]。其中Nieponice等[14]研究提及的食管黏膜重建选择来自猪源组织的ECM类生物材料,针对40%~50%的食管黏膜环周全层缺损(长度达到5 m),通过可膨胀支架固定ECM类生物材料,支架在治疗后9~14天取出。结果显示,ECM类生物材料可快速重构,形成新的上皮和黏膜下层组织,在后续的随访中,小部分患者出现轻度食管管腔狭窄需要短暂扩张,但较单纯黏膜切除缝合的患者而言,未出现严重及长期的食管管腔狭窄。而且在犬模型的食管壁重建中观察到,全黏膜层形成非狭窄性愈合,这一新生组织既具有功能性又具有神经支配性,且当对应肌层完好的前提下,观察到了黏膜功能的恢复。
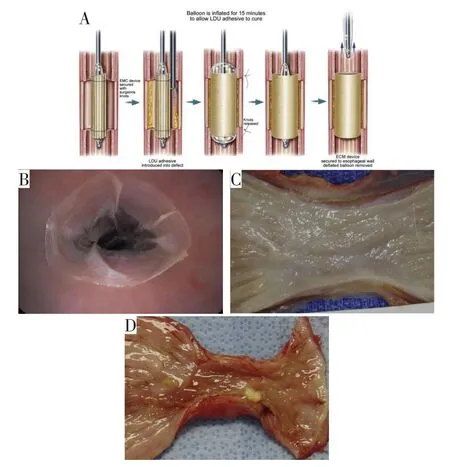
图8 犬食管黏膜切除术后ECM类生物材料食管壁重建模型与对照(图片引用自参考文献[13])
2.2 肌肉重建
肌肉重建在胃肠外科和腹壁外科中的应用场景包括外伤,肿瘤侵犯,感染损伤等。肌肉损伤后的自身再生能力有限。普遍认为,20%及以上的肌肉体积损失将导致瘢痕组织沉积替代、慢性肌活动无力甚至功能丧失,而不是自然再生修复[16]。目前,对于大体积肌肉损失后的重建技术主要包括自体组织移植,带血管蒂或游离肌瓣移植。虽然这些重建技术可以提供一定程度的美容改善和组织覆盖,但几乎没有原位的组织修复或功能恢复。此外,当肌肉组织缺损的面积过大或者体积过大时,这些重建技术的具体实施和修复效果就面临巨大的挑战。基于ECM类生物材料的骨骼肌重建方法,已在大体积肌肉损失的临床前模型中被证明能促进功能性、神经支配性和收缩性骨骼肌的形成[17-18]。在一项研究中[19],由猪小肠黏膜下层制成的ECM类生物材料被制作成三维结构,并植入到犬肌肉肌腱连接修复模型中,在这个模型中,腓肠肌和肌肉肌腱连接处远端三分之一被完全切除,在猪小肠黏膜下层ECM类生物材料植入后,切除的组织完全被ECM类生物材料再生替代。该项研究的结果表明,植入的ECM类生物材料促进了具备血管化及功能神经支配的新生骨骼肌的形成,在植入ECM类生物材料后6个月几乎无法与原生肌肉区分。前述研究发现已逐渐在临床实践中转化为对遭受一定体积肌肉损失患者的治疗方法。有文献报道,为一名22岁男性的股四头肌损伤患者(此前所有治疗都被证明无效)放置ECM类生物材料,结果发现植入ECM类生物材料后部分再生新的功能性骨骼肌,显著提高了等速运动性能和生活质量[20]。
2.3 ECM类生物材料使用要点
如前所述,ECM类生物材料实现组织再生的机制为ECM+宿主细胞+动态交互作用=组织再生塑形。因此,ECM类生物材料植入体内后,生物材料是否能够获得稳定的血供来源和细胞来源是其能否实现组织再生塑形这个转归结果的关键。因此临床医师选择使用ECM类生物材料进行组织修复时,术前,术中和术后需要通过一系列临床管理手段,使得ECM类生物材料可以在植入部位持续地接触到具有血供的组织,从而获得稳定的血供来源和细胞来源,实现组织再生塑形的转归结果。
3 小结
组织修补材料按照修补机制和体内转归的不同,大致可以分成合成补片(可吸收补片和不可吸收补片)和生物材料(ECM来源)这两大类。合成补片的修补机制是外源性替代,其中目前应用最广泛的是不可吸收补片。不可吸收补片的体内转归为异物残留+瘢痕固定+慢性炎症;可吸收补片的体内转归是补片被吸收之前无序的组织填充,本质上并非有效的组织重建。与合成补片不同,生物材料并不是另一种可吸收补片,生物材料的本质是ECM这个精细而复杂的微环境,其修补机制是ECM和宿主细胞之间通过动态交互作用实现内源性组织再生的过程,最终通过组织再生塑形的转归结果来实现组织结构和功能的多维度修复。从外源性替代到组织再生塑形是生物材料区别于合成补片的核心机制。生物材料与合成补片的转归机制和体内转归结果有本质的不同,因此生物材料与合成补片是组织修补材料中截然不同的两个大类,不应当混为一谈。
也正因为生物材料与合成补片的体内转归本质的不同,两者在临床应用的内涵和外延既有交集,又有区别。首先,高动力的解剖区域使用生物材料无疑更加安全,例如食管裂孔疝修补,盆底重建,腹壁修补等。其次,需要强调功能修复,症状改善和术后远期生活质量的手术治疗,使用生物材料的价值相对更大。最后,污染或轻度感染手术,或是术后感染顾虑较大的手术,使用生物材料也更加安全。无论何种使用场景,使用生物材料的关键要点是让ECM类生物材料获得稳定的血供来源和细胞来源。
无论选择何种类型的组织修补材料,最终的目的均为服务于临床诊疗方案的制定。因此在临床实践中,医师可以结合组织修补材料体内转归结果,组织修补材料的组织修补机制,综合患者病情以及术中判断来选择合适的组织修补材料,使患者最大程度获益。
利益冲突声明全体作者均声明不存在与本文相关的利益冲突。