低位直肠癌经肛提肌外腹会阴联合切除术及盆底重建的手术要点*
蒋松松,陈刚
南京大学医学院附属鼓楼医院普通外科 江苏 南京 210008
全直肠系膜切除术(total mesorectal excision,TME)是1982年Heald[1]提出用于治疗低位直肠癌的“金标准”术式。由于直肠系膜在肛提肌平面自然终止,而低位直肠癌常外侵至肛提肌、肛门括约肌及盆底软组织[2],因此TME并不能保证低位直肠癌环周切缘(circumferential margin,CRM)的阴性。研究表明,CRM阳性是直肠癌术后局部复发的重要独立危险因素,其危险程度超过区域淋巴结转移[3]。与中高位直肠癌前切除术(anterior resection,AR)相比,低位直肠癌采用新辅助放化疗并按TME原则行腹会阴联合切除术(abdominoperineal resection,APR)能够切除的瘤周组织较少,CRM阳性率、肿瘤局部复发率较高,5年生存率较低[4-5]。这是因为传统APR常在直肠肌管附近形成狭窄的“外科腰”,而低位直肠癌病灶常位于此,因此CRM阳性率和术中肠穿孔发生率较高。2007年,Holm等[6]采用柱状经腹会阴切除术(cylindrical abdominoperineal resection,cylindrical APR)治疗T3~T4期低位直肠癌,目的是通过行会阴部扩大切除,获得没有狭窄部位的圆柱状直肠癌手术标本,以降低CRM阳性率和局部复发率,该手术又称为经肛提肌外腹会阴联合切除术(extralevator abdominoperineal excision, ELAPE)。但ELAPE会阴部切除范围较大,术后切口裂开、盆底疝、肠梗阻等并发症的发生率增加[7-8]。在低位直肠癌ELAPE中,若直接关闭盆底腹膜,盆底腹膜张力往往较大,常导致盆底腹膜部分甚至完全撕裂,且仅靠一层薄薄的腹膜也难以预防盆底疝的发生,且患者由于术后排尿困难、腹胀、反复咳嗽、骶前负压吸引等因素可进一步促使小肠疝入盆腔。因此,实施盆底重建对于预防ELAPE术后会阴部相关并发症极其重要。目前,比较被认可的盆底重建方法主要有带蒂肌皮瓣重建术和生物材料盆底修复术[9-10]。本文结合笔者团队手术经验,介绍ELAPE手术操作要点,采用大网膜填补、带蒂肌皮瓣转移、生物补片修补等方法重建盆底的手术操作要点,改良ELAPE及其盆底重建的手术操作要点,以期降低ELAPE术后盆底及会阴部相关并发症的发生率。
1 ELAPE手术操作要点
1.1 腹部操作
腹部手术遵循TME原则,开腹或腹腔镜、达芬奇机器人手术均可。直肠后方操作止于尾骨上方,不必将直肠系膜从肛提肌表面解剖分离;直肠前方操作,男性止于精囊(图1A),女性止于阴道后穹窿水平(图1B)。手术操作相对简化,术中不需要分离直肠至直肠系膜终点,从而减少手术时间及难度,对于骨盆狭小或肥胖的患者,腹部手术的操作更容易。腹部手术操作完成后,施行左下腹永久性结肠造口术,常规关腹。
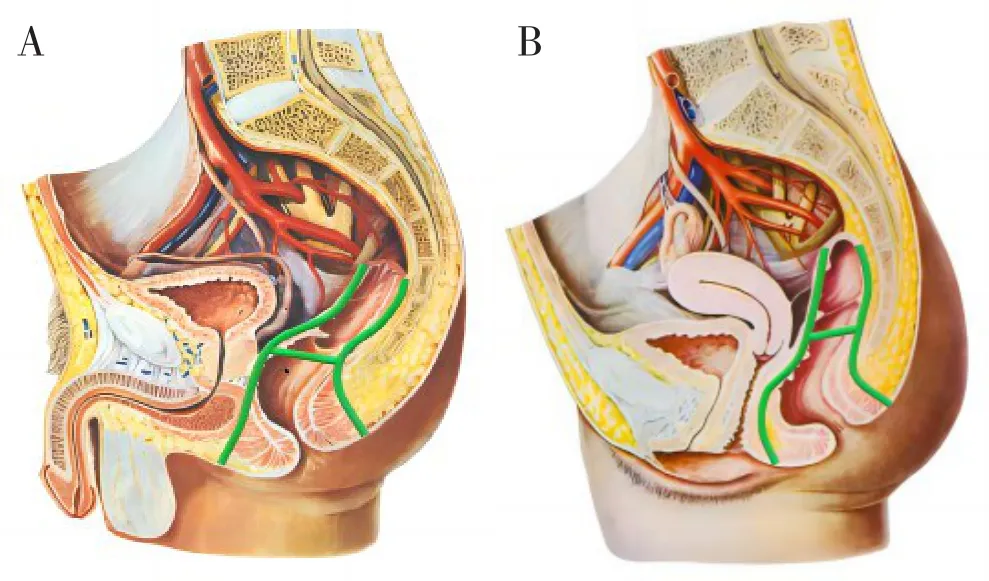
图1 术中手术平面(绿色线条区域)(图片引用自参考文献[11])
1.2 会阴部操作
传统APR手术采取截石位,会阴部手术操作困难,手术视野受限,可能会增加CRM阳性率和术中肠穿孔发生率。ELAPE在完成腹部操作后,将患者体位翻转成俯卧折刀位,在良好的暴露条件下,将肛提肌、肛管、直肠及直肠系膜一并切除。具体操作如下:取俯卧折刀位(取折刀位时,应将患者两腿分开,用宽胶布牵拉臀部两侧,充分暴露患者肛门周围的手术区域),围绕肛门作梭形切口。沿肛门外括约肌皮下部外侧向上游离,环周解剖出肛提肌;沿骶尾关节切除尾骨(切除尾骨会增加术后会阴部疼痛的发生率,如若术野清晰也可不切除尾骨),先从直肠后方进入盆腔,然后沿盆壁由后往前于肛提肌腱弓处切断两侧肛提肌,将近端肠管从盆腔提出,直视下将直肠自前列腺或阴道后壁解剖分离,必要时切除部分前列腺或阴道后壁,离断会阴中心腱,从会阴横肌后方切断盆底肌纤维,取出标本。
2 ELAPE的盆底重建
ELAPE能减少CRM癌组织残留和降低术中肠穿孔发生率,但会阴部扩大切除所造成的盆底较大缺损(图2)如不予修复,很可能会造成盆底疝或会阴疝,因此盆底重建极其重要。下面介绍几种盆底重建的方法。
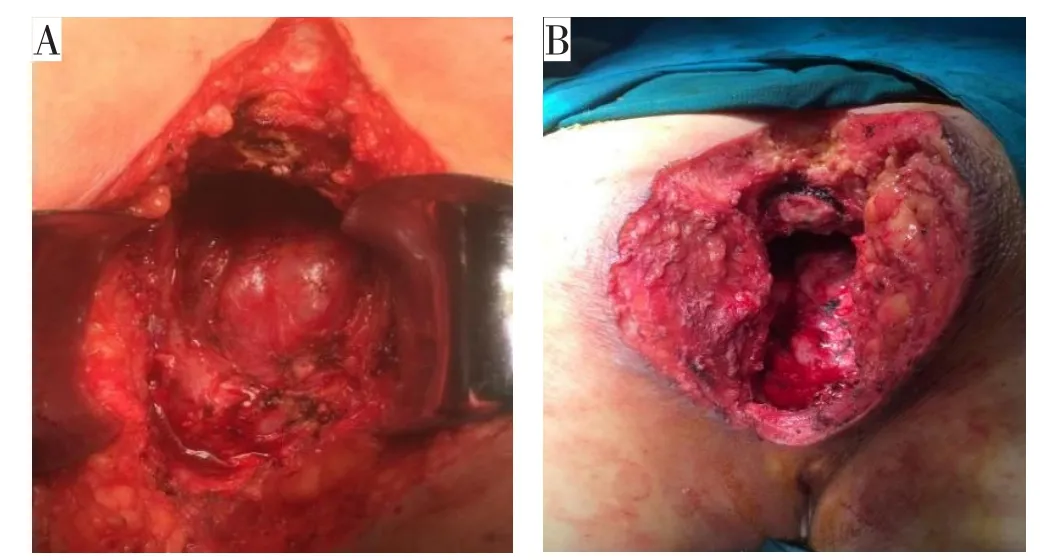
图2 ELAPE术后盆底缺损
2.1 大网膜填补
大网膜填补重建盆底是将大网膜裁剪成舌状,并下拖至盆底,与盆壁筋膜和肛提肌腱弓处的肛提肌断端进行缝合固定,用以填充盆底缺损[12]。大网膜填补重建盆底具有操作简单、手术时间短等优点。要点:(1)游离大网膜时,保留带血管蒂的大网膜,保证大网膜血供;游离大网膜呈舌状,以便于将其下拖至盆底;(2)翻转体位前,将大网膜提前放置在盆底,以便于在进行会阴部操作时可以快速地找到带血管蒂的大网膜;(3)将带血管蒂的大网膜缝合固定在盆壁筋膜和肛提肌腱弓处的肛提肌断端时,应将大网膜平铺在盆底缺损处,并且要保证大网膜有足够的承托力,这样才能有效防止腹腔内的肠管掉入盆底。该手术存在以下缺点:(1)部分患者大网膜长度不足或裁剪大网膜时血管蒂保护不良会导致用于填补的大网膜坏死;(2)大网膜的柔软性及支撑力不足时难以防止腹腔肠管掉入盆底。
2.2 肌皮瓣转移
带蒂肌皮瓣重建盆底需由普外科医师与整形外科医师共同参与,手术操作复杂,手术时间长,患者术后活动受限较多,术后恢复缓慢,并发症发生率较高,患者依从性较差,国内学者较少使用。带蒂肌皮瓣盆底重建的方式主要包括垂直腹直肌肌皮瓣盆底重建、带蒂臀大肌肌皮瓣盆底重建、横行腹直肌肌皮瓣盆底重建等[13]。国外多采用带蒂臀大肌肌皮瓣转移术进行盆底重建[6]。笔者团队也曾采用该术式进行盆底重建,但因手术时间长,术后患者活动受限,术后恢复缓慢等原因,目前很少开展此类术式。该方法通过切断臀大肌内侧缘1/3~1/2肌肉,向头侧和内侧游离,保证转移肌皮瓣无张力;转移肌皮瓣修补盆底缺损时需要分层缝合转移肌皮瓣的肌肉、皮下组织和皮肤;在肌肉深部和皮下组织中各放置一根引流管。带蒂臀大肌肌皮瓣转移术重建盆底的操作要点:(1)根据盆底创面大小及形状设计带蒂肌皮瓣,注意从轴点至皮瓣最远端的距离要大于轴点至会阴部创面最远端的距离;(2)术中应准确判断臀大肌和臀中肌间隙,臀大肌纤维为内上斜向外下,而臀中肌为纵向纤维肌走向;(3)处理肌皮瓣蒂部时,应在肌皮瓣的滋养血管周围保留少量臀大肌纤维,使肌皮瓣的滋养血管与周围组织形成窄小肌肉蒂,这样既能保护血管蒂,又方便带蒂肌皮瓣转移;(4)臀大肌有两组粗而规则的血管神经束,根据这两组血管神经束可分别设计臀大肌上部和下部的肌瓣或肌皮瓣,用以修补盆底巨大缺损[14-15](图3)。

图3 带蒂臀大肌皮瓣移植示意图
2.3 生物补片修补
2011年,英国诺丁汉大学医院首次在ELAPE中使用生物补片修复盆底。生物补片是组织经脱细胞处理,完整保留细胞外基质的三维框架结构的修复材料,可用于污染或感染区域的软组织缺损修复。其修复机制是诱导干细胞进入补片,经内源性组织再生后完成塑形重建。补片可被机体代谢降解且不在体内残留任何异物[16]。生物补片的问世是组织修复领域跨时代的进步。笔者团队也采用生物补片进行盆底重建。本团队采用的百得塞补片是由猪小肠黏膜下层脱细胞制成的组织再生修复材料,是一种非真皮、非交联的生物补片,弹性纤维的含量较低,不易被拉伸,能够诱导机体自我塑形,重建出血管化组织,使再生的组织强韧持久。此外,补片无需交联处理,组织相容性较高,可避免合成补片带来的相关侵蚀与感染风险。研究表明,使用生物补片重建盆底能够降低低位直肠癌ELAPE术后会阴部切口裂开、盆底疝等相关并发症的发生率[17-18]。此外,与带蒂肌皮瓣转移术相比,使用生物补片进行盆底重建操作更简单,手术时间和住院时间更短,患者术后恢复快,值得临床推广[19]。
进行补片固定时,应将补片平铺在盆底缺损处,不需要裁剪补片多余部分,可将其向内翻折,然后用2-0可吸收缝线以“降落伞”式缝合法将补片固定于盆壁筋膜和肛提肌腱弓处的肛提肌断端(图4)。其要点是要在恰当的位置将补片和肛提肌断端逐一缝合,缝线的位置距离补片边缘约1 cm,两针缝合间距约1 cm,以确保补片与组织有最大的接触面积。待全部缝合完成后再统一打结,以确保补片在缝合过程中展平并保持一定的张力(图5)。术后为防止盆底积液,需在骶前部位放置一根负压引流管。引流管自会阴切口旁戳孔引出、固定,并连接负压球,可避免补片周围及盆底积液,同时也有利于补片与周围组织的附着融合,起到加速补片降解,降低盆底感染发生率的作用[20]。最后将皮下组织、皮肤用可吸收线分层缝合,关闭会阴部切口。术后连续引流3天,当引流量小于20 mL/天即可拔除引流管。
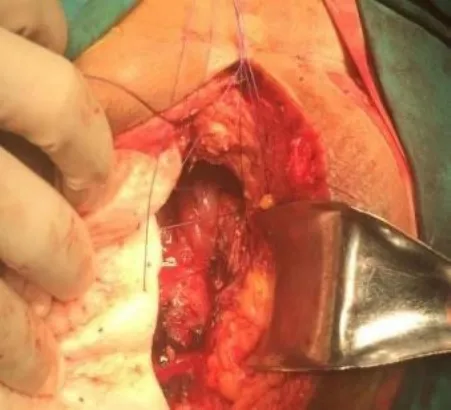
图4 “降落伞”式缝合法固定补片

图5 补片展平并保持一定的张力
3 改良ELAPE及其盆底重建
在临床工作中,我们发现即使是T4期的低位直肠癌病灶也并不都是呈环周生长的,肿瘤往往仅侵犯一侧的肛提肌及盆底软组织。对于T分期较早或仅侵犯一侧肛提肌的病灶,其健侧的肛提肌无癌组织生长,可用于重建盆底。因此,笔者团队对ELAPE进行了改良。改良后的ELAPE尽可能保留了健侧肛提肌及部分患侧肛提肌,利用患者自身肛提肌组织重建盆底,可减少手术创伤。研究表明,改良ELAPE并未增加CRM阳性率和术中医源性解剖穿孔的发生率[21]。
3.1 改良ELAPE操作要点
(1)改良ELAPE不宜过多保留患侧肛提肌,以确保CRM安全。如果术中发现患侧肛提肌难以保留,应及时改行ELAPE。(2)部分患者行肛提肌残端盆底重建后,盆底修补处仍然会存在一定张力,在进行腹腔操作分离直肠尾侧系膜与肛提肌时,应注意保留肛提肌上筋膜;在进行会阴部操作时应注意保留肛提肌下筋膜,以增加肛提肌韧性。(3)在进行腹腔操作时,应尽量保留盆底腹膜以关闭盆底。关闭盆底腹膜可以缓冲肠管下坠,减轻肛提肌残端张力。(4)若病灶未累及肛门外括约肌,可多保留坐骨直肠窝的脂肪,盆底重建时能缩小肛提肌与皮下组织之间的腔隙。
3.2 改良ELAPE的盆底重建
术中使用1-0可吸收缝线间断缝合保留的两侧肛提肌残端,完成全部缝合后统一打结(图6)。术后引流管拔除操作同前述。

图6 改良ELAPE的盆底重建
4 盆底腹膜缺损的处理
ELAPE或APR会造成一定的盆底腹膜缺损。如果术者在术中不关闭盆底腹膜,小肠可能会下坠并粘连于盆底粗糙面,导致不完全性或完全性肠梗阻。大部分术者在术中会尽量保留盆底腹膜,直接对拢缝合盆底腹膜以重建腹膜腔,这种方法简单有效。但在术中往往会发现盆底腹膜缺损较大,难以对拢缝合,勉强缝合常导致腹膜撕裂,尤其是越靠近骶骨岬,缝合张力越大;更甚者,术后小肠下坠导致缝合的腹膜裂开,宽度从1~5 cm不等,导致小肠肠管或部分肠壁疝入其中(图7),造成压迫性坏死。如果发现患者在术后数日内造口不排气并伴有腹胀,应高度警惕前述情况发生。建议行腹部CT(平扫)检查,以明确诊断,及时手术干预,解除梗阻。值得关注的是,盆底腹膜裂开处几乎不在缝合张力最大的骶骨岬处(此处腹膜多半已与盆底紧密贴合),而是在缝合张力相对较小的盆底最深处(道格拉斯窝),其中原因尚不明了,可能与盆底负压吸引、肠管下坠有关。同时,也有部分术者将膀胱底部的腹膜游离,翻转缝合于盆底腹膜缺损处。此方法操作较为复杂,造成的粗糙面宽大,易发生肠粘连。笔者团队采用的方法是将末端回肠系膜平铺于盆底,将背侧的系膜、浆膜间断缝合固定于盆底腹膜(图8)。此方法操作简单,效果可靠,大部分情况下都能施行。
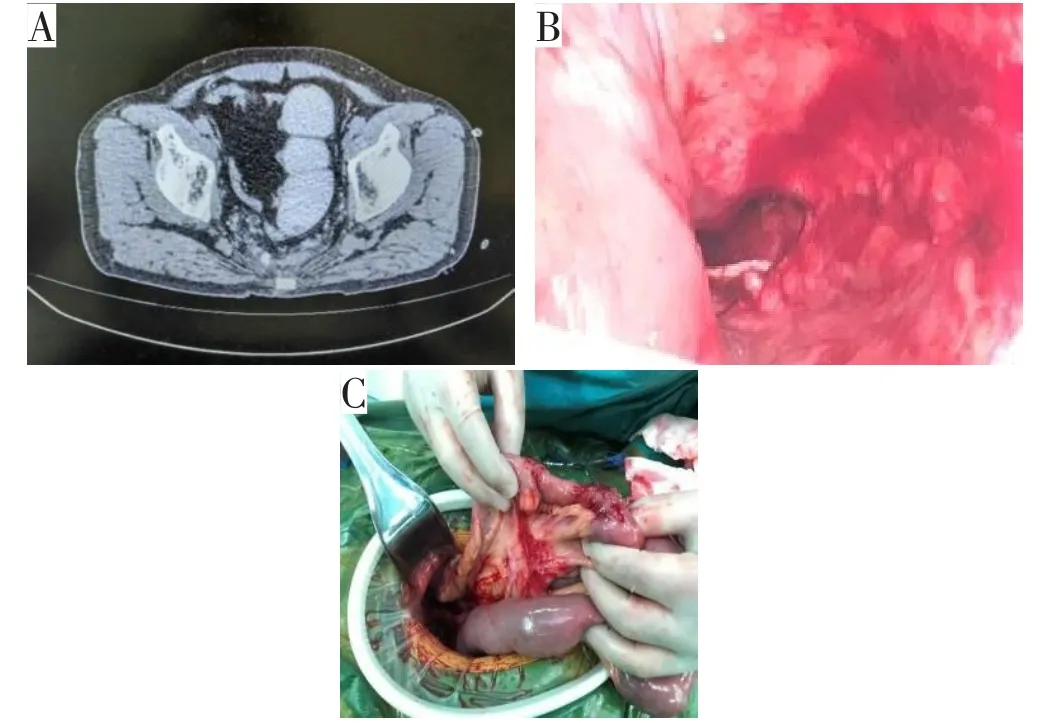
图7 ELAPE术后小肠盆底疝
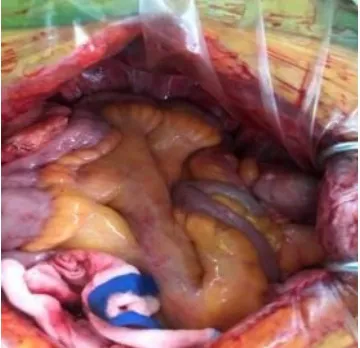
图8 用末端回肠系膜修补盆底腹膜缺损
5 小结
对于不能保留肛门的低位直肠癌患者,ELAPE能有效降低CRM阳性率和局部复发率。但ELAPE会阴部切除范围大,导致盆底及会阴部并发症的发生率相应增高,所以术中盆底重建极其重要。了解和掌握盆底重建要点能有效降低ELAPE术后盆底及会阴部并发症的发生率。因此,术前应完善影像学检查,建议同时行腹腔CT(平扫+增强)及盆腔MRI(平扫+增强)检查,以评估病灶大小、位置、T分期及侵犯肛提肌的范围。对于病灶环周生长、病灶侵犯双侧肛提肌或病灶完全侵犯一侧肛提肌的患者,推荐使用生物补片修补重建盆底。与大网膜填充、带蒂肌皮瓣转移等盆底重建方法相比,生物补片修补操作简单,手术时间和住院时间短,患者术后恢复快,会阴部切口裂开、盆底疝等相关并发症的发生率低。此外,对于T分期较早或仅侵犯一侧肛提肌的病灶,推荐行改良ELAPE,术中尽可能保留健侧肛提肌及部分患侧肛提肌,利用患者自身肛提肌组织重建盆底,其操作简单,手术创伤小,术后恢复快。总的来说,改良ELAPE有望成为无法保肛的进展期低位直肠癌患者的常规术式,术后推荐使用生物补片修补重建盆底,增加患者临床获益。
利益冲突声明全体作者均声明不存在与本文相关的利益冲突。