生物材料治疗肛瘘价值的再思考
曹佳伟,卢梅娟,苏丹,项小强,朱佩旋,任东林△
1中山大学附属第六医院肛肠外科 广东 广州 510655
2广东省结直肠疾病研究重点实验室 广东 广州 510655
3前海人寿广州总医院 广东 广州 511325
4陕西省医疗器械协会 陕西 西安 710076
美国结直肠外科医师协会(The American Society of Colon and Rectal Surgeons,ASCRS) 最新发布的肛瘘及肛周脓肿临床实践指南[1]中对生物材料治疗肛瘘的临床推荐意见描述为肛瘘塞及纤维蛋白胶封堵是治疗肛瘘相对无效的方法,推荐等级为1B级。这是否意味着此类封堵式的肛瘘手术没有价值?而寻找治愈率高,同时又能完整保留括约肌的理想肛瘘手术方法一直是肛肠外科医师追求的目标。因此,生物材料治疗肛瘘的价值仍值得肛肠外科医师思考和探索。本文结合文献就生物材料治疗肛瘘价值的再思考进行评述。
1 生物材料治疗肛瘘的研究现状
目前生物材料治疗肛瘘的常用方式有两种:(1)肛瘘塞(anal fistula plug,AFP)植入手术,即将AFP由内口向外口固定于瘘管,通过生物材料的组织再生功能来促进肛瘘内口和瘘管的愈合。AFP植入手术是由Johnson等[2]与Champagne等[3]教授团队于2006年提出的肛瘘治疗方法。(2)BioLIFT,即在括约肌间瘘管结扎术(ligation of intersphineteric fistula tract,LIFT)的基础上,在括约肌间植入片状生物材料,以生物材料的组织再生功能来再生一层自体组织实现瘘管的隔断与封闭。亦有将二者结合的LIFT-plug。BioLIFT首先见于2008年Ellis[4]教授的报道,国内的临床实践首先由王振军教授团队倡导[5]。
AFP植入手术采用脱细胞基质生物材料再生局部组织来封闭肛瘘内口,通常需将AFP内端固定在内括约肌及内口处,利用生物材料诱导组织生长的特性进行修补。AFP植入手术最初的成功率为83%~87%,且对肛门功能的保护极好,与当时其他手术方法的疗效相比显示出较大的优越性[3]。肛瘘的各种常用手术治疗方法各有利弊,目前尚没有一种手术方法能够在保护肛门功能和降低肛瘘术后复发率二者之间均达到最佳的效果。Johnson等[2]研究中报道高位复杂性肛瘘的整体复发率高达54%,其中采用传统瘘管完全切开术患者的失禁率高达35%,使用纤维蛋白胶治疗患者的瘘管封堵率仅为40%,瘘管完全闭合率甚至低于15%;而推移皮瓣技术的成功率为59.6%~75%,但该技术在操作方面略显困难,且并发症发生率接近40%[6-7]。
在最早期的病例研究中,AFP植入手术治疗腺源性肛瘘的成功率为83%~87%。之后的大规模临床研究数据分析结果提示,AFP植入手术的瘘管治愈率为24%~92%,其中复杂性腺源性肛瘘的治愈率为35%~87%,克罗恩病肛瘘的治愈率为29%~86%,单纯性瘘管的治愈率为44%~93%,多发瘘管的治愈率为20%~71%,术后脓肿形成率为4%~29%,AFP的术后脱落率为4%~41%[8]。上述数据提示AFP术后的治愈率范围波动较大,这或许与样本分层不足、合并其他疾病或干扰因素太多有关。新近的一项前瞻性多中心随机对照研究结果显示AFP和其他类型的肛瘘手术(包括保留括约肌或不保留括约肌的其他手术)相比,治愈率及患者的生活质量并没有明显的差异,但有更高的治疗成本和不确定的结局,这提示AFP植入手术可能并不是一项性价比高的肛瘘治疗方法[9]。生物材料治疗肛瘘的价值一直备受争议。
尽管文献报道生物材料治疗肛瘘的结局差异较大,但也可以看到一些令人振奋的研究成绩。Bio-LIFT最初应用于治疗直肠阴道瘘,它是一种改良的LIFT技术,即在完成瘘管结扎后,将生物材料放置在括约肌间平面,再进行缝合以加固瘘管的闭合,结果显示81%~92%的患者实现了直肠阴道瘘的成功闭合[4]。在此基础上,临床医师将BioLIFT扩大应用于治疗各种类型的肛瘘,治愈率高达94%[10]。
国内一项多中心随机对照研究显示,改良Bio-LIFT较LIFT的愈合率高,愈合时间短,组织损伤程度小,无肛门失禁发生,操作简单,未增加并发症的发生,是一种治疗慢性肛瘘更理想的手术方法[11]。新近的另一项研究显示BioLIFT与LIFT相比,前者治疗肛瘘的治愈率明显提高;另外,虽然手术时间有一定的延长,但是手术步骤简单易学,患者术中无明显不适,出血量也并无显著增加;其他如术后疼痛、肛门功能及创面愈合时间等指标比较差异均无统计学意义[12]。
2 生物材料治疗肛瘘失败的可能原因及解决方案
肛瘘治愈及手术成功标准通常定义为封闭所有内口及外口,没有瘘管、脓肿形成。在有多个内口的患者中,即使一个或多个瘘管已经成功闭合,残留一个持续存在的瘘管也被认为是失败的。尽管生物材料治疗肛瘘的治愈率受到质疑,但它对肛门功能的保护,操作的简便性,微创性及几乎不影响再次手术的优势还是得到临床认可的。基于多种适合保留括约肌手术的场景需求,医师们并没有放弃这种手术方法,而是去分析治愈率差异较大的原因,以便能够更有效率地使用这一治疗方法。此外,笔者认为,如果只根据现有的资料去否定此类手术的价值似乎还为时过早,或许研究设计本身并不太合理,并且该项手术具有一定的学习曲线,因为操作简单,系统培训的重要性似乎并没有得到重视。是否后续的临床实践与最初的推荐方案相比,忽略了某些手术操作的细节或术后某方面处理不当?在系统分析相关文献后,笔者初步总结了以下几方面的原因。
(1)术前:由于深部瘘管和内口存在隐匿的可能,对病灶的结构缺乏正确的认识及精确的客观评估,是手术失败的首要原因,应在术前做详细的体格检查,同时积极地完善辅助检查(如,经直肠超声、核磁共振成像或瘘管造影,甚至肠镜等)以全面地了解病灶情况及判断病情。术前使用松挂线(引流性挂线)是临时促进脓肿消退,使瘘管局限的一个重要措施,它能提高切口局部生长环境的质量。应当避免在瘘管的急性炎症期和脓肿期进行肛瘘手术,尤其应当避免在这两个时期植入任何材料,包括生物材料。然而,关于术前挂线也有争议。有研究表明,内口能否成功闭合与术前是否挂线不直接相关[4]。
(2)术中:术后早期手术失败最常见的原因是AFP的脱落,通常发生在术后1周内。解决方法是术中将AFP的头端埋入主内口,并采用2-0长效可吸收线进行“8”字缝合固定,以防止撕脱。外口处应留出间隙充分引流,不宜缝合过密。不应在过浅的肌束上缝合,过浅的内口周围组织的支持作用往往不足。应充分搔刮并冲洗瘘管上皮及腐烂组织,将AFP与新鲜的瘘管创面充分接触、填塞。若内口太大、分支瘘管粗大,则可能因AFP与组织接触不充分,导致愈合效果不理想。对这个问题的解决方案一是行分期手术,待瘘管及内口缩小后,再次手术以AFP进行修补。方案二是在一期手术中经过内口植入两个以上的AFP,分别植入内口以及分支瘘管以实现充分贴合。
(3)术后:医师需向患者强调在两周内避免过度活动的重要性。由于AFP植入手术的微创性和材料的组织相容性良好,术后患者的不适感轻微,恢复日常活动较早,然而围手术期过度活动(包括性行为等)容易引起AFP移位,从而影响组织再生和瘘管愈合的结果。但也因为上述特性,AFP术后并不需要绝对卧床,适当的体位引流及轻柔地从外口处挤出分泌物对瘘管愈合是有帮助的。术后应避免坐浴,以防缝合线脱落及愈合不良。术后远期的手术失败原因主要是内口不愈合,尤其是高位内口,笔者分析其主要原因是直肠和肛周的压力差易引起AFP移位,以及直肠肛管内有持续污染物(粪便)影响了创面愈合。术后使用抗生素、控制排粪、清洁肠道等措施可能对促进瘘管愈合有一定的好处,但尚存在争议。无论如何,避免用力排粪、保持局部清洁、促进引流通畅的原则是不变的。
整体而言,AFP植入手术治疗单纯性肛瘘的闭合率较高,在高位复杂性肛瘘中,尤其是一个主内口发出多个分支瘘管时,愈合率就相对较低。除手术本身的原因外,样本量小,纳入标准不严格,合并疾病多(如,糖尿病等),手术操作欠规范,缺乏长期随访条件等因素,均可能与不同研究的结果治愈率差异较大相关。
3 生物材料治疗肛瘘的优势应用场景
AFP植入手术及BioLIFT均可应用于各种类型肛瘘的治疗,笔者结合文献报道总结以下几个较适合选择AFP植入手术或BioLIFT的优势应用场景。
(1)肛管前方肛瘘及其他对括约肌保留要求高的场景:肛管前方的括约肌菲薄,尤其是女性,若是选择括约肌切开等传统手术方法,患者出现大便失禁、控便功能不良的概率极高。另外,对于已有肛门括约肌损伤的患者,如多次手术失败同时存在肛门功能损伤,又必须再次手术治疗肛瘘等对于括约肌保护要求高的肛瘘患者,是选择生物材料治疗的最佳指征。
(2)单纯经括约肌型肛瘘:据文献报道,AFP放置在单一开口的瘘管比在复杂性瘘管中成功率更高[13-16]。王振军教授团队的研究结果提示,Garg分级为Ⅰ级和SJUH分级为Ⅲ级的患者,即单纯的低位经括约肌型肛瘘,是选择生物材料治疗的适应证之一,治愈率较高[14]。Garg分级和SJUH分级详见图1。

图1 Garg分级和SJUH分级(图片引用自参考文献[14])
(3)克罗恩病肛瘘:O’Riordan等[17]的系统综述结果提示肛瘘封堵术治疗克罗恩病肛瘘患者的总体成功率为54.8%。鉴于克罗恩病肛瘘患者具有相对较低的局部组织生长能力,生物材料的植入可以促进瘘管的愈合,增加闭合的概率。AFP植入手术及Bio-LIFT可作为克罗恩病肛瘘患者经过局部挂线充分引流后,行确定性根治手术时的一线治疗方案。
(4)儿童肛瘘:Kouchi等[18]研究中应用AFP植入手术治疗儿童肛瘘,结果显示72.7%的患者成功治愈,且治疗后未见任何后遗症。儿童在3~5岁前应避免行瘘管切开术或瘘管切除术,但如果是多发性瘘管或瘘管较长,传统手术的侵入性较大,而且有损伤括约肌的风险,这对患者术后长期的潜在影响是不容忽视的。对于这类患者,AFP植入手术修补效果良好,并发症少,且手术操作简单,手术时间短,疼痛轻,治愈率高。因此建议APF植入手术作为儿童难治性肛瘘的首选治疗方法。
4 生物材料应用于肛瘘治疗的机制和意义
目前,应用于肛瘘治疗的生物材料主要是来自自然生物体的脱细胞外基质(extra cellular matrix,ECM)材料。ECM作为一种携带生物信号的支架,可以诱导组织细胞的爬行生长,从而实现愈合,而材料本身可完全再生塑形,即通过再生血供丰富的自体组织来实现长期修复。鉴于ECM类生物材料良好的组织相容性、具有诱导组织生长的能力、耐受局部感染等优越特性,目前仍有不少学者和临床专家对生物材料治疗肛瘘的前景充满期待,并且在进行积极地探索和总结。ECM类生物材料常见的组织来源包括皮肤、心包膜、心瓣膜、小肠黏膜下层等,其中取自猪小肠黏膜下层组织的原材料又称SIS(Small Intestinal Submucosa),前文所述的APF植入手术及BioLIFT植入的生物材料的主要成分即SIS来源的ECM,可以简称为SIS材料或者Biodesign百得塞R生物材料。
SIS材料本质上是猪小肠黏膜下层组织经过脱细胞等一系列工艺处理后的ECM,其中含有丰富的结构和功能成分,二者共同参与到组织再生的过程。以其结构成分为例,SIS来源的ECM结构成分主要为猪源性的胶原蛋白,主要包含有Ⅰ型胶原蛋白,同时还含有少量的Ⅲ型胶原蛋白。Ⅰ型胶原蛋白的生物学功能是通过自身特异性位点与细胞表面的特异性受体结合,激活信号传导通路,促进细胞的粘附、增殖和分化[19]。而Ⅲ型胶原蛋白的生物学功能是强化微血管强度与弹性,提供充足的细胞养分,并直接与血管母细胞结合促进新生血管形成。Ⅰ型胶原蛋白普遍高表达于各个组织中,而Ⅲ型胶原蛋白在血管和肺泡间质内含量较高,其他组织中也有发现,但分布杂乱且含量低。胶原蛋白之间通过疏水相互作用、范德华力等弱相互作用彼此聚集、交联,在微观上形成富含多孔的三维微观结构,其具有和人体组织类似的细胞支架结构,便于细胞的长入[20],实现组织修复及重建功能。由此可以看出SIS材料的结构成分有利于促进细胞的粘附、增殖、分化等活动,此外SIS材料中富含的生物化学分子等功能成分也有助于募集细胞,并调节组织再生的过程。
SIS材料的生物学特性主要包括以下几点。
(1)免疫原性:APF通过高低渗的方式去除材料中的细胞成分,保留细胞外的网状胶原结构,再通过碱处理的方式进一步去除细胞碎片和遗传物质,最后通过辐照灭菌工艺杀死细菌和可能附带的病毒。通过以上工艺制备的产品其主要结构成分为胶原蛋白[21],而胶原蛋白在哺乳动物中为保守蛋白,物种间几乎没有差异性,因此胶原蛋白具有低免疫原性的特性[22]。该类型材料已作为组织修复材料广泛应用于临床,同时不会导致免疫介导的炎性反应。除此之外,SIS来源的ECM还可以诱导促再生反应,其主要机制在于mTOR/Rictor依赖的Th2细胞途径,该途径引导IL-4依赖的巨噬细胞极化,这对功能性肌肉修复至关重要[23]。使用SIS来源的ECM激活适应性免疫系统可能会促进系统和局部再生免疫反应的发生,最终促进组织再生修复。
(2)生物相容性:Badylak等[24]采用六种不同类型的细胞种植于SIS脱细胞基质材料中,连续观察2周,对该材料的细胞相容性进行评价。六种不同类型的细胞分别为NIH小鼠3T3成纤维细胞、NIH 3T3/J2成纤维细胞、人前成纤维细胞、人前角质细胞、人微血管内皮细胞(HMECs)、大鼠骨肉瘤细胞(ROS),结果表明六种细胞均显示出在SIS材料下的粘附和增殖能力,同时所有成纤维细胞系可以扩散和/或迁移到SIS材料结构内部。总之,该项研究显示SIS材料提供了三维微环境结构,允许细胞迁入、生长、增殖,具有良好的细胞相容性。张凤兰等[25]参照国际标准ISO10993制定医疗器械生物学评价的相关检测方法,通过细胞毒性试验、热原试验、溶血试验、致敏试验、肌肉刺激试验等体内外生物学实验相结合评价小肠黏膜基质下层材料的生物相容性,结果表明小肠黏膜下层基质材料相容性良好,无溶血,无致热、致敏反应;肌肉刺激试验的组织学检测中,发现小肠黏膜下层基质材料周围无明显炎症反应及排斥反应,材料部分降解并见大量结缔组织生长。以上结果均表明小肠黏膜下层基质材料具有良好的生物相容性。
(3)可降解性:猪小肠黏膜下层脱细胞后的ECM在人体内会被逐渐被代谢为各类氨基酸和肽。在降解时间方面,由于材料的保存、处理工艺不同,材料的降解时间、降解周期也不完全一样。必须说明的是,使用ECM类生物材料并不应当过度强调材料本身的降解时间。一方面,ECM类生物材料在植入体内与宿主细胞结合之后才会开始发生变化,而在这个变化过程中,宿主细胞实现的是以新生组织替代植入的ECM类生物材料的过程,而不是材料被动降解的过程,因此所谓的降解时间和组织再生的时间是高度重叠的,应当作为一个整体来看。另一方面,材料在体外实验中测试得出的降解时间并不等同于植入体内之后的降解时间,材料在植入体内之后的组织再生塑形时间受到患者年龄、病情、局部组织条件、临床管理干预等多个因素的影响,并不能够以一个体外测试得出的降解时间一概而论。总而言之,ECM类生物材料并不是另一种可吸收补片。笔者团队曾开展了脱细胞黏膜基质材料的大鼠皮下植入实验,将脱细胞黏膜基质材料植入大鼠皮下,植入后1周、2周、4周、8周、17周、26周取样,苏木精—伊红染色检测组织学结果显示材料植入大鼠皮下1周后可明显辨别,与受体组织明显区分(图2A);植入2周、4周后,植入部位炎症细胞聚集较密,炎症反应明显,同时材料仍然可辨别,但有明显降解迹象(图2B、图2C);植入8周后,植入部位已无炎症细胞聚集,同时已无法区分受体组织和植入材料(图2D);植入17周、26周的结果显示,植入部位已近完全恢复正常,无炎症反应,也无法辨别植入材料(图2E、图2F)。该研究结果表明SIS材料植入大鼠皮下8~17周后,植入材料被新生组织替代。
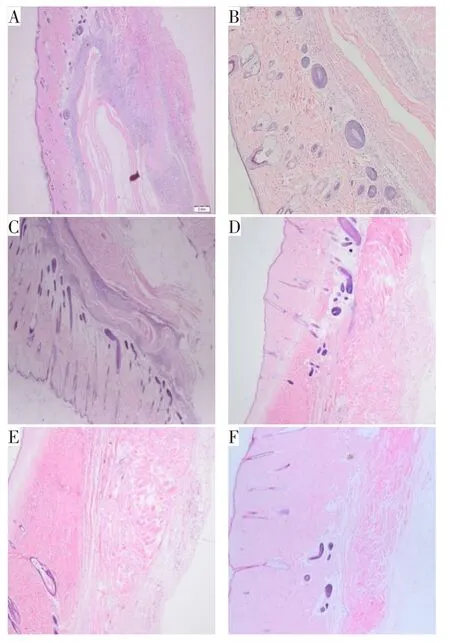
图2 大鼠皮下植入SIS材料实验(苏木精—伊红染色,×40)
SIS来源的ECM类生物材料的促进组织愈合的作用原理如下:SIS来源的ECM类生物材料微观结构具有天然的三维胶原支架孔隙结构,可以作为微环境诱导组织再生。ECM类生物材料具有的生物活性调节作用可以促进细胞的增殖和活性因子的分泌,在伤口愈合过程中细胞外基质,生长因子及细胞互相作用形成一个动态的过程。脱细胞基质吸附宿主组织分泌的细胞因子,刺激内皮细胞分泌血管生成因子,诱导成纤维细胞及上皮细胞增殖,形成新生自体组织,促使伤口愈合(图3、图4)。

图3 血管长入材料以及细胞与ECM结合过程示意图(图片来源于Cook Biotech库克生物技术公司资料)

图4 ECM诱导细胞长入过程(苏木精—伊红染色)(图片来源于笔者科室)
以SIS材料制成的肛瘘塞、软组织补片应用于肛瘘治疗,在植入初期通过与周围正常组织的接触和贴附,为组织长入提供空间;随即通过诱导组织作用,主动促进血管长入材料,细胞定向与材料结合,启动组织再生塑形的进程;随着组织再生塑形过程的进行,材料最终被具有正常血供和有序结构的自体组织完全替代。
5 小结与展望
生物材料治疗肛瘘的主要目的在于利用生物材料的组织再生塑形功能促进瘘管愈合,从而实现瘘管封闭、内口愈合。理想的治疗状态为既治愈肛瘘又完整地保护肛门功能和外观。尽管在过去10余年的实践中,两极分化式的临床研究结果让这类手术备受争议,但鉴于多种需要保留约肌的场景,以及生物材料治疗方案的操作简便性、微创性,不少学者和临床医师仍然选择继续探索生物材料治疗方案的价值,例如如何恰当选择适用病例,如何提高手术成功率。目前的研究表明,在肛管前方肛瘘、单纯的低位经括约肌型肛瘘、克罗恩病肛瘘、儿童肛瘘中使用ECM类生物材料治疗,是价值相对明确的优选治疗方案之一。当然,未来还需要更大样本的高质量临床研究,来进一步评价生物材料治疗方案在肛瘘治疗中的有效性和安全性。
利益冲突声明全体作者均声明不存在与本文相关的利益冲突。