不同淀粉对高水分组织化花生蛋白品质影响
关家乐,张一凡,朱 晶,梁春艳,朱旻鹏,肖志刚
(沈阳师范大学粮食学院,沈阳 110034)
高水分组织化植物蛋白具有与动物肉相似的产品特性和感官[1],营养特性、质地、味道和外观与肉类相似[2],在饮食上以组织化植物蛋白替代动物蛋白可降低人们体重、胆固醇和血压水平,从而降低患心脏病和癌症的风险[3]。虽然高水分组织化植物蛋白可以与动物肉的纤维结构相媲美,但要达到与动物肌肉组织对产品整体感官特性的影响效果仍然具有挑战性[4]。通过显微镜观察,挤压变性的组织化植物蛋白不具有肌肉纤维或纤维束的三维各向异性结构,肌肉纤维的质地及其固定水分的毛细作用才是肉类最理想的结构属性[5]。所以为了弥补这些差异,通常在植物替代产品中添加各种增稠剂、水结合剂和质地增强剂等以改善组织化蛋白持水和持油性。淀粉具有独特的增稠、凝胶、黏结、成膜、润胀、糊化等特性,可作为增稠剂、增强剂,增强组织化蛋白产品保水性,改善口感和色泽,使挤压过程以及产品的性质稳定[6]。Bon-Yeob等[7]研究表明添加10%玉米淀粉的组织化大豆蛋白比纯组织化大豆蛋白具有更好蛋白质网络结构。Zhang等[8]研究高水分挤压花生蛋白时,加入2%小麦淀粉,使挤出物氢键的数量显著增加,疏水作用、氢键与二硫键的相互作用均显著增强。Nanta等[9]研究羟丙基淀粉对组织化大豆蛋白产品质构特性的影响,添加羟丙基淀粉的组织化蛋白产品的硬度和胶着性均比对照样品有所降低。木薯淀粉(CS)分子内和分子间存在大量氢键,糊化温度低,能较早吸水溶胀,可改善肉制品的吸水、吸油性。乙酰化二淀粉磷酸酯(ADSP)具有较好的凝胶性,在肉制品中作为凝胶剂、保水剂、增稠剂和组织赋形剂。羟丙基淀粉(HS)在高温下黏度高并且稳定,与蛋白的加热变性同时发生可增加蛋白三维网络结构的稳定性[10]。这3种淀粉均有改善组织化蛋白品质的潜力,研究高水分挤压条件下淀粉类添加剂与植物蛋白的相互作用,对改善组织化植物蛋白食品的结构和功能具有重要意义。
本实验利用双螺杆挤压机生产高水分组织化花生蛋白,研究木薯淀粉、乙酰化二淀粉磷酸酯和羟丙基淀粉对组织化花生蛋白品质改良和蛋白结构的影响,为组织化植物蛋白的产业化生产提供参考。
1 材料与方法
1. 1 材料与设备
花生蛋白粉(蛋白质质量分数59.6%,干基);大豆分离蛋白(蛋白质质量分数87.4%,干基);木薯淀粉、乙酰化二淀粉磷酸酯、羟丙基淀粉,均为食品级;磷酸盐缓冲液、尿素(Urea)、十二烷基硫酸钠(SDS),均为分析纯;2-巯基乙醇(2-ME)为生物级。
DS56-Ⅲ双螺杆挤压机;CT3质构仪;CR-400色彩色差计;VETEX80傅里叶红外光谱仪;S4800扫描电子显微镜;Scientz-12冷冻干燥机;DR-3000酶标分析仪。
1. 2 方法
1.2.1 高水分组织化花生蛋白的制备
采用双螺杆挤压机挤出、冷却成型,挤压机由进料、挤压和控制系统组成,螺杆直径36 mm,长径比为40∶1。花生蛋白粉和大豆分离蛋白按4∶1比例混合,将木薯淀粉、乙酰化二淀粉磷酸酯和羟丙基淀粉分别按0%、3%、6%、9%和12%的比例加入后混合均匀。挤压参数设置:5段控温双螺杆挤压机各段由进料端至出料端的温度设置分别为60、80、130、160、160 ℃,螺杆转速 280 r/min,喂料速度8.5 kg/h,冷却温度55 ℃、物料含水量60%。
1.2.2 组织化度测定
样品裁剪形状如图1所示,厚度为10 mm,挤出方向如图1所示(FV)。采用 NONE 探头和TA-SBA夹具对样品进行剪切,剪切程度为样品厚度的70%,设置测试前速度、测试速度和测试后速度均为1 mm/s,组织化度为横向剪切力所做的功与纵向剪切力所做的功的比值[11],每个样品测量5次,取平均值。
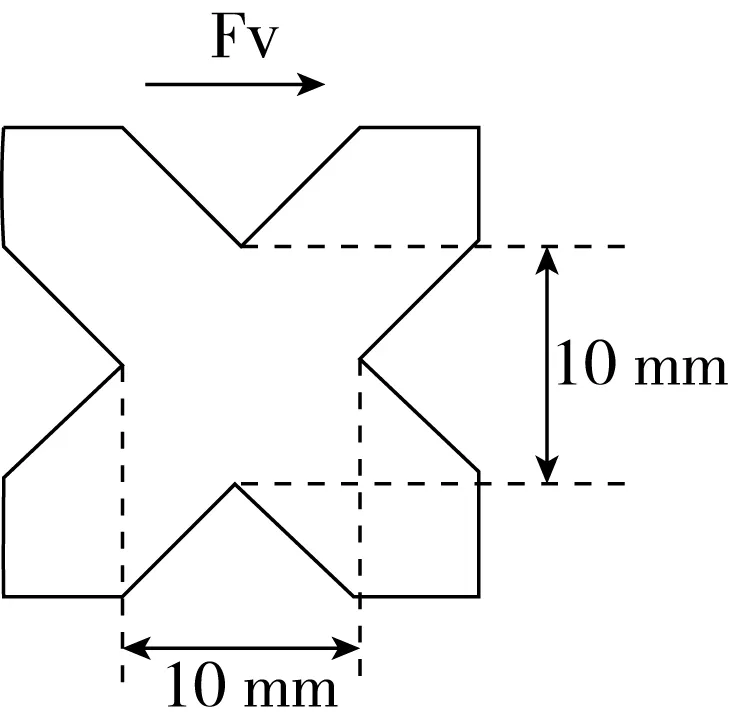
图1 组织化度测定样品形状示意图
1.2.3 色泽测定
采用色差仪对花生蛋白组织化样品的5个不同部位测定色泽,取平均值,应用L*、a*、b*表色系。L*为明度指数,值越大表明被测物越白亮。a*为红色度、b*为黄色度,ΔE表示产品与白色板的色差。
(1)
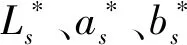
1.2.4 质构测定
选取硬度、内聚性、弹性、咀嚼性和胶着性5个指标反映挤出物的质构特性。测定样品边长为25 mm的正方形。质构仪的操作参数为:TPA 模式,探头 TA7,测试前、后速度均为1.0 mm/s,下压程度10%。每个样品测量5次,取平均值。
1.2.5 吸水、吸油能力
吸水能力(WAC)和吸油能力(OAC)的测定采用Sosulski等[12]方法,并略有修改。WAC测定:2 g冻干研磨样品与30 mL蒸馏水充分混合1 min,3 000 r/min离心30 min,离心后丢弃上清液,称样品的离心管质量,WAC表示为每克样品吸收水量。OAC测定:将1 g冻干研磨样品与10 mL玉米油于预称重的离心管中混合,搅拌2 min,使样品完全分散在油中,28 ℃静置30 min,3 000 r/min离心30 min,丢弃上清液倒置10 min,沥干油后称重,OAC表示为每克样品吸油量。所有样品均重复测定3次取平均值。
(2)
(3)
式中:m0、O0为干燥样品质量/g;m1、O1为离心管与样品总质量/g;m2、O2为离心管与沉淀物总质量/g。
1.2.6 傅里叶变换红外光谱分析(FT-IR)
根据Wang等[13]方法,准确称量2 mg样品及198 mg KBr ,使用液压机将其制成1~2 mm厚薄片。共进行了64次扫描,分辨率为4 cm-1,扫描范围为400~4 000 cm-1。溴化钾粉末作为空白,通过peakfit软件进行红外光谱拟合处理求蛋白质二级结构含量。
1.2.7 蛋白质溶解度测定
根据张金闯[14]的方法配制浸提溶剂:①0.04 mol/L pH 7.6,磷酸盐缓冲液(P);②pH 7.6,P+8 mol/L Urea溶解液;③pH 7.6,P+0.1 mol/L 2-ME溶解液;④pH 7.6,P+1.5%SDS溶解液;⑤ pH 7.6,P+8 mol/L Urea+0.1 mol/L 2-ME溶解液;⑥ pH 7.6,P+8 mol/L Urea+1.5%SDS溶解液;⑦pH 7.6,P+1.5%SDS+0.1 mol/L 2-ME溶解液;⑧pH 7.6,P+8 mol/L Urea+1.5%SDS+0.1 mol/L 2-ME溶解液。
样品浸提与稀释:不同挤压区段样品经过冷冻干燥后,粉碎,过80目筛网。取粉状样品0.25 g于25 mL烧杯中,分别加入10 mL8种溶剂,常温下搅拌浸提1 h后,放入冰箱4 ℃保存,离心(12 000 g,10 ℃,15 min),取上清液。沉淀中再分别加入10 mL 8种浸提溶剂,重复浸提2次,离心。取0.05 mL上清液于1.5 mL离心管中,加入0.95 mL去离子水,将上清液稀释20倍,用摇床混匀(160 r/min,1 h)。加20 μL上清液到 96 孔酶标板中,采用 Lowery法测得(测定波长650 nm)上清液中可溶性蛋白含量,原料和挤出样品中总的蛋白质含量采用凯氏定氮法测定。
蛋白质白质溶解度=
(4)
总蛋白质量浓度=
(5)
根据 Chen等[15]的方法,对蛋白质不同结合状态化学交联键分析:(1)天然状态蛋白,①;(2)氢键,②-①;(3)二硫键,③-①;(4)疏水相互作用,④-①;(5)氢键和二硫键交互作用,⑤+①-②-③;(6)氢键和疏水相互作用交互作用,⑥+①-②-④;(7)疏水相互作用和二硫键交互作用,⑦+①-③-④;(8)氢键、疏水相互作用和二硫键交互作用,⑧+②+③+④-①-⑤-⑥-⑦。
1.2.8 扫描电子显微镜(SEM)
将挤压样品沿纵向切割,样品冷冻干燥48 h,并使用场发射扫描电子显微镜在5 kV电子束操作下分析挤压样品切面微观结构,放大倍数500倍。
1.3 数据处理与分析
运用SPSS软件进行统计分析,每组实验做3次平行,采用Duncan对数据进行显著性分析(P<0.05),利用Origin 2017软件对数据进行绘图处理,结果的表达采用平均值±标准偏差的方式。
2 结果与讨论
2.1 淀粉对花生蛋白产品组织化度的影响
由图2可知,随着ADSP和HS含量的增加,产品组织化度先增加后降低,添加3%的ADSP和6%的HS可提高产品组织化度,而添加CS对产品组织化度没有显著改善。添加少量淀粉可提高产品组织化度,改善组织结构,产品纤维状结构比较细,排列紧密。这说明添加淀粉有利于沿挤压方向形成纤维结构,使组织化蛋白产品结构紧密。分散在蛋白质分子之间的淀粉可以改善蛋白的流动性和柔韧性,进一步促进各向异性纤维结构的形成。添加12%CS、12%ADSP和12%HS组织化度下降,纤维状结构比较粗,结构松软。添加大量淀粉形成的淀粉-蛋白质复合物会阻碍蛋白质的结合和聚合,此外,淀粉和蛋白之间的作用力可能导致产品更高的表面张力,从而阻止纤维结构的形成[16]。淀粉含量越高,淀粉本身的膨化作用增大了组织化蛋白产品组织结构间的缝隙,不利于产品成型。
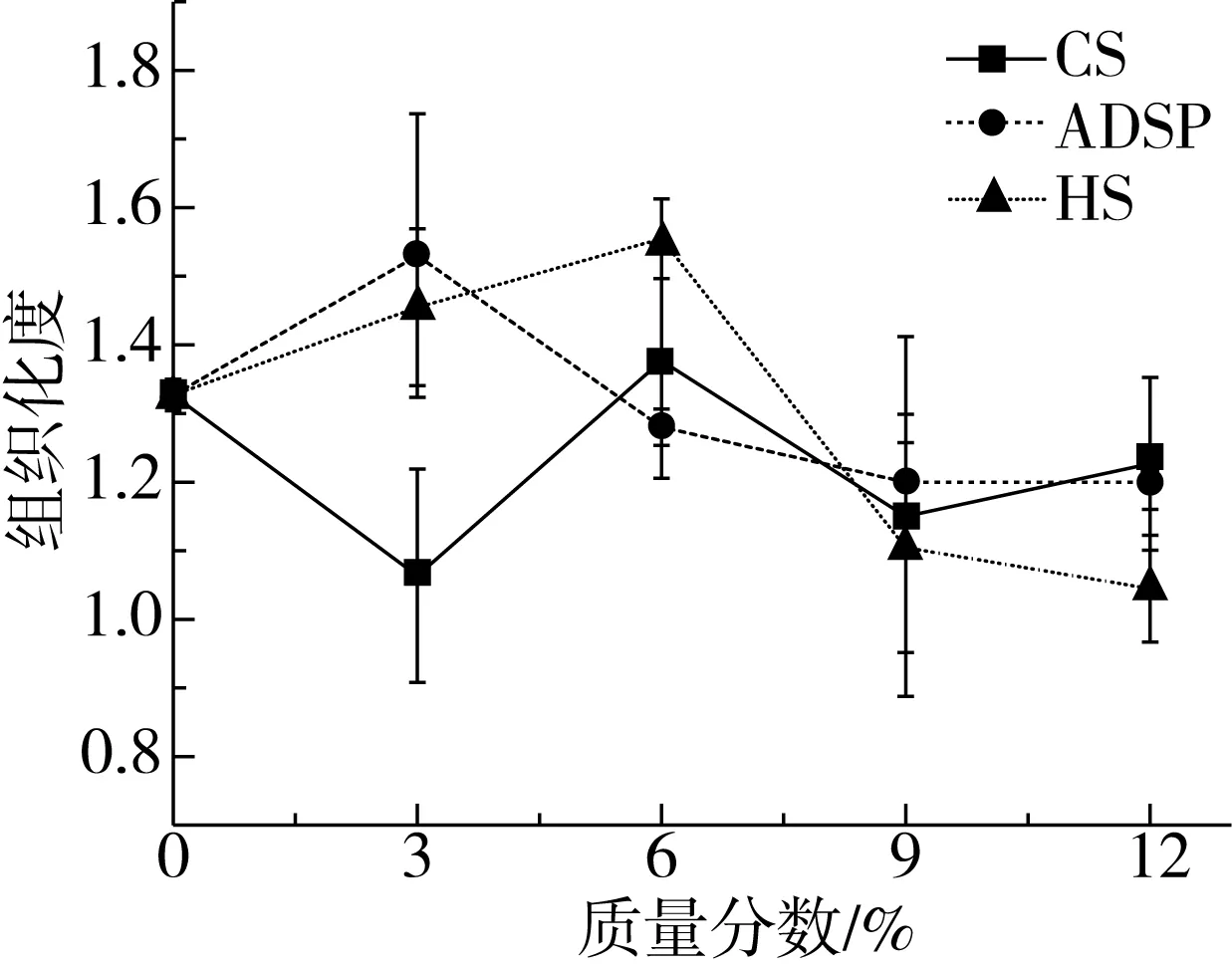
图2 淀粉对组织化蛋白产品组织化度的影响
2.2 淀粉对组织化花生蛋白产品色泽的影响
由表1可知,随着淀粉含量的增加组织化蛋白产品L*值逐渐升高,a*、b*和ΔE降低,产品色泽越来越明亮。常晓明等[17]研究表明淀粉的添加显著地影响了大豆组织化蛋白的颜色,并且添加量越高产品颜色越浅。添加ADSP组织化蛋白产品L*值显著高于另外2种淀粉,且产品a*、b*和ΔE显著低于其他淀粉,这可能由于ADSP糊化后比其他2种淀粉具有更高的透明度。添加CS组织化蛋白产品L*值较低,可能由于CS中含有较多的支链淀粉,支链淀粉能促进蛋白质分子间的相互作用,导致游离氨基的丢失[18],有利于发生美拉德反应导致产品颜色加深。Hellemans等[19]研究表明支链淀粉对分子降解更为敏感,会转化为短链糊精和低聚糖,它们可能通过美拉德反应与蛋白质的氨基相互作用。
2.3 淀粉对组织化花生蛋白产品质构特性的影响
如表2所示,随着CS和ADSP添加量的增加,产品硬度、胶着性和咀嚼性降低,这与Phawinee等[9]研究结果一致。蛋白与淀粉混合物在加热过程中表现出互相独立的热特性,淀粉的存在会与蛋白竞争水分,添加大量淀粉不利于形成蛋白质多孔网络结构,导致组织化蛋白产品质地松软。但CS添加后对产品内聚性和弹性影响不显著,ADSP可增加产品弹性。随着HS添加量的增加,产品内聚性升高,弹性和咀嚼性降低,HS的添加虽使产品硬度与胶着性降低,但在6%添加量时,产品的硬度、咀嚼性和胶着性仍较大。表明添加6%HS可增强蛋白三维网络结构的稳定性,有利于挤压组织化蛋白产品高纤维状结构的形成。羟丙基淀粉因氢键作用较弱,二硫键作用加强,蛋白三维网络结构得到稳定。
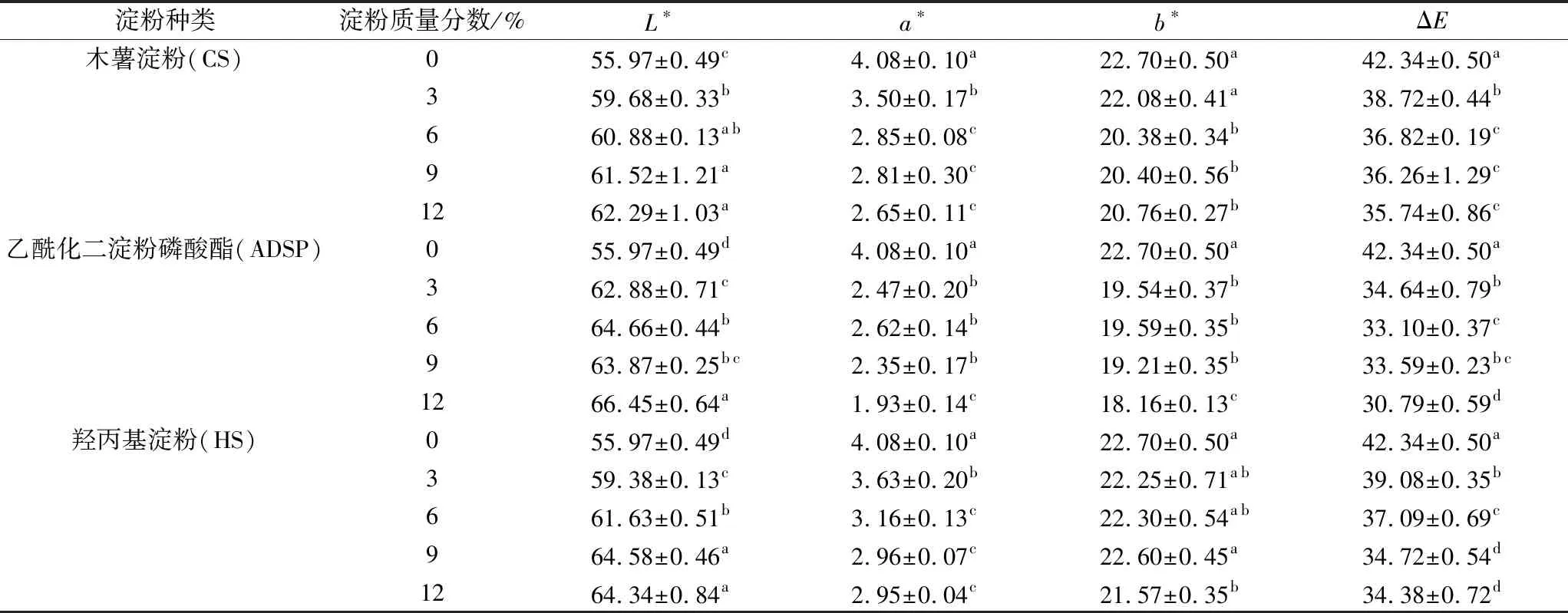
表1 淀粉对组织化花生蛋白产品色泽的影响
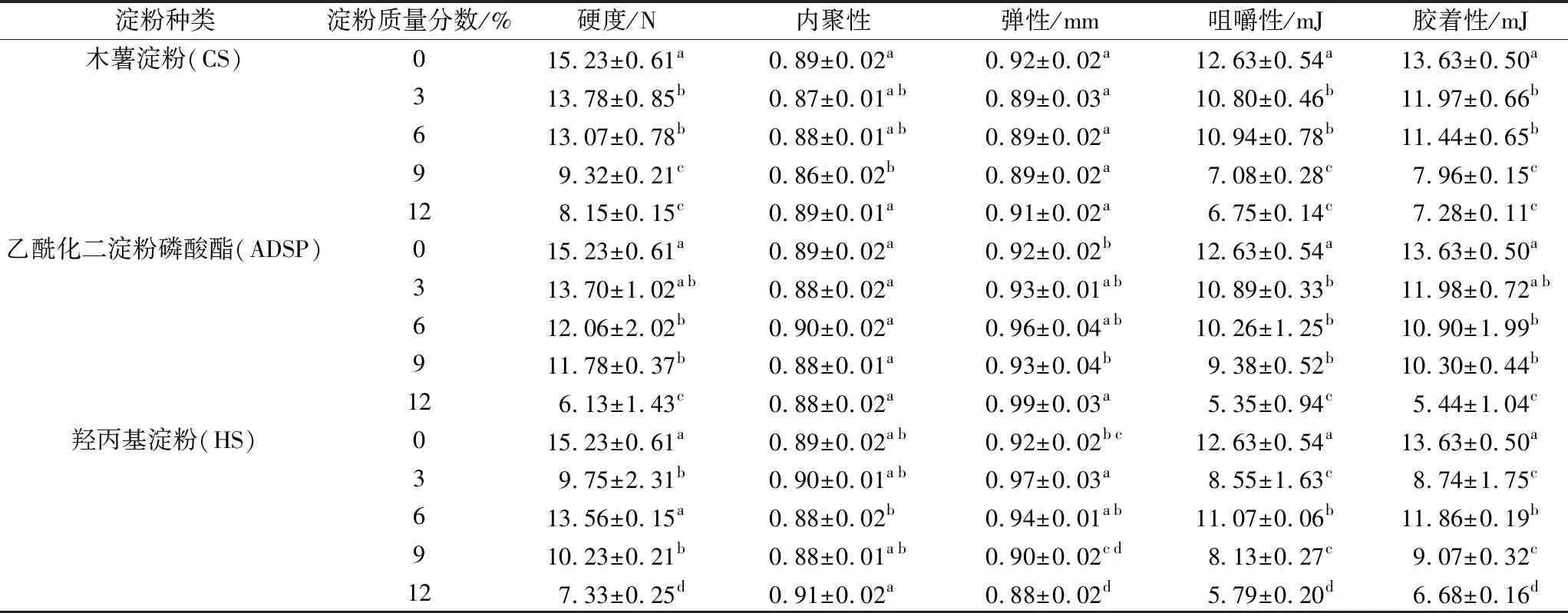
表2 淀粉对组织化花生蛋白产品质构特性的影响
2.4 淀粉对组织化花生蛋白吸水吸油能力的影响
由图3可知,添加ADSP和HS后组织化蛋白的WAC略有提高,这可能由于ADSP和HS与蛋白以及与水分子之间的相互作用,使组织化蛋白具有更高孔隙率。而CS在添加量为6%、9%的条件下WAC基本不变,3%和12%的条件下WAC略有提高,且与ADSP和HS相同添加量时的WAC相近。由于HS与蛋白的加热变性同时发生,二硫键作用加强,蛋白三维网络结构比较稳定,吸水能力比较强,HS添加量为12%时组织化蛋白吸水能力最强。在相同条件下,添加CS的样品吸水性低于添加ADSP和HS的样品,这可能由于木薯淀粉糊化温度较低,较早的吸水溶胀,不利于同蛋白质共同形成多孔网络结构。
由图4可知,添加3种淀粉均可提高组织化蛋白的OAC,在添加量相同的条件下,HS对OAC的提高最大,ADSP次之,CS最小。CS在添加量为3%时吸油力最高,ADSP添加为12%时吸油力最高,HS在添加量为9%时吸油力最高。原因可能是淀粉的糊化加大了物料的膨化,使得蛋白质凝聚度降低,结构越来越疏松,气腔增大,持水性、持油性变好,同时淀粉与油脂可以形成淀粉-脂肪复合物,使样品吸油能力逐渐增加。杨勇等[20]采用高湿挤压技术制备玉米淀粉-大豆分离蛋白基素肉,玉米淀粉添加量控制在 3%~4%范围内,持水性和持油性相对较高。
2.5 傅里叶变换红外光谱分析

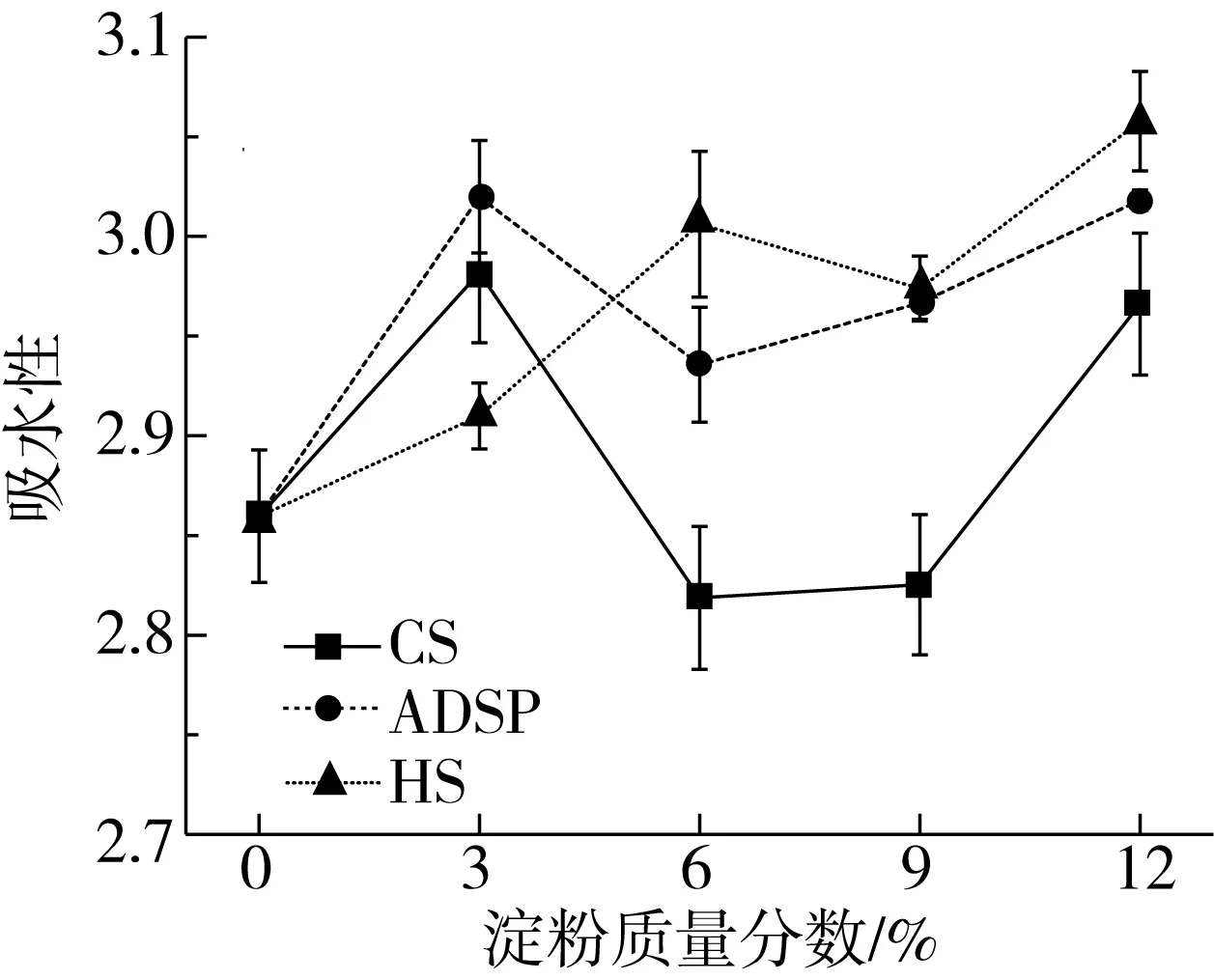
图3 淀粉对组织化花生蛋白吸水能力的影响
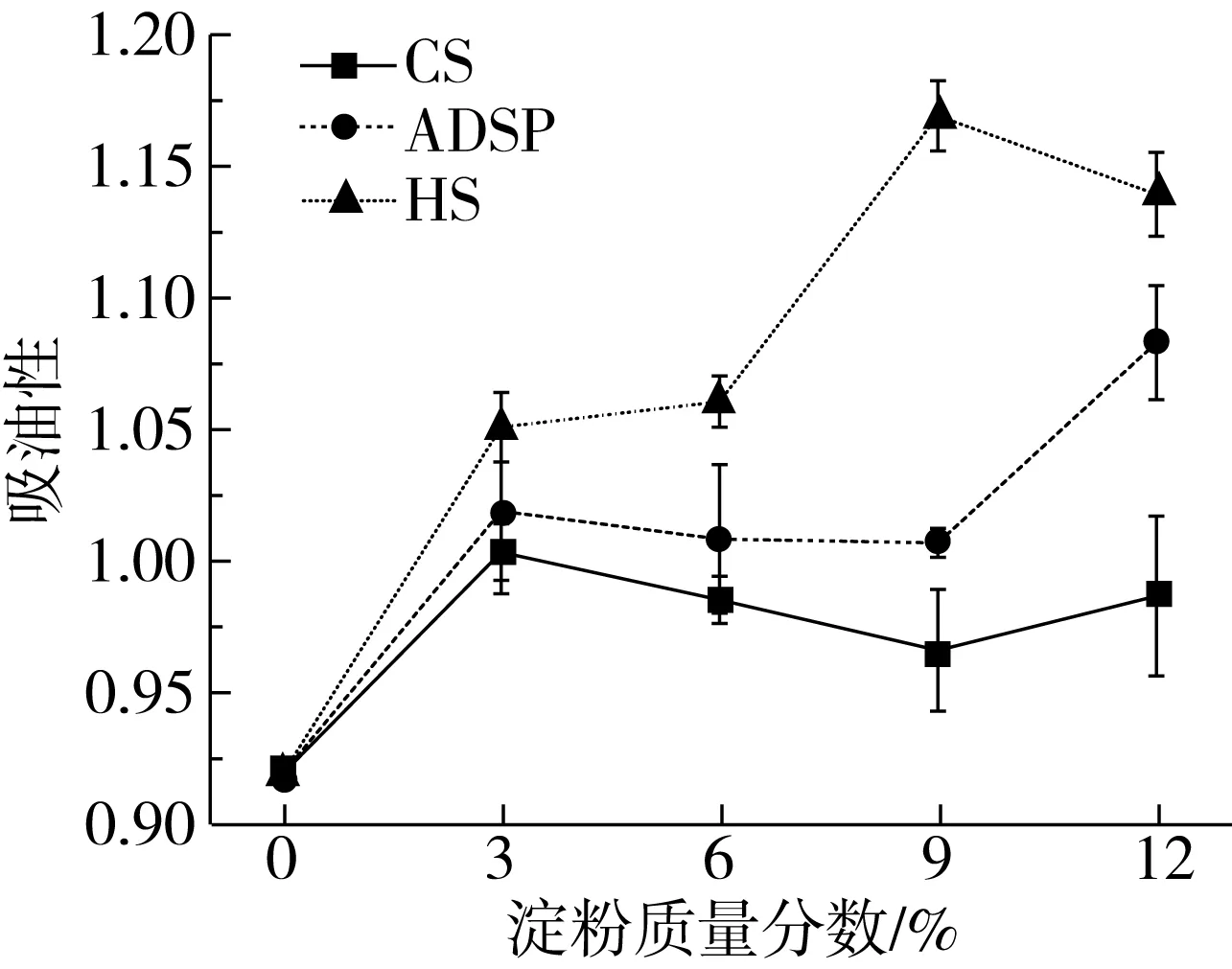
图4 淀粉对组织化花生蛋白吸油能力的影响
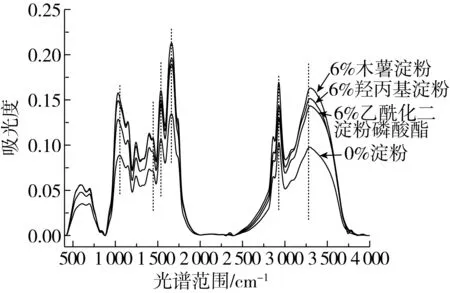
图5 添加不同淀粉的组织化蛋白红外谱图
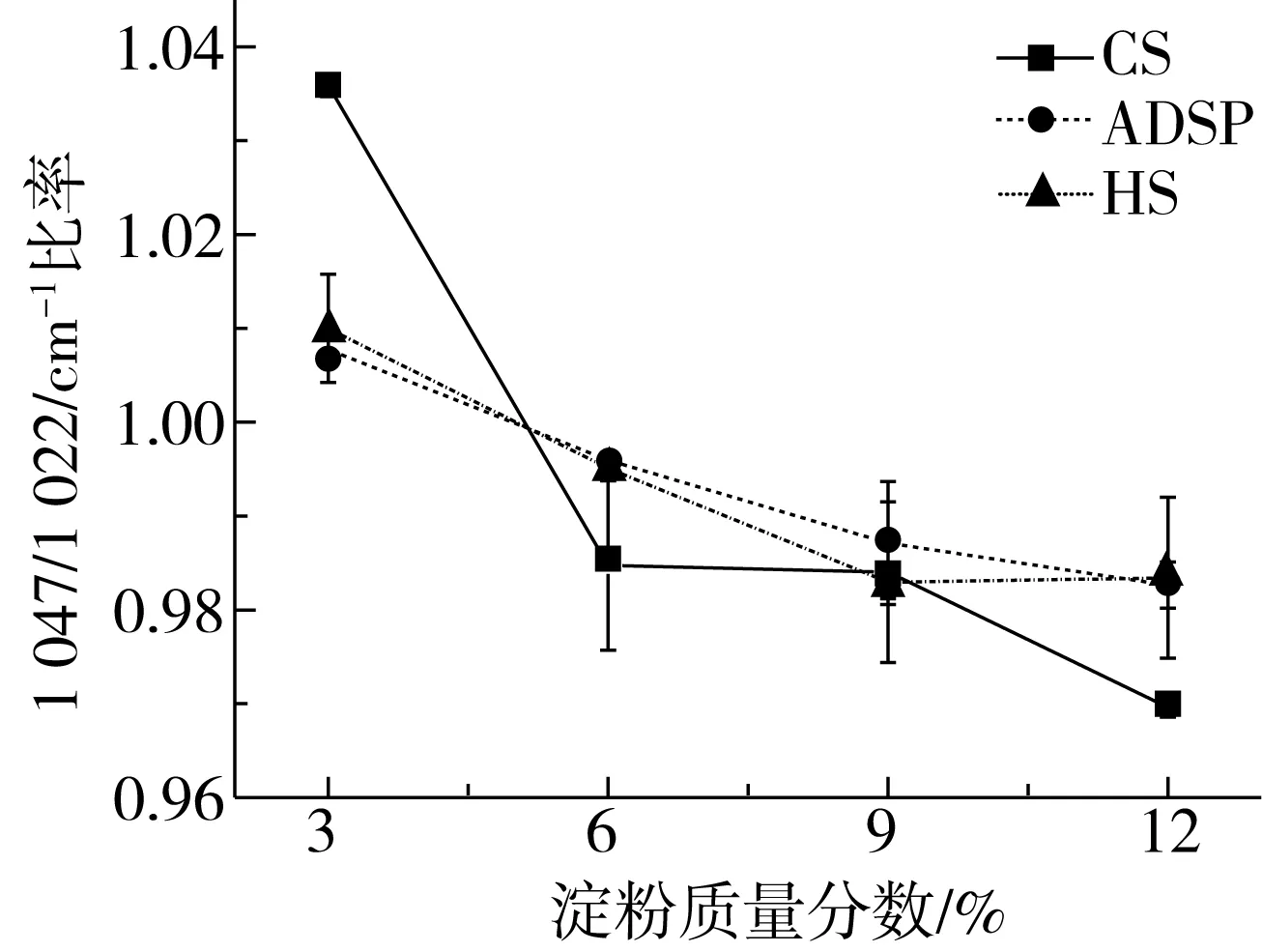
图6 不同淀粉对组织化蛋白样品比率的影响
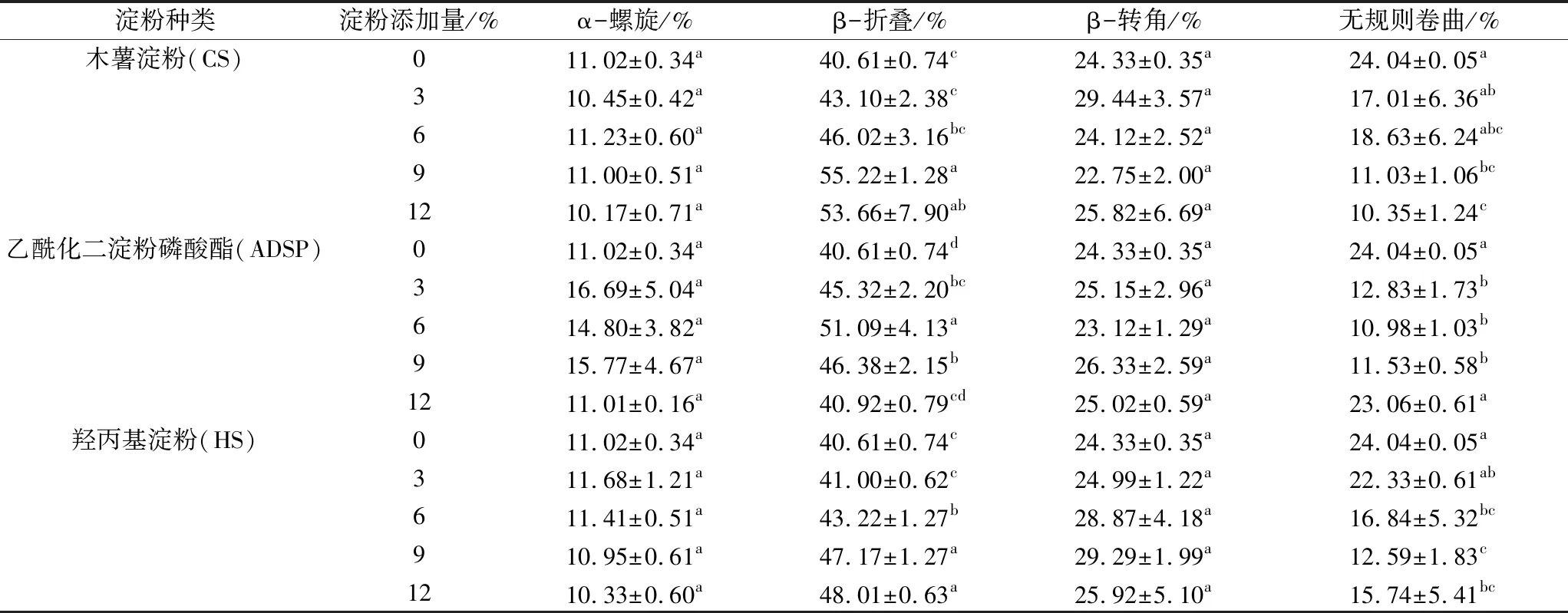
表3 淀粉对组织化花生蛋白二级结构的影响
酰胺Ⅰ带(1 700~1 600 cm-1)是研究蛋白质二级结构最敏感的光谱区,主要由肽链的C—O伸缩振动引起[24]。如图5所示,1 658 cm-1附近谱带强度大,表明β-折叠及β-转角结构为组织化花生蛋白酰胺Ⅰ带中主要构成。由表3可知,不同淀粉的加入对组织化蛋白二级结构中的α-螺旋及β-转角结构无显著影响,随着CS添加量的增加,β-折叠结构比例先增加后减小,无规则卷曲比例不断减小,说明部分无规则卷曲结构转变为β-折叠结构,在CS添加量为9%时,β-折叠比例最高;随着ADSP添加量增加,β-折叠含量先增加后减少,与之相应,无规则卷曲比例先减小后增加;随着HS添加量的增加,无规则卷曲含量逐渐降低,β-折叠不断增加。加入少量淀粉可提高组织化蛋白β-折叠结构含量,但淀粉添加量过多会使β-折叠结构含量降低,进而影响组织化蛋白产品的质构、感官等特性。
2.6 淀粉对组织化花生蛋白化学交联键变化分析
组织化蛋白化学交联键的变化可用蛋白在不同浸提溶液中的溶解度来表示,组织化蛋白样品在浸提溶液中溶解度的不同表明组织化蛋白产品化学键结构的多样性。蛋白溶解度越高,表明组织化蛋白中化学键作用越强。如图7所示,与原料相比,挤压组织化蛋白氢键、二硫键和疏水相互作用逐渐减弱,化学键之间的交互作用逐渐增强,可能是由于挤压蛋白质变性会导致氢键、二硫键和疏水相互作用向更为复杂的综合作用力转变,维持其构象的作用力变得更为复杂[25]。随着淀粉添加量的增加,蛋白质分子间疏水相互作用显著增强,这可归因于淀粉本身的吸水作用,由于淀粉竞争水分,蛋白质中的疏水侧链避开水而聚集到蛋白质内部,而不是被水溶剂化。由图7可知,疏水相互作用和二硫键交互作用是维持组织化蛋白网络状纤维结构的主要作用力,二硫键和疏水相互作用在蛋白挤压聚集过程中起关键作用,与Li等[26]研究结论一致。淀粉添加量增加,蛋白质分子间疏水相互作用逐渐增强,疏水相互作用是蛋白质折叠的主要驱动力,表明蛋白分子进一步交联,使维持组织化花生蛋白构象的作用力变得更为复杂,疏水作用增强也表明了蛋白质折叠和螺旋的稳定。需要说明的是计算氢键、疏水相互作用和二硫键之间的相互作用时,由于尿素溶液对氢键和疏水相互作用均有破坏作用,导致分析氢键和疏水相互作用时的重复计算,得出负值。
2.7 淀粉对产品微观结构的影响
组织化蛋白沿纵向剪切,切面的扫描电镜图如图8所示。无淀粉添加组织化蛋白结构比较紧密,内部存在纤维状结构,但纤维呈无序状排列,纤维间存在较大孔洞。添加一定量CS后,组织化蛋白的结构有所改善,内部纤维组织化结构更明显,质量分数为6%时内部结构更为有序,但仍存在较大孔洞。添加ADSP和HS可明显改善组织化蛋白的纤维结构,分别在质量分数为3%和6%时,表现出更细的纤维结构和更有序的排列。添加9%淀粉使组织孔洞增大,组织纤维化程度降低,这与组织化度的结果一致。添加少量淀粉稳定了水分,减少了网络结构中水分通道的出现,从而促进了致密完整蛋白质网络的形成。但淀粉添加量过多会破坏蛋白质形成的连续网络,两个独立网络相互交织很难形成刚性结构[27],所以组织化蛋白结构变松散,纤维结构比较粗,排列变混乱。
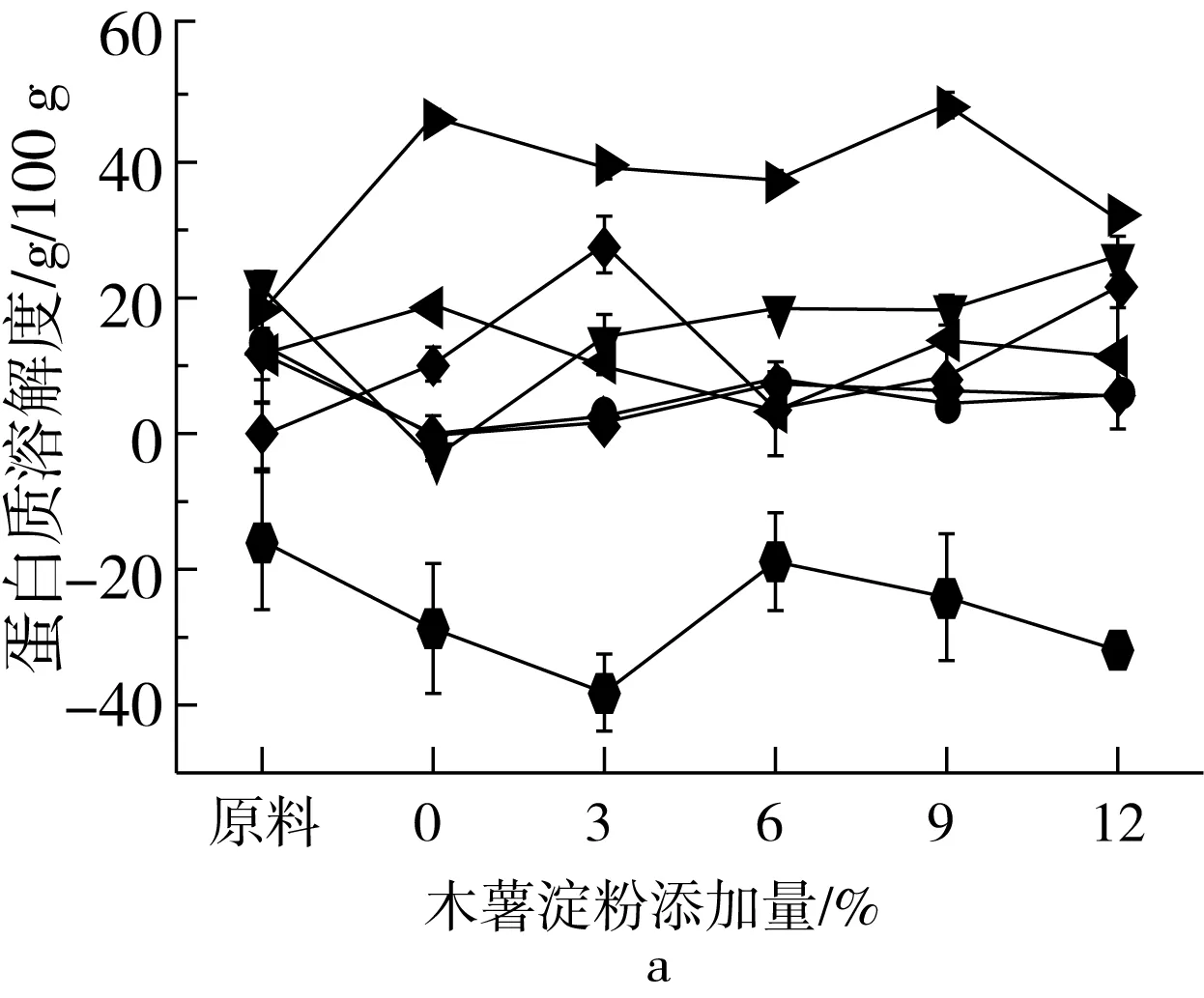
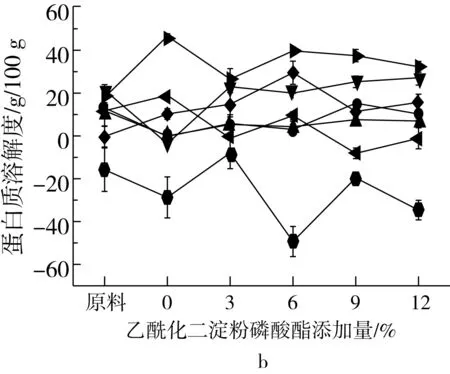
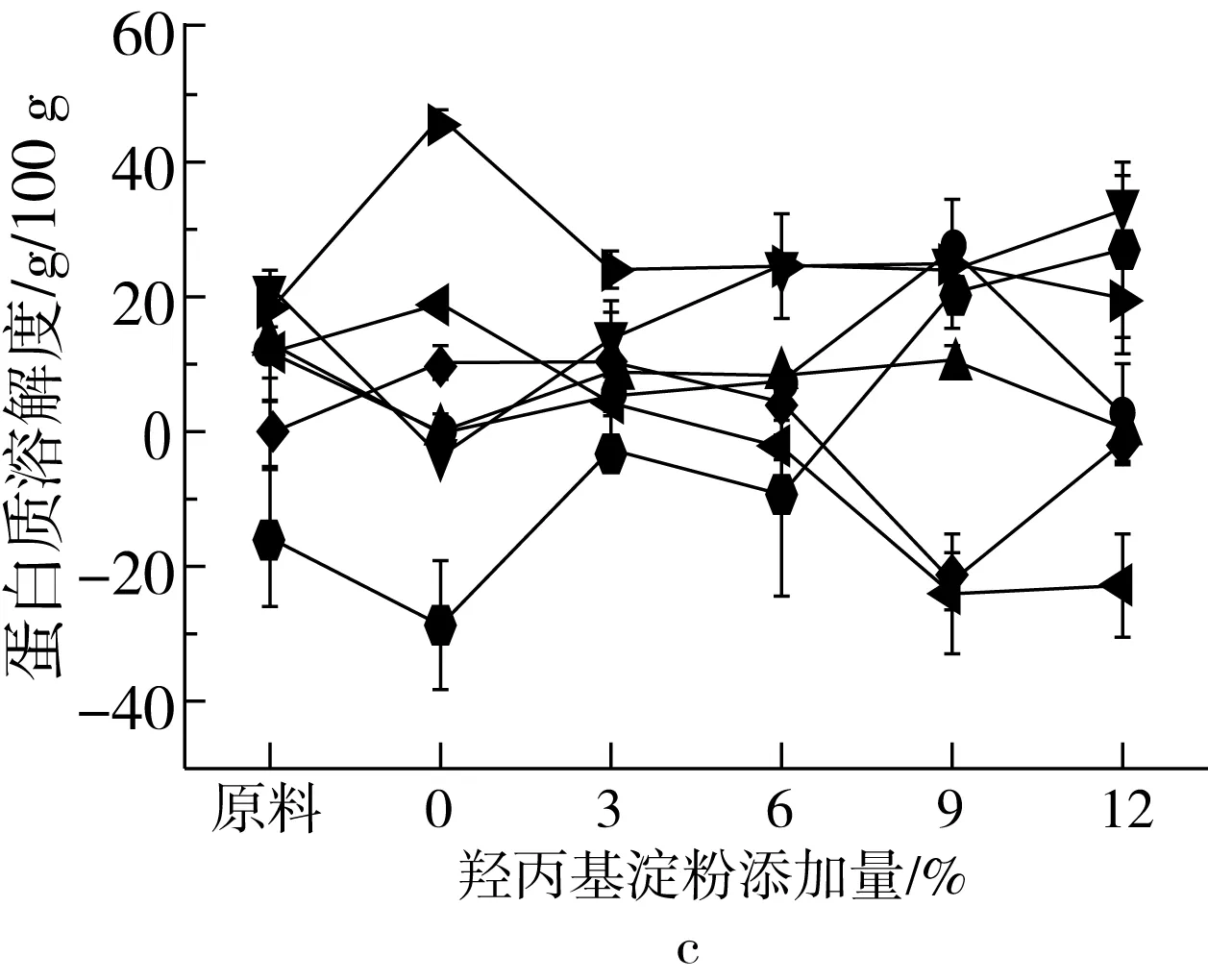
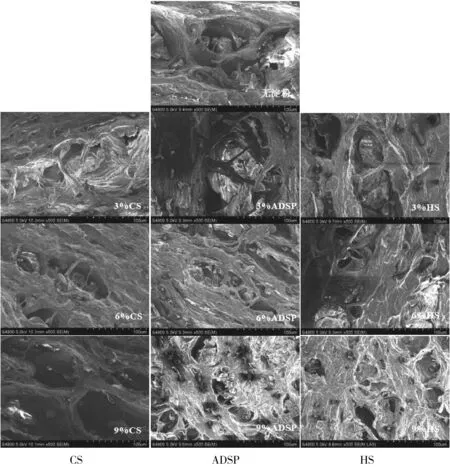
图8 淀粉对组织化花生蛋白微观结构的影响(×500)
3 结论
以花生蛋白粉为主要原料,研究CS、ADSP和HS对高水分组织化花生蛋白品质改良和蛋白结构的影响,结果表明:添加少量ADSP和HS有助于产品组织化度的提高,3种淀粉都改善了组织化蛋白产品色泽,产品亮度值增加,降低了产品硬度和咀嚼性。添加ADSP和HS提高了组织化蛋白产品的吸水吸油能力,有利于产品在食品工业中的应用。红外光谱研究表明淀粉增强了美拉德反应,促进蛋白质二级结构由无规则卷曲向β-折叠转变。化学交联键变化分析表明,淀粉促进了蛋白质之间疏水相互作用,疏水相互作用和二硫键交互作用是维持蛋白质网络状纤维结构的主要作用力。扫描电镜结果表明,淀粉添加有助于蛋白质网络结构的形成,添加3%ADSP组织化蛋白纤维结构明显,具有较高的组织化度。ADSP和HS对组织化蛋白品质改良具有更好的效果。

