氧化苦参碱通过TGF-β1/Smads信号通路对脓毒性休克大鼠心肌损伤的保护作用
蒋志虎 马竞 王小东 闫雪 张燕 许金鹏 王潇伟
脓毒性休克影响重症监护患者,是导致患者死亡的主要原因之一[1]。心肌功能障碍是常见并发症,会显著增加脓毒症休克患者的死亡率[2]。先前关于感染性休克的研究集中在炎性介质(包括肿瘤坏死因子-α和白细胞介素-1β)的产生以及对肝、肺和肾组织的损害上[3]。心肌抑制是脓毒症器官功能障碍的公认表现。然而,感染性心功能不全的各种机制仍不清楚,目前没有一种专门针对心肌功能障碍设计的治疗策略已被证明对感染性休克患者有效[4]。TGF-β1/Smads信号通路是研究最多的信号转导级联之一,对于参与免疫和炎性反应的细胞因子受体信号传导至关重要。TGF-β1/Smads信号分子结合细胞因子和炎性细胞因子(包括 TNF-α、IL-1β 和 IL-6)基因启动子区域中的特定核苷酸序列,诱导基因表达[5,6]。研究表明,在脓毒症大鼠肺组织中,TGF-β1/Smads信号通路被激活,TNF-α和IL-6的表达增加[7]。抑制TGF-β1/Smads通路可减轻败血症大鼠的多器官功能障碍[8]。因此,阻止TGF-β1/Smads信号通路的激活以减少炎症可能对感染性休克患者具有临床益处。氧化苦参碱(oxymatrine, OMT)是中药苦参的主要活性成分,已得到充分研究,其抗炎活性已在实验动物模型和临床研究中得到证实[9]。OMT 具有多种生物活性,包括清热解毒、抗炎、抑制肝纤维化、升高白细胞、抗柯萨奇病毒和调节免疫以及药理作用的其他方面[10]。已确定OMT可抑制内毒素血症小鼠的肺组织损伤,该机制与LPS识别受体表达的调节和下游炎性因子表达的下调有关[11]。这些结果表明OMT在抗炎反应中起着至关重要的作用,并且与本研究的假设一致,即OMT可以通过抑制TGF-β1/Smads信号通路的激活来预防感染性休克引起的心肌损伤。本研究对大鼠模型进行了盲肠结扎和穿刺(CLP),以检查OMT对脓毒性休克心肌损伤中TGF-β1/Smads信号通路抑制的影响。
1 材料与方法
1.1 实验试剂 OMT购自宁夏启元药业有限公司(中国银川)。地塞米松购自湖北天药制药有限公司(中国湖北)。考马斯亮蓝蛋白定量试剂盒购自南京建成生物工程公司(中国南京)。125I肿瘤坏死因子-α和125I白细胞介素-1β放射免疫测定试剂盒购自北京Chemclin生物工程有限公司(中国北京)。TRIzol从Invitrogen Life Technologies(Carlsbad, CA.USA)获得。PrimeScript RT试剂盒来自Takara Bio(中国大连)。RT-PCR 试剂盒来自Promega(Promega Corporation, Madison, WI, USA)。针对TGF-β1和Smads的大鼠单克隆抗体来自 Santa Cruz Biotechnology, Inc.(Santa Cruz,CA,USA),IP 细胞裂解物和 BCA 蛋白浓度测定试剂盒来自江苏格林生物技术公司(中国江苏)。
1.2 实验动物 动物研究得到医院动物护理委员会的批准。雄性Sprague-Dawley大鼠,无特定病原体,体重200~250 g,购自北京大学医学部实验动物科学部[合格证号:SCXK(京)2021-0013]。大鼠随机分为7组(n=8):假手术(CON)组、OMT组、CLP模型(CLP组)、阳性对照组[CLP+地塞米松(DEX)组,10 mg/kg]和CLP+OMT-M组(CLP+OMT 52 mg/kg)、CLP+OMT-H组(CLP+OMT 26 mg/kg)、CLP+DEX-L组(CLP+OMT 13 mg/kg)。感染性休克模型由CLP诱导。大鼠接受尾静脉注射药物(5 ml/kg)。CON组和OMT组大鼠静脉注射0.9%氯化钠溶液和OMT(26 ml/kg),CLP组仅注射0.9%氯化钠溶液(26 ml/kg)。处理后,盲肠在无菌条件下暴露。术后监测大鼠尾动脉压,降至基础血压的2/3,脉压<20 mm Hg判断脓毒症模型成功。
1.3 观察指标 (1)心脏功能:由右侧颈总动脉测定大鼠心率(HR)、平均动脉压(MAP)、左心室内压变化率(LVdp/dtmax)、左心室收缩末期压(LVESP)和通过插入心导管术测量左心室舒张末压(LVEDP)。(2)组织学分析:收集顶端组织块 2 mm3并固定在10%甲醛中,然后包埋在石蜡中。苏木精-伊红染色后,光镜下观察心肌组织病理变化。将约2 mm3的额外心肌组织置于2%戊二醛中并切片作为电子显微镜标本以确定超微结构变化。
1.4 RT-PCR分析 使用TRIzol制备总RNA,并使用PrimeScript RT试剂盒逆转录为cDNA。RT-PCR 使用市售试剂盒进行如下:94℃变性60 s、58℃退火60 s和72℃延伸50 s,35个循环。β-肌动蛋白用作内部对照以评估TNF-α和IL-1β的相对表达。见表1。

表1 引物序列
1.5 蛋白质印迹分析 本研究采用BCA试剂盒测量总蛋白质浓度。以10%SDS-PAGE电泳分离等量的蛋白质(40 μg),然后将凝胶转移到0.45 μm PVDF膜上。将印迹浸泡在封闭缓冲液(5%脱脂牛奶)中,然后与一抗在4℃环境下孵育过夜。用TBST缓冲液彻底清洗后,应用辣根过氧化物酶偶联的二抗(1∶10 000),然后使用增强型化学发光检测系统观察免疫复合物。
1.6 放射免疫测定 通过放射免疫测定法测定心肌组织中TNF-α和IL-1β的水平。心肌组织(100 mg)与3倍体积的PBS混合并匀浆,然后在4℃条件下以13 000 g 离心20 min。使用放射免疫分析试剂盒定量上清液中TNF-α和IL-1β的蛋白质水平。
2 结果
2.1 心脏功能测定 心肌舒张功能的变化是感染性休克的一个重要特征[12]。与CON组比较,OMT组的心功能参数,包括HR、MAP、LVSP、LVEDP和±LVdp/dtmax未受影响(P>0.05)。CLP组与CON组比较,指标均有显著变化(P<0.01)。不同剂量OMT治疗后,CLP+OMT-H组HR降低(P<0.05),MAP和LVSP升高(P<0.01);与CLP组相比,LVEDP 降低(P<0.01),±LVdp/dtmax 增加(P<0.01)。CLP+OMT-M组HR降低(P<0.05),MAP和LVSP增加(P<0.05),LVEDP减少(P<0.05),±LVdp/dtmax增加(P<0.01),LVdp/dtmax升高在CLP+低剂量OMT组中增加了13%(P<0.05)和-LVdp/dtmax 增加了9%(P<0.05)。CLP+DEX组与CON组、CLP+OMT-H和CLP+OMT-M组比较各项指标未见显著差异(P>0.05),但与CLP组和CLP+OMT-L组比较,各项指标均存在显著差异(P<0.05)。见表2。
表2 OMT对感染性休克大鼠心功能的影响
2.2 心肌组织学测定 CON组和OMT组未发现心肌组织的差异,心内膜完整,无水肿及纤维结缔组织增生,心肌条纹清晰,细胞核居中,未见血管舒张和炎性细胞浸润,心外膜在基质中完整,没有炎性渗出物。与CON组比较,CLP组明显的心内膜下心肌结构紊乱,大量炎性细胞浸润,有相当数量的单核细胞和少量淋巴细胞和中性粒细胞,并有毛细血管扩张和出血。CLP组还表现出不同程度的间质水肿、成纤维细胞增殖和细胞坏死和纤维化。在不同剂量的OMT治疗后,与CLP组比较,CLP+OMT-L组心肌组织损伤减少,但低水平的心肌结构紊乱,伴有炎症细胞浸润、毛细血管扩张和出血,细胞坏死和纤维化。然而,CLP+OMT-M组和CLP+OMT-H组的心肌组织损伤明显减轻,并观察到正常的基本心脏结构,水肿、变性和坏死明显减轻,但仍伴有少量炎性细胞浸润和渗出性改变。与CLP组比较,CLP+DEX组心肌损伤明显减轻,心肌细胞排列成行,伴有少量炎性细胞浸润,未发现细胞肿胀、变性和坏死的显著变化。见图1。
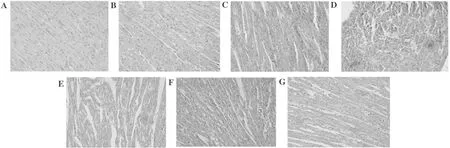
图1 感染性休克大鼠的心肌组织学分析(苏木精-伊红染色×100);A CON组;B OMT组;C CLP组;D CLP+OMT-L组;E CLP+OMT-M组;F CLP+OMT-H组;G CLP+DEX组
2.3 心肌超微组织学改变 与CON组比较,OMT组心肌组织(肌丝、肌节、毛细血管、线粒体、肌浆网和核仁)未见明显变化,均有正常的形状和清晰的结构,肌丝和肌节排列正常,血流量正常;线粒体结构正常清晰,膜完整,脊致密,基质清晰,插入的圆盘有序且连续,肌浆网光滑连续,核仁清晰,光核固缩,染色质均匀。CLP组超微组织心肌组织受到显著损伤,线粒体明显肿胀,膜损伤和嵴紊乱;肌丝溶解,肌节紊乱,导致空泡;细胞核显著减小,并观察到染色质边缘;嵌入盘的溶解表现出不连续性和不均匀分布。与CLP组比较,CLP+OMT组心肌组织损伤明显减轻,心肌纤维排列正常,大部分线粒体结构完整,虽然脊的一部分不明确,但排列仍然规则,线粒体肿胀减少,特定的损伤没有完全恢复。CLP+OMT-L组表现出最高水平的损伤。CLP+DEX 组的超微组织心肌组织几乎正常,很少受伤,心肌纤维排列整齐,大部分线粒体结构完整,脊线致密,纤维排列有序,特定的损伤未完全恢复,插入的椎间盘显示明显连续。肌浆网光滑连续,核仁清晰,核固缩较轻,染色质均匀。见图2。
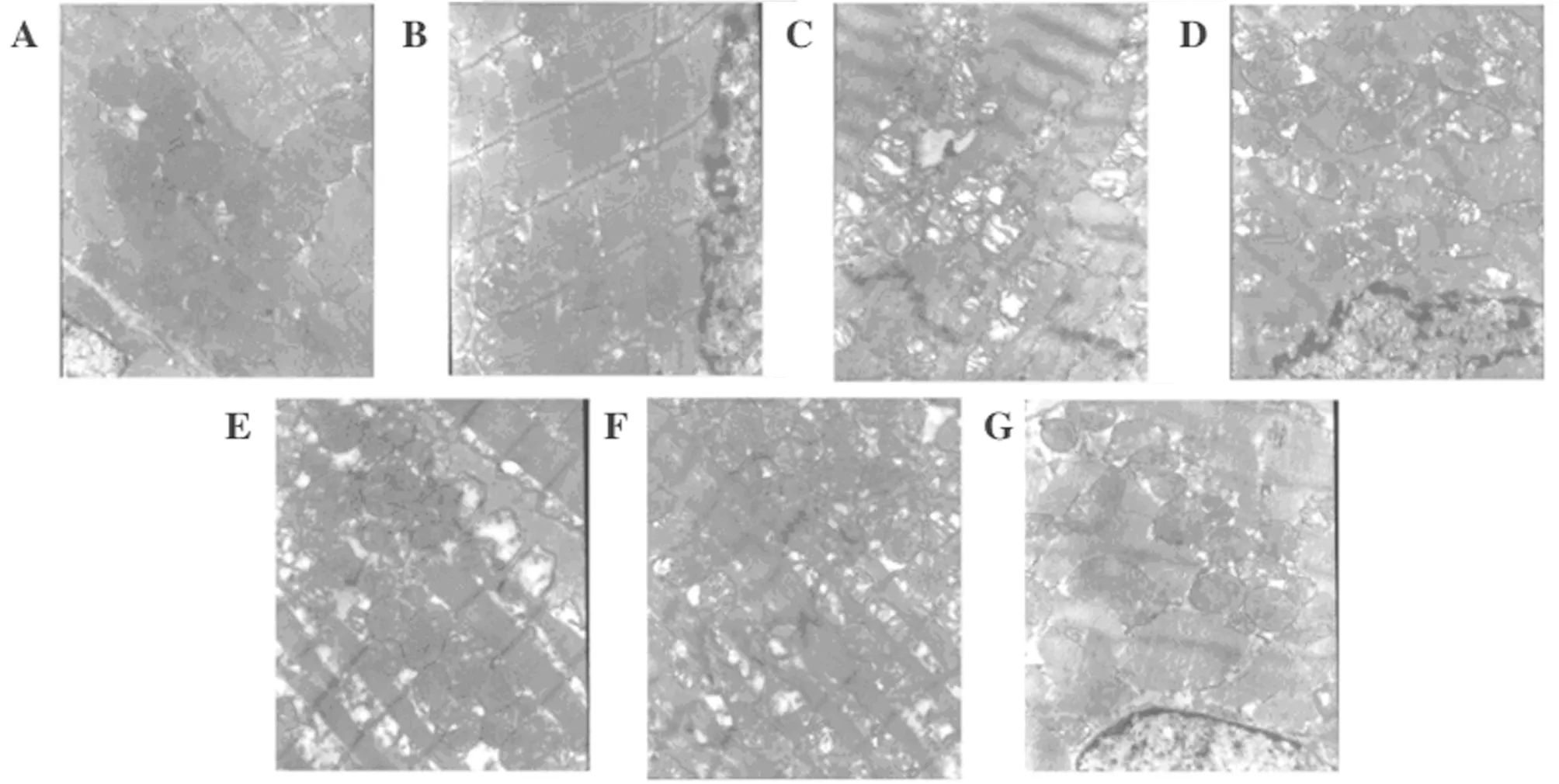
图2 心肌超微组织学分析(×12 000);A CON组;B OMT组;C CLP组;D CLP+OMT-L组;E CLP+OMT-M组;F CLP+OMT-H组;G CLP+DEX组
2.4 OMT对TGF-β1和Smad2蛋白表达的影响 蛋白质印迹分析显示OMT对照心肌组织中TGF-β1和Smad2蛋白水平与 CON组相似,但在CLP组中更高(P<0.05)。然而,与CLP比较,CLP+OMT和阳性对照组的TGF-β1和Smad2蛋白水平显着降低(P<0.05)。见图3,表3。
表3 OMT对脓毒性休克大鼠心肌TGF-β1和Smad2蛋白表达的影响

图3 OMT对脓毒性休克大鼠心肌TGF-β1和Smad2蛋白表达的影响;泳道 1~7 分别显示 CON、OMT 对照、CLP、CLP + OMT-L、CLP + OMT-M、CLP + OMT-H 和 CLP + DEX 组
2.5 OMT对TNF-α和IL-1β蛋白表达的影响 与CON组和OMT组比较,CLP组TNF-α和IL-1β蛋白水平显著升高(P<0.05)。与CLP 组比较,CLP+OMT组和CLP+DEX组中TNF-α 和IL-1β蛋白水平显著降低(P<0.05)。见图4,表4。
表4 OMT对脓毒性休克大鼠心肌TNF-α和IL-1β蛋白表达的影响
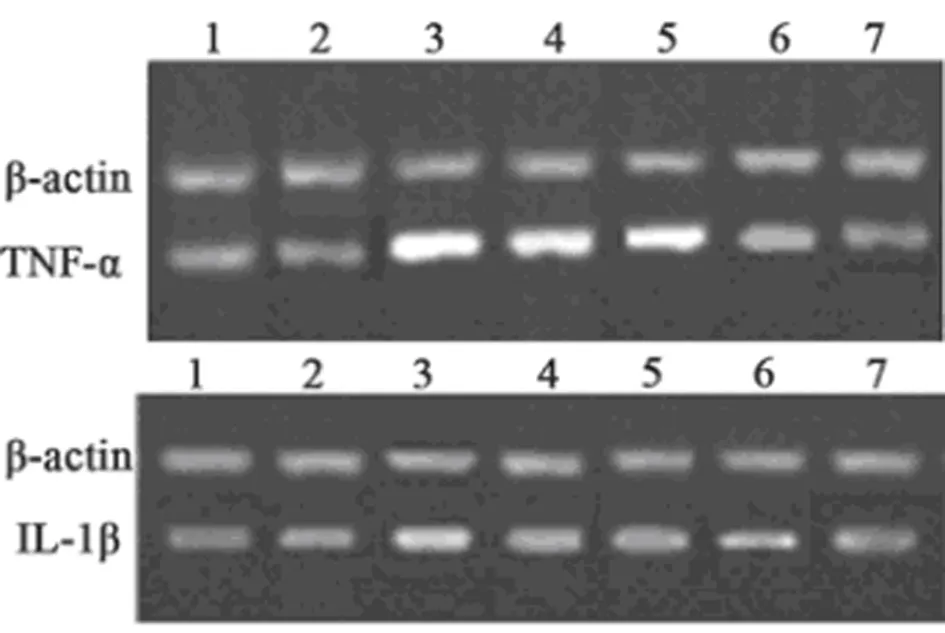
图4 OMT对脓毒性休克大鼠心肌组织TNF-α和IL-1βmRNA表达的影响;泳道 1~7 分别显示 CON、OMT 对照、CLP、CLP + OMT-L、CLP + OMT-M、CLP + OMT-H 和 CLP + DEX 组
2.6 OMT对TNF-α和IL-1β mRNA表达的影响OMT组、CON组心肌组织TNF-α和IL-1β mRNA水平正常,CLP组显著增加(P<0.05)。与 CLP组比较,CLP+OMT和CLP组+DEX组中TNF-α和IL-1β mRNA水平显著降低(P<0.05)。见表5。
表5 OMT对脓毒性休克大鼠心肌TNF-α和IL-1β mRNA的影响
3 讨论
感染性休克中细胞的广泛活化导致许多炎性介质释放,如细胞因子、趋化因子、前列腺素、脂质介质和活性氧。脓毒症中炎性介质的过量产生与许多信号通路有关,如MAPK和NF-κB,特别是TGF-β1/Smads[13]。TGF-β1和Smads促进细胞因子的释放,包括TNF-α和IL-1β,且与不受控制的炎性反应、感染性休克和急性器官损伤显著相关[14]。Xu等[15]报道,IL-2和IFN-γ与TGF-β1/Smads通路的激活直接相关,抑制该通路可减少大鼠脓毒性休克中重要器官的功能障碍。
OMT是一种从苦参中提取的生物碱,其生物活性已得到广泛研究[16-18]。已发现OMT通过靶向肝星状细胞和减少肝纤维化来减轻肝纤维化。通过抑制诱导型一氧化氮合酶表达和TGF-β/Smads信号通路,缓解博莱霉素诱导小鼠肺纤维化。此外,发现 OMT 在脑缺血/再灌注中表现出神经保护作用。
之前的研究表明,OMT 显著抑制脓毒症大鼠肺组织中TGF-β1和Smad2的活性,降低TNF-α和IL-6水平、W/D比和肺系数,减少肺组织充血、水肿、中性粒细胞浸润、透明膜形成和其他病变[19,20],在本研究中,开发脓毒性休克大鼠模型,通过检测TGF-β1和Smad2的表达以及TNF-α和IL-6的释放来检查OMT对心脏组织损伤和TGF-β1/Smads信号通路的影响。组织学分析表明,OMT干预显著减少了由HR和LVSP增加引起的大鼠感染性休克。降低的±LVdp/dtmax 增加了心肌顺应性,降低了心肌僵硬,改善了心脏功能,增强了心肌收缩力,纠正了心室舒张末期压力增加并降低了前负荷。这些心脏保护作用与TGF-β1/Smads信号通路的激活有关。蛋白质印迹分析和RT-PCR显示OMT抑制 TGF-β1和Smad2的激活,导致促炎细胞因子、TNF-α和IL-6的表达降低。
总之,心脏损伤与TGF-β1/Smads信号通路相关,并且OMT具有抑制该信号通路激活的能力。TGF-β1和Smad2的激活导致TNF-α和IL-6的上调。TNF-α和IL-6的释放对心脏组织有显著影响。目前观察表明,OMT保护心肌损伤,并且至少部分地与脓毒性休克大鼠中TGF-β1/Smads信号传导的显著抑制相关,并且可能是治疗脓毒性休克的潜在治疗药物。

