C57BL/6小鼠骨髓间充质干细胞的体外分离培养、分化及两种不同品牌血清对其增殖的影响
刘剑锋,汤剑明,阳莲,程建红,李露,洪莉
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一种存在于骨髓结缔组织中的基质细胞,具有广泛的增殖能力以及多向分化的潜能,是组织修复方向的研究热点[1]。目前BMSCs被广泛用于多种疾病的治疗和研究,如心肌梗死[2]、肢体缺血[3]、压力性尿失禁[4]等。目前,BMSCs提取方法有多种,包括全骨髓差速贴壁法[5]、密度梯度离心法[6]、免疫磁珠分选法[7]等。然而,BMSCs的生长增殖受多种因素的影响,其体外培养条件及方法尚无统一观点。血清是细胞培养过程中至关重要的环节,当下市面上的血清种类多样,成分、来源不同,使BMSCs的分离培养效果具有差异。本文采用贴壁培养法进行C57BL/6小鼠BMSCs的体外分离培养,选用配置10%浓度的血清培养基[8-9],并探究在相同实验条件下含两种不同品牌胎牛血清(Yeasen血清,Gbico血清)的培养基对BMSCs细胞数量、形态以及生长周期的影响,从而为BMSCs体外分离培养的血清选择提供更加优化的方案,以服务于临床和科研。
1 材料与方法
1.1 实验动物
4~6周SPF级C57BL/6雄性小鼠,体重15~20 g,由武汉大学实验动物中心提供,实验过程中对动物的处置符合动物伦理学标准。
1.2 主要试剂
0.25%胰蛋白酶,磷酸盐缓冲液(PBS)、胎牛血清(Fetal Bovine Serum,中国,Yeasen公司,货号:40130es76),DMEM/F12 培养基(Hyclone) 、胎牛血清(Fetal Bovine Serum,美国,Gibco公司,货号:10099-141),Cell Counting Kit-8(CCK-8) 试剂盒(武汉科瑞生物技术有限公司),台盼蓝染液(凯基生物公司),青链霉素,兔抗小鼠CD34、44、90及106多克隆抗体(Ⅰ抗,美国Santa Cruz 产品),兔抗小鼠CD34、CD44、CD90、CD106(Ⅰ抗,Abcam公司)。Oricell C57BL/6小鼠BMSCs成骨诱导分化培养基试剂盒(Cyagen公司,货号:MUBMX-90021),Oricell C57BL/6小鼠BMSCs成脂诱导分化培养基试剂盒(Cyagen公司,货号:MUBMX-90031)。
培养基配制:Yeasen胎牛血清组:10% Yeasen胎牛血清+89% DMEM/F12+1%青链霉素;Gibco胎牛血清组:10% Gibco胎牛血清+89% DMEM/F12+1%青链霉素。
1.3 主要仪器
超净工作台,25 cm2细胞培养瓶,六孔板,二氧化碳培养箱(中国香港,Healforce),普通倒置显微镜、倒置荧光显微镜(日本,Olympus),酶标仪(美国,Waltham MA),低温离心机(德国,Eppendorf)。
1.4 小鼠BMSCs的原代分离和培养
颈椎脱臼法处死小鼠,酒精浸泡2~3 min后转移至超净工作台,组织镊剥离干净股骨和胫骨上附着的肌肉等组织(见图1)放入含10%青链霉素的PBS液中清洗3遍,剪去股骨和胫骨的骨骺端,暴露骨髓腔,用10 mL注射器吸取DMEM-12完全培养基冲洗骨髓腔,直至骨髓腔变白。随后1 000 r/min 离心含有骨髓细胞的悬液5 min,弃上清液,重悬细胞沉淀经均匀转入25 cm2细胞培养瓶里,台盼蓝染色检测其细胞活力,放入37℃、5%CO2孵育箱中培养。
1.5 实验分组
本实验共分为两组:Yeasen组:含10% Yeasen胎牛血清的DMEM/F12培养基组;Gbico组:含10% Gbico胎牛血清的DMEM/F12培养基组,36 h后首次换液,72 h后半定量换液,随后每2 d换液1次。
1.6 细胞形态学观察
倒置显微镜(100×)下,每24 h观察两组细胞培养瓶中原代细胞的生长情况和形态特征。
1.7 免疫荧光检测
采用第三代细胞进行后续实验,细胞融合达80%时传代至六孔板培养。弃去培养基,取出预先放置于6孔培养板中爬满细胞的盖玻片,PBS 冲洗3次,每次3 min;40 g/L多聚甲醛固定30 min,PBS 冲洗3次,每次3 min;3 g/L 聚乙二醇辛基苯基醚(Triton-X-100)孵育30 min,PBS 冲洗3次,每次3 min;FBS室温封闭30 min,弃去,分别加兔抗小鼠CD34、CD44、CD90、CD106(1∶200)一抗4℃过夜,PBS 冲洗3 次,每次 3 min;羊抗兔IgGⅡ抗室温1 h,PBS 冲洗3次,每次 3 min;荧光倒置显微镜(400×)下观察,并统计阳性细胞数。
1.8 BMSCs诱导分化
成骨:取第3代生长良好的细胞,细胞生长至70%~80%融合时,用0.25% Trypsin-0.04% EDTA进行消化,以2×104/cm2密度均匀铺至0.1%明胶包被的6孔板中,每孔加入2 mL完全培养基。当细胞融合到60%~70%时,换用2 mL Oricell C57BL/6小鼠BMSCs成骨诱导分化完全培养基,诱导2~4周后,茜素红染色。
成脂:取第3代生长良好的细胞,细胞生长至80%~90%融合时,用0.25% Trypsin-0.04% EDTA进行消化,以2×104/cm2密度均匀铺至6孔板中,每孔加入2 mL完全培养基,当细胞融合到100%时,换用2 mL Oricell C57BL/6小鼠BMSCs成脂诱导分化完全培养基,诱导16~27 d后,油红O染色。
1.9 生长曲线绘制
采用第三代生长状态良好的原代细胞制备成单细胞悬液,血球计数板计数,调整细胞浓度为1×105个/mL,接种到96孔板,每孔100 μL,每组副孔3 个,放置于 37℃、5% CO2培养箱中培养细胞贴壁0.5 h;弃去上清,每孔加CCK-8 10 uL;在 37℃ CO2培养箱内孵育1 h,用酶标仪检测其 450 nm处吸光度。实验步骤严格按照 CCK-8检测试剂盒进行,重复4次,求其平均值,连续检测8 d,并绘制其细胞生长曲线。
1.10 统计学方法
使用SPSS 22.0统计学软件进行数据分析。计量资料采用单因素方差分析和t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 细胞形态学观察
采用倒置显微镜分别观察原代以及传代后不同时间段(2 d、4 d、6 d)BMSCs的生长情况,结果显示,原代刚接种的BMSCs呈圆形,大小不一,悬浮于培养基中。培养2 d后细胞开始贴壁,贴壁细胞多呈梭形或多角形,出现成团生长现象。其中,Gbico组细胞较Yeasen组,成团生长现象更为明显且细胞生长密度更大。后在4 d、6 d 的倒置图像也显示出,Gbico组细胞密度明显高于Yeasen组。详见图 2。

图2 两种品牌血清培养基培养BMSCs在2 d、4 d、6 d的细胞形态(100×)
2.2 免疫荧光鉴定
在荧光倒置显微镜(400×)下观察BMSCs的表面抗原标志物CD34、44、90、106的表达。结果显示,在梭形或多角形的P3细胞的免疫荧光图像中,CD106、CD90和CD44为阳性表达,CD34为阴性表达,如图3。
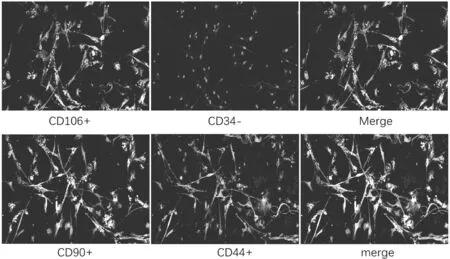
图3 BMSCs 表面抗原荧光检测情况(400×)
2.3 细胞成骨、成脂诱导分化
第3代BMSCs经过成骨诱导培养基的诱导,在7 d后可见细胞形态发生变化,诱导21 d时可见多处钙结节沉积,茜素红染色阳性;成脂诱导第12天,可见多量圆形细胞,从第12~20天,圆形细胞内部有脂滴形成并逐渐增多,油红O染色可见密集红色脂滴,如图4。
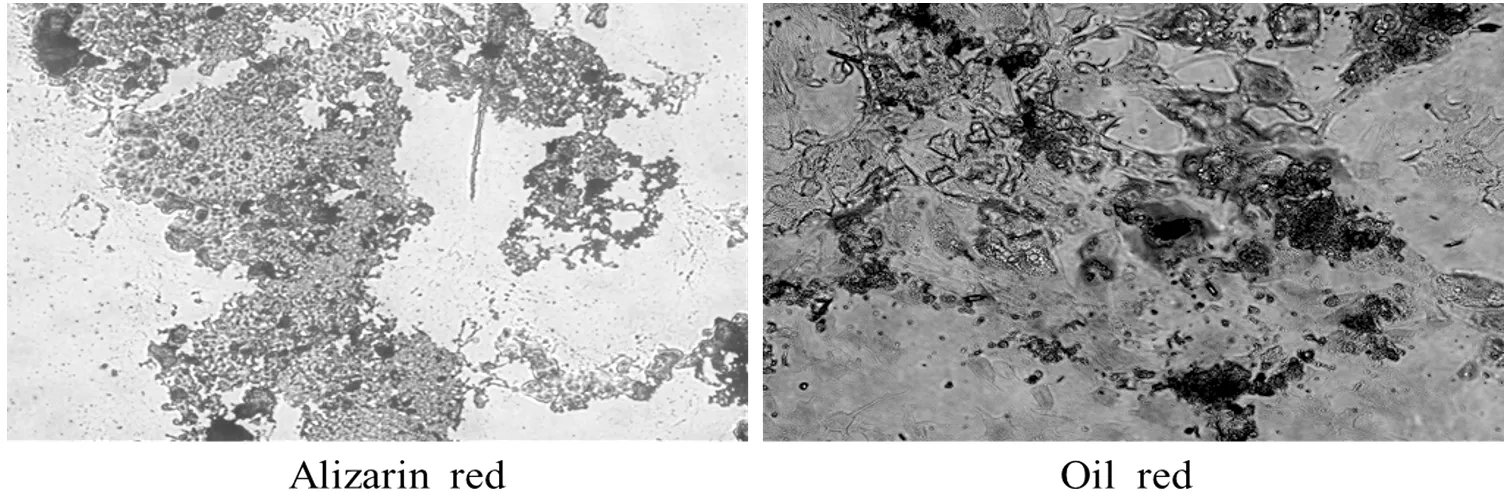
图4 BMSCs成骨、成脂诱导分化(100×)
2.4 细胞生长曲线检测
通过CCK-8法分别从0 d、2 d、4 d、6 d、8 d测得细胞生长曲线,从而间接反映小鼠BMSCs的生长趋势,结果显示含10% Gbico血清与10% Yeasen血清的BMSCs都呈增长趋势,无血清培养基组细胞未见增长。相较于Yeasen组,Gbico组的BMSCs生长趋势更为显著。如图5。
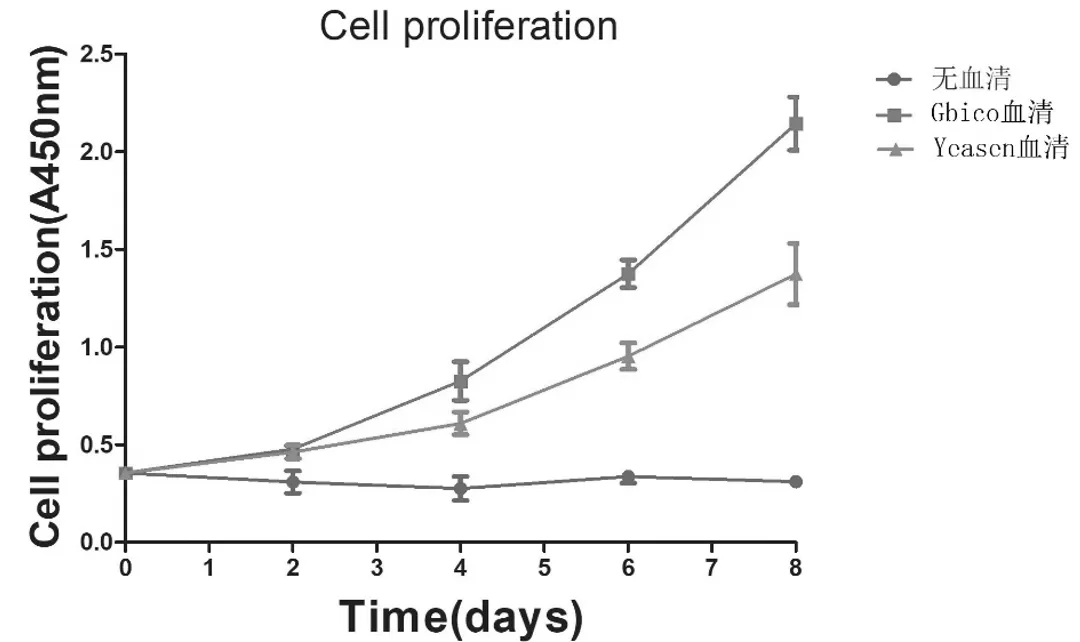
图5 小鼠骨髓间充质干细胞体外培养生长曲线
3 讨论
间充质干细胞(mesenchymalstemcells,MSCs)是存在于骨髓腔与多个组织器官的成体干细胞,可以分化为骨、软骨、脂肪、神经等组织,具有多向分化潜能[10-12]。同时,干细胞疗法在多种组织修复的研究中表现出巨大潜力[13-15]。然而,BMSCs在小鼠骨髓中含量少、存活率低、提取困难,其体外分离培养的难度很大。常用的MSCs体外分离培养方法包括:差速贴壁法、密度梯度离心法、免疫磁珠分选法和细胞表面标志物分选法4种方法[16]。
本次实验采用差速贴壁法提取小鼠BMSCs,是一种快速、简单、经济的分选方法,根据骨髓细胞群的贴壁能力以及对胰酶的敏感程度不同,在换液以及胰酶消化传代过程中不断分离出BMSCs。在体外分离实验后,通过倒置显微镜观察到了呈梭形或多角形、团状生长的MCSCs,随着时间的推移数量明显增多。BMSCs的表型具有间充质细胞、上皮细胞和内皮细胞的特点,一般通过不表达CD14、CD34等,表达CD44、CD90、CD106等标志,对BMSCs进行初步鉴定[17-18]。本实验通过免疫荧光检测发现细胞群高表达CD44、CD90、CD106,低表达CD34。免疫荧光图片与倒置显微镜图说明了BMSCs的成功分离与增殖。同时,本实验应用BMSCs成骨、成脂分化培养基对BMSCs进行定向诱导,通过茜素红染色(+)与油红染色(+)表明了诱导的成功,进一步说明了BMSCs的多向分化能力。
BMSCs对血清、培养基等微环境敏感,体外培养需要苛刻的环境条件。目前,市面上的血清种类复杂、来源多样、成分不清,对不同细胞的培养效果差异较大[19]。KuboH等[20]在BMSCs的培育中发现,相较于自体血清,补充普通胎牛血清BMSCs的血小板减少趋势明显,更有利于其增殖。本文结合了以往的大量研究文献,选用了两种常用的特级胎牛血清:Yeasen胎牛血清和Gbico血清,以10%血清+89%DMEM/F12+1%双抗比例配置培养基,对两种培养基进行比较,以观察BMSCs在两种培养基环境中的生长状态。通过倒置图片发现,两种培养基都发生了BMSCs的生长与增殖。但是,含Gbico血清的培养基相较于含Yeasen胎牛血清的培养基,BMSCs的数目增多更为明显。并进一步通过CCK-8实验检测两组细胞以及无血清条件下的BMSCs在0、2、4、6、8d的数目,绘制了生长曲线,以观察细胞活力与生长趋势。结果显示,两种血清环境下BMSCs都表现出增长趋势,其中Gbico血清促进效果更加明显,而Yeasen血清有着更加优惠的价格。Gbico胎牛血清来自澳洲,Yeasen胎牛血清选自南美,这两种特级胎牛血清都有着低含量的内毒素与血红素,为干细胞培养提供了合适的生长环境,二者表现上的差异可能与Gbico胎牛血清能够提供与体内更加相似的环境有关。关于造成这一差异的更深层次原因,其血清内具体成分以及这些成分与BMSCs的关系如何,值得进一步探究。
本研究从BMSCs的体外分离培养、鉴定、分化等一系列过程进行了较为全面的探究。总之,不同类型的血清确实会影响到BMSCs的体外培养。通过差速贴壁法快速简便地获取该细胞,含10%Yeasen血清与10%Gbico血清的DMEM/F12培养基都适用于该细胞的体外培养。其中Yeasen血清有着更高的性价比,10%Gbico则在促进增殖方面表现更加良好。

