不同小麦品种花青素含量多样性及其合成基因表达分析
苏培森,隋超,颜君,王晨,韩磊,王舒涵,刘晓倩,郭尚敬
(1.聊城大学农学与农业工程学院,山东 聊城 252000;2.山东农业大学信息与工程学院,山东 泰安 271018)
小麦(Triticum aestivumL.)在我国已经有五千多年的栽培历史,种植区域广泛,是目前我国仅次于水稻和玉米的第三大重要粮食作物,其制品是人类膳食的主要来源[1]。随着人们生活水平的提高及对健康饮食的重视,对营养价值高、具有保健功能作物的需求日益增加[2-4]。小麦籽粒中胚乳、麸皮和胚芽分别占粒重的16.0%、81.2%、2.8%[5]。研究表明,增加全谷物的摄入可以有效预防心血管疾病、Ⅱ型糖尿病及癌症等[6,7]。因此,培育特色功能性小麦品种对于改善人类膳食营养具有重要价值。
花青素(anthocyanins)属于类黄酮次生代谢产物,是存在于高等植物体内的一种常见水溶性色素。目前已知的花青素有600多种,植物中比较常见的主要有6类,分别为飞燕草素、芍药素、矮牵牛色素、矢车菊素、锦葵色素和天竺葵素[8,9]。花青素具有着色、抵御紫外线伤害、抗低温等生物学功能[10]。花青素是植物花、叶片、果实、种子等组织中红、蓝、紫等颜色的主要显色物,从而使植物呈现出不同的颜色,具有一定的观赏价值[11-15]。花青素可保护光系统Ⅱ免受到达叶绿体的多余光子的影响,有助于降低己糖积累从而起到糖缓冲作用,并对光合作用的反馈调节具有积极影响[16]。花青素有助于清除胁迫下植物体内积累的活性氧,其含量与活性氧积累呈负相关,即花青素含量减少会降低植物的活性氧清除能力,导致组织中活性氧积累增多,使植物遭受更重的氧化损伤[17];干旱和极端温度变化会造成植物体内花青素沉着,且干旱时间延长会增加色素沉着[18]。此外,花青素可以清除细胞中的自由基[19],在预防肥胖、心血管健康、抗炎、抗癌等方面发挥着重要作用[20-22],如能抑制脂蛋白氧化和血小板聚集[23],对抑制老年人动脉粥样硬化有一定的作用[24];对改善与年龄有关的神经退化和认知下降等有一些有益作用,帮助老年人改善记忆力[25];可在一定程度上促进肿瘤细胞的凋亡,从而抑制癌细胞转移[26-28]。花青素还能在一定程度上抑制视网膜的光化学损伤、放松睫状平滑肌,起到保护视力的作用[29,30]。
不同类型的花青素主要在内质网中被查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄烷酮3-羟化酶(F3H)、黄酮3′-羟化酶(F3′H)、类黄酮3′,5′-羟化酶(F3′5′H)、二氢黄酮醇-4-还原酶(DFR)及无色花青素双加氧酶/花青素合成酶(LDOX/ANS)等一系列酶催化合成,在经过一个或多个位点的甲基化、酰化或糖基化等修饰后,最终形成稳定的花青苷[31,32],并由谷胱甘肽转移酶(glutathione S-transferases,GST)或其他方式转移至液泡中,形成各种不同的颜色[33]。目前编码这些酶的很多基因已经在模式植物拟南芥中确定,包括CHS(tt4)、CHI(tt5)、F3H(tt6)、F3′H(tt7)、DFR(tt3)、LDOX/ANS(tt18,tt11,tt17,tds4)、GSTF12(tt14,tt19)与MATE(tt12)[34]。研究表明,拟南芥中AtDFR基因可以通过诱导甘蓝型油菜中花色苷的积累,有效地调控盐分和干旱胁迫耐受性[35];拟南芥UFGT基因突变会导致不能合成色素,并且在突变体中过表达TaUFGT-4能使花青素合成恢复[36];将藤茶的AgCHS1基因在烟草中过表达,可以提高烟草花瓣中的花青素含量[37];在烟草中过表达HbF3′H1基因会导致其花瓣大量积累花青素,与非转基因烟草相比颜色显著加深[38]。
目前对花青素的研究已有很多,但关于不同小麦品种间花青素含量及相关基因表达的差异还有待探究。因此,本试验通过比较不同小麦栽培品种幼苗期花青素含量的差异,并利用qRT-PCR对花青素代谢相关基因的表达量进行分析,以筛选富含花青素的小麦品种及影响花青素合成的关键基因,为后续培育功能性小麦提供种质资源和基因储备。
1 材料与方法
1.1 试验材料
试验于2021年9月至2022年3月在聊城大学农学与农业工程学院进行。供试58个小麦栽培品种为泡子麦、扬麦、苏麦3号、小白麦、浙徐福75-3、介吉麦、Arz、紫优6号、周黑麦1号、山农紫麦1号、紫优5号、土麦、丝粉麦、淮麦33、扬麦158、老芒麦、融安小麦、九太石、和尚麦、迟熟小麦、火烧麦、淮麦、洋拉子、铜柱头、红麦、宜都小麦、富阳小麦、田晚、鲁麦15、烟5158、莞7815-5-2-1、东莞小麦、有芒红壳、黄塘麦、白慈麦、崇洋小麦、农林90、猪狼麦、白芒大籽、平头麦、豫农211、郑麦6号、生选6号、济麦44、宛麦20、红壳茧子头、有芒红壳、白麦、中青、Cp07-14、软秆洋麦、封麦6号、KN199、05Z4-020、和阳春、济麦22、海盐种、泰农2413。挑选籽粒饱满的种子,种植于营养土中培养3周,快速剪下小麦幼苗地上部分,迅速置于液氮中保存,用于花青素含量测定及RNA提取。
1.2 试验方法
1.2.1 花青素含量测定 参照Serrano等[39]的方法进行,具体步骤如下:称取50 mg小麦叶片置于1.5 mL离心管中,在液氮中研成粉末;加入700μL酸性甲醇(甲醇与HCl体积比为99∶1),于4℃过夜提取;然后于4℃、12 000 r/min离心1 min,取600 μL上清液于新的离心管中,加入1 mL三氯甲烷,再加400 μL蒸馏水,于4℃、12 000 r/min离心10 min,取上清液,利用分光光度仪(U-3000,HITACHI)分别在530、657 nm处测OD值。设3组生物学重复,每组重复测3次。计算公式:W=(OD530-0.25OD657)/m[39],其中,W为花青素相对含量,OD530、OD657分别为530、657 nm处的光密度值,m为样品质量(g)。
利用Microsoft Excel 2016进行数据整理,采用Graphpad prism 9软件进行单因素方差分析和LSD显著性检验(P<0.05)。
1.2.2 RNA提取与cDNA合成 采用天根生化科技(北京)有限公司的RNAprep Pure植物总RNA提取试剂盒(RNAprep Pure Plant Kit)提取总RNA,然后用诺唯赞HiScript®ⅡQ RT Super-Mix for qPCR(+gDNA wiper)反转录试剂盒反转录生成cDNA。去除基因组DNA体系(16 μL):4×gDNA wiper Mix 4 μL,100~300 ng/μL模板RNA 3 μL,加RNase-free ddH2O至16 μL;用移液器轻轻混匀,置于42℃2 min。随后配制逆转录反应体系20 μL(包括第一步反应液16 μL,5×HiScriptⅡqRT SuperMix 4 μL),用移液器轻轻混匀,然后50℃15 min进行逆转录反应,再85℃5 s使反应酶失活。
1.2.3 花青素合成相关基因的qRT-PCR检测根据花青素合成的代谢通路,选取参与花青素合成的相关基因TaMYB-7D1、TaMYC-2A1、TaCHI-5D、TaPAL-6D1-T2、TaDFR-3B-T1、TaUFGT、TaCHS、TaF3′H、TaF3′5′H和TaANS,以小麦18S rRNA为内参进行qRT-PCR分析。引物(表1)使用Primer Premier 5设计,由北京擎科生物科技有限公司合成。荧光定量PCR扩增使用诺唯赞荧光定量试剂盒(HiScriptⅢRT superMix),反应体系为20 μL,包括cDNA模板2.0 μL,上下游引物(10 μmol/L)各0.4 μL,2×TB Green PremixTaqⅡ(TliRNaseHPlus)10 μL,ddH2O 7.2 μL。Real Time PCR反应程序为:95℃30 s;95℃10 s,55℃32 s,72℃1 min,40个循环。

表1 花青素合成相关基因的qRT-PCR引物
2 结果与分析
2.1 不同小麦栽培品种花青素含量多样性分析
58个小麦栽培品种的花青素含量见表2,其中,浙徐福75-3的花青素含量最低,红麦的花青素含量最高,是浙徐福75-3的6倍多;紫优6号、Arz、生选6号、宛麦20、紫优5号的花青素含量也较高;而泡子麦、苏麦3号、淮麦、融安小麦、九太石、猪狼麦、泰农2413、扬麦、小白麦、田晚的花青素含量较低。经统计分析,有39个品种的花青素含量显著高于苏麦3号(P<0.05),有18个品种的花青素含量与苏麦3号差异不显著。

表2 不同小麦品种的花青素含量
2.2 花青素合成相关基因差异表达分析
为了进一步阐释不同小麦品种花青素合成的差异机制,从58个小麦品种中选择含不同水平花青素的10个品种进行花青素合成相关基因的表达分析,包括紫优6号、Arz、生选6号、紫优5号、济麦44、农林90、封麦6号、小白麦、苏麦3号和浙徐福75-3。
(1)调控花青素合成的转录因子TaMYB-7D1、TaMYC-2A1的表达量在不同小麦品种间差异明显,均在生选6号中高表达,在苏麦3号中不表达。另外,TaMYB-7D1在花青素含量较高的Arz、花青素含量低的浙徐福75-3、花青素含量中等的济麦44中表达量也较高,TaMYC-2A1在济麦44中的表达量也较高,但两者在其他品种中的表达量均显著降低(图1)。

图1 调控花青素合成的转录因子基因TaMYB-7D1、TaMYC-2A1在不同小麦品种中的表达情况
(2)花青素合成路径上游相关基因TaPAL-6D1-T2、TaDFR-3B-T1、TaUFGT在不同小麦品种中的表达量也存在明显差异,均在生选6号中表达量最高,在苏麦3号中表达量最低(图2)。其中,TaPAL-6D1-T2的表达量表现为生选6号>农林90>浙徐福75-3>济麦44>小白麦>Arz>紫优5号>紫优6号>封麦6号>苏麦3号,在紫优6号、苏麦3号和封麦6号中几乎不表达,在浙徐福75-3、济麦44、小白麦、Arz、紫优5号中表达水平相对较低。TaDFR-3B-T1的表达量表现为生选6号>浙徐福75-3>农林90>Arz>小白麦>紫优6号>紫优5号>济麦44>封麦6号>苏麦3号,在紫优6号、紫优5号、济麦44、封麦6号、苏麦3号中几乎不表达,在浙徐福75-3、农林90、Arz中表达水平相对较低。TaUFGT的表达量表现为生选6号>农林90>济麦44>紫优6号>紫优5号>Arz>浙徐福75-3>小白麦>封麦6号>苏麦3号,在苏麦3号中几乎不表达,在紫优5号、Arz、浙徐福75-3、小白麦、封麦6中表达水平相对较低。
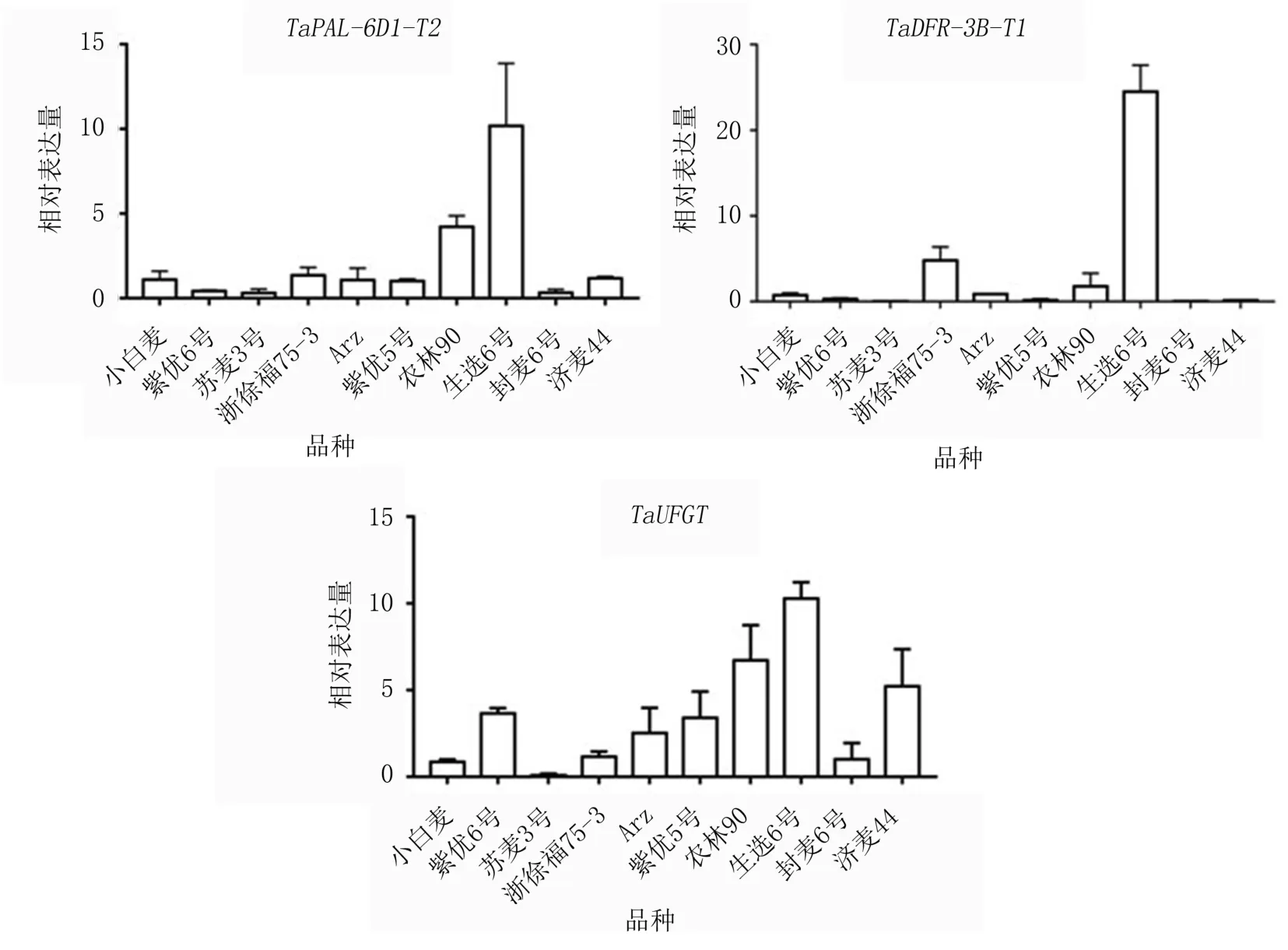
图2 花青素合成相关基因TaPAL-6D1-T2、TaDFR-3B-T1、TaUFGT的相对表达量
(3)花青素合成路径的关键酶基因TaCHI-5D、TaCHS、TaF3′H、TaF3′5′H、TaANS的表达量也均以生选6号中最高,苏麦3号或封麦6号中最低(图3)。其中,TaCHI-5D在其他品种中的表达量较低,在小白麦、紫优5号、封麦6号、苏麦3号中几乎不表达;TaCHS在紫优6号中的表达水平也较高,仅略低于生选6号,在小白麦和苏麦3号中几乎不表达,在其他品种中的表达水平较低;TaF3′H在济麦44、农林90中的表达量也较高,在小白麦、紫优6号、封麦6号中几乎不表达,在其他品种中表达水平较低;TaF3′5′H在农林90、济麦44中表达水平也较高,在封麦6号、小白麦、苏麦3号中几乎不表达,在其他品种中表达水平相对较低;TaANS在浙徐福75-3、Arz、紫优5号、济麦44、农林90中的表达量相对较高,在小白麦、苏麦3号、封麦6号中几乎不表达。
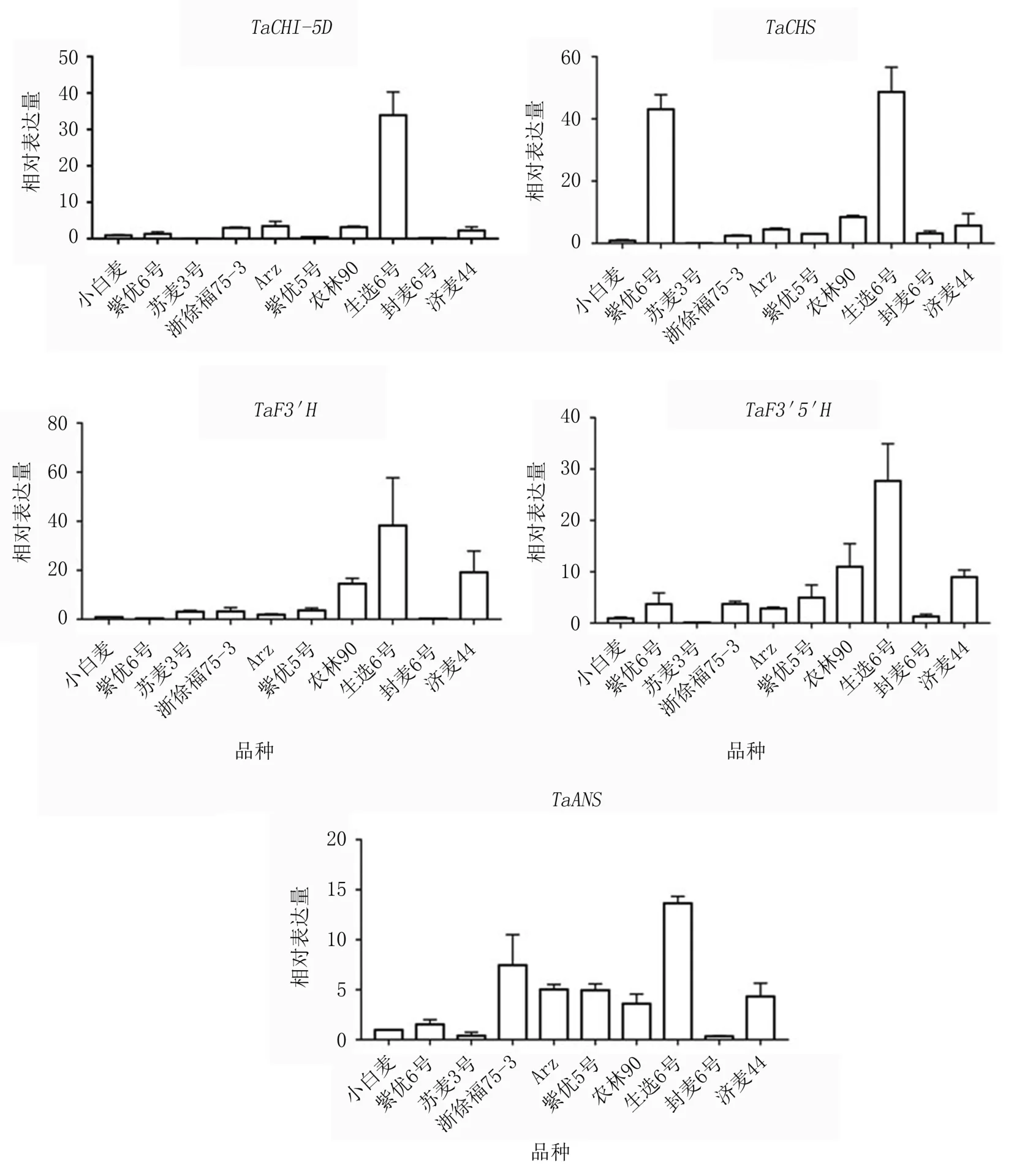
图3 花青素合成路径相关基因的表达量分析
综合可见,上述基因均在花青素含量较高的生选6号中高表达,且表达量明显高于其他品种;均在花青素含量较低的苏麦3号中表达量很低或不表达,且除TaF3′H和TaANS表达量略高于封麦6号外,均明显低于其他品种。其余品种中,紫优6号的高表达基因是TaCHS;Arz、浙徐福75-3中TaMYB-7D1表达水平相对较高;紫优5号中TaCHS、TaF3′5′H、TaF3′H、TaANS表达量较高;花青素含量中等的品种济麦44中TaMYC-2A1表达水平相对较高;TaF3′5′H、TaF3′H、TaUFGT的表达水平在花青素含量中等的农林90中相对较高。
3 讨论与结论
花青素不仅是类黄酮化合物中的一种,也是对植物着色和果实颜色形成很重要的一种色素,植物各组织器官的着色情况与花青素等类黄酮物质的生物合成调控网络密不可分。目前,对植物类黄酮合成途径的研究已相当清楚。根据花青素生物合成途径,可将调控花青素合成的基因分为上游结构基因、早期结构基因、后期结构基因和修饰基因。上游结构基因包括苯丙氨酸氨酰化酶基因(PAL)和4-香豆酸-CoA连接酶基因(4CL);早期结构基因包括CHS、CHI、F3H、F3′H和F3′5′H;后期结构基因包括DFR和ANS;修饰基因包括葡萄糖基转移酶基因(GT)、甲基化转移酶基因(MT)和酰基化转移酶基因(AT)[40-42]。但关于小麦花青素合成机制以及调控花青素合成相关基因功能验证的研究还相对较少。
本研究对58个小麦栽培品种的测定分析表明,不同品种间花青素含量存在差异,红麦、紫优6号、Arz、生选6号、宛麦20、紫优5号中的花青素含量较高,而浙徐福75-3、泡子麦、苏麦3号、淮麦、融安小麦的含量较低。选用不同花青素含量等级的10个品种进一步进行花青素合成路径相关基因(TaMYB-7D1、TaMYC-2A1、TaCHI-5D、TaPAL-6D1-T2、TaDFR-3B-T1、TaUFGT、TaCHS、TaF3′H、TaF3′5′H和TaANS)的表达分析,发现各基因在不同小麦品种中的表达量差异明显,均在花青素含量较高的生选6号中高表达,在花青素含量较低的苏麦3号中表达量很低或不表达。此外,TaMYB-7D1和TaMYC-2A1表达水平在花青素含量中等的济麦44中也较高,TaF3′5′H、TaF3′H和TaUFGT基因在中等花青素含量品种农林90和济麦44中表达水平也较高;紫优6号的高表达基因是TaCHS;Arz、浙徐福75-3中TaMYB-7D1表达水平相对较高;紫优5号中TaCHS、TaF3′5′H、TaF3′H、TaANS表达量较高,其余基因也均有一定表达。推测TaMYB-7D1、TaMYC-2A1、TaF3′5′H、TaF3′H、TaUFGT、TaCHS和TaANS可能在小麦花青素合成中扮演着更为重要的角色,其在不同品种中表达模式的差异可能是引起花青素含量存在明显差异的重要原因,这可为今后进一步探索调控小麦花青素含量的分子机制提供重要的基因资源和种质储备。
苯丙氨酸解氨酶(PAL)基因属上游结构基因,在植物花青素合成过程中扮演着重要的角色。前期有报道指出,在拟南芥中,细胞分裂素(Cytokinin)能够通过诱导PAL1、CHI、CHS和DFR等基因的表达从而促进花青苷的积累[43]。本研究发现TaPAL-6D1-T2在10个小麦品种中均表达,尤其在花青素含量高的小麦品种中表达水平较高。
CHS是黄酮类化合物合成途径的入口,可将1分子的香豆酰-CoA和3分子的丙二酰-CoA合成黄色的查耳酮,然后CHI再将查耳酮异构化形成柚皮素,柚皮素在F3H的作用下形成二氢山奈酚,然后分别在F3′H和F3′5′H的催化下形成二氢槲皮素和二氢杨梅素[44,45]。F3′H和F3′5′H都属于P450细胞色素家族,分别是负责为飞燕草素和矢车菊素形成提供底物的关键酶[46]。本研究结果显示,TaCHS基因在生选6号中的表达量最高,在紫优6号中次之,均明显高于在其他品种中的表达;TaCHI-5D基因在生选6号中特异性高表达,在其他品种中表达量较低或不表达;F3′H和F3′5′H基因在生选6号、农林90和济麦44中的表达量相对较高,尤以生选6号中的表达量最高。表明这4个基因在不同品种小麦花青素合成过程中发挥着不同的作用,其具体的功能及调控机制仍需进一步研究。
DFR和ANS是花青素合成路径中主要的后期结构基因。其中,DFR是花青素合成途径后期的第一个关键酶,是一种还原酶,可催化二氢山奈酚、二氢槲皮素、二氢杨梅素分别形成无色不稳定的原天竺葵素苷元、原矢车菊素苷元和原飞燕草素苷元,然后ANS、GT、AT及MT再将无色的花青素苷元合成有色且稳定的花青素苷,从而使植物呈现不同的颜色[47,48]。此外,DFR还可借助NADPH的作用将二氢黄酮醇催化成原花青素苷元,为下一步有色花青素苷的形成提供物质基础[48],而且其对底物的特异性决定了一种植物积累哪种花青素[49]。ANS是植物花青素生物合成末期的关键酶,主要催化无色花色素向有色花色素转变[50]。在烟草中过量表达McANS能够使烟草花瓣花青素积累增加,花色加深[51]。本研究结果显示TaDFR-3B-T1在不同花青素含量小麦品种中均表达,但表达量不同,在生选6号中的表达量显著高于其他品种;TaANS在生选6号、Arz、紫优5号、浙徐福75-3、济麦44和农林90等花青素含量较高的品种中表达量明显高于其他品种。
此外,前人研究表明贵紫麦1号中GzMYB-7D1和GzMYC-2A1参与调控其花青素合成[52]。本研究也发现TaMYB-7D1和TaMYC-2A1在不同小麦品种中表达水平差异明显,尤其在花青素含量较高的生选6号、浙徐福75-3和济麦44中表达量较高。
综上所述,本研究筛选到一些花青素含量较高的小麦栽培品种,并初步探索了调控花青素合成的相关基因在不同花青素含量小麦品种中的表达情况。这不仅可为功能性小麦品种选育提供优异的种质资源,也可为小麦花青素合成机制的深入探究提供理论基础和基因储备。

