智利大麦2Hch、4Hch和5Hch染色体特异分子标记的建立
陈志伟刘静娴宫文萍韩冉李豪圣刘建军贾举庆刘成
(1.山西农业大学农学院,山西 太谷 030801;2.山东省农业科学院作物研究所/小麦玉米国家工程研究中心/农业农村部黄淮北部小麦生物学与遗传育种重点实验室/山东省小麦技术创新中心/济南市小麦遗传改良重点实验室,山东 济南 250100;3.山东农业大学农学院,山东 泰安 271018)
小麦(Triticum aestivumL.)是世界上种植面积最大的粮食作物,养活了世界上超过1/3的人口[1]。在我国,小麦是第二大粮食作物,产量约占粮食总产量的22%[2]。然而,在小麦遗传改良过程中,由于长期的品种间杂交选育,育成的小麦品种的遗传基础越来越狭窄,对生物胁迫和非生物胁迫的抗性下降甚至丧失,制约着小麦产量的进一步提高[3]。野生近缘物种是小麦抗病抗逆育种的优异基因源,通过杂交将其优良性状导入小麦,可以丰富小麦的遗传基础,对提高小麦育种水平具有重要意义[3,4]。
智利大麦(Hordeum chilense,2n=2x=14,HchHch)是一年生野生种,主要分布于南美洲的智利、阿根廷等地[5],其基因组内含有抗白粉病、叶锈病、秆锈病、全蚀病和颖枯病等的抗病基因[6,7]及抗干旱胁迫和盐胁迫等的抗逆基因[8,9],是小麦育种优异基因的潜在来源[10]。蒋继明等[11]将智利大麦与小麦杂交并进行染色体加倍获得了小麦-智利大麦双二倍体,通过与小麦回交自交获得一批小麦-智利大麦附加系和代换系等珍贵材料,为后续智利大麦优异基因的定位与利用奠定了基础。
近年来,分子标记辅助育种越来越被育种家们接受并应用。SCAR、SSR及KASP等[12]标记已被广泛应用于追踪和选择目标基因以及前景选择和背景选择[13,14],大大缩短了育种年限,降低了育种成本,提高了育种效率。研究表明,禾本科物种的基因序列有较高的保守性[15],可以根据已测序物种的基因序列开发引物来建立未测序物种的分子标记[16,17]。基于此,PLUG引物[18]和IT引物[19]应运而生,并被用于小麦背景下远缘物种染色体分子标记开发[14]。本研究利用PLUG引物和IT引物对中国春-智利大麦双二倍体及对照小麦中国春进行PCR扩增,筛选能扩增出多态性片段的引物,对一套中国春-智利大麦附加系进行扩增,定位相关多态性片段,进而对相应附加系与小麦杂交后代进行检测,验证标记可用性,从而为小麦背景中智利大麦染色质的追踪提供新的检测手段。
1 材料与方法
1.1 试验材料
小麦中国春(Chinese Spring,CS)由电子科技大学杨足君教授提供。中国春-智利大麦双二倍体(CS-Hchamp)由英国约翰英纳斯中心(John Innes Centre,JIC)的Reader S.M.教授提供。CS-智利大麦2HchS端体附加系(TA7587)、CS-智利大 麦4Hch附 加 系(TA7588)、5Hch附 加 系(TA7589)、6Hch附加系(TA7590)以及7Hch附加系(TA7591)由美国堪萨斯州立大学小麦遗传与基因资源中心(Wheat Genetic and Genomic Resources Center,WGGRC)的Gill B.S.教授提供。济麦22(JM22)、济 麦23(JM23)、济 麦262(JM262)、济麦229(JM229)、济麦38(JM38)和济麦44(JM44)由山东省农业科学院作物研究所小麦遗传育种团队培育。CZW1—CZW96是CS-智利大麦2HchS端体附加系/CS的杂交F2后代,CZW97—CZW192是CS-智利大麦4Hch附加系/CS的杂交F2后代,CZW193—CZW288是CS-智利大麦5Hch附加系/CS的杂交F2后代。
1.2 试验方法
1.2.1 DNA提取 供试材料基因组总DNA用快捷型植物基因组DNA提取试剂盒(天根生化科技有限公司)提取。称取约100 mg的叶片放入2mL离心管(提前加入直径2 mm的钢珠)中,液氮中速冻3 min,然后用SCIENTZ-192组织研磨机在30 Hz频率下将叶片打碎至粉末,提取方法参见文献[14]。
1.2.2 IT引物的PCR扩增及电泳 IT引物序列参见文献[14]。PCR扩增程序:预变性94℃3min;变性94℃45 s,退火57℃45 s,延伸72℃1.5 min,共35个循环;充分延伸72℃10 min,4℃保存。706对IT引物由青岛擎科天成生物技术有限公司合成,其中,染色体第二到第七同源群各175、120、89、140、71、111对。IT-PCR产物在2%琼脂糖凝胶中电泳后,在紫外凝胶成像仪GDSGel Dol 2000下扫描照相。
1.2.3 PLUG引物的PCR扩增及电泳 PLUG引物序列参照文献[14],PCR扩增程序同IT引物。477对PLUG引物由青岛擎科天成生物技术有限公司合成,其中,染色体第二到第七同源群各66、83、80、86、54、108对。未经过限制性内切酶酶切、经过限制性内切酶HaeⅢ或TaqⅠ酶切的PLUG-PCR产物分别在2%琼脂糖凝胶中电泳后,在紫外凝胶成像仪GDS-Gel Dol 2000下扫描照相。
酶切体系(15 μL):酶0.2 μL,Buffer 1.5 μL,ddH2O 4.5 μL、PCR产物8.8 μL。酶切程序:TaqⅠ65℃2 h,HaeⅢ37℃2 h。
2 结果与分析
2.1 用于PCR稳定扩增的引物筛选
用477对PLUG引物对中国春和中国春-智利大麦双二倍体的基因组DNA进行PCR扩增,结果发现,309对引物可以在供试材料中扩增出清晰明显的DNA条带,占总引物比约为64.8%;每对PLUG引物扩增出的条带数量为1~7条,扩增出的片段大小为170~2 000 bp。上述309对引物中,能在供试材料中扩增出多态性条带的,用一套小麦-智利大麦附加系进行扩增定位多态性标记所在染色体;不能直接扩增出多态性条带的,利用限制性内切酶HaeⅢ和TaqⅠ对其PCR产物进行酶切,能酶切出多态性的,再用一套小麦-智利大麦附加系进行扩增后酶切定位多态性标记所在染色体。
用706对IT引物对中国春和中国春-智利大麦双二倍体的基因组DNA进行PCR扩增,结果发现,670对引物可以在供试材料中扩增出清晰明显的DNA条带,占总引物比约为94.9%;每对IT引物扩增的条带数为1~4条,扩增出的片段大小为100~2 000 bp。这670对引物中,能在供试材料中扩增出多态性条带的,再用一套小麦-智利大麦附加系进行扩增定位多态性标记所在染色体。
2.2 智利大麦特异PLUG和IT标记的筛选
为了筛选智利大麦染色体特异性引物,我们利用中国春和中国春-智利大麦双二倍体对上述引物进行进一步的筛选。结果发现,98对PLUG引物可在中国春与中国春-智利大麦双二倍体间扩增或扩增/酶切出多态性条带,其中,TNAC1061、TNAC1063和TNAC1066等引物的扩增结果如图1A所示。37对IT引物可在中国春与中国春-智利大麦双二倍体间扩增出多态性条带,其中,CINAU1115、CINAU1116和CINAU1119等引物的扩增结果如图1B所示。

图1 PLUG引物和IT引物在中国春和中国春-智利大麦双二倍体中的扩增结果
2.3 智利大麦染色体特异性PLUG和IT标记的建立
为了明确上述智利大麦特异性标记所在的染色体,我们利用这37对IT引物和98对PLUG引物对中国春、中国春-智利大麦附加系进行扩增,结 果 发 现,CINAU1093、CINAU1101和CINAU1121等17对IT引 物 以 及TNAC1240、TNAC1510和TNAC1326等38对PLUG引物能在小麦-智利大麦附加系中扩增出多态性片段,其中,有4对引物仅在智利大麦的2Hch染色体上扩增出特异性条带,20对引物仅在4Hch染色体上扩增出多态性条带,29对引物仅在5Hch染色体上扩增出多态性条带,CINAU1217引物能同时在2Hch、4Hch和5Hch染色体上扩增出多态性条带,CINAU1187能同时在4Hch和5Hch染色体上扩增出多态性条带。因此,本研究共计获得智利大麦染色体特异分子标记55个(表1)。引物CINAU1121和TNAC1510的扩增结果分别如图2A、B所示。
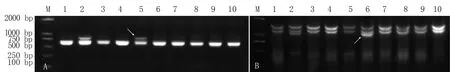
图2 引物CINAU1121和TNAC1510在供试材料中的扩增结果

表1(续)

表1(续)
2.4 智利大麦PLUG和IT标记的验证
为了验证建立的智利大麦染色体特异分子标记的可用性,利用筛选到的2Hch、4Hch和5Hch染色体特异引物(表1)分别对CS-智利大麦2HchS端体附加系/CS的杂交F2后代CZW1—CZW96、CS-智利大麦4Hch附加系/CS的杂交F2后代CZW97—CZW192以及CS-智利大麦5Hch附加系/CS的杂交F2后代CZW193—CZW288进行扩增,结果发现,上述引物均能在相应附加系/CS杂交后代中扩增出目标多态性条带,说明这些标记可用于检测小麦背景中的智利大麦染色质。其中,引物CINAU1121在CZW1—CZW24的扩增结果如图3A所示,引物TNAC1615在CZW197—CZW220的扩增结果如图3B所示。
3 讨论与结论
智利大麦对小麦遗传改良具有重要意义,因此多个智利大麦染色体特异标记得到建立。Hernández等[20]利用RAPD引物建立了11个可以用于鉴定小麦背景中智利大麦染色质的STS标记;Castillo等[21]利用EST-SSR引物建立了21个可用于对智利大麦多态性分析以及小麦标记辅助导入育种的EST-SSR标记。Said和Cabrera[22]利用SSR引物和STS引物建立了智利大麦8个SSR标记和4个STS标记;Mattera等[23]利用EST和COS引物建立了智利大麦特异性标记60个;陈志伟等[24]利用染色体第一同源群的PLUG引物和IT引物建立了智利大麦1HchL染色体的PLUG标记和IT标记各1个。但这对于智利大麦的染色体物理图谱构建和基因精细定位还远远不够。鉴于此,本研究开展了智利大麦染色体特异性分子标记的建立,共建立智利大麦染色体特异分子标记55个,包括38个PLUG标记和17个IT标记,为鉴定小麦背景中智利大麦染色体提供了新的检测手段。
研究证明,PLUG引物和IT引物可以应用于小麦近缘物种染色体特异性标记的建立[3,14,17]。然而,利用这两种引物建立智利大麦分子标记的报道却比较少见。本研究利用上述两种引物建立了智利大麦染色体特异PLUG标记38个和IT标记17个,标记获得率分别为8.0%和2.4%,低于PLUG引物在帝国黑麦、多年生簇毛麦和无芒山羊草中的标记获得率54.9%[25]、41.7%[26]和6.9%[27],也低于IT引物在无芒山羊草以及簇毛麦中的标记获得率21.5%[27]和51.8%[19]。利用PLUG和IT引物建立智利大麦染色体特异标记获得率低的原因可能是智利大麦与小麦的亲缘关系相对小麦与山羊草、黑麦和簇毛麦远,上述猜测得到了来自物种5S RNA短间隔序列、5S RNA长间隔序列以及ITS序列分别对小麦族物种进行系统学分析结果的支持[28]。
智利大麦染色体上拥有小麦育种所需的优异基因[29-31],其中,4Hch染色体上具有抗小麦叶枯病基因,4Hch和5Hch染色体上具有耐盐基因。本研究建立的55个特异分子标记中50个被定位到4Hch或5Hch染色体上,其实用性也经过相应杂交分离群体进行了验证,因此,可通过这些标记辅助从相应杂交分离群体后代材料中选择鉴定耐盐或抗叶枯病的小麦-智利大麦4Hch和5Hch染色体系。目前,笔者正在利用建立的智利大麦染色体特异分子标记结合荧光原位杂交以及耐盐和叶枯病表型调查对小麦-智利大麦杂交后代材料CZW97—CZW288进行鉴定。

