UFLC-MS/MS法测定人胎盘灌流液中氟西汀、去甲氟西汀、舍曲林的浓度及其胎盘透过率
王晶晶 黄桦 晏林 高杉 李骞 王丹 张峻

中圖分类号 R969.1 文献标志码 A 文章编号 1001-0408(2022)02-0217-08
DOI 10.6039/j.issn.1001-0408.2022.02.15
摘 要 目的 建立测定人胎盘灌流液中氟西汀、去甲氟西汀、舍曲林浓度的方法并测定胎盘透过率。方法 以格列本脲为内标,采用蛋白沉淀法对样品进行前处理,采用超快速液相色谱-串联质谱(UFLC-MS/MS)法检测。以SynergiTM Hydro-RP 80A LC为色谱柱,以水(含0.1%甲酸)-乙腈(含0.1%甲酸)为流动相进行梯度洗脱,流速为0.70 mL/min,柱温为40 ℃,进样量为5 μL。采用电喷雾离子源,以多反应监测模式进行正离子扫描,用于定量分析的离子对分别为m/z 309.9→148.1(氟西汀)、m/z 296.0→134.4(去甲氟西汀)、m/z 306.1→159.0(舍曲林)、m/z 493.9→369.1(内标)。建立单个胎盘小叶双向循环灌注模型,在母体侧胎盘灌流液中加入氟西汀(160 ng/mL)、去甲氟西汀(160 ng/mL)、舍曲林(100 ng/mL)和安替比林(阳性对照,100 ng/mL),采用上述UFLC-MS/MS法于循环0、10、20、30、45、60、90、120、150、180 min时分别测定氟西汀、去甲氟西汀、舍曲林的浓度并计算胎盘透过率。结果 氟西汀、去甲氟西汀、舍曲林检测质量浓度的线性范围均为5.00~500 ng/mL(r均大于0.990),定量下限均为5.00 ng/mL;日内、日间RSD均不高于14.0%,相对误差为-9.6%~14.7%;稳定性试验的相对误差为-4.0%~11.0%;残留效应、提取方法、基质效应均不影响待测成分的定量分析。成功建立人胎盘体外循环灌注模型31个,其中15个为氟西汀、去甲氟西汀灌流,10个为舍曲林灌流,6个为安替比林灌流。灌流3 h后,氟西汀、去甲氟西汀、舍曲林的平均胎盘透过率分别为(8.74±1.67)%、(10.70±4.81)%、(5.90%±1.25)%。结论 所建UFLC-MS/MS法操作简便、灵敏度和准确度均较高,可用于测定人胎盘灌流液中氟西汀、去甲氟西汀及舍曲林的浓度。氟西汀、去甲氟西汀、舍曲林均可透过胎盘,但舍曲林的胎盘透过率更低。
关键词 氟西汀;去甲氟西汀;舍曲林;超快速液相-串联质谱法;胎盘灌流;胎盘透过率
Determination of fluoxetine, norfluoxetine and sertraline concentration in human placental perfusate and their placental permeability by UFLC-MS/MS
WANG Jingjing1,HUANG Hua1,YAN Lin1,GAO Shan1,LI Qian1,WANG Dan2,ZHANG Jun1(1. Dept. of Clinical Pharmacy, the First Affiliated Hospital of Kunming Medical University, Kunming 650032, China; 2. Dept. of Neurology, the First Affiliated Hospital of Kunming Medical University, Kunming 650032, China)
ABSTRACT OBJECTIVE To establish the method for determining the concentrations of fluoxetine, norfluoxetine and sertraline in human placental perfusate method and their placental permeability. METHODS Using glyburide as internal standard, the samples were pretreated by protein precipitation method and detected by ultra-fast liquid chromatograph-mass spectrometer/mass spectrometer (UFLC-MS/MS). The determination was performed on SynergiTM Hydro-RP 80A LC column with mobile phase consisted of water (containing 0.1% formic acid)-acetonitrile (containing 0.1% formic acid) at the flow rate of 0.70 mL/min, with a gradient elution. The column temperature was set at 40 ℃, and sample size was 5 μL. Detection was performed with electrospray ionization source in multiple reaction monitoring mode. The ion pairs for quantitative analysis were m/z 309.9→148.1 (fluoxetine), m/z 296.0→134.4 (norfluoxetine), m/z 306.1→159.0 (sertraline), m/z 493.9→369.1 (internal standard). The perfusion model of singal placenta under bidrectional cardiopulmonary bypass was established. Fluoxetine (160 ng/mL), norfluoxetine (160 ng/mL), sertraline (100 ng/mL) and antipyrine (positive control, 100 ng/mL) were added into the maternal perfusate. The concen- trations of fluoxetine, norfluoxetine and sertraline were measured by above UFLC-MS/MS at 0, 10, 20, 30, 45, 60, 90, 120, 150 and 180 min of circulation, and the placental permeability was calculated. RESULTS The linear range of fluoxetine, norfluoxetine and sertraline were 5.00-500 ng/mL (all r>0.990), and the lower limits of quantification were all 5.00 ng/mL. The RSDs of intra-day and inter-day were all less than 14.0%, and relative error ranged -9.6% to 14.7%. The relative error of stability test was -4.0% to 11.0%; the residual effect, extraction method and matrix effect did not affect the quantitative analysis of the substance to be tested. Totally 31 perfusion model of human placenta under cardiopulmonary bypass were successfully established, including 15 fluoxetine and norfluoxetine perfusion, 10 sertraline perfusion and 6 antipyrine perfusion. After 3 hours of perfusion, the average placental permeability of fluoxetine, norfluoxetine and sertraline were (8.74±1.67)%, (10.70±4.81)%, (5.90±1.25)%, respectively. CONCLUSIONS The established UPLC-MS/MS is simple, sensitive and accurate. It can be used for determination of fluoxetine, norfluoxetine and sertraline in human placental perfusate. Fluoxetine, norfluoxetine and sertraline can pass through the placenta, but sertraline has a lower placental permeability.
KEYWORDS fluoxetine; norfluoxetine; sertraline; ultra-fast liquid chromatograph-mass spectrometer/mass spectrometer; placental perfusate; placental permeability
妊娠期妇女因生理、心理等多方面的变化,可能出现妊娠期焦虑和抑郁[1-2]。有研究表明,妊娠期抑郁症可对妊娠期妇女和胎儿的健康造成诸多不利影响,如致胎儿心血管畸形、肺动脉高压、早产等[3]。中、重度以上的妊娠期抑郁症妇女需要接受药物治疗[4-5]。选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRI)是一种新型的抗抑郁药物,包括氟西汀(fluo- xetine,FXT)、舍曲林(sertraline,SERT)、西酞普兰、帕罗西汀、氟伏沙明等[6],其中FXT和SERT均是《中国抑郁障碍防治指南(第二版)》推荐的一线抗抑郁药物,也是妊娠期抑郁症妇女使用最多的SSRI类抗抑郁药物[7-10]。有研究指出,FXT在体内可代谢为具有抗抑郁活性的去甲氟西汀(norfluoxetine,NFXT)[9]。目前,关于SSRI用于妊娠期抑郁症的安全性尚未明确,近年来有研究发现,与正常妊娠期妇女娩出的胎儿相比,妊娠期使用FXT妇女娩出胎儿的不良结局更明显,主要表现为心脏畸形(包括房室隔缺损、房室瓣缺损或房室瓣关闭不全等),发生率为1.18%~1.60%,高于正常妊娠期妇女娩出胎儿心脏畸形的发生率(0.40%~1.00%)[11-12]。因此,检测FXT、NFXT、SERT的浓度就显得尤为重要。
在妊娠期用药安全性评价中,胎儿的药物暴露量常被作为风险评估的理论基础和重要参考,而胎盘屏障是胎儿与母体之间最重要的物质交换通道[13]。因此,研究药物的胎盘透过率,明确药物透过胎盘的速度和程度,可作为妊娠期用药安全性评价研究的方法之一,也是妊娠期用药安全性评价内容的重要依据和补充。目前,我国尚无FXT、NFXT、SERT胎盘透过性研究的相关报道。本课题组前期已成功建立了人胎盘灌注模型,并对药物的胎盘透过性进行了研究[14]。在此基础上,本研究采用超快速液相色谱-串联质谱(ultra-fast liquid chromatograph-mass spectrometer/mass spectrometer,UFLC- MS/MS)法建立了测定人胎盘灌流液中FXT、NFXT、SERT浓度的方法,探讨了上述成分的胎盘透过率,旨在为妊娠期安全用药提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有API 3200TM型三重四极杆串联质谱仪及配备的电喷雾离子源(electrospray ionization,ESI)、氮气源、Analyst Software 1.5.2定量处理软件(美国AB SCIEX公司),LC-20AD型液相色谱系统及配备的LC-20AD XR型高压泵、SIL-20A型自动进样器、CTO-20AC型柱温箱、DGU-20A3型在线脱气机(日本Shimadzu公司),XPE105型电子分析天平(瑞士Mettler Toledo公司),SB3222型超声仪[必能信超声(上海)有限公司],Elix型纯水仪(美国Merck Millipore公司),XH-B型涡旋混匀器(姜堰市康健医疗器具有限公司),5804R型低温高速台式离心机、移液器(德国Eppendorf公司)等。
1.2 主要药品与试剂
盐酸氟西汀对照品(批号100513-201602,纯度99.3%)、盐酸舍曲林对照品(批号100702-202103,纯度99.8%)、格列本脲对照品(内标,批号100135-201806,纯度99.8%)、安替比林对照品(阳性对照,批号100506-202003,纯度>99.9%)均购自中国食品药品检定研究院;盐酸去甲氟西汀对照品(批号10716,纯度99.0%)购自美国Santa Cruz Biotechnology公司;低分子右旋糖酐(批号P1054729)购自上海阿达玛斯试剂有限公司;氯化钠注射液(国药准字H19994067,批号S1709062,规格100 mL ∶ 0.9 g)购自上海百特医療用品有限公司;Krebs-Ringer缓冲液(含葡萄糖1.8 g/L、氯化镁0.047 g/L、氯化钾0.34 g/L、氯化钠7.0 g/L、磷酸氢二钠0.1 g/L、磷酸二氢钠0.18 g/L,批号11801060)购自北京索莱宝科技有限公司;碳酸氢钠注射液(国药准字H41021050,批号11807201,规格10 mL ∶ 0.5 g)购自遂成药业股份有限公司;注射用青霉素钠(国药准字H13020657,批号F7032124,规格80万单位)购自华北制药股份有限公司;肝素钠注射液(国药准字H32020612,批号51809105,规格2 mL ∶ 12 500单位)购自江苏万邦生化医药股份有限公司;小牛血清蛋白(bovine serum albumin,BSA)干粉(批号0306C272)购自美国VWR Life Science公司;甲酸、乙腈、甲醇均为色谱纯,水为超纯水。
2 方法与结果
2.1 溶液的制备
2.1.1 混合对照品贮备液 精密称取盐酸氟西汀对照品2.79 mg、盐酸去甲氟西汀对照品2.80 mg、盐酸舍曲林对照品2.79 mg,用甲醇溶解并定容,制得FXT、NFXT、SERT质量浓度均为50.0 μg/mL的混合对照品贮备液,于-30 ℃下保存,备用。
2.1.2 标准曲线工作溶液、质控工作溶液和内标工作溶液 取“2.1.1”项下混合对照品贮备液,用甲醇逐级稀释,制成FXT、NFXT、SERT质量浓度均分别为5 000、2 500、1 250、500、250、125、50.0 ng/mL的系列标准曲线工作溶液。另取“2.1.1”项下混合对照品贮备液,用甲醇稀释,制得FXT、NFXT、SERT质量浓度均分别为4 500、2 500、150 ng/mL的系列质控工作溶液。精密称取内标对照品150 mg,用乙腈溶解并定容,制得质量浓度为3.00 mg/mL的内标贮备液,于-30 ℃下保存;使用时,取上述内标贮备液80.0 μL,加入乙腈300 mL稀释,混匀,制得质量浓度为800 ng/mL的内标工作溶液。
2.1.3 空白胎盘灌流液和含药胎盘灌流液 取Krebs- Ringe缓冲液500 mL,加入5%碳酸氢钠注射液4 mL、肝素钠注射液2 mL、注射用青霉素钠0.48 g,混匀后,加入BSA 15.0 g,充分搅拌,溶解。将该溶液均分为2份,其中1份加入低分子右旋糖酐7.5 g,充分搅拌均匀,得子体侧胎盘灌流液(含低分子右旋糖酐约30 g/L,即空白胎盘灌流液)。另1份加入低分子右旋糖酐2.1 g,充分搅拌均匀,得母体侧胎盘灌流液(含低分子右旋糖酐约8.4 g/L)。
2.1.4 标准曲线样品溶液 取“2.1.3”项下空白胎盘灌流液180 μL,加入“2.1.2”项下系列标准曲线工作溶液20 μL,制得FXT、NFXT、SERT质量浓度均分别为500、250、125、50.0、25.0、12.5、5.00 ng/mL的标准曲线样品溶液。
2.1.5 质控样品溶液 取“2.1.3”项下空白胎盘灌流液180 μL,加入“2.1.2”项下系列质控工作溶液20 μL,制得FXT、NFXT、SERT质量浓度均分别为450、250、15.0 ng/mL的质控样品溶液。
2.2 样品处理
2.2.1 标准曲线样品溶液及质控样品溶液 取“2.1.4”项下标准曲线样品溶液及“2.1.5”项下质控样品溶液各200 μL,加入“2.1.2”项下内标工作溶液800 μL,涡旋混匀,以14 000 r/min离心8 min,取上清液进样分析。
2.2.2 胎盘灌流液样品 取“2.1.3”项下胎盘灌流液样品180 μL,加入甲醇20 μL,混匀,加入“2.1.2”项下内标工作溶液800 μL,涡旋混匀,以14 000 r/min离心8 min,取上清液进样分析。
2.3 色谱与质谱条件
2.3.1 色谱条件 以SynergiTM Hydro-RP 80A LC(50 mm×2 mm,4 μm)为色谱柱,以水(含0.1%甲酸,A)-乙腈(含0.1%甲酸,B)为流动相进行梯度洗脱(0~1.00 min,2%B;1.00~2.00 min,2%B→90%B;2.00~3.00 min,90%B;3.00~3.10 min,90%B→2%B;3.10~4.00 min,2%B);流速为0.70 mL/min;柱温为40 ℃;进样量为5 μL。
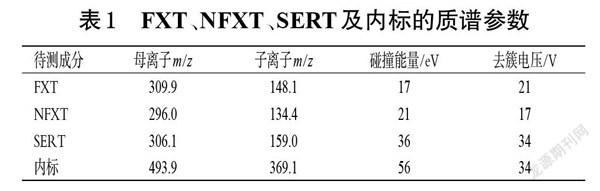
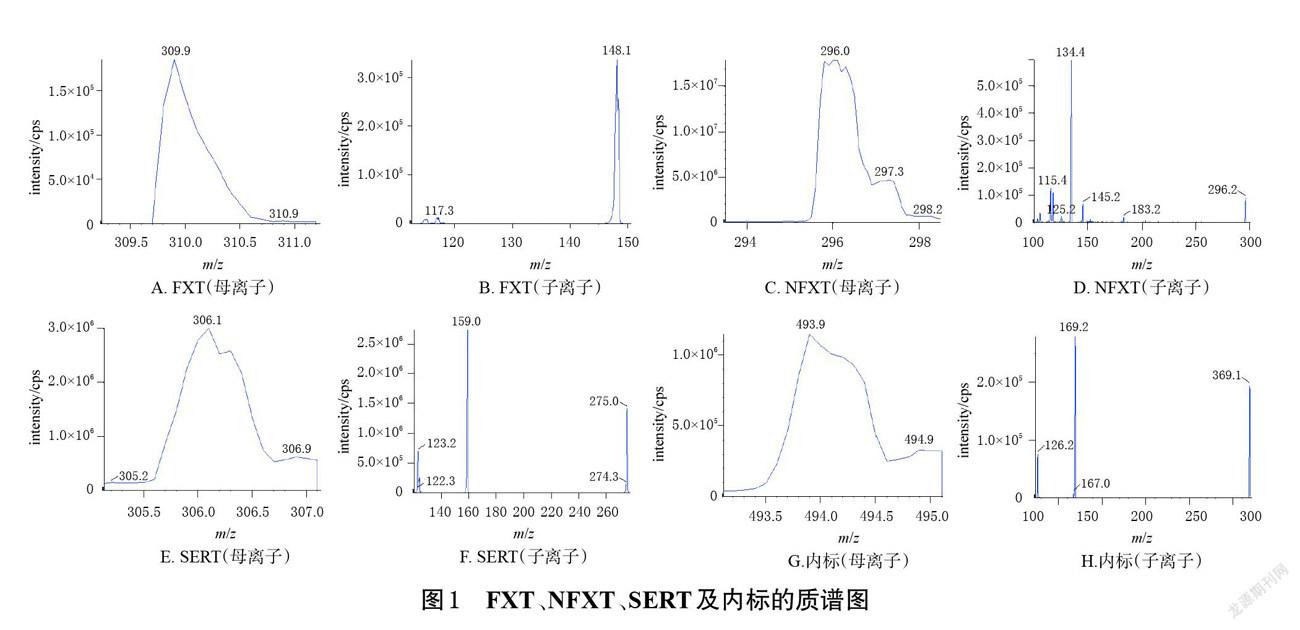
2.3.2 质谱条件 离子源为ESI,检测模式为正离子模式,以多反应监测(multiple reaction monitoring,MRM)模式进行扫描;离子源电压为5 000 V;离子化温度为600 ℃;雾化气(gas1,N2)压力为414 kPa;辅助气(gas2,N2)压力为345 kPa;碰撞气压力为83 kPa;气帘气压力为83 kPa;采用Analyst Software 1.5.2软件对数据进行分析。FXT、NFXT、SERT及内标的质谱参数见表1,其质谱图见图1。
2.4 方法学考察
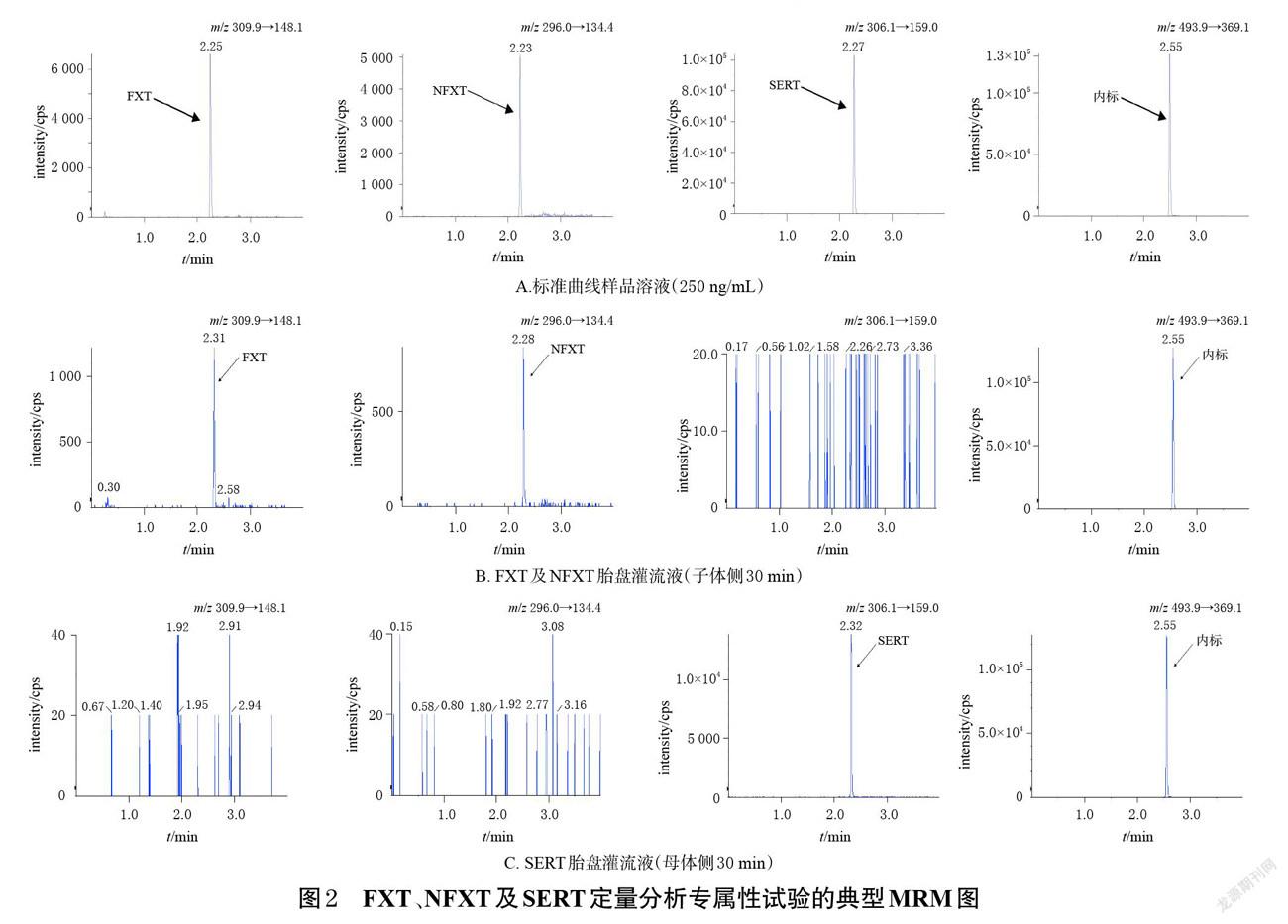
2.4.1 专属性考察 分别取“2.1”项下空白胎盘灌流液、标准曲线样品溶液、含药胎盘灌流液,按“2.2”项下方法处理(空白胎盘灌流液勿需添加内标)后,再按“2.3”项下色谱与质谱条件进样分析,记录色谱图。结果显示,胎盘灌流液中的缓冲液、低分子右旋糖酐等物质对各药物的测定无干扰,表明该方法专属性良好。结果见图2。
2.4.2 线性关系考察 取“2.1.4”项下标准曲线样品溶液,按“2.2”项下方法处理后,再按“2.3”项下色谱与质谱条件进样分析,记录峰面积。以待测成分的质量浓度(x,ng/mL)为横坐标、待测成分与内标峰面积的比值(y)为纵坐标进行线性回归(权重为1/x)。结果显示,FXT的回归方程为y=0.003 88x+0.001 15(r=0.991 2),NFXT为y=0.003 86x+0.002 52(r=0.993 9),SERT为y=0.005 59x+0.031 4(r=0.994 8),FXT、NFXT、SERT检测质量浓度的线性范围均为5.00~500 ng/mL,定量下限均为5.00 ng/mL。
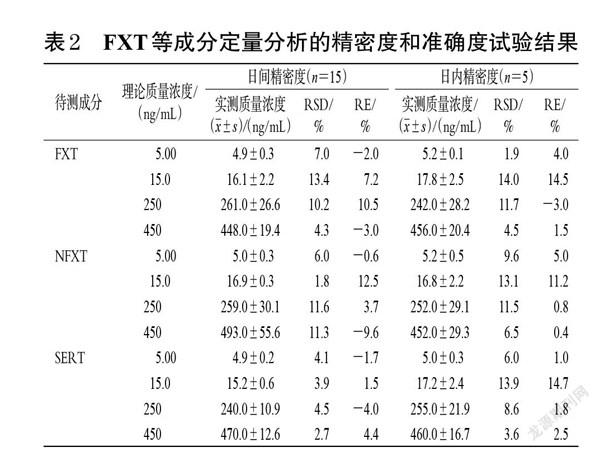
2.4.3 精密度和准确度试验 取“2.1.4”项下质量浓度为5.00 ng/mL(即定量下限)的标准曲线溶液和“2.1.5”项下质量浓度为450、250、15.0 ng/mL的质控样品溶液,各5份,于1 d内按“2.2”项下方法处理后,再按“2.3”项下色谱与质谱条件进样分析,考察日内精密度;连续3 d按“2.2”项下方法处理后,再按“2.3”项下色谱与质谱条件进样分析,考察日间精密度。以实测质量浓度与理论质量浓度进行比较,用相对误差(relative erro,RE)考察准确度。结果显示,各样品的日内、日间RSD均不高于14.0%,RE为-9.6%~14.7%,表明方法的精密度和准确度良好[15]。结果见表2。
2.4.4 稳定性试验 取“2.1.5”项下质量浓度分别为450、250、15.0 ng/mL的质控样品溶液,分别于-30 ℃冷冻保存8 d、反复冻融(-30 ℃~室温)3次后按“2.2”项下方法处理,再按“2.3”项下色谱与质谱条件进样分析,记录峰面积。以实测质量浓度与理论质量浓度进行比较,用RE考察准确度。每样品平行操作6次。结果显示,各样品的RSD均不高于11.5%,RE为-4.0%~11.0%,表明样品在上述各种条件下稳定性良好。结果见表3。
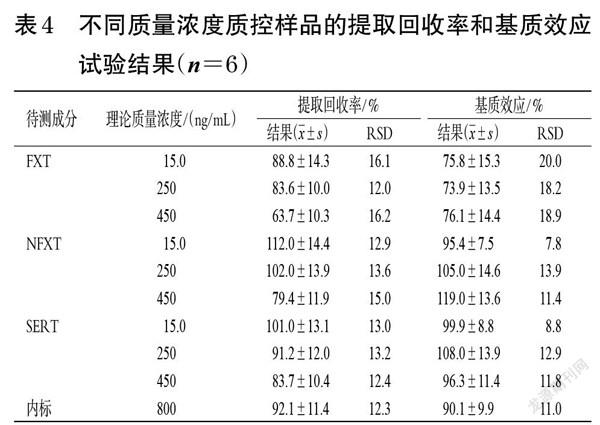
2.4.5 提取回收率和基质效应考察 取“2.1.5”项下质量浓度分别为450、250、15.0 ng/mL的质控样品溶液,每质量浓度平行6份,按“2.2”项下方法处理后,再按“2.3”项下色谱与质谱条件进样分析,记录峰面积A。取“2.1.3”项下空白胎盘灌流液,按“2.2”项下方法处理后,取上清液180 μL作为空白基质,加入“2.1.2”項下4 500、2 500、150 ng/mL的质控工作溶液各20.0 μL,每质量浓度平行6份,按“2.3”项下色谱与质谱条件进样分析,记录峰面积B。取水180 μL代替空白胎盘灌流液,按“2.1.5”项下方法制备质量浓度分别为450、250、15.0 ng/mL的质控样品溶液,每质量浓度平行6份,按“2.2”项下方法处理后,再按“2.3”项下色谱与质谱条件进样分析,记录峰面积C。提取回收率=A/B×100%,基质效应=B/C×100%。结果显示,FXT的平均提取回收率为63.7%~88.8%(RSD≤16.2%),平均基质效应为73.9%~76.1%(RSD≤20.0%);NFXT的平均提取回收率为79.4%~112.0%(RSD≤15.0%),平均基质效应为95.4%~119.0%(RSD≤13.9%);SERT的平均提取回收率为83.7%~101.0%(RSD≤13.2%),平均基质效应为96.3%~108.0%(RSD≤12.9%);内标的平均提取回收率为92.1%(RSD=12.3%),平均基质效应为90.1%(RSD=11.0%)。结果见表4。
2.4.6 残留效应考察 取“2.1.3”项下空白胎盘灌流液180 μL,按“2.1.4”项下方法制备质量浓度为500.0 ng/mL的样品溶液,按“2.2”项下方法处理后,再按“2.3”项下色谱与质谱条件进样分析。取空白胎盘灌流液适量,按“2.1.4”项下方法制备质量浓度为0 ng/mL的样品溶液,同法测定,考察方法的残留效应。每样品平行测定5次。结果显示,空白胎盘灌流液色谱图中未见明显色谱峰。
2.5 胎盘透过率的检测
2.5.1 胎盘纳入与排除标准 本研究中胎盘的纳入标准为:(1)经阴道自然分娩或剖宫产娩出的新鲜胎盘;(2)足月生产(妊娠37~41周)娩出的新鲜胎盘;(3)结构完整且胎盘小叶无明显破损,胎膜、羊膜完整的胎盘;(4)无基础疾病妊娠期妇女娩出的胎盘。排除标准为:(1)经人工剥离的胎盘;(2)经医师判断需要进行病理检查的胎盘;(3)患有基础代谢性疾病或传染性疾病妊娠期妇女娩出的胎盘;(4)分娩超过10 min的胎盘。
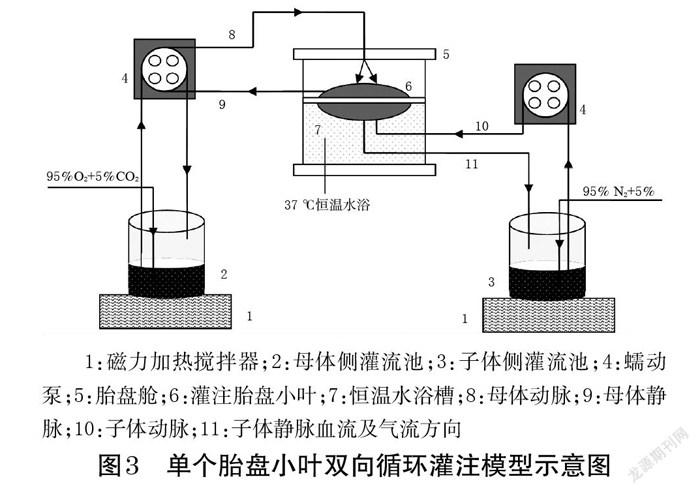
2.5.2 胎盘来源及灌注模型建立 在获取胎盘前已征得妊娠期妇女或家属知情同意,并与之签署了胎盘处置告知书。本研究方案经医院伦理委员会批准,伦理编号为(2016)伦审L第5-1号。选择2017年3月-2020年9月昆明医科大学第一附属医院妇产科提供的胎盘,按如下方法建立胎盘灌注模型:根据胎盘的结构和功能特点,采集刚分娩出的胎盘,选取其中一块完整的胎盘绒毛小叶,建立母体面和胎儿面(子体面)的双向循环,根据实验设计使用含目标物质的胎盘灌流液替代人体血液循环灌注胎盘小叶,模拟真实子宫内母体和胎儿的血液流动情况和内环境,以进行母体和胎儿间各种营养物质和药物交换的研究[9,16-18]。单个胎盘小叶双向循环灌注模型示意图见图3。
本研究成功建立31个胎盘灌注模型,其中15个为FXT、NFXT灌流,10个为SERT灌流,6个为安替比林灌流(阳性对照,由于安替比林为小分子亲脂性化合物,不与蛋白结合,可通过被动扩散经胎盘转运,在胎盘灌流实验中可作为阳性对照以评估模型是否建立成功,也可用于分析不同实验室数据是否存在差异[14])。
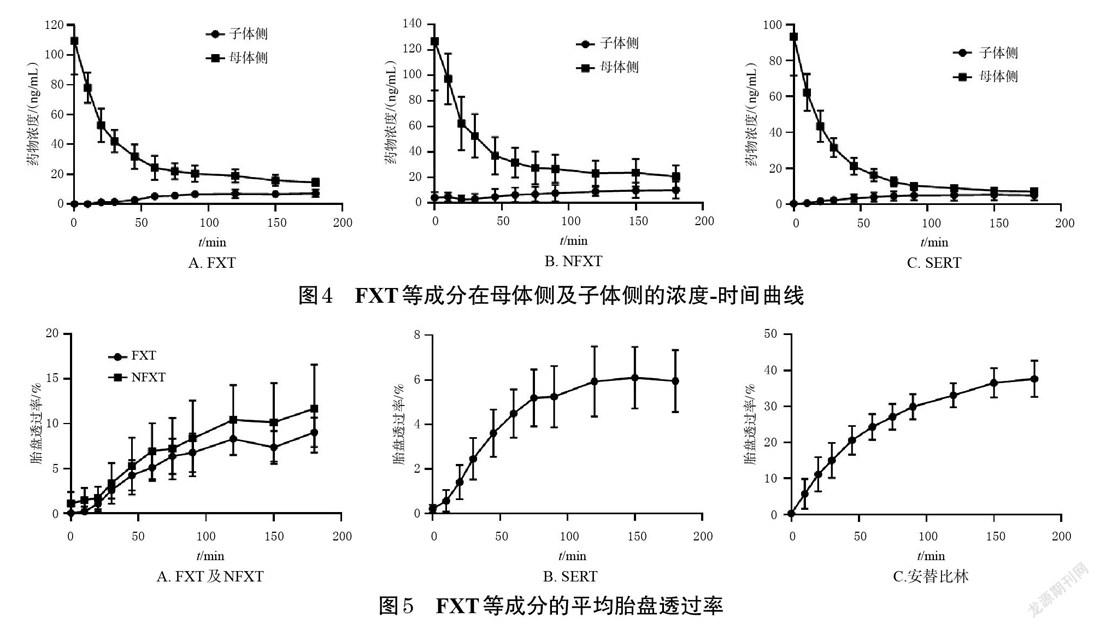
2.5.3 胎盘透过率测定 在FXT的灌注实验中,取“2.1.3”项下母体侧胎盘灌流液,加入盐酸氟西汀对照品、盐酸去甲氟西汀对照品,使FXT和NFXT在母体侧胎盘灌流液的起始质量浓度均为160 ng/mL;在SERT的灌注实验中,取“2.1.3”项下母体侧胎盘灌流液,加入盐酸舍曲林对照品,使SERT在母体侧胎盘灌流液的起始质量浓度为100 ng/mL。在上述单一含药胎盘灌流液中均加入安替比林,使其质量浓度为100 μg/mL。单个胎盘小叶双向闭合循环灌注过程共持续180 min,分别于循环0、10、20、30、45、60、90、120、150、180 min时取子体侧胎盘灌流液样品和母体侧胎盘灌流液样品各0.5 mL,分析FXT、NFXT、SERT以及阳性对照安替比林的质量浓度(安替比林质量浓度检测方法及其方法学验证相关内容参考本课题组已发表的文献[14,19]),使用Graphpad Prism 12.0软件绘制浓度-时间曲线,并按公式计算胎盘透过率:胎盘透过率=CF/CM×100%[20]。式中,CF表示子体侧胎盘灌流液样品各采样点的药物浓度,CM表示母体侧胎盘灌流液样品的最初药物浓度。结果显示,安替比林在灌流3 h后,子体侧胎盘灌流液样品和母体侧胎盘灌流液样品的平均胎盘透过率为(37.68±5.87)%,与既往研究报道的结果[(36.62±5.08)%]基本一致,表明模型功能良好[14,16-17,21]。灌流3 h后,FXT、NFXT、SERT的平均胎盘透过率分别为(8.74±1.67)%、(10.70±4.81)%、(5.90%±1.25)%,表明FXT、NFXT及SERT均可在子体侧胎盘灌注模型中检测到,上述3种药物均可透过胎盘。结果见图4、图5。
3 讨论
本课题组前期分别比较了FXT、NFXT及SERT在ESI正、负离子扫描下的响应情况。结果发现,三者在正离子模式下的响应值均为负离子模式的10倍左右,故选择检测模式为正离子模式。与甲醇-5 mmol醋酸铵溶液等流动相体系相比,以水(含0.1%甲酸)-乙腈(含0.1%甲酸)为流动相时,质谱响应较强,且背景噪音有所降低,故选择水(含0.1%甲酸)-乙腈(含0.1%甲酸)为流动相。本课题组还比较了等度及梯度洗脱对待测成分色谱保留和灵敏度的影响,结果显示,梯度洗脱所得色谱峰峰形良好,灵敏度高,故选择梯度洗脱;同时,根据各待测成分的理化性质及结构,通过摸索最终确定了“2.3.1”项下梯度洗脱程序。此外,本课题组还对不同流速进行了比较,结果发现,当流速为0.5 mL/min时,待测成分出峰速度过慢;当流速为1.0 mL/min时,出峰速度虽有所加快,但其离子化效果较差,影响待测成分的离子化与定量分析,故最终选择流速为0.70 mL/min。通过对色谱与质谱条件的优化,最终确定了“2.3”项下色谱与质谱条件,并实现了待測成分的快速检测(检测时间<4 min)。
目前,药物暴露量与潜在风险的相关性是临床应用中较为关注的问题,也是药物安全性和风险评估的重要参考[8]。药物胎盘透过率是药物暴露量的直接评价指标,胎盘透过率高的药物会有较高的胎儿暴露量,如果药物对胎儿的生长发育存在风险,则容易造成胎儿不良结局,如死胎、早产、低体质量等[9]。Gentile等[22]研究指出,SSRI暴露会引起胎儿呼吸活动改变、心脏血流改变、表观遗传学改变、促肾上腺皮质激素释放激素变化等,但该研究并未考虑剂量差异带来的影响。Mulder等[23]通过B超监测SSRI暴露量与胎儿活动之间的联系,结果发现,与健康人群或使用低剂量SSRI的妊娠期妇女相比,使用常规剂量或更大剂量者,其胎儿睡眠受到影响,胎儿活动次数增加,但不同SSRI之间没有差异。Rurak等[24]研究发现,与晨起给药前相比,峰浓度的SSRI可引起胎儿心率增加、脑动脉血流降低等现象。
由于道德和倫理的限制,基于人体的药物胎盘转运研究难以开展,多以动物模型为基础,再将实验结果外推于人体,然而由于种属的差异,导致结论可能存在争议。人胎盘体外循环灌注模型是目前国际上公认的物质胎盘透过性研究的经典方法,也是应用较为广泛的模型之一[9,16-18]。该模型能够在胎盘完整的前提下,直观地对药物胎盘转运程度进行研究,其优势包括:(1)胎盘的获取已征得妊娠期妇女签字同意,娩出后交予医院进行处理,不存在伦理和道德争议;(2)较原代滋养层细胞等而言,胎盘较易获得;(3)灌注模型是非侵入性的,相比单细胞层模型等更接近于人体体内生理环境,可研究胎盘代谢、激素和酶产生及释放等多种行为[18]。
本研究参考《精神科治疗药物监测指南》[25]及相关文献[26],以160 ng/mL FXT、NFXT或100 ng/mL SERT作为母体侧药物浓度,建立人胎盘灌注模型并进行离体循环灌注研究。结果发现,灌流3 h后,FXT、NFXT、SERT的平均胎盘透过率分别为(8.74±1.67)%、(10.70±4.81)%、(5.90%±1.25)%,表明FXT、NFXT、SERT均可透过胎盘。该结果与体内小样本量研究结果(当给予妊娠期妇女日剂量20 mg的FXT,其FXT与NFXT的脐血/母体浓度比为32%~74%、12%~92%[9,27])差异较大,推测可能与灌流时间较短,而FXT、NFXT、SERT在体内分布较广且具有一定的组织蓄积性有关[28]。胎盘透过性研究结果表明,FXT与SERT仅有少量透过胎盘,且与FXT相比,SERT的透过率更低,故临床更倾向于选择SERT。由于目前国内外缺乏对FXT、SERT引起胎儿发育异常的相关机制研究,故后续需进一步考察上述药物对胎儿发育的影响,以明确其妊娠期应用的安全性。
综上所述,所建UFLC-MS/MS法操作简便、灵敏度和准确度均较高,可用于测定人胎盘灌流液中FXT、NFXT及SERT的浓度。FXT、NFXT、SERT均可透过胎盘,但SERT的胎盘透过率更低。
参考文献
[ 1 ] VIGOD S N,WILSON C A,HOWARD L M. Depression in pregnancy[J]. BMJ,2016,352:i1547.
[ 2 ] BECKER M,WEINBERGER T,CHANDY A,et al. Depression during pregnancy and postpartum[J]. Curr Psy- chiatry Rep,2016,18(3):32.
[ 3 ] NAKIĆ RADOŠ S,TADINAC M,HERMAN R. Anxiety during pregnancy and postpartum:course,predictors and comorbidity with postpartum depression[J]. Acta Clin Croat,2018,57(1):39-51.
[ 4 ] BAŁKOWIEC-ISKRA E,MIROWSKA-GUZEL DM,WIELGOŚ M. Effect of antidepressants use in pregnancy on foetus development and adverse effects in newborns[J]. Ginekol Pol,2017,88(1):36-42.
[ 5 ] DAWSON A L,AILES E C,GILBOA S M,et al. Antidepressant prescription claims among reproductive-aged women with private employer-sponsored insurance-United States 2008-2013[J]. MMWR Morb Mortal Wkly Rep,2016,65(3):41-46.
[ 6 ] BÉNARD-LARIBIÈRE A,PAMBRUN E,SUTTER-DALLAY A L,et al. Patterns of antidepressant use during pregnancy:a nationwide population-based cohort study[J]. Br J Clin Pharmacol,2018,84(8):1764-1775.
[ 7 ] O’HARA M W,ENGELDINGER J. Treatment of postpartum depression:recommendations for the clinician[J]. Clin Obstet Gynecol,2018,61(3):604-614.
[ 8 ] BÉRARD A,ZHAO J P,SHEEHY O. Antidepressant use during pregnancy and the risk of major congenital malformations in a cohort of depressed pregnant women:an updated analysis of the Quebec Pregnancy Cohort[J]. BMJ Open,2017,7(1):e013372.
[ 9 ] HUYBRECHTS K F,PALMSTEN K,AVORN J,et al. Antidepressant use in pregnancy and the risk of cardiac defects[J]. N Engl J Med,2014,370(25):2397-2407.
[10] 李凌江,马辛.中国抑郁障碍防治指南:第二版[S]. 2015年版.北京:中华医学电子音像出版社,2015:59.
[11] GAO S Y,WU Q J,SUN C,et al. Selective serotonin reuptake inhibitor use during early pregnancy and congenital malformations:a systematic review and meta-analysis of cohort studies of more than 9 million births[J]. BMC Med,2018,16(1):205.
[12] GAO S Y,WU Q J,ZHANG T N,et al. Fluoxetine and congenital malformations:a systematic review and meta- analysis of cohort studies[J]. Br J Clin Pharmacol,2017,83(10):2134-2147.
[13] EWING G,TATARCHUK Y,APPLEBY D,et al. Placental transfer of antidepressant medications:implications for postnatal adaptation syndrome[J]. Clin Pharmacokinet,2015,54(4):359-370.
[14] 黄桦,张峻,马润玫,等.人类胎盘体外循环灌注模型的建立[J].中国药理学与毒理学杂志,2013,27(6):1014- 1019.
[15] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:363-368.
[16] SCHNEIDER H. IFPA senior award lecture:energy meta- bolism of human placental tissue studied by ex vivo perfusion of an isolated Cotyledon[J]. Placenta,2015,36(Suppl 1):S29-S34.
[17] CONINGS S,AMANT F,ANNAERT P,et al. Integration and validation of the ex vivo human placenta perfusion model[J]. J Pharmacol Toxicol Methods,2017,88(Pt 1):25-31.
[18] 马雯婷,王晶晶,王茜,等.药物胎盘转运模型的应用研究进展[J].中国临床药理学杂志,2020,36(2):209-212.
[19] 黄桦,姚勤,闫晨,等.超快速液相色谱-串联质谱法测定胎盘灌流液中的安替比林[J].中国药学杂志,2013,48(15):1319-1322.
[20] BOURGET P,ROULOT C,FERNANDEZ H. Models for placental transfer studies of drugs[J]. Clin Pharmacokinet,1995,28(2):161-180.
[21] CONINGS S,TSEKE F,VAN DEN BROECK A,et al. Transplacental transport of paracetamol and its phase Ⅱmetabolites using the ex vivo placenta perfusion model[J]. Toxicol Appl Pharmacol,2019,370:14-23.
[22] GENTILE S,FUSCO M L. Placental and fetal effects of antenatal exposure to antidepressants or untreated maternal depression[J]. J Matern Fetal Neonatal Med,2017,30(10):1189-1199.
[23] MULDER E J H,VERVERS F F,DE HEUS R,et al. Selective serotonin reuptake inhibitors affect neurobeha- vioral development in the human fetus[J]. Neuropsychopharmacology,2011,36(10):1961-1971.
[24] RURAK D,LIM K,SANDERS A,et al. Third trimester fetal heart rate and Doppler middle cerebral artery blood flow velocity characteristics during prenatal selective serotonin reuptake inhibitor exposure[J]. Pediatr Res,2011,70(1):96-101.
[25] DE L J. A critical commentary on the 2017 AGNP consensus guidelines for therapeutic drug monitoring in neuropsychopharmacology[J]. Pharmacopsychiatry,2018,51 (1/2):63-68.
[26] HIEMKE C,BERGEMANN N,CLEMENT H W,et al. Consensus guidelines for therapeutic drug monitoring in neuropsychopharmacology:update 2017[J]. Pharmacopsychiatry,2018,51(1/2):9-62.
[27] HENDRICK V,STOWE Z N,ALTSHULER L L,et al. Placental passage of antidepressant medications[J]. Am J Psychiatry,2003,160(5):993-996.
[28] WANG J J,HUANG H,YAO Q,et al. Simple and ac- curate quantitative analysis of 16 antipsychotics and antidepressants in human plasma by ultrafast high-performance liquid chromatography/tandem mass spectrometry[J]. Ther Drug Monit,2015,37(5):649-660.
(收稿日期:2021-07-26 修回日期:2021-12-10)
(編辑:陈 宏)

