植物冷信号枢纽CBF转录因子转录调控研究进展
李丽丽, 曹磊, 王际宇, 王瑞丹, 毛文文, 侯娟, 李翔, 朱华玉, 李琼, 胡建斌
(河南农业大学园艺学院,河南 郑州 450002)
冷胁迫是自然界中广泛存在的一种重要的非生物逆境,主要分为冷害和冻害两类。冷害指0 ℃以上的低温,可导致植物细胞膜流动性发生变化、活性氧积累和代谢紊乱;而冻害指0 ℃以下的低温,导致细胞内形成一些小冰晶,使细胞壁和细胞膜受损,植株表现出脱水症状[1]。为了应对环境的冷胁迫,植物进化出了一系列复杂的冷响应机制,以减少低温逆境对自身的伤害。研究表明,低温胁迫可激活一系列冷响应相关基因[COR(cold-regulated)、LTI(low temperature-induced)、RAB(responsive to abscisicacid)、KIN(cold-inducible)、RD(responsive to desiccation)、ERD(early dehydration-inducible) ]等的表达,从而启动植物自身的低温防御系统,增强植物的耐冷性[2-3]。CBF转录因子作为冷信号途径中的中心枢纽或“分子开关”,在植物响应冷胁迫过程中起着关键作用,同时也是高等植物中保守存在的冷响应调控因子[4]。目前,依赖于CBF的冷信号通路研究较为透彻,CBF可直接结合下游靶基因(如COR等基因)启动子,通过调控靶基因的转录参与调节植物耐冷性;同时,CBF基因的转录活性也受到上游调控因子的调控[4-5]。例如,拟南芥CBFs基因启动子上的顺式作用元件十分丰富,包括EE、G-box、CarG box、E-box、MYB、CBS、BRRE、MYC、LTR等,许多转录因子能够识别这些元件,从而实现对拟南芥CBFs转录活性的调控[6]。近期研究表明,CBF基因上游调控因子[如ICE(inducer of CBF expression)]的磷酸化、泛素化、类泛素化等翻译后修饰在ICE-CBF-COR信号通路中普遍存在,精细调控CBF的转录活性,从而使植株更好地适应环境中的低温逆境[7]。本研究针对近期发现的CBF上游调控因子及其翻译后修饰进行分析和讨论,以期深化对植物冷响应机制的理解。
1 CBF基因家族及其结构特点
CBF基因家族是一类包含AP2/ERF(APETALA2/ethylene-responsive)DNA结合域的转录因子,它们能够与COR基因启动子区域CRT/DRE(C-repeat/dehydration response element)元件CCGAC结合,调控COR基因的转录活性[8]。拟南芥CBF基因家族有4个成员,其中CBF1(DREB1B)、CBF2(DREB1C)和CBF3(DREB1A)在第4染色体上串联排列,参与调控拟南芥响应冷胁迫[8-9],而CBF4则参与调控拟南芥的耐旱性[10]。CBF1、CBF2和CBF3的氨基酸序列相似性极高(>85%),可能起源于同一基因。过量表达CBF1、CBF2和CBF3基因均能提高植株的耐冷性,并诱导植株体内COR、RD等基因的表达[11],说明它们在植物耐冷性遗传改良中具有潜在利用价值。
对拟南芥CBF的蛋白结构分析发现,CBF属于AP2/ERF家族的一个亚家族,拟南芥中该亚家族有145个成员[12]。CBF蛋白除了含有AP2/ERF DNA结合域之外,还含有2个高度保守的氨基酸序列,即PKKP/PKKPAGR(RAGRxxKFxETRHP)和 DSAWR,这两个序列分别位于AP2/ERF结合域的上游和下游。分子生物学试验证明,拟南芥CBF1的PKKPAGR序列对其转录活性至关重要,该序列的突变削弱了CBF1蛋白与COR15a基因启动子上DNA识别元件(CRT/DRE)结合的能力,降低了COR15a基因表达,植株表现出对冷胁迫更加敏感[12],说明PKKPAGR基序对CBF蛋白行使转录因子功能极为重要。
2 CBF基因的生物学功能
植物冷信号通路可划分为2类,即依赖于CBF和不依赖于CBF的信号通路。其中,依赖于CBF的信号通路是一种复杂的冷信号调控网络,主要通过ICE1-CBF-COR级联模式调控植物耐冷性[5-7]。当植物遭遇冷胁迫时,ICE1转录因子直接结合到CBF启动子区域,激活CBF下游COR等基因的转录,快速响应冷胁迫,增强植物的耐冷性。除ICE1之外,还有一些转录因子(如MYB)与CBF的启动子结合,参与冷胁迫下CBF的转录调控[4-6]。
CBF基因主要在植物遭遇冷胁迫的初期发挥功能,能够使植物迅速响应冷胁迫。在拟南芥中,CBF1/2/3的转录活性在冷处理15 min就被激活,之后转录水平迅速升高,在3 h达到峰值,而CBF基因的下游靶基因COR的转录水平在处理的2 h开始升高[8]。尽管CBF1/2/3功能相似,但表达模式却不完全相同。NOVILLO等[13]研究发现,CBF2突变体比冷驯化前后的野生型的耐冷性更强,冷处理后cbf2突变体CBF1和CBF3的表达量显著升高,且CBF1和CBF3的表达时间要早于CBF2。此结果说明,拟南芥CBFs基因之间存在着负向反馈调节机制,即CBF2可以负调控CBF1和CBF3的表达,从而共同调控下游冷胁迫相关基因的表达。然而,CBF1和CBF3的启动子上并没有CBF2的结合位点[14],说明CBF2并非直接调控CBF1和CBF3。CBF2调控CBF1和CBF3的分子机制目前还不清楚。与CBF2不同的是,CBF1和CBF3不参与调节其他CBFs基因的表达,二者通过一种协同的加性效应方式,正向调控植物的耐冷性[14]。
CBF基因广泛存在于有花植物中,在进化过程中具有保守性,单子叶和双子叶植物的CBF基因均与低温胁迫响应密切相关。在单子叶植物中,过表达玉米ZmDREB1A(与拟南芥DREB1s/CBFs同源)能提高转基因拟南芥的抗旱性和耐冷性[15],在拟南芥中异源表达水稻OsDREB1A和OsDREB1B能显著提高植株的耐冷性,在水稻中过表达OsDREB1能显著提高转基因植株的耐冷性[16]。在双子叶植物番茄中也鉴定到3个CBF基因(LeCBF1/2/3),与拟南芥中的情况相似,LeCBF1/2/3在基因组上呈串联排列。在拟南芥中异源表达LeCBF1能够诱导下游靶基因COR的表达,从而提高拟南芥的耐冷性[17]。然而,在番茄中过表达LeCBF1或AtCBF3基因则不能增强植株的耐冷性[17],在番茄中异源表达甜瓜CmCBF1反而降低转基因番茄的耐冷性和叶片脯氨酸、可溶性糖等抗逆物质的含量[18],说明依赖于CBF冷信号调控途径在番茄和拟南芥中差异较大。以上结果说明,CBF基因在单子叶、双子叶植物中具有高度保守性,但在不同物种中其生物学功能存在一定差异。
3 CBF基因的上游调控因子
CBF基因通过复杂而精细的调控网络在植物响应冷胁迫过程中发挥重要作用,而作为冷信号通路的中心枢纽,CBF基因的转录活性也受各种上游调控因子精准调控。这些调控因子可分为2大类,即正调控因子和负调控因子(表1)。正调控因子包括ICE1/2、CAMTA3/5、CESTA、BZR1/BES1、CCA1/LHY、IPA1等基因,他们能够激活CBF及其下游冷信号靶基因表达,增强植株的耐冷性;而bZIP52/68、PIF3/4/7、EIN3、SOC1、TOC1、PRR5/7/9等则抑制CBF基因的转录及下游靶基因的表达,使植株对冷敏感,属于负调控因子。此外,MYB15基因在不同物种中调控方式不一致。部分CBF基因的上游调控因子(转录因子)还存在翻译后修饰,包括磷酸化、泛素化、类泛素化等(表1),参与调控因子活性和稳定性的调节,从而有效调控植株应对环境的低温胁迫。
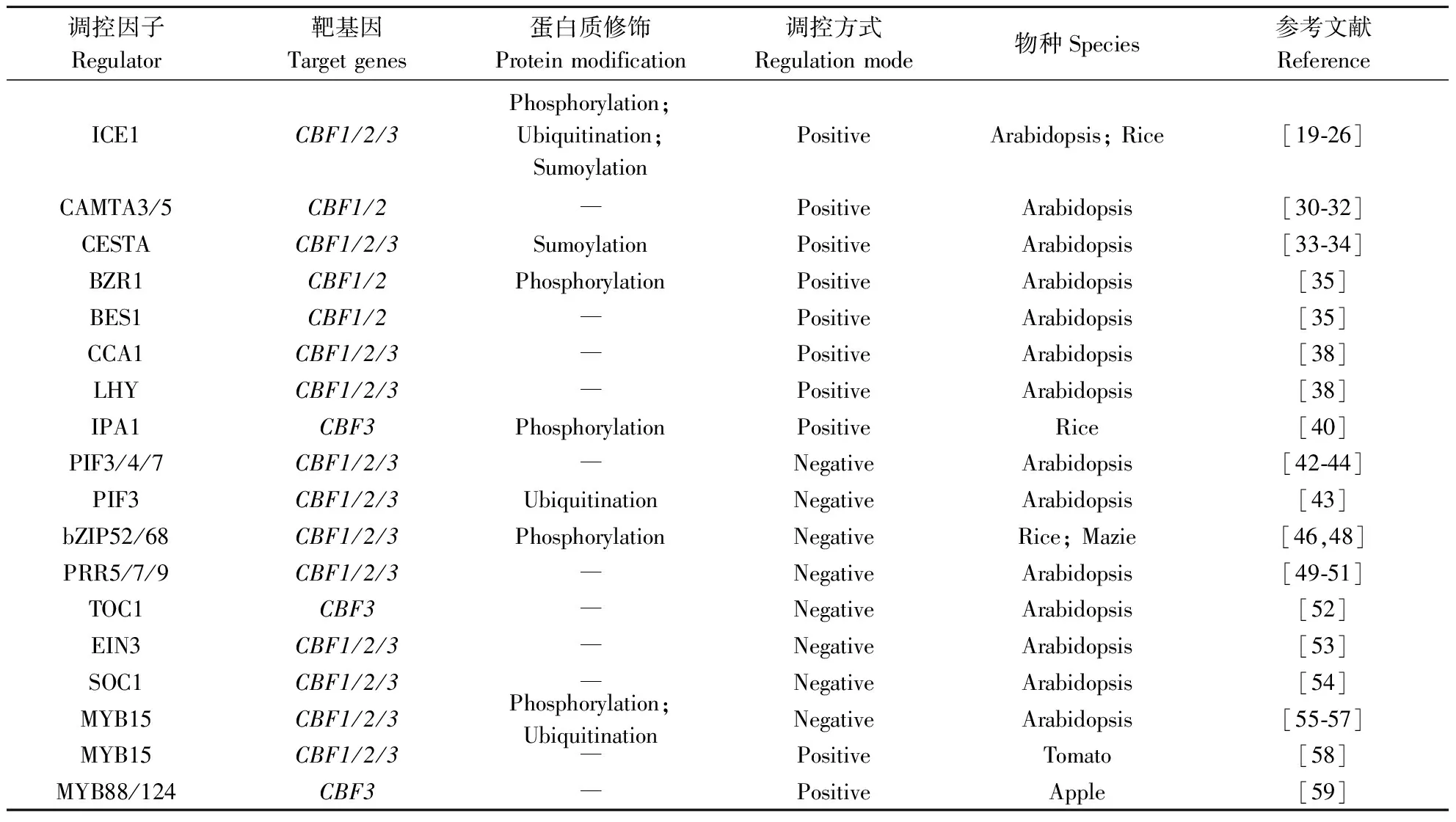
表1 冷信号通路中CBF基因的调控因子Table 1 Regulators of the CBF genes in cold signal pathway
4 CBF上游调控因子的调控方式
4.1 正向调控方式
4.1.1 ICE转录因子家族 ICEs属于MYC-like bHLH(basic helix-loop-helix)类转录因子,拟南芥中有2个成员ICE1和ICE2,且二者高度同源,均能结合到CBF1/2/3的启动子,激活CBFs基因表达[19]。进一步研究发现,冷胁迫下ICE1可结合到CBF1/2/3启动子的MYC结合位点,与MYB15(负调控CBF转录)竞争该位点,形成占位效应,抑制MYB15的负调控作用,从而促进CBF及下游靶基因的表达[20]。此外还发现,突变体ice1表现出对低温高度敏感,而ice2的耐冷性并无明显变化,双突变体ice1ice2中CBF1/2/3表达量显著下降,植株耐冷性显著降低,说明ICE1和ICE2基因存在功能冗余[20]。但ICE1的功能更为保守,在水稻[21]、玉米[22]、番茄[23]等作物中,均可通过直接调控CBFs基因转录活性来增强植物的耐冷性。
近期研究表明,ICE1蛋白能够被蛋白激酶OST1 (open stomata 1)[24]和MPK3/6[25-26]磷酸化修饰,从而增强转录激活活性,参与植物冷胁迫信号调控途径。OST1是ABA信号通路中重要的Ser/Thr蛋白激酶,冷胁迫下OST1与ICE1互作并将ICE1磷酸化,增强ICE1蛋白的转录活性,从而提高植物的耐冷性[24]。在拟南芥中,MPK3和MPK6与ICE1互作并将其磷酸化,促使ICE1降解,进而抑制CBFs基因表达,使植株对冷敏感[26]。而在水稻中,冷胁迫下蛋白激酶OsMPK3能够磷酸化OsICE1,阻止E3泛素连接酶HOS1(high expression of osmotically responsive gene 1)对OsICE1的降解,同时增强OsICE1基因的转录活性,增强植物的耐冷性[27]。因此,在不同物种中ICE1磷酸化修饰的作用方式并不一致,具有明显的物种特异性。
此外,HOS1还能与ICE1/2蛋白互作,通过泛素化调控其在体内和体外的降解,进而影响CBFs的转录活性[28]。而HOS1与ICE1蛋白的互作又可被OST1所干扰,即OST1与ICE1的互作削弱了HOS1和ICE1之间的互作,从而抑制HOS1介导的ICE1在冷胁迫下的降解,维持CBFs的转录活性。MIURA等[29]研究发现,冷胁迫下E3连接酶SIZ1促使SUMO (small ubiquitin-related modifier)与ICE1蛋白底物的结合,导致ICE1蛋白发生类泛素化(SUMO化)修饰,增强ICE1蛋白在冷胁迫下的稳定性,其中ICE1的第393位赖氨酸残基是识别SUMO偶联的关键位点。
4.1.2 CAMTA转录因子家族 CAMTAs(calmodulin-binding transcription activators)是保守的转录因子家族,拟南芥有6个成员,其中CAMTA1、CAMTA2和CAMTA3关系最为密切,并且在CBF冷信号通路中功能冗余[30]。在冷诱导下,CAMTA3能快速结合到CBF1和CBF2启动子上,激活CBFs基因的转录,突变体camta3中CBF1和CBF2显著下调表达,在双突变体(camta1camta2、camta1camta3和camta2camta3)中CBF1、CBF2和CBF3基因均下调表达,但是CBF3下调量稍低,说明CAMTA1/2/3主要调控CBF1和CBF2的转录。DOHERTY等[31]发现,CBF2启动子有7个保守的CM基序(CM1~CM7),其中CM4和CM6具有负调控活性,CM2同时具有负调控和正调控活性。CAMTA3能够与CM2基序结合,激活CBF2表达,正调控植物耐冷性。
自然界中冷胁迫有两种方式:一种是环境温度骤然下降,另一种是环境温度逐渐下降。CAMTA3和CAMTA5只对温度的快速下降作出反应,能快速诱导CBFs的表达,而CAMTA1除了能响应骤然降温外,还受缓慢降温的诱导[32]。说明植物可通过行使CAMTA基因不同功能,响应昼夜变温(骤然降温)和季节变温(逐渐降温)。
4.1.3 CESTA转录因子 CESTA(CES)为bHLH型转录因子,是油菜素内酯(brassinosteroids,BRs)合成途径的关键基因,BRs信号能够为植物提供基础抗性,有助于植物的冷驯化。BRs和CES既能调控依赖于CBF的冷信号通路,又能调控不依赖于CBF的冷信号通路,以多种方式参与植株冷响应调控。在依赖于CBF的冷信号通路中,CES能够结合到CBF1/2/3启动子上,激活CBFs基因及下游COR15A基因的表达,增强植物的耐冷性;而在不依赖于CBF的冷信号通路中,CES蛋白可直接激活COR基因的表达[33]。
CES蛋白包含一个SUMO基序,BRs信号的激活可导致CES发生SUMO化[33],而CES的SUMO化状态能否参与调控CBF冷信号通路,这一问题在很长时间未得到解释。KHAN等[34]设计了包含CES野生型(35S:CESwt-YFP,line 32)、CES SUMO化缺失株系(35S:CESK72R-YFP,line 411)、CES SUMO化增强株系(35S:CESS75A+S77A-YFP,line 310)等系列特殊试验材料,检测了冷处理前后CBF的靶基因COR15A的表达,结果发现,COR15A在CES SUMO化增强株系中的表达量显著高于CES野生型,在CES SUMO化缺失株系中的表达量显著低于CES野生型,并且CES SUMO化缺失株系比CES野生型冷害程度更严重,而CES SUMO化增强株系的冷害只是略低于CES野生型。此结果说明,BRs 和CES参与依赖于CBF的冷信号通路调控,CES蛋白SUMO化修饰有助于增强植株的耐冷性。
4.1.4 BZR1/BES1转录因子 BZR1(brassinazole resistant 1)和 BES1(BRI1 EMS suppressor)是BRs信号传导中的2个重要成员,同CES一样,BZR1也可以调控依赖于CBF和不依赖于CBF的冷信号通路[35]。对BZR1和 BES1的结构域激活突变体(bzr1-1D和bes1-D)的检测发现,无论是否经过冷驯化,bzr1-1D和bes1-D表现出比野生型更强的耐冷性,说明BZR1和BES1正调控植物耐冷性。蛋白互作试验证明,在依赖于CBF的冷信号通路中,BZR1和 BES1能够直接结合到CBF1/2启动子BRRE和E-box位点,激活CBFs基因的表达;此外,BZR1还可以调控不依赖于CBF冷信号通路的其他基因(WKRY6、PYL6、SOC1、JMT、SAG21等)表达,调节植物响应冷胁迫[35]。
BZR1的磷酸化状态在调控BRs信号通路响应低温等非生物胁迫中起着重要作用[36]。LI等[35]检测冷处理不同时间点野生型BZR1蛋白表达量和磷酸化状态时发现,在冷处理前BZR1同时具有磷酸化和去磷酸化2种形态,且以磷酸化形态为主;随着冷处理时间的延长,BZR1的去磷酸化量逐渐增加,在冷处理3 h达到峰值,随后下降,说明冷处理促使BZR1蛋白由磷酸化状态向去磷酸化状态转变,植株对低温响应逐渐减弱。
4.1.5 CCA1/LHY转录因子 CCA1(clock-associated 1)和LHY(late hypocotyl)是2个关系密切的R1/R2型MYB转录因子,是植物生物钟的核心结构(中央振荡器)重要组成成分,参与植物昼夜节律和光周期的调控,二者存在部分功能冗余[37]。DONG等[38]发现,CBF1/2/3的表达(包括冷诱导)受昼夜节律调控。双突变体cca1lhy的CBF1/2/3基因的冷诱导作用明显减弱,CBF1/3的昼夜节律调节消失,CBF2的昼夜节律调节幅度也显著降低;双突变体中COR47和COR78基因的表达也显著降低,植株变得对低温敏感。CBFs基因的启动子CBS区域是CCA1/LHY结合位点。因此,CCA1/LHY通过调节昼夜节律参与CBFs基因冷信号通路,正调控植物的耐冷性。
4.1.6 IPA1转录因子IPA1(ideal plant architecture 1)编码一个含有SBP-box结构域的转录因子,是调控水稻理想株型的关键基因[39]。最近JIA等[40]研究发现,IPA1蛋白的磷酸化对提高水稻耐冷性具有重要作用。水稻应激活化蛋白激酶SAPK6(osmotic stress/aba-activated protein kinase 6)能与IPA1互作,并在S201和S213两个位点对IPA1进行磷酸化修饰,进而维持IPA1蛋白的稳定性。通过突变体ipa1S213N(IPA1蛋白S213位点无法被磷酸化)表型分析发现,该突变体对冷敏感,说明IPA1的S213位点的磷酸化对于植株耐冷性表型具有关键作用;而磷酸化的IPA1蛋白能直接结合CBF3启动子GTAC基序上激活其基因表达,增强植株的耐冷性。这一研究是对IPA1基因功能的进一步挖掘,揭示了该基因的应用价值。
4.2 负向调控方式
4.2.1 PIFs转录因子 光敏色素互作因子PIFs(phytochrome-interacting factors)是植物生长发育的必需因子,也是整合多种内外信号调控植物发育的核心部件。PIFs蛋白中保守的bHLH结构域能特异性地与启动子中的G-box元件结合,从而调控靶基因的表达[41]。植物的CBF冷信号通路也受光周期调控[42]。PIF3是抑制植物光形态建成的关键转录因子,它通过直接与CBF基因启动子结合,负调控CBF及下游靶基因的表达[43]。植物经过长期的进化,已经能够适时地调节生长发育来适应环境中温光变化。在温暖的长日照生长期,PIF4和PIF7能够抑制CBF信号通路,减少不必要能量和营养分配,加速植株生长发育;而在短日照条件下,PIF4和PIF7对CBF的转录抑制减弱,使植物能够更好地应对即将到来的低温[42]。KIDOKORO等[44]发现,在光照条件下pif7突变体中DREB1B(CBF1)和DREB1C(CBF2)的表达没有受到抑制,说明在昼夜节律调控下,PIF7是CBF1和CBF2基因的转录抑制因子。
PIF3基因的转录活性受泛素化修饰的调控。F-box型E3泛素连接酶EBF1和EBF2能与PIF3蛋白互作并将其泛素化,进而通过26S蛋白酶体途径将其降解。与野生型相比,突变体ebf1和ebf2对冷敏感,并且冷处理能促进EBF1和EBF2的降解,增强PIF3蛋白的稳态,抑制CBF基因的表达[43]。
4.2.2 bZIP转录因子家族 bZIP是真核生物中分布最为广泛、进化上最为保守的一类转录因子。拟南芥中的bZIP转录因子分为13个亚家族,共有78个成员,具有调控植物发育、种子休眠、光信号转导、非生物胁迫应答等多种生物学功能[45]。
水稻bZIP52基因的表达受4 ℃低温强烈诱导。bZIP52能结合到CBF基因启动子的G-box基序上,同时也能形成同源二聚体,负调控水稻对低温的耐受性[46]。而水稻bZIP家族另一成员bZIP73在粳稻进化中受到强烈选择,与bZIP71蛋白互作来调节水稻体内脱落酸(ABA)和活性氧(ROS)水平,从而调节水稻对低温的耐受性[47]。在玉米中,bZIP68能够抑制CBF信号途径中多个COR基因的表达,是玉米响应冷胁迫的负调控因子。进一步研究发现,bZIP68通过结合在DREB1s(CBFs)基因启动子A-box元件上,抑制DREB1s的表达,从而参与依赖于CBF的冷信号通路调控。细胞核中的激酶MPK8能直接磷酸化bZIP68的Ser250位点,促进其在冷胁迫下的蛋白积累,增强bZIP68对下游靶基因DREB1启动子的结合。玉米与其祖先种大刍草在bZIP68启动子区域存在一个358bp的片段插入,该片段的插入使bZIP68在玉米中的表达量升高,并导致玉米的耐冷性下降[48]。此结果表明,在玉米驯化过程中bZIP68的耐冷优势等位变异并没有被选择利用,而保留在大刍草中的bZIP68耐冷优势等位变异能为玉米耐冷性分子育种提供基因靶点。
4.2.3 PRR基因家族PRRs(pseudo response regulators)基因是调控植物生物钟的重要成员,在植物光周期控制开花途径中起抑制作用,并通过调控ABA等途径影响植物非生物抗性。目前在拟南芥中鉴定出了5个PRR成员(PRR1/TOC1、PRR3、PRR5、PRR7和PRR9),水稻中也有5个直系同源基因(OsPRR1/OsTOC1、OsPRR37、OsPRR73、OsPRR59和OsPRR95),这5个基因在水稻冷处理后均显著上调[49]。对双突变体prr7prr9的研究发现,PRR7和PRR9可以调节CCA1和LHY响应环境变温;而三突变体prr5prr7prr9的DREB1/CBF基因表达量最高,耐冷性显著增强,植株中棉子糖和脯氨酸的积累也达到了很高水平,因此PRR5/7/9通过调节包括DREB1/CBF在内的应激反应基因来调控植物的耐冷性[50]。采用CHIP-Seq和ChIP-qPCR技术鉴定到PRR5蛋白的直接靶基因为包含AP2/ERF结构域的家族基因DREB1A、DREB1B和DREB1C,而PRR7/9也能直接结合到DREB1B和DREB1C的启动子CBS区域,调控其转录[51]。拟南芥中TOC1能够直接结合到CBF3的启动子上抑制CBF3基因的转录[52]。
4.2.4 EIN3和SOC1转录因子 EIN3(ethylene insensitive3)是乙烯信号通路中的一个重要转录因子,与EIL1(EIN3-like1)共同担负着乙烯信号通路的“总开关”作用,并通过乙烯信号通路调控植物的耐冷性。SHI等[53]研究发现,EIN3过表达植株的耐冷性减弱,而单突变体ein3-1和双突变体ein3eil1耐冷性增强,双突变体CBFs基因表达显著上调;而且EIN3能够结合到CBF和ARR5/7/15的启动子上,负调控这些基因的表达。开花整合基因SOC1(suppressor of overexpression of CO1)属于MADS-box转录因子,也可以直接结合CBF启动子的CarG位点抑制CBF及下游系列COR基因表达,行使其对植株耐冷性的负调控作用[54]。
4.3 其他调控方式
4.3.1 MYB转录因子家族 MYB是植物中最大的转录因子家族之一, 参与植物的生长、代谢、抵御生物和非生物胁迫等多种生理生化过程。R2R3型转录因子MYB15能识别并结合在CBF1/2/3启动子上的MYB位点,抑制CBFs及下游COR基因的表达,是拟南芥、水稻耐冷性的负调控因子[55]。KIM等[56]发现MYB15的转录活性受MPK6介导的磷酸化调控。MPK6能与MYB15互作,通过磷酸化MYB15的Ser168位点抑制MYB15蛋白与CBF3启动子的结合,进一步增强MYB15对植株响应冷胁迫的负调控作用。此外,MYB15的转录活性还受E3泛素连接酶的调控。PUB25和PUB26是编码U-box型E3泛素连接酶的两个基因,他们都能够通过多聚泛素化方式修饰MYB15蛋白,通过26S蛋白酶体途径降解MYB15蛋白,解除MYB15对CBF基因的抑制作用,进而增强冷胁迫下CBF基因表达。冷诱导的OST1蛋白能够磷酸化PUB25和PUB26,增强其E3连接酶活性,加速冷诱导MYB15蛋白降解,增强植株的耐冷性[57]。
然而在番茄中,MYB15的表达可以被HY5(long hypocotyl 5)转录因子所激活,进而促进CBF1/2/3的转录,从而正调控番茄植株的耐冷性[58]。MYB88/124在苹果的抗寒性调节中也起正调控作用,他们不仅能直接正调控CBFs的转录,还能通过不依赖于CBF的途径激活冷休克结构域蛋白MdCSP3(cold shock domain protein 3)的转录,增强控苹果的耐寒性[59-60]。
4.3.2 长链非编码RNA 高等生物基因组上大多数DNA都不编码蛋白,但也能够被RNA聚合酶Ⅱ(RNAPⅡ)转录成长链非编码RNA,即lncRNA(long non-coding RNA)。大多数lncRNA的生物学功能目前还不清楚。KINDGREN等[61]在拟南芥基因组的低温敏感区域鉴定了一个名为SVALKA的lncRNA。SVALKA的突变会影响CBF1基因的表达和植物的耐冷性。RNAPⅡ通过转录SVALKA基因在反义链上产生一个与CBF1基因重叠的lncRNA,即asCBF1。SVALKA-asCBF1 lncRNA级联导致的RNAPII碰撞严格控制着CBF1基因的实时表达,以最小的适应性“成本”获得最大化的耐冷性,有助于植物增强对于低温逆境的适应性。
5 问题与展望
低温作为全球范围内长期存在的主要非生物胁迫之一,是影响植物生长发育和区域分布的关键环境因素。随着全球气候的变化,低温天气出现的频次日益增多,已经成为制约全球农业进一步发展的重要因素。因此,培育能够适应未来低温气候的植物新品种,是保障中国粮食安全、稳定农业生产的关键。
随着生命科学的快速发展,以分子设计育种途径培育耐冷性植物新品种,已经成为学术界的共识,而其首要条件是获得具有育种价值的基因,并明确其生物学功能。在过去的20多年里,人们在多种植物中克隆出响应冷胁迫的CBF/DREB1基因家族[3-5],并以拟南芥、水稻、番茄等模式植物为研究对象,鉴定了一系列CBF信号通路重要的上游调控因子,包括转录因子、蛋白激酶、E3泛素连接酶等(图1),构建了较为完善的植物应答冷胁迫的调控网络[6-8],为培育耐冷性植物新品种积累了基因资源。然而,植物低温应答反应是一个涉及多基因、多信号途径的复杂过程,是一个精细、严密的调控系统,这一系统是植物在长期进化历史中形成的。尽管人们在植物冷信号传导领域取得了不俗的成绩,但我们对植物低温应答机制的认识还十分有限,这主要体现在3个方面:第一,所鉴定的低温应答基因并不能直接用于育种。目前植物低温应答基因大多是采用反向遗传学方法获得,由于物种间遗传背景的差异,这些基因并不能直接用于育种。例如,异源表达CBF1/2/3会导致转基因植株生长发育异常,如矮化、器官变小、花期延迟等,而其原因并不清楚[62-63]。而在番茄中,CBF1的过表达并不能提高植株耐冷性,甚至导致植株对低温敏感[17]。第二,植物感知外界低温信号机制的研究相对薄弱。目前的研究大多集中在转录调控层面,也就是转录因子与启动子顺式元件的结合方式,而转录调控只是植物应答低温信号调控网络的一部分,上游低温信号感受器及其诱发因子(如各种外源物质),可能是启动或关闭转录调控的“开关”,但研究报道较少,目前仅在水稻中发现了外界低温感受器COLD1(chilling tolerance divergence 1)[64]。第三,对冷信号通路中关键转录因子翻译后修饰的方式了解不多。从目前的研究现状来看,CBF基因的上游各种调控因子及其磷酸化、泛素化、SUMO化等少数几种翻译后修饰方式,形成了对植物应答外界低温的精细调控方式的认识,而mRNA前体剪接编辑等转录后修饰的研究甚少。例如,植物生物钟组分CCA1能通过选择性剪切产生2种异构体,均参与对CBFs基因的调控[65]。
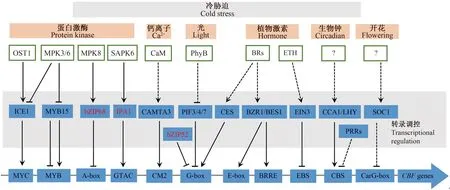
箭头为正调控,T为负调控;实线表示直接作用,虚线表示非直接作用;红色字体的转录因子表示源自作物的基因,其他均为拟南芥基因;?代表未知因子。
随着越来越多植物基因组测序的完成,以及各种组学(基因组、转录组、代谢组等)技术的不断进步,充分利用丰富的植物基因组信息和种质资源,借助现代生物科学和信息学科技术方法,未来可在以下几个方面加强研究,实现植物低温应答机制的突破性进展。1)采用正向遗传学方法挖掘耐冷优异基因。植物耐冷性是复杂的数量性状,不同生育期其表型可能不同,首先要建立高通量耐冷性表型全生育期检测系统以获取精准表型数据,利用丰富的种质资源和遗传群体,采用全基因组关联分析(GWAS)、连锁遗传定位等方法挖掘控制耐冷性的主效QTL及其关键候选基因,克隆一批能在生产中应用的耐冷优异基因和基因模块,积累一批具有育种价值的基因资源。2)继续寻找植物冷信号通路上游温度信号感知因子(特别是膜蛋白基因),因为这些低温感受器(蛋白)极有可能发挥整个冷信号通路的“开关”功能;此外,ABA、JA、BRs、Ca2+离子等作为信号分子参与了植物低温应答调控[6-8]。这些信号分子是如何通过信号转导途径激活相关基因的表达,是否参与了低温感受器的调控。阐明这些问题不仅可以完善植物低温应答信号通路,还有助于研发增强植物耐冷性的栽培管理方法(如外源物质施用),为生产服务。3)进一步拓展转录因子修饰方式的研究。除了常见的磷酸化、泛素化和SUMO化修饰之外,糖基化、脂基化、甲基化、乙酰化等翻译后修饰在决定转录因子的启动子结合、转录激活、蛋白质构象及蛋白互作等关键功能方面也有重要作用,mRNA前体剪接加工、编辑、转运及microRNA介导的mRNA降解,也是转录因子转录后修饰的重要方式,针对这些修饰方式的研究,将进一步丰富植物应答低温的调控方式,深化人们对植物冷信号调控机理的认识。

