UPLC-MS/MS测定畜禽肉中利巴韦林药物与β-受体激动剂残留量
文 娜,毛琼玲,左书瑞,陈国通*
(1.新疆维吾尔自治区分析测试研究院,新疆乌鲁木齐 830011;2. 新疆维吾尔自治区第三人民医院检测中心,新疆乌鲁木齐 830011)
利巴韦林又名病毒唑,系广谱强效的抗病毒药,为单磷酸次黄嘌呤核苷脱氢酶抑制剂,抑制肌红蛋白转变为乌苷酸,阻碍病毒核酸的合成,阻止病毒复制和传播,从而达到抗病毒的作用[1]。该类药物易产生耐药性,使病毒发生变异,长期使用对机体细胞产生毒害作用,其对人体产生的最突出的安全性问题是溶血性贫血、遗传毒性、生殖毒性和致癌性等[2]。
β-受体激动剂主要包括克仑特罗(俗称“瘦肉精”)、妥布特罗、沙丁胺醇、喷布特罗、莱克多巴胺、西马特罗、氯丙那林、非诺特罗、特布他林共9种,该类化合物曾经作为药物用于治疗支气管哮喘[3]。 这些药物的高合成代谢潜能使其可被用于运动学和动物饲养学,以提高肌肉合成、减少身体脂肪,但大剂量的使用会导致其在动物体内残留蓄积,其在肌肉、肾脏、肝脏、肺脏中的残留蓄积量依次升高,残留蓄积浓度可达100~500 ng/g,人食用了这种猪肉后可能会产生剧烈腹痛、肌肉震颤等症状[3],因此限制或禁止在食用动物养殖中使用 β-受体激动剂[3]。
目前还未有利巴韦林和β-受体激动剂残留同时测定的标准方法。已有的方法都是单独检测这2种药物[4-8],对于同一种基质来说要进行2次前处理、2次上机,才能完成一个基质2个项目的测定,不仅要多耗费试剂,还要多耗费人力,对于检测任务繁重的检测人员来说效率低下。该研究以现有文献方法[9-10]为基础,建立了利巴韦林和β-受体激动剂残留同时检测的UPLC-MS/MS方法,以期为检测人员提供技术帮助。
1 材料与方法
1.1 试验材料
1.1.1仪器。Waters UPLC(H-Class) Xevo TQ-S micro高效液相色谱质谱仪(美国 Waters 公司);漩涡振荡器;高速离心机; 多位氮气浓缩仪; Milli-Q 默克超纯水制备系统(德国 MERCK公司); Agilent Bond Elut Plexa PCX 固相萃取小柱(60 mg,3 mL,美国 Agilent 公司)。
1.1.2试剂。利巴韦林标准品(纯度 99.35%),购自德国Dr.Ehrenstorfer公司。利巴韦林-13C5内标物质,购自德国Dr.Ehrenstorfer公司。9种受体激动剂标准品克仑特罗、妥布特罗、沙丁胺醇、喷布特罗、莱克多巴胺、西马特罗、氯丙那林、非诺特罗、特布他林,纯度 99%左右,均购自德国Dr.Ehrenstorfer公司。同位素内标物克仑特罗D-9、沙丁胺醇D-3,均购自德国Dr.Ehrenstorfer公司。甲酸(HPLC级)、甲醇(HPLC级)、β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶,均购自德国 Merck 公司。乙酸钠(分析纯)、冰醋酸(分析纯)、氢氧化钠(分析纯)、异丙醇(分析纯)、乙酸乙酯(分析纯)、高氯酸(分析纯)、氯化钠(分析纯)。去离子水由Milli-Q 超纯水系统(德国 Merck公司)制得。
1.1.3样品来源。全疆14个地州市市场上在售的牛肉、猪肉、羊肉、猪肝、鸡肉。
1.2 溶液的配制
1.2.1标准储备液的配制。分别精密称取利巴韦林、克仑特罗、妥布特罗、沙丁胺醇、喷布特罗、莱克多巴胺、西马特罗、氯丙那林、非诺特罗、特布他林标准品,用甲醇分别配制成100 μg/mL 的标准储备液。
1.2.2混合标准使用溶液(1 μg/mL)的配制。分别准确吸取1.0 mL 利巴韦林、克仑特罗、妥布特罗、沙丁胺醇、喷布特罗、莱克多巴胺、西马特罗、氯丙那林、非诺特罗、特布他林标准储备液至 100 mL 容量瓶中,用甲醇稀释至刻度,摇匀。
1.2.3利巴韦林内标储备液的配制。称取适量利巴韦林-13C5内标,用甲醇溶解,并稀释配制成100 μg/mL的内标储备液。
1.2.4受体激动剂同位素内标储备溶液的配制。称取适量克仑特罗D-9、沙丁胺醇D-3,用甲醇溶解并稀释配制成100 μg/mL 的标准贮备液。
1.2.5同位素内标工作溶液的配制。将上述利巴韦林、受体激动剂同位素内标储备溶液用甲醇适当稀释,配制成受体激动剂内标10 ng/mL、利巴韦林内标100 ng/mL。
1.3 样品处理称取2.0 g(精确至 0.01 g) 已制备好的样品于50 mL离心管中,加入 8 mL乙酸钠(0.20 mol/L)缓冲液(pH 5.2),充分混匀,加入50 μLβ-盐酸葡萄糖醛苷酶/芳基硫酸酯酶,混匀后, 37 ℃水浴12 h。添加100 μL同位素内标工作溶液(受体激动剂内标10 ng/mL,利巴韦林内标100 ng/mL)于水解后样品中,加盖置于漩涡振荡器振荡15 min,离心10 min(5 000 r/min),取上清液加入0.1 mol/L高氯酸溶液5 mL,混合均匀,用高氯酸调节 pH 至 1.0±0.3,以 5 000 r/min 的速度离心 10 min后,将全部上清液置于另一个 50 mL 离心管中,用10 mol/L氢氧化钠溶液调节 pH 至 11.0±0.1,加入10 mL饱和氯化钠溶液和10 mL异丙醇-乙酸乙酯(6+4)混合溶液,充分提取,在 5 000 r/min 下离心10 min,转移全部有机相,在40 ℃水浴下氮气吹干[9]。
将 PCX柱连接到真空过柱装置。将上述残渣溶液上柱,依次用 2 mL水、2 mL 2%甲酸水溶液和 2 mL甲醇洗涤柱子并彻底抽干,最后用 2 mL的 5%氨水甲醇溶液洗脱柱子上的待测成分。 洗脱液在 40 ℃ 水浴下氮气吹干[9]。准确加入1.00 mL 0.1%甲酸/水-甲醇溶液 (95+5),超声混匀。过滤,供UPLC-MS/MS检测。
1.4 UPLC-MS/MS条件
1.4.1液相色谱条件。色谱柱为Waters BEH-C18柱(100 mm×2.1 mm,1.8 μm); 流动相为含0.1%甲酸的水溶液(A),甲醇(B); 梯度洗脱程序见表1,流速为0.3 mL/min;进样量3 μL;柱温为30 ℃。
1.4.2质谱条件。离子源为ESI电喷雾离子源,正离子模式;毛细管电压3.5 kV; 锥孔电压30.0 V;去溶剂温度500 ℃;去溶剂气流1 000 L/h;锥孔气流20 L/h;多反应监测(MRM)扫描模式。监测离子、碰撞能量等见表2~3。

表1 梯度洗脱程序Table 1 Gradient elution procedure
2 结果与分析
2.1 酶的选择由于利巴韦林以原药、利巴韦林单磷酸酯、利巴韦林二磷酸酯和利巴韦林三磷酸酯等形式存在,所以必须对体内磷酸酯化的利巴韦林进行酶解才能对利巴韦林总量进行测定[10-11]。而受体激动剂也是要进行酶解才能对克伦特罗、沙丁胺醇、莱克多巴胺总量进行测定,所以该研究采用GB/T 22286—2008方法和SN/T 4519—2016方法对阳性肌肉样本进行酶解,对比酸性磷酸酯酶和β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶酶解后的利巴韦林、9种受体激动剂的总量。结果表明,按照GB/T 22286—2008方法用β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶酶解 12 h 后的利巴韦林含量比SN/T 4519—2016方法酸性磷酸酯酶酶解测得利巴韦林的量增加了 10%,9种受体激动剂的总量也比酸性磷酸酯酶酶解测得的量高6%。所以该研究选择β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶37 ℃水浴12 h作为酶解条件。
2.2 固相萃取柱的选择固相萃取法一直是降低基质干扰、富集目标物和提高检测灵敏度最好的净化方法。该研究尝试了 MCX、PBA、PCX 等固相萃取小柱,发现MCX小柱对利巴韦林、受体激动剂的重复性较差,PCX 小柱的回收率较PBA小柱的优势较为明显,使得利巴韦林和9种受体激动剂都能得到较好的保留。
2.3 定量方法的选择一是按照国家标准的要求[9,12],利巴韦林和受体激动剂都按照内标法来定量;二是经比较,采用内标法分析得到的利巴韦林和9种受体激动剂回收率在90%以上,比外标法计算得到的回收率高。故该研究采用内标法进行分析计算。但同位素内标量少且贵,大批量样品筛查时成本较高,建议阳性样品再用内标法定量。
2.4 色谱柱的选择该研究时间有点短只是对Waters BEH-C18柱(100 mm×2.1 mm,1.8 μm)和ACQUITY UPLC®HSS T3 (150 mm×2.1 mm,1.8 μm)色谱柱进行了比较,结果发现,Waters BEH-C18柱能将利巴韦林与内源性化合物较好分离,且9种受体激动剂也能较好分离,BEH-C18柱应用广泛,可以检测多种农药兽药,方便检测人员在同一根色谱柱下完成多种检测任务,故选择Waters BEH-C18柱。
2.5 流动相的选择液相色谱流动相常用的有机溶剂有甲醇和乙腈,试验发现,当定容液中有甲醇、流动相中有乙腈时,目标物色谱峰峰形变宽,影响分离度,将乙腈改成甲醇后,目标物色谱峰峰形较好,再比较乙腈、甲醇的毒性、价格、提取率后,建议从提取到流动相都选用甲醇。当流动相中加入0.1%甲酸时可以增加利巴韦林和9种受体激动剂的信号响应,加入乙酸铵时,可以改善色谱峰形[7],但每次检测完后需要大量纯水清洗色谱柱、泵,清洗不干净会腐蚀仪器零件,降低柱效,考虑到样品量、分析时间、色谱柱柱效、仪器耐受等因素,该研究采用甲醇-含0.1%甲酸的水溶液作为流动相。
2.6 质谱条件的选择该研究采用ESI离子源进行分析。将 1 μg/mL标准溶液在正离子模式下进行母离子扫描,确定利巴韦林和9种受体激动剂的母离子。结果发现,利巴韦林有m/z245、m/z267这2个母离子,虽然m/z245 响应较小,但其为加氢峰且较为稳定,故选择其作为母离子;然后对其子离子进行全扫描,其碎片离子主要为m/z113.0、m/z95.9、m/z132.9。m/z113.0 响应较高,可作为定量离子。经优化碰撞能量参数,得到了最佳质谱条件,质谱检测参数见表2。受体激动剂按照国标方法找到其母离子及子离子,见表3。

表2 利巴韦林定性定量离子对、锥孔电压、碰撞能量Table 2 Qualitative and quantitative ion pairs,cone voltage,collision energy of ribavirin
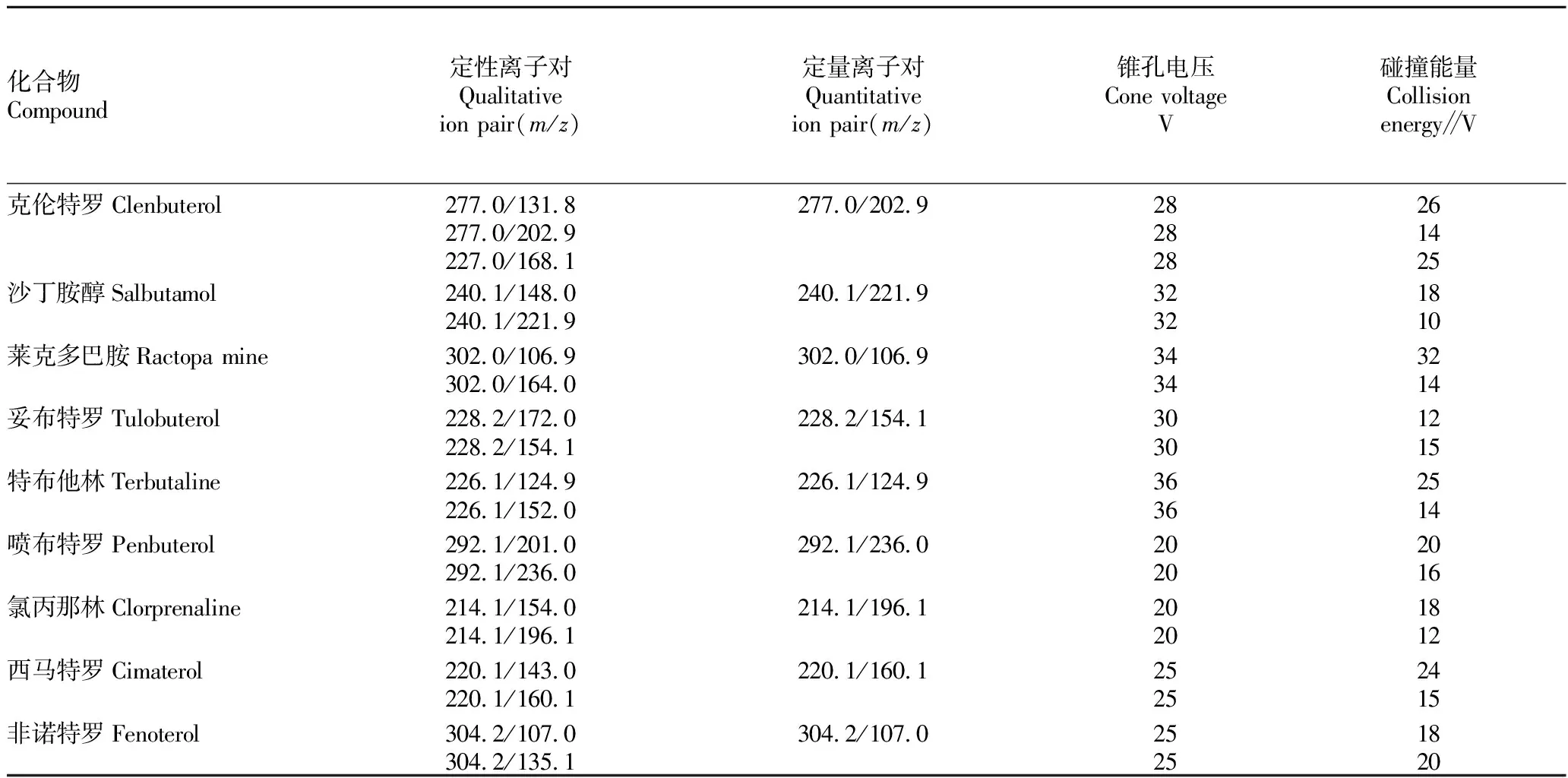
表3 9种受体激动剂的定性离子对、定量离子对、锥孔电压、碰撞能量Table 3 Qualitative ion pair,quantitative ion pair,cone hole voltage,capillary voltage of 9 receptor agonists
2.7 基质影响根据市场监测需求,采集市场的猪肉和鸡肉作为基质,按该方法进行测定。选择其中不含利巴韦林、9种受体激动剂的猪肉和鸡肉作为基质空白,分别添加定量浓度水平的利巴韦林、9种受体激动剂标准溶液,与相应无基质标准溶液进行比较。结果表明,样品基质不会干扰目标化合物的测定,用内标法定量更能消除不同因素对结果的影响。质谱图见图1~2。
2.8 线性范围以目标物峰面积与内标峰面积的比值为纵坐标、目标物的浓度为横坐标绘制各目标物的标准工作曲线。利巴韦林按照浓度为2、5、10、30、50、100、200 ng/mL的系列标准工作液进样,结果表明,利巴韦林浓度在 1~100 μg/kg 呈良好的线性关系(R2>0.999)。9种受体激动剂按照浓度为 0.5、1.0、5.0、10.0、25.0、50.0、100.0 ng/mL的系列标准工作液进样,结果表明,在0.25~50.00 μg/kg呈良好的线性关系(R2>0.999)。具体见表4。
2.9 回收率在空白猪肉及鸡肉样品中,添加利巴韦林和克仑特罗、妥布特罗、沙丁胺醇、喷布特罗、莱克多巴胺、西马特罗、氯丙那林、非诺特罗、特布他林定量检出限的1倍、3倍、10倍3个水平的混合标准溶液进行加标回收率试验。按该研究中前处理方法测定。每个浓度平行测定6个样品。结果表明(表5),10种目标物的回收率为84.6%~108.0%,RSD为1.6%~5.2%,满足食品理化检测中的质控要求[13]。
2.10 方法应用应用该研究中的方法测定了全疆14个地州市市场上在售的约700个主要样本(牛肉、猪肉、羊肉、猪肝、鸡肉)中利巴韦林和9种受体激动剂残留量,结果表明(表6),个别猪肉中检出利巴韦林、克伦特罗,牛肉中检出克伦特罗,其他畜禽肉未发现非法使用10种药物的现象。
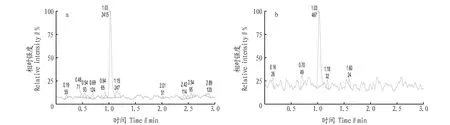
图1 利巴韦林标准品定量离子(a)和定性离子(b)质谱图Fig.1 Mass spectrum of quantitative ion (a) and qualitative ion (b) of ribavirin standard

图2 9种受体激动剂标准物质定量离子、定性离子质谱图Fig.2 Mass spectrum of quantitative ion and qualitative ion of nine receptor agonist reference materials

表4 利巴韦林、9种受体激动剂标准工作曲线Table 4 Standard working curves of ribavirin and 9 receptor agonists

表5 10种目标物回收率测试结果(n=6)Table 5 Recovery rate test results of 10 target substances
3 结论与讨论
该研究建立了利巴韦林与9种β-受体激动剂的超高效液相色谱-串联质谱(UPLC-MS/MS)检测方法,提高食品检测人员检测效率。在样品前处理中,采用β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶酶解,用高氯酸调节 pH,沉淀蛋白后离心,上清液用异丙醇-乙酸乙酯提取,经固相萃取柱净化,前处理步骤可以将利巴韦林和9种受体激动剂同时处理。在UPLC-MS/MS上同时检测这10种目标物,且能达到国家标准要求的检出限(利巴韦林1.00 μg/kg,9种受体激动剂的检出限均为 0.25 μg/kg),线性范围内相关系数良好,回收率在84.6%~108.0%,RSD为1.6%~5.2%,满足食品理化检测中的质控要求[13]。该方法在一次前处理一次上机检测的同时,完成了10种药物的监测,节省检测成本,提高工作效率,可用于各种畜禽肉中利巴韦林与β-受体激动剂残留量的定量检测及风险监测。

表6 畜禽肉检出情况Table 6 Detection of livestock and poultry meat

