QuEChERS-HPLC-MS/MS在畜禽肉中兽药残留分析的应用
张定秋,苏 燕,杜 钢,蒋珍菊
(1.西华大学,四川成都 610039;2.四川食品检验研究院,四川成都 611700)
喹诺酮类兽药因具有吸收快、见效好、毒性较低等特点,被广泛用于畜禽病患的预防和治疗[1-2]。但如果不恰当使用此类抗生素药物,容易导致残留在受体动物内,经过食物链传递而进入人体内,可能导致人体对该类药物产生耐药性[3]。世界各国相继出台了喹诺酮类多种兽药的最高残留限量标准,我国农业部第235 号和2292号公告对兽药的使用及限量也进行了明确规定[4]。目前,动物性食品中喹诺酮类兽药残留的检测方法主要有高效液相色谱法(HPLC)[5-8]、高效液相色谱串联质谱法(HPLC-MS/MS)[9-12]、荧光偏振免疫分析(FPIA)[13]和胶体金免疫层析方法[14]等。由于食品特别是动物食品及制品基质的复杂性,在前处理净化后并不能有效地去除样品基质的干扰,这严重影响分析结果的准确度和精密度,因此基质干扰问题是食品检测人最关注的问题[15-16]。检测方法的基质效应会随前处理方法、样品种类、基质浓度和兽药浓度等因素的变化而变化,并影响检测结果的准确性[17]。
QuEChERS(Quick,Easy,Cheap,Effective,Rugged,Safe)是一种快速、简单、廉价、高效、可靠和安全的分散固相萃取技术,目前被广泛应用于食品中农药、兽药的残留检测[18-23],但是目前该前处理技术应用于检测肉类食品(鸡肉、猪肉)中喹诺酮类兽药残留的报道不多。笔者为降低基质效应,以市售生猪肉和鸡肉为例,采用EMR-Lipid 增强型脂质去除净化管,提升供试溶液洁净度[24],建立QuEChERS-高效液相色谱串联质谱法快速测定猪肉和鸡肉中环丙沙星、双氟沙星、恩诺沙星、氟罗沙星、洛美沙星、氧氟沙星、培氟沙星、沙拉沙星和司帕沙星共9喹诺酮类兽药残留的分析方法,并将其结果与现行国家食品安全检测方法GB/T 21312—2007[25]检测结果进行比较。
1 材料与方法
1.1 试验材料
1.1.1试剂。环丙沙星、双氟沙星、恩诺沙星、氟罗沙星、洛美沙星、氧氟沙星、培氟沙星、沙拉沙星和司帕沙星共9种标准品(均为固体),均购于天津阿尔塔科技有限公司。甲醇、乙腈、正己烷、二甲亚砜,色谱纯,Thermo Fisher Scientific;甲酸、乙酸,色谱纯,CNW Technologies;醋酸铵、柠檬酸、磷酸氢二钠、氢氧化钠、乙二胺四乙酸二钠,分析纯,成都市科龙化工试剂厂;EMR-Lipid、EMR-Polish粉包,分析纯,Agilent Technologies;超纯水;有机系微孔滤膜(13 mm×0.22 μm),天津亿鼎鑫分析仪器有限公司。
1.1.2试材。样品来源于市场抽样。
1.1.3仪器与设备。Agilent1290-6495高效液相色谱串联质谱仪,Mettler ToledoBSA423S和 XS204 电子天平,IKA MS3digital涡旋仪,Thermo Heraeus X3R 离心机,Thermo Legend Micro 17R离心机,IRM AS1511519超声机,Caliper Tyrbovap LV氮吹仪,Mettler ToledoS220-K酸度计,Waters固相萃取仪,Merck MilliporMilli-Q超纯水机,Eppendorf 20 μL、100 μL、1 000 μL、5 mL可调量程移液器。
1.2 试验方法
1.2.1标准品溶液配制。分别精密称取9种喹诺酮类标准物质约10.0 mg,用乙腈溶解、定容至10 mL,配制成1 mg/L的标准储备溶液,保存于2~8 ℃冰箱。临用前分别取储备液0.1 mL,用乙腈定容、配制浓度为1 μg/mL的中间液。再用15%乙腈-水溶液依次稀释,配制成1.00、2.50、10.00、50.00、100.00 ng/mL的标准曲线溶液。
1.2.2QuEChERS方法。称取均质后样品(鸡肉、猪肉)5 g(精确至0.01 g),放置50 mL离心管中,加入 5% 甲酸乙腈提取液10.0 mL,再加2颗陶瓷均质子,2 000 r/min涡旋混匀 5 min,5 000 r/min离心 5 min;移取 5.0 mL提取液到经过活化的EMR-Lipid dSPE管中,快速振摇并涡旋 2 min(2 000 r/min),再5 000 r/min离心 5 min;将上层液转移至 50.0 mL 离心管中,加2颗陶瓷均质子及3.5 g EMR-Polish粉包,剧烈、快速振摇并涡旋 2 min(2 000 r/min)后离心 5 min(5 000 r/min);取 2 mL 上层溶液至玻璃试管中,加入 0.050 mL 二甲亚砜以防止在40 ℃下氮气浓缩时溶液被吹干,浓缩至剩余液体约 0.050 mL向试管中加入 0.950 mL 15% 乙腈-水溶液,2 000 r/min涡旋10 s,超声辅助处理10 s,2 000 r/min涡旋 1 min;将前处理后的溶液转移至 1.5 mL 离心管中,10 000 r/min离心 2 min,有机系微孔滤膜过滤,将滤液收集至15 mL离心管中,待分析。同理制得空白基质溶液,按照“1.2.1”方法配制相同浓度基质混合标准溶液,待分析。
1.2.3国家食品安全检测方法。与GB/T 21312—2007方法一致,并制得空白基质溶液,按照“1.2.1”方法配制相同浓度基质混合标准溶液。
1.3 仪器工作条件
1.3.1色谱条件。Agilent 1290高效液相色谱仪,Agilent 6495型串联质谱仪。色谱柱为安捷伦 C18柱(3.0 mm×150 mm,1.8 μm);流动相A为0.2%甲酸水,B为0.2%甲酸乙腈;梯度洗脱程序见表1;流速0.5 mL/min;柱温40 ℃;进样量2 μL;运行时间26 min。
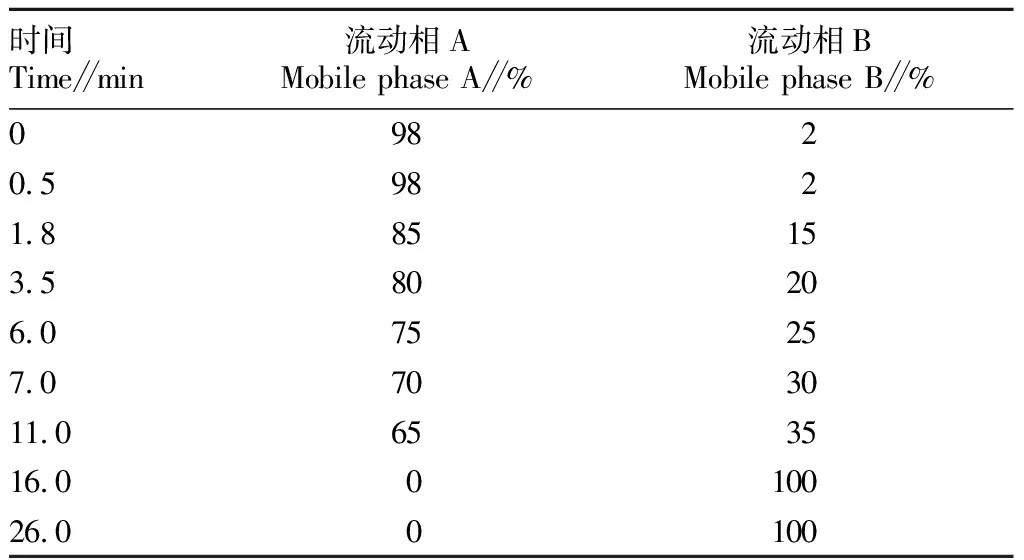
表1 梯度洗脱程序Table 1 Gradient elution procedure
1.3.2质谱条件。电离模式为ESI(正模式);检测方式为动态多反应离子监测(dMRM);电离电压为3.5 kV;干燥气流速为13 L/min;干燥气温度为150 ℃;鞘气流速为12 L/min;鞘气温度为300 ℃;雾化器流量为241.32 kPa。
1.3.3质谱参数。以2 μL/min 的流速注入200 ng/mL的9种喹诺酮类兽药混合标准溶液进行质谱扫描,筛选出最佳母离子扫描的条件,再对母离子进行扫描,以信号最强的离子对作为定量离子对,以信号次强的离子对作为定性离子对,得到9种喹诺酮类兽药质谱参数,详见表2。

表2 质谱采集参数及保留时间Table 2 Mass spectrum acquisition parameters and retention time
2 结果与分析
2.1 QuEChERS提取溶剂的选择提取溶液中酸浓度升高会使蛋白质快速成团,从而影响目标兽药的提取。在相同提取步骤下进行3组提取溶剂,每组3个平行,每个平行连续测定2次,第1、2、3组分别用10.0 mL乙腈、3% 甲酸乙腈、5% 甲酸乙腈进行提取,其余的净化、除水、氮吹和复溶等所有操作完全一致。不同加标浓度在鸡肉基质和猪肉基质中回收率平均值(n=2)比较见图1~2。结果表明采取5% 甲酸乙腈提取,9种喹诺酮类兽药响应值最高、峰形更尖锐、回收率更佳。

图1 3种提取试剂在不同加标浓度的鸡肉基质回收率比较Fig.1 Comparison of recovery rates of three extraction reagents in chicken substrate with different spiked concentrations

图2 3种提取试剂在不同加标浓度的猪肉基质回收率比较Fig.2 Comparison of recovery rates of three extraction reagents in pork substrate with different spiked concentrations
2.2 方法检验
2.2.1线性范围和检出限。按照“1.2.1”方法处理质量浓度梯度为1.00、2.50、5.00、10.00、50.00、100.00 ng/mL的基质加标标准工作溶液,按照“1.3”条件进行检测,以加标基质标准工作溶液浓度为横坐标、定量离子的峰面积为纵坐标绘制标准曲线,以QuEChERS技术前处理后,HPLC-MS/MS检测结果表明,9种喹诺酮类兽药在鸡肉和猪肉基质中浓度在1~100 ng/mL 线性关系良好(R2>0.998),线性回归方程和决定系数见表3~4。结合空白基质噪音响应,以信噪比S/N=3确定方法的检出限(LOD),鸡肉基质检出限为0.5 μg/kg、猪肉基质检出限为0.2 μg/kg。
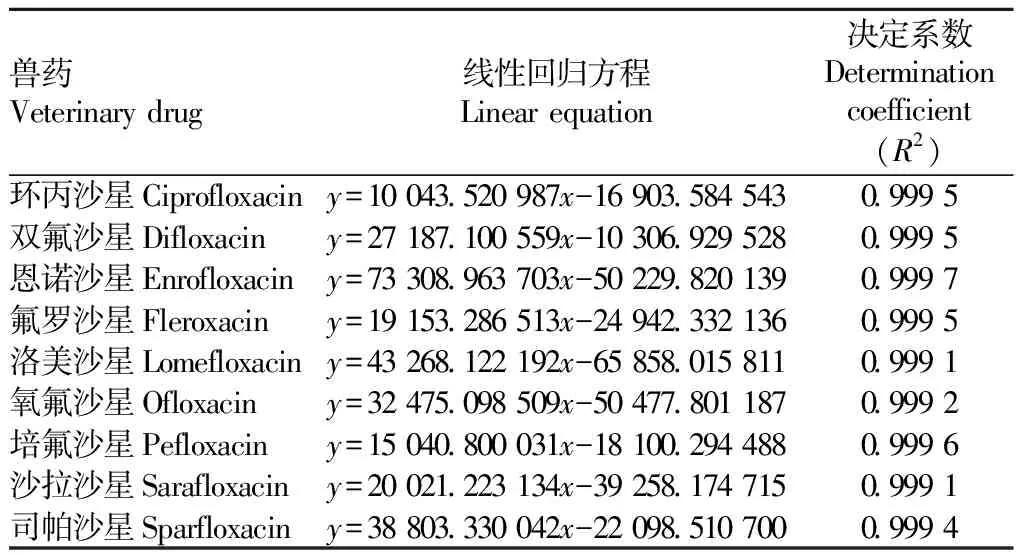
表3 鸡肉基质线性方程和决定系数Table 3 Linear equation and determination coefficient of chicken matrix

表4 猪肉基质线性方程和决定系数Table 4 Linear equation and determination coefficient of pork matrix
2.2.2准确度、精密度和稳定性。为了验证QuEChERS技术测定9种喹诺酮类兽药残留在猪肉和鸡肉中的可行性和准确性,以已检测过的阴性样品的空白鸡肉基质样品和空白猪肉基质样品进行加标回收率验证,加标量梯度分别为2.5、10.0、100.0 μg/kg,按照“1.2.2”方法用QuEChERS技术处理,重复试验6次,再计算平均相对标准偏差(RSD)和回收率,试验结果见表5~6。从表5~6可以看出,空白鸡肉基质样品平均回收率为80.7%~115.3%,RSD为0.02%~1.01%;空白猪肉基质样品平均回收率为75.0%~116.3%,RSD为0.08%~3.32%,方法的准确度和精密度符合实验室测定需求[25]。
加标水平为50.0 μg/kg的鸡肉基质和猪肉基质,分别在时间间隔2、4、6、8、12和24 h测得9种兽药的RSD在2.6%以内和2.9%以内,表明9种兽药在鸡肉和猪肉中的稳定性满足试验测定要求。

表5 鸡肉基质加标回收率和RSD(n=6)Table 5 Recovery rate and RSD of chicken matrix

表6 猪肉基质加标回收率和RSD(n=6)Table 6 Recovery rate and RSD of pork matrix
2.3 基质效应按照Matuszewski等[26]提出的提取后添加法定量评价基质效应强度进行基质效应评价,即基质效应在85%~115%则认为基质效应不明显。在相同色谱和质谱参数条件下,鸡肉样品和猪肉样品分别采用QuEChERS方法和 GB/T 21312—2007方法测得的基质效应比较见图3。从图3可以看出,QuEChERS方法基质效应在85%~115%,优于国家食品安全检测方法 GB/T 21312—2007,可视为无基质效应。

图3 鸡肉基质(a)和猪肉基质(b)2种不同方法基质效应比较Fig.3 Comparison of substrate effects between chicken substrate(a)and pork substrate(b)by two different methods
EMR-Lipid 增强型脂质去除净化管能有效去除样品基质中脂肪等物质,提升供试溶液洁净度,降低基质效应,同时也增强了低浓度兽药的信噪比和峰面积响应值,确保试验结果的准确度和精密度[18]。
2.3.1信噪比比较。在相同色谱和质谱参数条件下,将鸡肉样品和猪肉样品空白基质配制浓度为1.0、10.0和100.0 ng/mL 9种兽药混合标准溶液,分别采用QuEChERS方法测得的信噪比(S/N)与GB/T 21312—2007方法测得的信噪比(S/N),其比值见图4。从图4可以看出,随着浓度升高,2种方法的信噪比(S/N)比值在减小,则QuEChERS方法在检测低浓度这9种兽药残留有明显优势。

图4 鸡肉基质(a)和猪肉基质(b)2种不同方法信噪比(S/N)比值Fig.4 Signal to noise ratio(S/N)ratio of chicken substrate(a)and pork substrate(b)by two different methods
2.3.2峰面积比较。在相同色谱和质谱参数条件下,QuEChERS方法测得的峰面积与GB/T 21312—2007方法测得的峰面积的比值见图5。从图5可以看出,采用QuEChERS方法的样品峰形更尖锐,响应值更高,与GB/T 21312—2007方法的峰面积比值较大,QuEChERS方法更有利于检测这9种兽药。
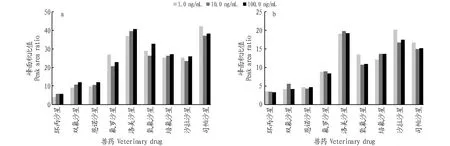
图5 鸡肉基质(a)和猪肉基质(b)2种不同方法峰面积比值Fig.5 Peak area ratio of chicken substrate(a)and pork substrate(b)by two different methods
2.4 MRM提取离子色谱图在优化的色谱和质谱条件下鸡肉基质和猪肉基质中9种喹诺酮类标准溶液(100 ng/mL)及对应空白基质的总离子图分别如图6~9所示。
2.5 实际样品测定按该研究所建立的QuEChERS技术和国家食品安全检测方法GB/T 21312—2007,抽检20份实验室产地各异的鸡肉和猪肉样品,进行喹诺酮类兽药残留检测,结果发现有2份鸡肉和1份猪肉结果呈阳性,通过比较,2种方法测定结果完全一致。表明QuEChERS方法为该项目的风险监测与安全评估提供了新的技术支持。
3 结论
国家食品安全检测方法GB/T 21312—2007采用EDTA-Mcllvaine缓冲液(pH =4.0)作为提取方式,由于溶液难以澄清而导致堵塞固相萃取柱,国标中EDTA-Mcllvaine缓冲液提取方式均存在不足,提取时导致基质效应影响较大[27]。该研究采用QuEChERS技术联合HPLC-MS/MS分析方法,能够快速测定鸡肉和猪肉中环丙沙星、双氟沙星、恩诺沙星、氟罗沙星、洛美沙星、氧氟沙星、培氟沙星、沙拉沙星和司帕沙星共9种喹诺酮类兽药残留,且方法科学合理,采用EMR-Lipid 增强型脂质去除净化管,有效解决了样品处理过程中堵塞固相萃取柱、回收率不高、存在峰形拖尾及复杂基质有干扰等问题,与GB/T 21312—2007分析过程比较,具有操作更加简单、检测更加快速、除脂效果好、基质效应小、回收率高和灵敏度更高等优点,完全满足测定喹诺酮类兽药残留在鸡肉、猪肉中的限量要求,为相关企事业单位的安全监测及质量控制提供技术支撑。

图6 鸡肉基质9种喹诺酮类兽药标准溶液总离子图Fig.6 Total ion diagram of 9 quinolone veterinary drug standard solutions in chicken substrate

图7 空白鸡肉基质总离子图Fig.7 Total ion diagram of blank chicken substrate

图8 猪肉基质9种喹诺酮类兽药标准溶液总离子图Fig.8 Total ion diagram of 9 quinolone veterinary drug standard solutions in pork substrate
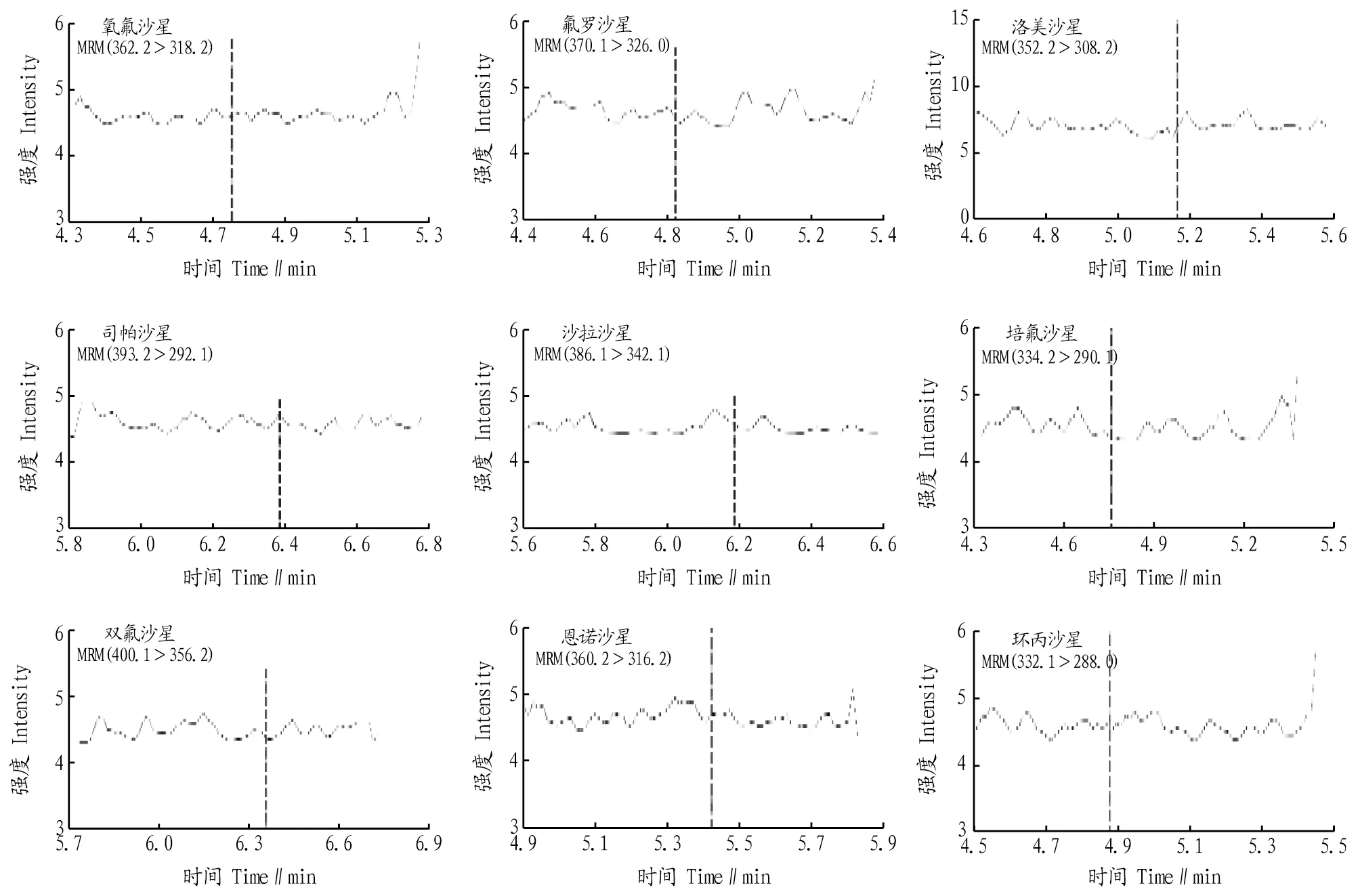
图9 空白猪肉基质总离子图Fig.9 Total ion diagram of blank pork substrate

