香港牡蛎钙调蛋白基因的克隆和组织表达分析
李素萍,喻达辉,李应清,王 培,郭 颖,白丽蓉
(北部湾大学海洋学院,广西北部湾海洋生物多样性养护重点实验室,广西钦州 535011)
双壳类动物的贝壳都是钙代谢产物,含有90%以上的CaCO3晶体和百分之几的生物大分子基质[1]。近10年,人们为阐明壳的形成机制作出了许多努力,已从双壳贝类中鉴定出10余种基质蛋白[2-5]。然而,以往对贝壳形成的分子机制研究集中于基质蛋白的纯化和表征上,而忽略了贝类钙代谢的机制。钙离子不仅是参与双壳类动物许多生理过程的调节剂,而且是参与壳结构形成的主要阳离子,在贝壳的形成过程中,需要大量的钙离子不断沉积在基质蛋白形成的骨架上[6]。Ca2+摄取、积累、转运、掺入的机制以及这些过程中涉及的特定调节剂仍然是一个有吸引力的领域,有待进一步研究。
钙调蛋白(Calmodulin,CaM)是一种主要的细胞内钙受体,存在于许多不同的细胞类型中,是动物中最保守的蛋白质之一。CaM以钙离子(Ca2+)依赖性方式结合并调节蛋白质丝氨酸/苏氨酸激酶。它参与一系列细胞过程,包括分泌、细胞分裂和分化、DNA复制和修复、肌肉收缩和糖原代谢、渗透细胞体积调节和细胞内通讯[7]。在高等脊椎动物中,CaM由多种基因编码,如人和小鼠的CaM I、II和III,鸡的CaM I和II[8-9]。在双壳类生物中,钙调蛋白可以调节Ca2+-ATPase膜系统来捕获环境中的Ca2+,细胞外CaM或CaM样蛋白(CaMLP)和CaM或CaMLP结合蛋白被认为在生物矿化中起重要作用[10-11]。CaM基因在外套膜裙带及外套膜外表皮上高表达,外套膜主要参与贝壳形成过程中Ca2+的分泌,因此,双壳类动物体内的CaM不仅是参与许多生理过程的调控,而且是贝壳结构形成的主要调控因素[12]。
香港牡蛎(Crassostreahongkongensis)分布于我国南部沿海,是两广地区最常见、最主要的牡蛎养殖种类之一,具有较高的营养价值和经济价值[13-15]。但香港牡蛎生长速度缓慢,养殖周期长,沿海地区台风频繁,牡蛎养殖深受其害,常常造成巨大经济损失,故在香港牡蛎的养殖产业中,一直存在着提高生长速度、缩短养殖周期的强烈需求[16]。香港牡蛎的生长与贝壳形成密切相关,为提高香港牡蛎生长速度、缩短养殖周期,加快贝壳的形成,探究贝壳形成的分子矿化机制是重中之重[17-19]。目前,CaM作为生物体内重要的调控蛋白,是贝壳形成的主要调控因素,因此以香港牡蛎为研究对象,对香港牡蛎贝壳形成的分子矿化机制进行研究。
笔者采用RACE技术克隆了香港牡蛎CaM基因cDNA全长序列,并分析其核酸和氨基酸序列,预测CaM二级结构和三级结构,并采用实时荧光定量PCR技术检测香港牡蛎CaM基因在不同组织中的表达情况,对香港牡蛎CaM基因的功能进行深入研究,旨在为研究香港牡蛎贝壳形成机制及CaM基因蛋白功能研究提供分子理论基础,为生产实践提供参考依据。
1 材料与方法
1.1 材料香港牡蛎采集于广西钦州市东风市场,取其新鲜的外套膜、鳃、闭壳肌、性腺、心脏、血淋巴、触唇和消化腺8个组织立即放入液氮速冻,置-80 ℃冰箱中保存备用。
1.2 总RNA提取与cDNA的合成取香港牡蛎的闭壳肌、外套膜、鳃、血液、性腺、心脏、触唇和消化腺8个组织用研磨仪研磨,参照TransZol Up Plus RNA Kit试剂盒(全式金)提取总RNA,使用1%琼脂糖凝胶电泳检验RNA的完整性并用Little Lunatic(USA)测定其浓度,用TransScript II One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒(全式金)合成模板cDNA,置-20 ℃保存备用。
1.3 RACE获得香港牡蛎CaM基因cDNA全长根据GenBank中已知的太平洋牡蛎(Crassostreagigas)CaM基因cDNA全长序列,设计特异性引物CaM-F和CaM-R,扩增出目的片段,反应程序为94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,运行35个循环;72 ℃终延伸10 min。PCR产物用DNA胶回收试剂盒(TIANGEN)纯化,参照pEASY®-T1 Cloning Kit(全式金)说明书进行连接转化,阳性克隆送生工生物工程(上海)有限公司测序,测序结果与长牡蛎CaM基因cDNA序列比对,相似性极高。
根据测序出的目的片段设计5′RACE和3′RACE扩增的基因特异性引物,参照5′RACE试剂盒(北京百奥博莱科技)说明进行上游未知片段扩增,利用引物5′RACE-A将模板RNA进行逆转录成cDNA,模板cDNA经加帽反应使用引物5′RACE-B进行第1轮反应,反应程序为:94 ℃变性5 min;50 ℃退火2 min,72 ℃延伸4 min,进行1个循环;94 ℃变性40 s,55 ℃退火1 min,72 ℃延伸3 min,进行29个循环;72 ℃终延伸15 min。以稀释20倍的第1轮PCR产物为模板,用引物5′RACE-C进行第2轮反应,反应程序为:94 ℃变性40 s;55 ℃退火1 min,72 ℃延伸3 min,进行30个循环;72 ℃终延伸15 min。
参照3′RACE试剂盒(北京百奥博莱科技)说明进行下游未知片段扩增,使用引物3′RACE-A进行第1轮反应,反应条件为:55 ℃ 2 min,72 ℃ 40 min,1个循环;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸3 min,30个循环;72 ℃ 15 min。以稀释20倍的第1轮PCR产物为模板,引物3′RACE-B进行第2轮反应,反应程序为:94 ℃ 40 s;55 ℃ 1 min,72 ℃ 3 min,30个循环;72 ℃终延伸15 min。将2轮反应之后的5′RACE和3′RACE PCR产物分别进行胶回收后进行连接转化,阳性克隆送生工生物工程(上海)有限公司测序。引物序列见表1。

表1 试验所用引物序列Table 1 Sequences of primers in this study
1.4 生物信息学分析利用NCBI数据库中的Blast(https://www.ncbi.nlm.nih.gov/)、ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)和ChromasPro.2.1.3等软件对测序结果进行验证分析并拼接出全长cDNA序列。使用ProtParam(http://web.expasy.org/protparam/)预测该蛋白的基本理化性质;使用Soft Berry-Psite(http://linux1.softberry.com/berry.phtml)预测蛋白功能位点;使用Signa1P 4.1 Server(http://www.cbs.dtu.dk/services/Sig-nalP)预测信号肽序列;使用TMpred(http://www.cbs.dtudk/services/TMHMM)预测跨膜结构域;使用SMART(http://smart.embl-heidelberg.de/)预测该蛋白质结构域;使用SOPMA(https://npsa-prabi.ibcp.fr/NPSA/npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/interactive)分别预测该蛋白质的二级和三级结构;使用PSORTⅡPrediction软件(https://psort.hgc.jp/form2.html)进行亚细胞定位分析;使用Clustalx1.81软件进行多重序列比对;使用MEGA 7.0软件的邻接法(neighbor-joining,NJ)构建系统发育进化树,进化距离的计算采用Kimura双参数模式。
1.5 荧光定量PCR分析以香港牡蛎8个组织的cDNA为模板,根据全长序列设计定量引物qRTCaM-F和qRTCaM-R,以GAPDH为内参基因,每个样品进行3次重复。参照TransStart® Tip Green qPCR SuperMix荧光定量试剂盒(全式金)进行qRT-PCR,反应程序为:94 ℃预变性30 s;94 ℃变性5 s,55 ℃退火15 s,进行30个循环;72 ℃延伸10 s。数据由Roche LightCycler 96软件生成并记录,按照2-ΔΔCt计算组织表达水平,采用SPSS 22软件进行单因素方差分析法(one-way ANOVA),Tukey检验,P<0.05表示显著性差异。
2 结果与分析
2.1 香港牡蛎CaM基因cDNA全长序列以香港牡蛎的cDNA为模板,使用RACE试剂盒获得香港牡蛎钙调蛋白ChCaM基因序列全长cDNA(Gen Bank登录号为:MZ192519),其全长为770 bp,开放阅读框(Open reading frame,ORF)为450 bp,5′非编码区(5′-UTR)54 bp及3′非编码区(3′-UTR)266 bp,香港牡蛎CaM基因编码149个氨基酸。通过SMART在线分析软件预测香港牡蛎CaM含有4个EF-hand结构域,分别位于12~40、48~76、85~113、121~149位氨基酸(图1)。针对香港牡蛎CaM蛋白质进行理化性质分析,发现氨基酸理论分子量为16.82 kD,带正电荷的氨基酸残基(Arg+Lys)有15个,带负电荷的氨基酸残基(Asp+Glu)有38个,理论等电点为4.14。该蛋白脂溶指数(Aliphatic index)为64.83,亲水性(GRAVY)总平均值为-0.656,半衰期约为30 h,不稳定指数为31.08,因此该蛋白是一类稳定的亲水性蛋白质。Soft Berry-Psite预测该蛋白功能位点,发现香港牡蛎CaM具有2个N-肉豆蔻酰化位点,7个酪蛋白激酶II磷酸化位点,2个蛋白激酶C磷酸化位点和1个N-糖基化位点(图2)。使用SignalP 4.1 Server程序未能预测到信号肽信号;使用TMpred软件未发现跨膜结构,不属于跨膜蛋白;利用PSORTⅡPrediction软件对香港牡蛎CaM蛋白进行亚细胞定位分析发现该蛋白在细胞质中分布最多,占52.2%,在分泌系统小泡中分布最少,为4.3%,细胞核和线粒体中分别为30.4%和13.0%。

注:方框表示起始密码子和终止密码子,绿色阴影部分为钙调蛋白结构域,黄色阴影部分为AATAAA加尾信号 Note:The boxes represent the start and stop codons,the green area represents the calmodulin domain,and the yellow area represents the AATAAA tail addition signal图1 香港牡蛎CaM基因的核酸序列和氨基酸序列Fig.1 Nucleotide and deduced amino acid sequence from ChCaM gene
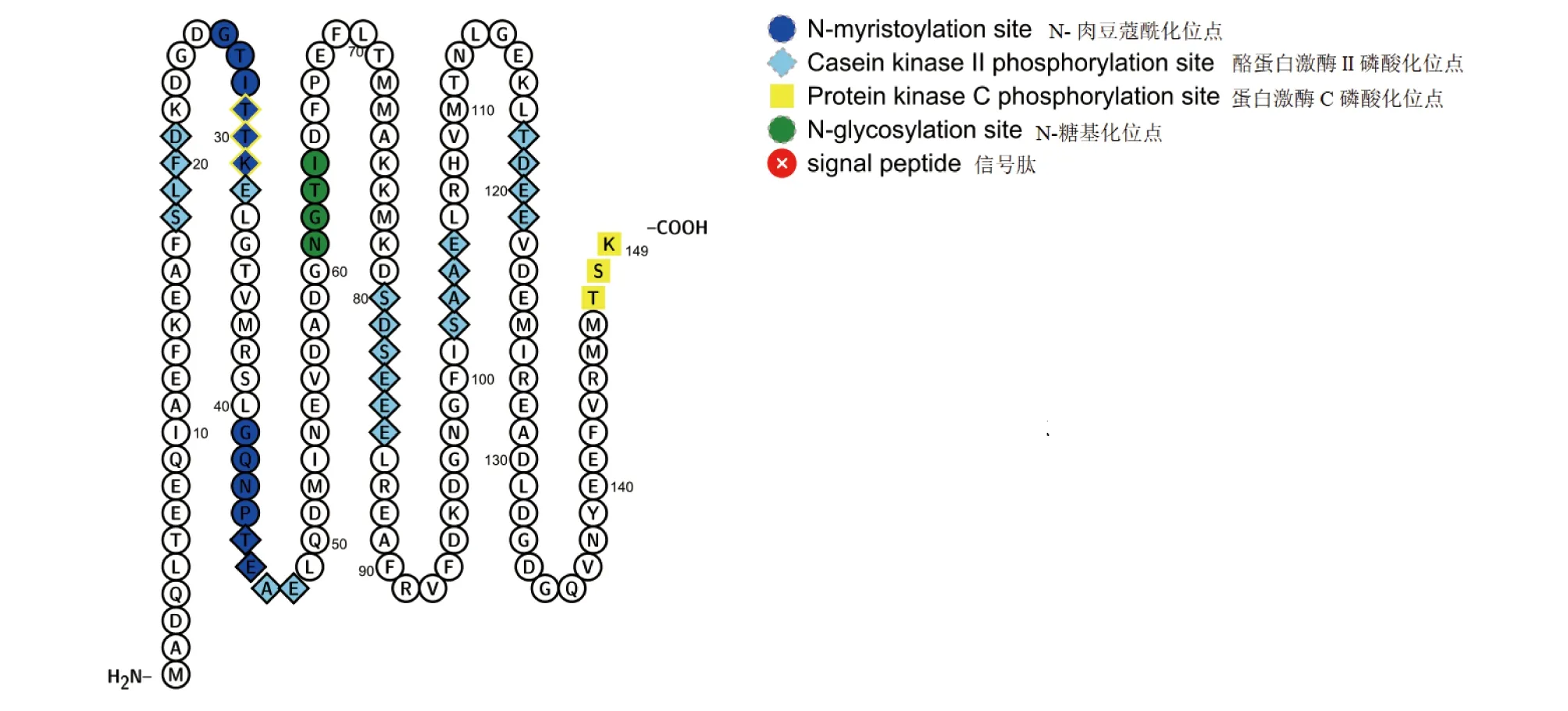
图2 香港牡蛎CaM的功能位点预测Fig.2 Prediction of functional site of ChCaM
2.2 香港牡蛎CaM结构预测使用SOPMA工具对香港牡蛎CaM蛋白的二级结构进行预测,结果显示,CaM预测蛋白包含59.73% α螺旋(alpha helix)、6.04%延伸链(extended strand)、9.40% β转角(beta turn)和24.83%不规则卷曲(random coil)(图3)。通过SWISS-MODEL对香港牡蛎和人的CaM基因编码的蛋白进行三级结构模拟,模拟发现二者蛋白三级结构相似性极高(图4)。
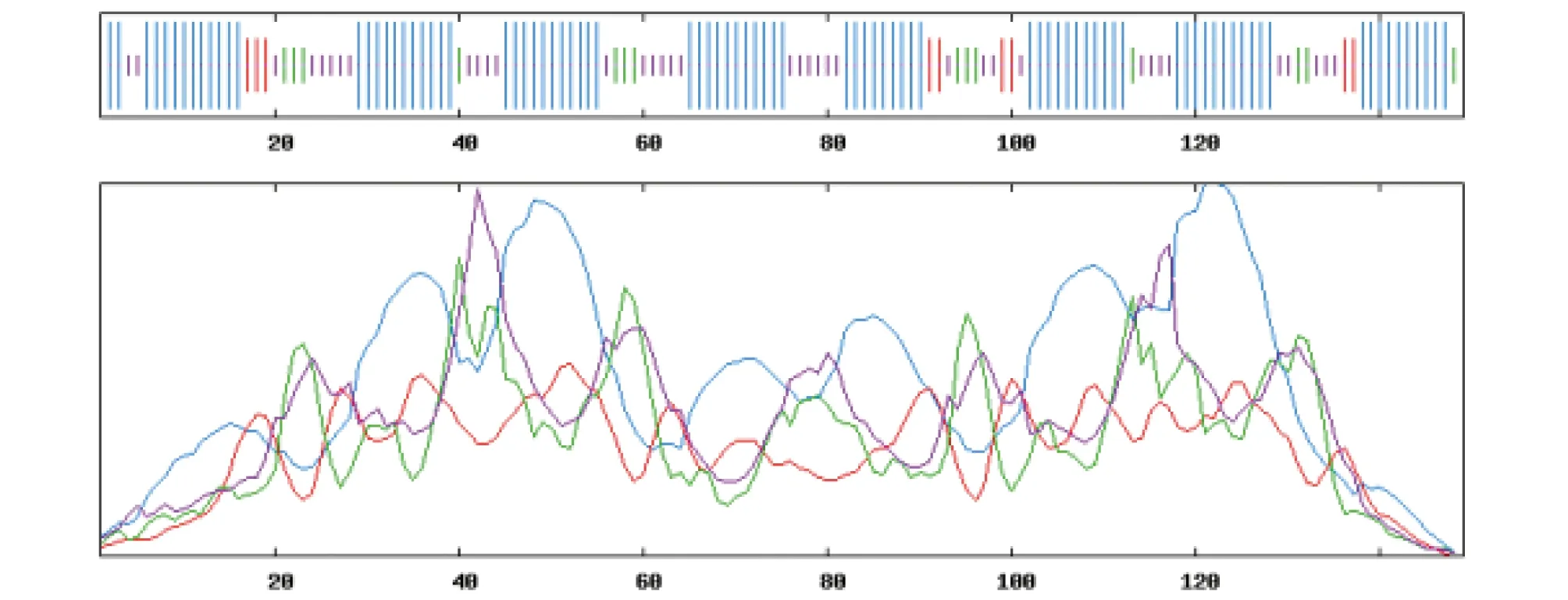
注:蓝色.α螺旋;红色.延伸链;绿色.β转角;粉红.不规则卷曲 Note:Blue.Alpha helix;Red.Extended strand;Green.Beta turn;Pink.Random coil图3 香港牡蛎CaM蛋白质二级结构预测Fig.3 Predicted two-dimensional structure of ChCaM
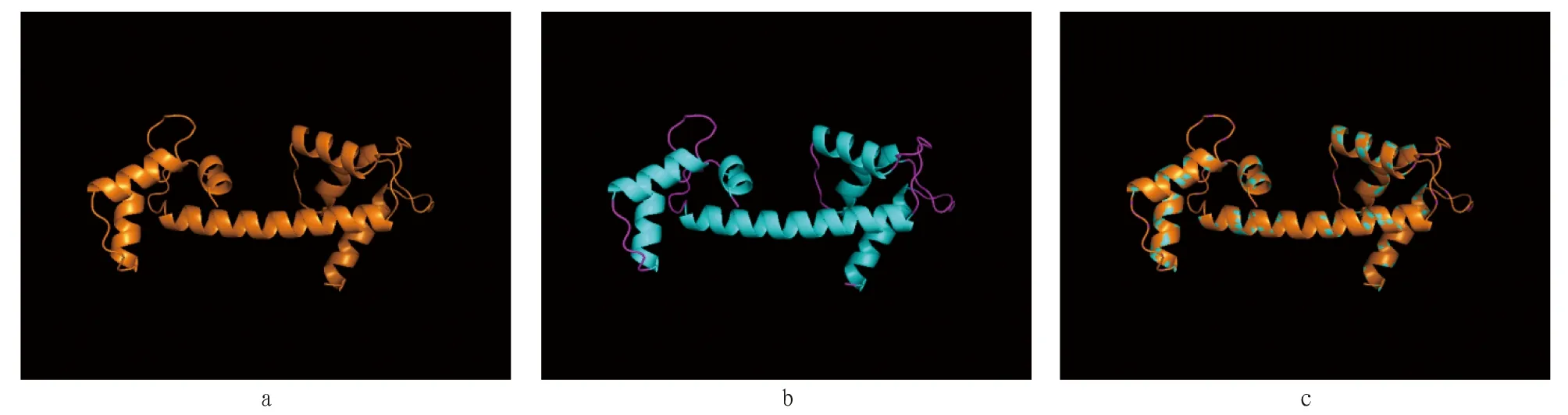
注:a.香港牡蛎;b.人;c.叠加 Note:a.Crassostrea hongkongensis;b.Homo sapiens;c.Overlay图4 CaM蛋白质三级结构预测Fig.4 Predicted three-dimensional structure of CaM
2.3 香港牡蛎CaM氨基酸序列同源性从NCBI下载11个其他物种CaM氨基酸序列(表2),经DNAstar软件对香港牡蛎与其他物种的CaM进行氨基酸序列同源性分析(图5),结果发现香港牡蛎和长牡蛎的CaM同源性最高,相似度高达100%,美洲牡蛎次之,达到98.7%,其他物种的相似度为93%~97%。运用DNAMAN软件将香港牡蛎CaM的氨基酸序列与其他已公布的8种生物进行多重序列比对分析(图6),结果显示,香港牡蛎CaM氨基酸序列与长牡蛎和美洲牡蛎有较高的相似性,而与鱼类、甲壳类和哺乳动物序列相似性相对较低;CaM氨基酸排序呈现很高的相似性和高度保守性。结果表明,CaM的氨基酸序列具有典型的钙调蛋白特征(EF-hand结构域),发现以上9个物种均有4个EF-hand结构域(I、II、III和IV),且它们表现出彼此的序列同源性。每个结构域由12个氨基酸残基组成,其中6个作为金属-蛋白质复合物中Ca2+的配体[如天冬氨酸(D)和谷氨酸(E)]。CaM基因所编码的氨基酸序列高度保守,尤其表现在EF-hand结构域Ca2+结合位点上,暗示CaM基因在机体中有极其重要的功能和作用。
2.4ChCaM基因系统进化树为比较不同物种CaM基因序列的亲缘关系,从NCBI数据库中查找其他物种CaM基因cDNA序列,用MEGA 7.0软件构建ChCaM与其他物种的系统进化树(图7),结果显示,香港牡蛎CaM与长牡蛎的遗传距离最近,并与美洲牡蛎、虾夷扇贝和池蝶蚌等双壳类动物聚为一大支,具有较高的同源性,而与文昌鱼和虹鳟等鱼类、人和小鼠等哺乳动物以及中华绒螯蟹和克氏原螯虾等甲壳类动物分支较长,距离较远,同源性较低。
2.5 香港牡蛎CaM基因的组织特性表达使用SPSS 22.0软件进行单因素分析,通过实时定量PCR的方法检测香港牡蛎CaM mRNA在各个组织中的表达量,结果表明,CaM基因在香港牡蛎各个组织中均有表达,其中鳃组织的表达量最高,其次为外套膜、消化腺、触唇、血淋巴、性腺、闭壳肌,在心脏的表达量最低(图8)。

图5 香港牡蛎CaM氨基酸与其他11个物种的同源百分比Fig.5 Percent identity of CaM amino acids of Crassostrea hongkongensis and other 11 species
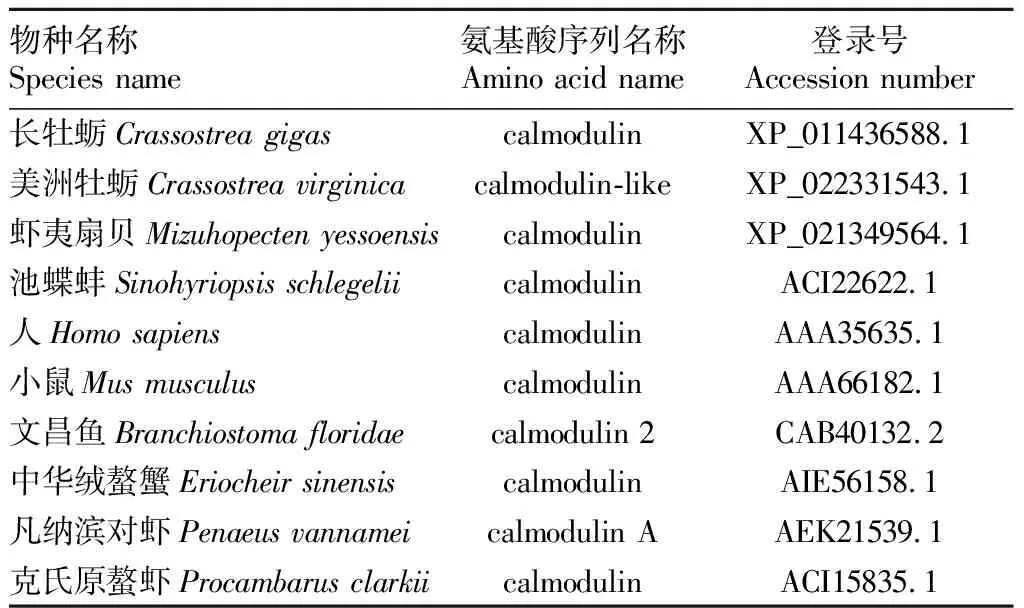
表2 同源百分比与序列比对所用物种Table 2 Species used in alignment and percent identity
3 讨论
3.1 香港牡蛎CaM基因cDNA序列特征和系统进化钙调蛋白是贝类中重要的调控蛋白,是钙离子结合蛋白家族成员,能够结合微量钙离子,对真核细胞内的酶起到激活作用,调节细胞的生命活动,进而调控Ca2+的吸收、转运和分泌[20-21]。该研究利用RACE技术克隆获得香港牡蛎CaM基因的cDNA序列,全长为770 bp,编码149个氨基酸。生物信息学分析香港牡蛎CaM蛋白具有4个典型的EF-hand结构域,能够与钙离子结合,属于典型的钙离子结合蛋白家族成员,这与已有研究报道的合浦珠母贝体内的钙调蛋白的结构域相似[10]。钙调蛋白是一种由148个氨基酸残基组成的蛋白质,可形成2个球状区域,由1个灵活的中心连接器连接[22]。

注:颜色表示氨基酸序列相似度(黑色.100%;粉色.70%;绿色.50%及以上;白色.50%以下),上方绿色箭头表示4个EF-hand结构域,红色方框为EF-hand钙结合域 Note:The color indicates the similarity of amino acid sequence(black.100%;Pink.70%;Green.≥50% and <70%;White.<50%).Green arrow indicates 4 EF-hand domains above,the red box is EF-hand calcium-binding domain图6 香港牡蛎CaM氨基酸序列与其他物种CaM的序列比对Fig.6 Alignment CaM amino acid of Crassostrea hongkongensis and other species

注:括号中为GenBank登录号 Note:The GenBank entry number is given in parentheses图7 CaM核酸序列构建的系统进化树Fig.7 Phylogenetic tree of CaM from various species
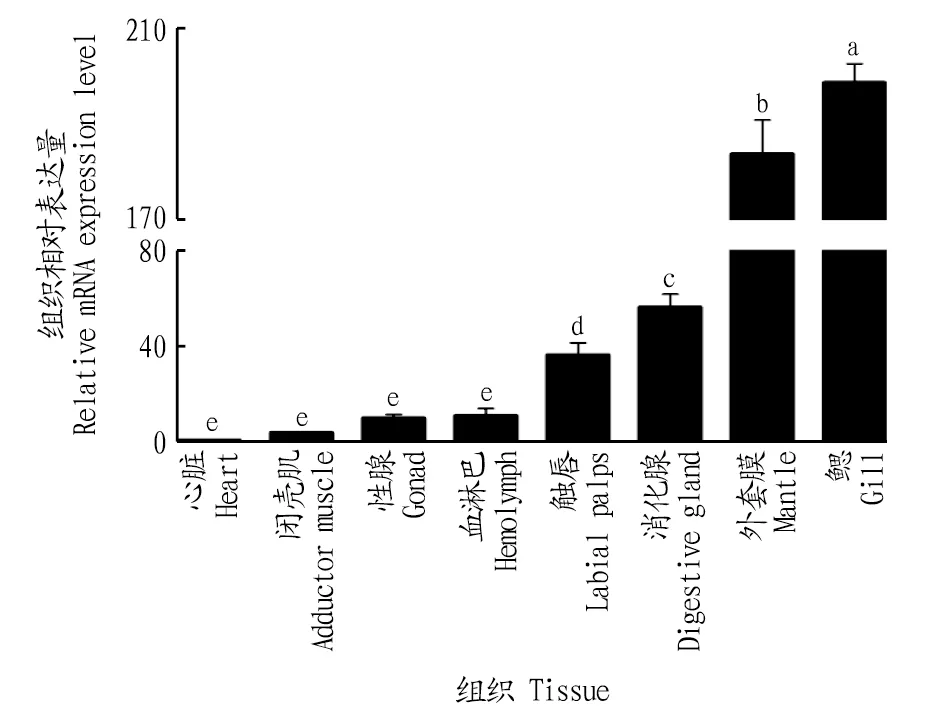
注:不同小写字母表示差异显著(P<0.05) Note:Different lowercase letters indicate significantly different (P<0.05)图8 CaM基因在香港牡蛎不同组织的表达情况Fig.8 Expression pattern of CaM gene in different tissues of Crassostrea hongkongensis
每个区域结合EF-hand基序中的2个钙离子,这是钙结合蛋白中普遍存在的一个基序,因此钙调蛋白可以结合4个钙离子,与哺乳动物人和软体动物香港牡蛎的三级结构预测结果一致。钙结合位点为12个氨基酸,包含许多负电荷或极性氨基酸残基,如天冬氨酸、谷氨酸和天冬酰胺,这些氨基酸的侧链与Ca2+形成离子键。CaM含有丰富氧原子侧链的氨基酸残基,即使在Ca2+浓度很低的环境中也能吸引钙离子促进Ca2+与氨基酸结合。氨基酸的功能位点预测发现,其4个EF-hand结构域上有1个N-糖基化位点,2个蛋白激酶C磷酸化位点,3个酪氨酸激酶磷酸化位点等,表明其在细胞与细胞间结合和信号传导过程中起着重要作用。
钙调蛋白是一种必需的蛋白质,也是一种稳定的蛋白质,任何一种钙调蛋白编码基因的突变或者钙调蛋白结合位点的损伤通常都是致命的[7]。来自不同脊椎动物物种的CaM基因编码具有相同氨基酸序列的相同CaM分子,表明其在脊椎动物进化过程中高度保守[23]。此外,2个不同的无脊椎动物海葵(Metridiumsenile)和池蝶蚌(Hyriopsisschlegeli)也编码相同的CaM蛋白,表明CaM蛋白在无脊椎动物进化过程中也高度保守[23-24]。通过多序列比对,发现香港牡蛎CaM基因与长牡蛎CaM基因的同源性最高,核酸序列同源性为97.11%,氨基酸序列同源性高达100%,说明CaM蛋白在双壳类动物进化过程中高度保守,进一步反映了这种蛋白质在细胞正常功能中的重要性。比较香港牡蛎CaM基因核酸序列EF-hand结构域之间的同源性,发现EFh1和EFh3与EFh2和EFh4核酸序列具有高度同源性,均为57.5%,表明参与钙离子结合的部分分子比其他部位更保守[10]。构建系统发育树发现,香港牡蛎CaM基因和长牡蛎CaM基因位于同一分支,说明香港牡蛎和长牡蛎的亲缘关系较近,与其他物种的亲缘关系较远,这与他们的生物学分类相符。由此推测,CaM保守结构域在进化过程中具有较高的保守性,并且不同物种有不同的差异性。
3.2 香港牡蛎CaM基因的组织表达分析贝壳形成是一个复杂、精密调控的生物矿化过程,自然条件下构成贝壳的碳酸钙晶体并不是在单一组织作用下形成的,而是多个组织共同作用的结果[25-26]。荧光定量检测发现,CaM基因在香港牡蛎鳃组织中表达量最高,是心脏组织表达量的(198.57±4.00)倍,与合浦珠母贝和池蝶蚌CaM基因组织表达趋势相同[24]。在双壳类动物中,鳃是从水中吸收钙的主要器官,在膜Ca2+-ATP酶系统中发挥调节作用[27-28]。香港牡蛎CaM在鳃组织中高表达,说明CaM在香港牡蛎鳃吸收和积累钙的过程中具有重要的调控作用。在软体动物中,外套膜与贝壳直接接触的区域能够分泌角质层和钙化层[29],是壳的形成过程中的关键调控因子。笔者发现CaM基因在香港牡蛎外套膜组织中表达量是心脏组织的表达量的(183.64±7.18)倍,这与其他动物的报道相似。这暗示了香港牡蛎CaM基因通过鳃和外套膜组织共同参与调控Ca2+的吸收、转运和分泌等钙代谢途径。由此推测香港牡蛎贝壳的形成是由鳃从外界环境中吸收Ca2+并转运到外套膜中,并通过钙泵将离子从外套膜运输到外套腔分泌中形成贝壳。因此,在贝类贝壳形成的生物矿化过程中,钙调蛋白被认为有极其重要的作用。
4 结论
该研究克隆了香港牡蛎CaM基因cDNA序列,全长为770 bp,编码149个氨基酸,具有4个EF-hand结构域。通过多序列比对及构建系统发育树发现,香港牡蛎CaM基因与长牡蛎CaM基因的同源性最高(97.11%),并且位于同一分支。荧光定量检测发现,CaM基因在香港牡蛎各组织中都有表达,其中鳃组织的表达量最高,其次为外套膜、消化腺、触唇、血淋巴、性腺、闭壳肌,心脏的表达量最低。该研究结果将有望为香港牡蛎贝壳形成的生物矿化机制及CaM基因功能研究提供基础资料。

