灰葡萄孢Bromodomain转录因子家族成员鉴定及表达分析
邓思琪,李 白,马宇馨,曹宏哲,邢继红,张 康
(河北农业大学,华北作物改良与调控国家重点实验室/河北省植物生理与分子病理学重点实验室,河北 保定 071000)
灰葡萄孢(Botrytis cinerea)是一种世界性分布的重要植物病原真菌[1],其寄主范围广泛、传播十分迅速,以菌丝、分生孢子及菌核的形式侵染,常给农业生产造成严重经济损失[2-3]。灰葡萄孢的菌丝可以在3 ~30 ℃的温度范围内生长,其最适生长温度为20 ~25 ℃,且在具有相对较高湿度的环境下会引起大范围的灰霉病发生[4-5]。到目前为止,灰霉病的防治主要为化学防治,通过在作物叶表面喷洒化学药剂来防控灰霉病。此方法虽然高效,但灰葡萄孢变异频繁,会产生高抗药性,导致防治效果逐渐减弱,从而杀菌剂用量不断增加,严重威胁了农产品的安全[6]。随着基因组测序工作的完成,灰葡萄孢已经成为发育生物学、微生物学、植物病理学研究的模式生物之一,也是研究病原微生物与寄主植物互作的一种重要的模式生物。因此,充分挖掘与灰葡萄孢生长发育和致病相关基因,探究调控病菌生长发育和致病力的分子机制,不仅可以为灰霉病的生物防治提供理论依据,还可以为其他真菌的相关研究提供重要参考价值。
组蛋白乙酰化是表观遗传研究的重要组成部分,是翻译后修饰的重要方式之一。Bromodomain (BRD)是一类能够特异性识别组蛋白中乙酰化赖氨酸的保守蛋白结构域,可特异性识别组蛋白末端乙酰化的赖氨酸位点,通过与乙酰化赖氨酸结合促使染色质重塑因子和转录因子等相关蛋白富集于特定的基因转录位点,改变RNA 聚合酶Ⅱ的活性,从而调节基因的转录表达[7]。Bromodomain 亦可通过对转录因子等非组蛋白的乙酰化修饰广泛参与细胞周期调控、细胞分化、信号转导等过程[8]。据研究报道,所有与组蛋白乙酰化酶有关的转录辅激活因子都包括Bromodomains,而BRDs 也是目前已知的唯一能对赖氨酸乙酰化物特异性识别的蛋白。BRD 存在于多种表观遗传调控蛋白中,包括转录激活因子、组蛋白乙酰化转移酶以及染色质等。BRD 蛋白不仅单独存在,而且常与其他组蛋白密码解读蛋白结构域相连[9-10],例如 PHD 这些结构域通过协同方式调节基因转录、细胞周期以及细胞凋亡。虽然其大部分功能未知但值得注意的是一种溴结构域蛋白BS69,在基因转录抑制复合物中起着重要的作用,这表明组蛋白乙酰化可能含有多重的、不同的功能[11]。
Bromodomain 转录因子最开始在果蝇的基因中发现,随后在人体组织和酵母中发现。目前的研究表明,Bromodomain 转录因子在人体中广泛表达,主要参与染色质重塑,具有调控相关基因表达、促进细胞分化等功能,这些功能参与了成人造血干细胞的功能维持,Bromodomain 转录因子表达异常会导致严重的造血缺陷,会引起骨髓衰竭和贫血等疾病[12-15]。拟南芥中含有拟南芥溴多糖的蛋白质BRD1、BRD2 和BRD13 可能是真正的SWI/SNF 亚基,与核心SWI/SNF 成分SWI3C 和SWP73B 相互作用,对拟南芥的基因组靶向至关重要[16-17]。在酵母中发现的一种温度敏感的突变体Bromodomain factor 1,在体外可结合组蛋白H3 和H4,因此被认为在染色质重塑中起重要作用[18]。而在禾谷镰刀菌中首次发现保守结构域Bromodomain 对研究FgGCN5的调控机制是必不可少的[19-20]。
目前,有关灰葡萄孢Bromodomain 转录因子家族的系统研究尚未见报道。因此,利用生物信息学的方法对灰葡萄孢中Bromodomain 转录因子家族进行分析,挖掘Bromodomain 转录因子家族成员的功能,并利用qPCR 技术分析该家族基因在NaCl 和刚果红胁迫处理下的表达变化,探究Bromodomain 转录因子家族在灰葡萄孢生长发育以及致病力的分子机制,从而为灰葡萄孢防治和Bromodomain 家族基因功能和调控机制研究提供参考。
1 材料与方法
1.1 试验材料
本研究用到的灰葡萄孢(B.cinerea)B05.10 菌株由河北农业大学真菌毒素与植物分子病理学实验室提供并保存。
1.2 灰葡萄孢Bromodomain 转录因子家族基因的筛选与鉴定
在Ensembl Fungi(http://fungi.ensembl.org/)和 在Pfam(http://pfam. xfam. org) 中 获 取 灰葡萄孢基因组相关数据以及隐马尔可夫模型(HMM model),再利用Hmmsearch 软件找出其Bromodomain 转录因子家族蛋白序列。
1.3 灰葡萄孢Bromodomain 转录因子家族基因的理化性质分析
利用ProtParam(https://web. expasy. org/protparam/)在线网页分析灰葡萄孢Bromodomain 转录因子家族基因的理化性质,包括分子量、氨基酸组成、等电点等。
1.4 灰葡萄孢Bromodomain 转录因子家族基因染色体定位分析
利用在线工具Gene Structure Dispaly Server (GSDS),将在Ensembl Fungi(http://fungi.ensembl.org/)查询的灰葡萄孢染色体长度和灰葡萄孢Bromodomain 转录因子家族基因位置信息,使用TBtools 软件绘制成Bromodomain 转录因子家族基因染色体定位图。
1.5 灰葡萄孢Bromodomain 转录因子家族基因的系统进化分析
利用Ensembl 数据库(http://fungi.ensembl.org/)和真菌转录因子数据库(http://ftfd.snu.ac.kr/index.php?a=view)搜集灰葡萄孢(Botrytis cinerea)、禾谷镰孢(Fusarium graminearum)、酿酒酵母(Saccharomyces cerevisiae)、稻瘟病菌(Magnaporthe oryzae)以及黄曲霉(Aspergillus flavus)中含有Bromodomain 结构域的蛋白序列,并利用MEGA7.0对40 条Bromodomain 转录因子蛋白序列(其中包含灰葡萄孢蛋白序列8 条、禾谷镰孢蛋白序列7 条、酿酒酵母蛋白序列10 条、稻瘟病菌蛋白序列9 条、黄曲霉蛋白序列6 条)进行多序列比对,然后用邻接法构建系统发育树,bootstrap 值设置为1 000。
1.6 灰葡萄孢Bromodomain 转录因子家族的基因结构分析
在灰葡萄孢B05.10 基因组数据库中找到灰葡萄孢Bromodomain 家族基因DNA 序列,利用IBS 软件绘制灰葡萄孢Bromodomain 转录因子家族的基因结构图。
1.7 灰葡萄孢Bromodomain 转录因子家族保守结构域分析
利用SMART(http://smart.embl-heidelberg.de/)和Pfam(http://pfam. xfam. org)网站对灰葡萄孢8 个Bromodomain 转录因子家族蛋白进行保守结构域分析,然后利用IBS1.0.3 软件绘制8 个Bromodomain转录因子家族蛋白保守结构域。
1.8 灰葡萄孢Bromodomain 家族基因在分生孢子中的表达分析
利用GEO(http://www. ncbi. nlm. nih. gov/geo/)数据库获得灰葡萄孢分生孢子发育时期的表达谱数据,然后对Bromodomain 家族基因在不同发育时间的表达数据与对照(0 h)做比值,再取以2 为底的对数值,使用TBtools 软件分析灰葡萄孢Bromodomain 家族基因分生孢子萌发期间的全基因组基因表达水平。
1.9 灰葡萄孢Bromodomain 家族基因在侵染过程中的表达分析
利 用GEO(http://www. ncbi. nlm. nih. gov/geo/)数据库获得灰葡萄孢侵染葡萄过程中的表达谱数据,然后对Bromodomain 家族基因在侵染不同时间的数据与对照(0 h)做比值,再取以2 为底的对数值,使用TBtools 软件分析灰葡萄孢Bromodomain 家族基因在灰葡萄孢侵染葡萄过程中的表达变化。
1.10 灰葡萄孢Bromodomain 家族基因在胁迫处理下的表达分析
以0.8 mol/LNaCl 和2 mg/mL 刚果红分别处理灰葡萄孢野生型B05.10 菌株,以未作处理的灰葡萄孢野生型B05.10 菌株为对照,处理7 d 取样,提取RNA,利用反转录试剂盒合成cDNA。以灰葡萄孢β-tubulin基因为内参,用灰葡萄孢Bromodomain 家族基因的特异性引物进行qPCR 检测(表1)。利用Primer Premier 5 设计引物,由北京博迈德基因技术有限公司合成。每个样品重复3 次。PCR 反应体系:PCR Mix 7 μL、cDNA 2 μL、基因特异性上下游引物各0.5 μL,总体积10 μL;PCR 程序:94 ℃预变性1 min,94 ℃变性30 s,55 ℃退火15 s, 72 ℃延伸30 s,30 个循环。利用GraphPad Prism 软件对数据进行单因素方差分析,0.01 <P<0.05 为差异显著,P<0.01 为差异极显著。

表1 用于qPCR 的引物Table 1 Primers used for qPCR
2 结果与分析
2.1 灰葡萄孢Bromodomain 转录因子家族基因的筛选与鉴定
在Ensembl Fungi 和 在Pfam 中 获 取 灰葡萄孢基因组相关数据以及隐马尔可夫模型(HMM model), 再 利 用hmmsearch 找 出 其Bromodomain 转录因子家族的蛋白序列。最终鉴定出8 个灰葡萄孢Bromodomain 转录因子家族 成 员:BCIN_05g00170、BCIN_02g08510、BCIN_14g05240、BCIN_02g06970、BCIN_04g04900、BCIN_13g01660、BCIN_05g01870、BCIN_10g03430(见表2)。
2.2 灰葡萄孢Bromodomain 转录因子家族基因的理化性质分析
通过用保守结构域Bromodomain 对灰葡萄孢进行全基因组检索,获得了8 个灰葡萄孢Bromodomain 家族基因(表2)。分析发现,灰葡萄孢Bromodomain 家族基因编码区CDS 长度在1 119 ~4 302 bp 之间变化;编码蛋白的氨基酸数目为327 ~1 433 aa;相对分子质量在42 755.37 ~163 110.01 D 之间变化;等电点在5.06 ~8.91 之间,其中pI <7.0 的Bromodomain 家族基因有3 个,占37.5%,呈弱酸性;62.5%的Bromodomain 家族基因pI >7.0,这表明该家族基因编码的蛋白富含碱性氨基酸。

表2 灰葡萄孢Bromodomain 转录因子家族基因的理化性质Table 2 The physicochemical properties of Bromodomain transcription factor family genes in B. cinerea
2.3 灰葡萄孢Bromodomain 转录因子家族基因染色体定位分析
利用在线工具GSDS,将在Ensembl Fungi 查询的灰葡萄孢染色体长度和灰葡萄孢Bromodomain 转录因子家族基因位置信息,绘制成Bromodomain 转录因子家族基因染色体定位图(图1)。结果发现,灰葡萄孢Bromodomain 家族的8 个基因分别处于灰葡萄孢的6 条染色体中。其中,BCIN_02g06970和BCIN_02g08510位于2 号染色体,BCIN_04g04900位于4 号染色体,BCIN_05g00170和BCIN_05g01870位于5 号染色体,BCIN_10g03430位于10 号染色体,BCIN_13g01660位于13 号染色体,BCIN_14g05240位于14 号染色体。
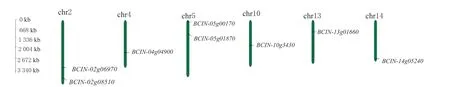
图1 灰葡萄孢Bromodomain 转录因子家族基因染色体定位Fig.1 Chromosomal localization of Bromodomain transcription factor family genes in B. cinerea
2.4 灰葡萄孢Bromodomain 转录因子家族基因的系统进化分析
利用Ensembl 数据库和真菌转录因子数据库搜集灰葡萄孢(B.cinerea)、禾谷镰孢(F.graminearum)、酿酒酵母(S.cerevisiae)、稻瘟病菌(M.oryzae)以及黄曲霉(A.flavus)中Bromodomain 转录因子家族蛋白序列,分别包含8、7、10、9、和6 条。用MEGA7.0 软件对Bromodomain 转录因子家族蛋白进行系统发育分析(图2)。

图2 灰葡萄孢Bromodomain 家族蛋白系统发育树Fig. 2 Phylogenetic tree of Bromodomain family protein in B. cinerea
结果发现40 个Bromodomain 转录因子家族蛋白 可 以 分 为4 个 亚 家 族:BROMO、BROMOBAH、DEXDc-HELICc-SnAC-BROMO、BROMOAT_hook。在8 个灰葡萄孢Bromodomain 转录因子家 族 蛋 白 中BCIN_13g01660、BCIN_05g01870、BCIN_14g05240、BCIN_04g04900、BCIN_02g08510属于BROMO 亚家族,BCIN_02g06970 属于BROMOBAH 亚 家 族,BCIN_10g03430 属 于DEXDc-HELICc-SnAC-BROMO 亚家族,BCIN_05g00170 属于BROMOAT_hook 亚家族。
2.5 灰葡萄孢Bromodomain 转录因子家族的基因结构分析
利用IBS 软件绘制灰葡萄孢Bromodomain 转录因子家族的基因结构,发现该基因家族的基因结构存在明显差异。其中BROMO 亚家族基因结构较 为 复 杂,BCIN_13g01660和BCIN_05g01870包含1 个 内 含 子,2 个 外 显 子;BCIN_14g05240和BCIN_02g08510包 含2 个 内 含 子,3 个 外 显 子;而BCIN_04g04900没有内含子,只有1 个外显子。BROMO-BAH 亚 家 族 的BCIN_02g06970包含3 个 内 含 子,4 个 外 显 子;DEXDc-HELICc-SnAC-BROMO 亚家族的BCIN_10g03430包含2 个内含子,3 个外显子;BROMO-AT_hook亚家族的BCIN_05g00170包含5 个内含子,6 个外显子(图3)。

图3 灰葡萄孢Bromodomain 转录因子家族基因的基因结构分析Fig. 3 Analysis of gene structure of Bromodomain transcription factor family genes in B. cinerea
2.6 灰葡萄孢Bromodomain 转录因子家族的结构域分析
利 用SMART 和Pfam 网 站 对 灰 葡 萄 孢8 个Bromodomain 转录因子家族蛋白进行保守结构域分析,并用IBS 软件绘图。结果如图4 所示,8个Bromodomain 转录因子家族成员可分为4 类,BCIN_13g01660、BCIN_05g01870、BCIN_14g05240、BCIN_04g04900、BCIN_02g08510 属 于BROMO 亚家 族, 其 中BCIN_13g01660、BCIN_05g01870、BCIN_04g04900、BCIN_02g08510 仅 有1 个BROMO结构域,BCIN_14g05240 含有2 个BROMO 结构域;BCIN_02g06970属于BROMO-BAH 亚家族,含有2 个BROMO 和1 个BAH 结 构 域;BCIN_10g03430属于DEXDc-HELICc-SnAC-BROMO 亚家族,含有4 个 结 构 域DEXDc、HELICc、SnAC 和BROMO;BCIN_05g00170 属于BROMO-AT_hook 亚家族,包含2 个结构域BROMO 和AT_hook。

图4 灰葡萄孢Bromodomain 保守结构域分析Fig. 4 Analysis of conserved domains Bromodomain in B. cinerea
2.7 灰葡萄孢Bromodomain 家族基因在分生孢子中的表达分析
利用GEO 数据库获得灰葡萄孢分生孢子发育时期的表达谱数据,对灰葡萄孢Bromodomain 家族基因在分生孢子发育时期的表达水平进行分析。结果发现,该家族基因在灰葡萄孢分生孢子发育过程中的表达水平存在明显差异,BCIN_10g03430在0 ~2.5 h 呈 下 降 趋 势、 在2.5 ~4 h表达水平短暂升高、 在4 ~15 h 再次下调;BCIN_05g00170、BCIN_14g05240、BCIN_05g01870和BCIN_02g08510在0 ~15 h 持续下调,下调程度略有不同;BCIN_02g06970在0 ~15 h 持续上调,上调程度略有不同;BCIN_13g01660在0 ~4 h 呈下降趋势、在4 ~15 h 上调表达;BCIN_04g04900在1 ~2.5 h 出现短暂的下调趋势,其他时间几乎无变化(图5)。上述结果表明,灰葡萄孢Bromodomain 家族基因在发育过程中呈现不同的表达规律,推测其参与灰葡萄孢不同时期的生长发育过程。

图5 灰葡萄孢Bromodomain 家族基因在分生孢子发育过程中的表达Fig. 5 Expression of Bromodomain family genes during conidial development of B. cinerea
2.8 灰葡萄孢Bromodomain 家族基因在侵染过程中的表达分析
利用GEO 数据库获得灰葡萄孢侵染葡萄过程中的表达谱数据,对灰葡萄孢Bromodomain 家族基因在侵染葡萄不同时期的表达水平进行分析。结果发现(图6),BCIN_04g04900、BCIN_02g08510、BCIN_02g06970和BCIN_14g05240在病菌侵染过程中持续上调表达;BCIN_13g01660、BCIN_10g03430和BCIN_05g00170在病菌侵染0 ~48 h 过程中持续下调表达,下调程度有所不同;BCIN_05g01870在侵染0 ~16 h 出现短暂上调、在16 ~48 h 呈下调趋势。

图6 Bromodomain 家族基因在灰葡萄孢侵染不同时期的表达Fig. 6 Expression of Bromodomain family genes at different infection stages of B. cinerea
2.9 灰葡萄孢Bromodomain 家族基因在胁迫处理下的表达分析
利用qPCR 技术对灰葡萄孢Bromodomain 家族基因在NaCl 和刚果红处理后的表达水平进行分析。结果发现,灰葡萄孢Bromodomain 家族基因在NaCl 和刚果红胁迫处理下的表达水平均呈现下调趋势,但下调程度有所不同(图7)。以0.8 mol/L NaCl 处理7 d 后,BCIN_04g04900、BCIN_13g01660、BCIN_05g01870以及BCIN_10g03430基因下调最为显著,并且BCIN_10g03430几乎不表达。以2 mg/mL 刚果红处理7 d 后,BCIN_04g04900、BCIN_05g01870和BCIN_10g03430基因下调最为显著。
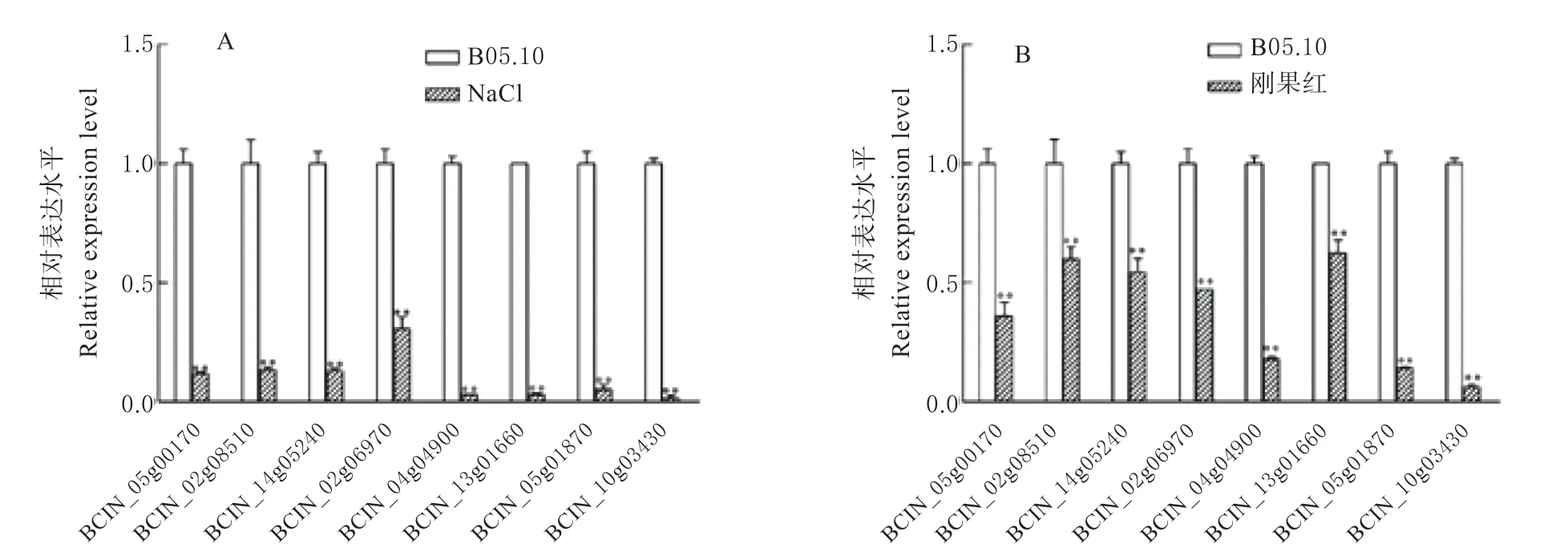
图7 胁迫处理对灰葡萄孢Bromodomain 家族基因表达的影响Fig.7 The effect of stress treatment on the gene expression of B. cinerea Bromodomain family
3 结论与讨论
在真核细胞中,组蛋白乙酰化主要由组蛋白乙酰化酶和组蛋白去乙酰化酶共同调节。研究表明,大多数组蛋白乙酰化酶相关的转录激活因子均存在Bromodomain,它可以与乙酰化赖氨酸特异结合[21]。Bromodomain 转录因子家族在动物、植物、病菌中普遍存在,家族成员较多,功能较为复杂,对于病菌的生长发育及其致病力具有重要影响[22]。目前的研究表明,人体内的Brd2 具有激酶活性,在某些白血病中激酶活性上升,它可以通过C 端序列与E2F1 或E2F2 相互作用,影响E2F 调控的细胞周期基因的转录[23];而BRD4 属于BET 家族的成员,通过结合乙酰化组蛋白并调节基因表达从而参与一系列重要的生物学过程,如细胞生长、凋亡、炎症、免疫抑制等[24]。大鼠中含溴多胺的蛋白4 表达增强,最终导致伤害性神经元兴奋性增强和热痛觉过敏[25]。在拟南芥中,组蛋白GTE9 和GTE11 与BT2相互作用,介导拟南芥中的ABA 和糖反应[26]。
Bromodomain 转录因子只有在模式物种酵母中有部分研究,但在其他真菌中研究较少。本研究发现灰葡萄孢包含了8 个Bromodomain 转录因子家族基因,系统进化分析将其分为4 个亚家族,不同成员在病菌分生孢子发育的不同时期、侵染时期和NaCl 以及刚果红胁迫处理下的表达水平存在明显差异,因此推测Bromodomain 家族基因在灰葡萄孢分生孢子发育、侵染过程以及胁迫应答过程中具有比较重要的作用。
本研究发现BCIN_02g06970在灰葡萄孢分生孢子发育的不同时期持续上调表达,推测其在灰葡萄孢分生孢子发育过程中具有重要作用。BCIN_04g04900、BCIN_02g08510、BCIN_02g06970和BCIN_14g05240在病菌侵染过程中持续上调表达,在侵染0 h 时表达水平最低,在16 ~48 h 时表达量明显上调,因此推测其在病菌侵染过程中发挥重要作用。本研究还发现在NaCl 以及刚果红胁迫处理下,灰葡萄孢Bromodomain 转录因子家族不同基因均呈现下调表达趋势,因此推测其在病菌胁迫应答过程中可能发挥重要作用。本研究结果初步确定了灰葡萄孢Bromodomain 家族基因在分生孢子发育、侵染过程以及NaCl 和刚果红胁迫应答中发挥重要作用,但机制尚不明确,还有待进一步探究。

