小鼠纹状体尾部和听皮层PV神经元的电生理性质比较
游佳鹏,宋长宝,梁妃学
南方医科大学生物医学工程学院神经信息工程实验室,广东 广州 510515
动物通过双耳获得外界的声音信息,并从多个平行的神经通路将声音信号和行为反应联系起来,从而指导它们自身的活动[1],纹状体在这里发挥了重要作用。啮齿动物的纹状体沿着喙尾轴延伸分布,并接收来自大脑各个皮层的神经输入[2-6]。尽管进行了数十年的研究,但目前关于纹状体的解剖功能组织知识和衍生理论在很大程度上都依赖于对其喙部研究所获得的结果[7]。纹状体的尾部区域,又被称为纹状体的尾巴(TS),是一个相对较小的区域。虽然现有的研究确定了感觉运动皮层、视觉皮层和听觉皮层(AC)是TS神经元的主要输入来源[8],特别是来自听觉核团的神经输入会汇集于TS内[9],但有关于TS的特性,包括神经元特性,仍然是不清楚的。
根据现有的研究表明,纹状体主要的神经元类型是GABA能的中等多棘神经元(MSN),也被称为纹状体投射神经元(SPN),它在神经元群中的占比高达95%[10]。剩余只有不到5%是中间神经元,由几种不同的GABA能和胆碱能中间神经元组成,其中包括以表达小白蛋白(PV)中间神经元为代表的快速尖峰中间神经元(FSI)[11]等。虽然中间神经元的占很少,但都能提供局部的输入影响SPN的活动[12,13]。在这里,PV神经元发挥了重要作用。
根据现有的研究表明,PV神经元在AC及其下行听觉投射脑区TS内都是主神经元抑制性调控的主要来源[14-18]。虽然PV神经元在这两个脑区局部环路的调控中都发挥了关键作用,但TS的GABA能神经元数量占比很小,而皮层内的GABA能神经元数量占比却达到了20%[19],这表明PV神经元在这两个脑区的局部调控中可能发挥着不同的作用。神经元的电生理特性是神经元网路功能作用的基础,虽然目前对纹状体PV神经元电生理特性的研究有了一定的进展[14],但这些进展依然是建立在对喙部研究的基础上,根据有关报道指出,纹状体不同区域的PV 神经元存在不同的电生理特性[20],TS内的还不是很清楚。另外,目前对AC的PV神经元操控听觉信息的表达[21]以及对调控动物和听觉有关的行为[22,23]等已经有非常充分的研究,因此,本研究重新评估TS的PV(TS-PV)神经元的电生理特性,并和AC的PV(AC-PV)神经元作比较,这将有助于我们理解TS的PV神经元处理听觉信息的机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物 本实验所使用的转基因鼠Ai14小鼠、PV-Cre小鼠最初在Jackson Laboratory处购得,后在上海南方模式生物净化处繁殖产生子代鼠,子代鼠在南方医科大学SPF级动物中心饲养、繁殖,经基因鉴定后,筛选出Ai14、PV-Cre基因阳性的小鼠。PV-Cre雄性小鼠(5~8周龄)与Ai14雌性小鼠(纯合子,5~8周龄)同笼饲养杂交,其后代小鼠4周龄时,经过基因鉴定筛选出PVCre-Ai 14的子代杂交鼠。所有的动物繁殖和实验手术程序都遵循[南方医科大学动物伦理与使用委员会标准(批准号为L2017207)]。
1.1.2 实验试剂 麻醉气体异氟烷(瑞沃德生命科技有限公司),磷酸盐缓冲液(PBS,思玛特生命科技有限公司),氯化钠(NaCl)、氯化钾(KCl)、六水合氯化镁(MgCl2·6H2O)、氯化钙(CaCl2)、三水合磷酸二氢钠(NaH2PO4·3H2O)、丙酮酸钠(Sodium Pruvate)、碳酸氢钠(NaHCO3)、葡萄糖(Glucose)、蔗糖(Sucrose)[西格玛奥德里奇(上海)贸易有限公司]。
1.2 实验方法
1.2.1 PV-Cre-Ai14小鼠基因鉴定 PV-Cre-Ai14转基因小鼠可以标记全身所有PV神经元,呈红色荧光。出生后7d 内的小鼠,颅骨壁薄,毛发还未生长,用绿色LED光照射小鼠头部,佩戴红色滤光眼镜观察,如果能清楚地看到小鼠头部存在红色区域,比如鼻子、耳朵部分,则该小鼠的基因型为PV-Cre-Ai14。使用该方法筛选出PV-Cre-Ai14阳性小鼠,用以选择性记录AC和TS内的PV神经元。
1.2.2 动物灌流 通过吸入式气体(异氟烷)深度麻醉小鼠,在操作台上固定小鼠的四肢,暴露胸腹部,使用外科手术剪剪开胸腔的皮肤,剪断肋骨,暴露心脏和肝脏。灌注针扎进左心室的心尖处,剪开右心耳,灌注大约15 mL 1×PBS后就可以观察到小鼠的肝脏和四肢开始发白,继续灌注直至从右心房流出的液体接近透明无色,更换PBS为4%多聚甲醛(PFA)继续灌注。PFA灌入后,可以观察到小鼠的尾巴开始翘起,全身的肌肉僵硬收缩。继续灌注直至小鼠尾巴翘起后又放下。用剪刀取下头部,用外科剪小心完全剥离颅骨,取下脑组织,浸泡在4%PFA中,放到4 ℃冰箱中固定24 h以上。
1.2.3 离体脑片的制备和孵育 PV-Cre-Ai14小鼠称取质量后,通过吸入式气体(异氟烷)深度麻醉小鼠,用大手术剪剪断头后,迅速剖开颅骨,取下脑组织置于含有碎冰的冷冻切片液中,切片液成分如下:60 mmol NaCl,3 mmol KCl,1.25 mmol NaH2PO4,25 mmol NaHCO3,115 mmol Sucrose,10 mmol Glucose,7 mmol MgCl2,0.5 mmol CaCl2,pH 为7.4,渗透压为300 mOsm/(kg·H2O)。随后在切片液中使用振动切片机(T-l000S,LEICA,USA)制备出含有AC和TS,厚度为300 μm的冠状脑切片若干,并迅速转移至恒温(34 ℃)人工脑脊液孵育槽内孵育,人工脑脊液的成分为:126 mmol NaCl,2.5 mmol KCl,1.25 mmol NaH2PO4,26 mmol NaHCO3,1 mmol MgCl2,2 mmol CaCl2,0.5 mmol Ascorbic acid,2 mmol Sodium Pruvate,and 10 mmol Glucose,pH 为7.4,渗透压为310 mOsm/(kg·H2O),至少孵育30 min。实验全程都给予95%O2和5%CO2的混合气体。
1.2.4 电生理记录 选取孵育槽内的脑片移至记录槽内。在配备有红外光源的直立荧光显微镜(Nikon Eclipse FN1)下观察并记录神经元,在绿色光源下,只有具有红色荧光标记的PV神经元才是全细胞记录的对象。记录用的玻璃电极为带有内芯的硼硅酸盐玻璃微电极(USA),电极尖端灌入含钾基的细胞内溶液,成分为:125 mmol K+-gluconate,10 mmol HEPES,10 mmol EGTA,4 mmol Mg-ATP,0.3 mmol GTP,2 mmol KCl,0.1 mmol CaCl2,8 mmol Phosphocreatine Sodium,pH为7.2。保持尖端电阻在7~12 MΩ。通过微型操作仪(MP-285,Sutter Instrument,USA)将有一定正压的玻璃电极移到目标神经元表面,压迫在细胞膜上形成凹痕,撤去正压给予较小的负压以形成高阻封接(电阻在1 GΩ 以上),稳定后口吸破膜形成全细胞记录。在电流钳模式下,通过向细胞内注入-150~600 pA的步进电流来记录PV神经元的动作电位(AP)反应,步进间隔为50 pA,电流持续注入时间为300 ms。实验全程循环灌流恒温(34 ℃)人工脑脊液,并给予含95%O2和5%CO2的混合气体。在电压钳模式下进行PV神经元胞体染色。记录用的玻璃电极尖端内灌注含有0.3%生物素(Biocytin)的含钾基细胞内溶液,形成全细胞记录后,停留20 min,使得Biocytin能够充分侵染PV神经元的胞体、树突和轴突。实验结束后,将脑片浸泡于4%多聚甲醛溶液(PFA)中8 h以上。
1.2.5 免疫染色 脑片浸泡结束后,转移至磷酸盐缓冲液PBS中冲洗3遍,随后浸泡在0.3%Triton中,并用锡箔纸完全密封避光,放置在摇床上振荡。3 h后,用PBS冲洗。随后浸泡在用5%牛血清稀释的Streptavidin-Cy3中,用锡箔纸完全包裹住避光。在摇床上振荡6 h后,将其用磷酸盐PBS冲洗,封片,在共聚焦显微镜下观察所记录神经元的形态,并拍照保存。
1.3 数据处理
TS-PV和AC-PV神经元的电生理性质比较包括AP的峰电位特性、后电位特性以及重复放电特性的比较。在全细胞电流钳模式下向PV神经元细胞内注入步进电流激发并记录其电反应。分析AP反应时,选取基强度(Rheobase,引起PV神经元产生AP的最小电流强度)下产生的第一个AP进行分析。峰电位特性主要分析的指标有:AP半峰宽、幅值、AP最大上升斜率和最大下降斜率。后电位特性主要的分析指标有包括后超极化持续时间和后超极化波谷[24]。重复放电特性的分析指标有F/I斜率[25]和AP的尖峰频率自适应(SFA)[24]。所有实验数据的读取、分析都通过Clampfit和MATLAB 2018b(Math Works)软件完成,随后的画图主要通过Excel、Origin 2021(Origin Lab)软件完成。
1.4 统计学分析
使用Origin 2021(Origin Lab)软件进行统计处理,各个结果的数值都以均数±标准误来表示。两个脑区实验数据之间的比较都首先使用夏皮罗-威尔克检验(Shapiro-Wilk'Test)检验两组数据是否都符合正态分布。都符合正态分布的数据使用样本t检验,不符合正态分布的数据使用曼-惠特尼u检验(Mann-WhitneyUTest),P<0.05表示差异具有统计学意义。
2 结果
2.1 两类PV神经元动作电位发放比较
图1A 为使用Biocytin 填充并重建形态学后的TS-PV神经元,图1C为AC-PV神经元。可以看到,和AC-PV神经元相比,TS-PV神经元有更为密集分布的树突轴突。图1B和图1D分别显示了TS-PV神经元和AC-PV神经元分别在亚阈值和超阈值步进电流下的响应示例,两类PV神经元在长时间步进电流中都表现出了高频放电,但相比较之下,TS-PV神经元的放电频率较低,AC-PV神经元发放AP的时间更早。为了具体研究两类PV神经元AP的发放特性,我们测量了它们响应基强度电流的第一个AP发放延迟(图1E),TS-PV神经元的为50.1±9.62 ms,AC-PV神经元的为11.0±1.54 ms,具有统计学差异(P<0.001)。对两类PV神经元内在电生理特性的测量表明,虽然它们处于相同的静息膜电位上(图1F;TS-PV神经元:65.4±1.26 mV;AC-PV神经元:67.3±1.32 mV;P>0.05),但是TS-PV神经元的SFA要大于AC-PV神经元(图1G),具有统计学差异(TS-PV神经元:1.35±0.11338;AC-PV神经元:0.966±0.0977;P<0.01)。
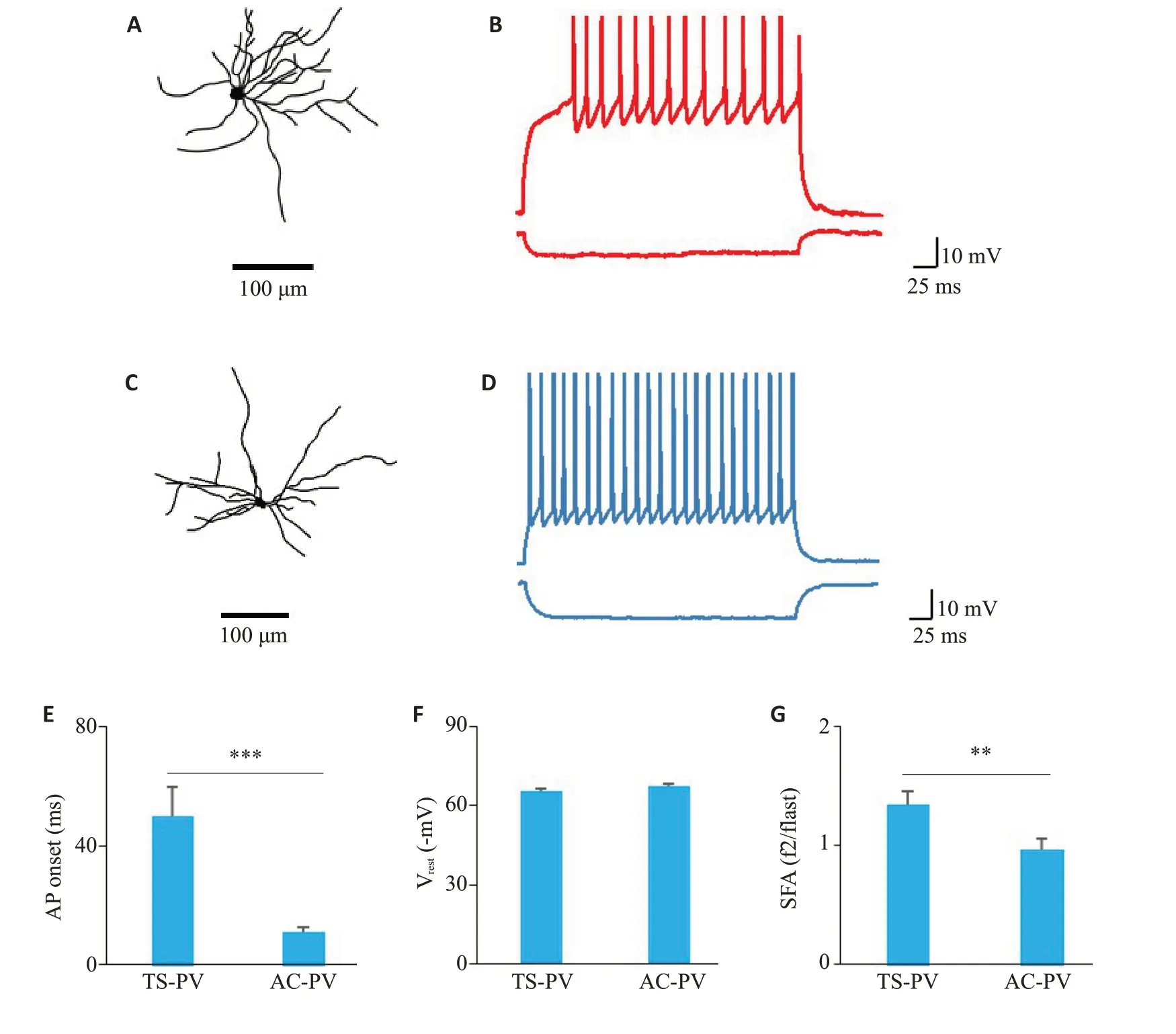
图1 小鼠TS-PV和AC-PV神经元的AP发放特性Fig.1 AP release characteristics of TS-PV and AC-PV neurons in mice.A: Morphological reconstruction of TS-PV neuron recorded by biocyton.B,D:Response recorded during injection of a hyperpolarizing current and a train of APs recorded during injection of a depolarizing current from a TS-PV neuron and a AC-PV neuron,respectively.C:Morphological reconstruction of a ACPV neuron recorded by biocyton.E:Comparison of AP onsets between TS-PV(n=29)neurons and AC-PV (n=22) neurons (***P<0.001).F: Comparison of resting potentials between TS-PV (n=29)neurons and AC-PV(n=22)neurons(P>0.05).G:Comparison of SFA between TS-PV(n=29)neurons andAC-PV(n=22)neurons(**P<0.01).
2.2 两类PV神经元重复放电特性比较
图2A和图2B分别是TS-PV神经元和AC-PV神经元响应去极化步进电流的放电示例,两类PV神经元的重复放电模式在对去极化电流的反应上有所不同。TSPV 神经元的放电阈值较高(图2C),具有统计学差异(TS-PV 神经元:169±10.1 pA;AC-PV 神经元:116±12.0 pA;P<0.01)。另外,虽然AC-PV神经元的平均放电率都高于TS-PV神经元(图2E),但TS-PV神经元的F/I斜率要更大(图2D),具有统计学差异(TS-PV神经元0:0.491±0.0261 Hz/pA;AC-PV神经元:0.385±0.0225 Hz/pA;P<0.01)。

图2 TS-PV和AC-PV神经元的重复放电特性Fig.2 Repetitive firing characteristics of TS-PV and AC-PV neurons.A,B: Representative firing in response to increasing depolarizing current (0-350 pA,50 pA increments) recorded from a TS-PV neuron and a AC-PV neuron,respectively.C: Comparison of rheobase between TS-PV (n=29) neurons and AC-PV (n=22) neurons(**P<0.01).D,E:Comparison of F/I slope and normalized average firing rate,respectively,between TS-PV(n=10)neurons andAC-PV(n=12)neurons(**P<0.01).
2.3 两类PV神经元在阈值附近放电特性比较
图3A分别是TS-PV神经元(红色)和AC-PV神经元(蓝色)在阈值附近放电的AP波形。在峰电位特性上,TS-PV 神经元的AP 半峰宽较短(TS-PV 神经元:0.332±0.0169 ms;AC-PV 神经元:0.617±0.0120 ms;P<0.001,图3B),但幅度更大(TS-PV 神经元:71.8±1.46 mV;AC-PV 神经元:63.4±2.16 mV;P<0.01,图3B)。在后电位特性上,AC-PV神经元AHP持续时间更长(TS-PV 神经元:11.5±0.660 ms;AC-PV 神经元:14.9±0.976 ms;P<0.01),但TS-PV神经元AHP波谷更大(TS-PV 神经元:12.7±0.664 mV;AC-PV 神经元:9.60±1.19 mV;P<0.05,图3C)。对两类PV神经元AP上升支和下降支的分析比较显示,TS-PV神经元的AP上升支有更大的最大上升斜率(TS-PV神经元:156±6.56 mV/ms;AC-PV神经元:125±7.88 mV/ms;P<0.01,图3D),下降支也有更大的最大下降斜率(TS-PV神经元:-75.1±4.48 mV/ms;AC-PV神经元:-59.1±5.59 mV/ms;P<0.05,图3E)。
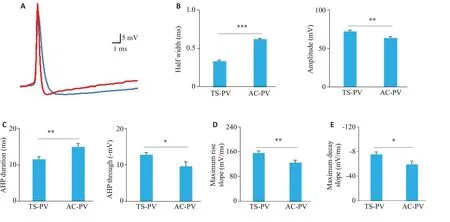
图3 TS-PV和AC-PV神经元的AP波形特性Fig.3 AP waveform characteristics of TS-PV and AC-PV neurons.A:Pepresentative APs recorded from a TS-PV neuron(red trace)and a AC-PV neuron(bule trace).B:Comparison of half width(left,***P<0.001)and AP amplitude(right,**P<0.01)between TS-PV(n=29) neurons and AC-PV (n=22) neurons.C: Comparison of AHP duration (left, **P<0.01) and AHP through (right,*P<0.05)between TS-PV (n=29) neurons and AC-PV (n=22) neurons.D,E: Comparison of AP maximum rise slope (**P<0.01) and AP maximum decay slope(*P<0.05),respectively,between TS-PV(n=29)neurons andAC-PV(n=22)neurons.
3 讨论
本研究使用与现有文献报道相类似的方法[24],运用离体膜片钳技术结合转基因动物,系统地探究并比较了小鼠TS和AC内主要的抑制性神经元PV神经元的电生理性质,结果显示这两类PV神经元都表现出了高频放电的电生理特性,这与以往的文献报道的结果相类似[11,24]。本研究结果进一步从AP固有特性的其他方面证明了TS-PV神经元和AC-PV神经元在电生理性质上存在的异同。
现有的研究显示,在啮齿动物的大脑中,GABA能抑制性中间神经元占整个皮层神经元群约20%[19],而在纹状体内的占比不到5%[11]。抑制性中间神经元种类繁多,包含了PV神经元在内的几种类型。为了能够准确地记录目标神经元,本研究通过使用转基因动物PVCre-Ai14小鼠来选择性地标记PV神经元。我们记录了TS-PV神经元和AC-PV神经元的放电模式,以及使用形态学染色的方法重建了它们的细胞形态。现有的研究表明,在形态学上,纹状体的PV神经元表现出紧凑且呈球形的轴突场,AC的PV神经元则会形成独特的烛台状突触终端,在电生理特性上它们都具有快放电的特性,单位时间内动作电位的发放频率要明显高于其它类的抑制性神经元[11,26]。本研究TS-PV神经元的整个轴突场十分密集且大致呈球形结构,AC-PV神经元的轴突向四周伸展且呈灯形,它们都表现出了高频放电的特性。解剖学特征结合电生理特征验证了我们的转基因动物对PV神经元的标记是准确的。值得一提的是,和AC-PV神经元相比,TS-PV神经元的轴突高度分支。现有的研究表明,皮层内的PV神经元对兴奋性神经元的抑制支配局限在同一层[16],而纹状体的PV神经元在其轴突的区域半径内会尽可能地连接SPN[12,13],这种差异可能也是由于它们解剖形态学所导致。
AP的阈值和神经元的兴奋性有着密切的联系,阈值越低,神经元的兴奋性越高。在本研究中,我们发现TS-PV神经元的AP不但阈值更大,在基电流强度下的发放延迟也远远大于AC-PV神经元。另外,记录它们对一系列去极化步进电流的响应也显示出和AC-PV神经元相比,TS-PV神经元的平均放电率要更小。我们的结果表明虽然两类PV神经元都具有高频放电的特性,但是TS-PV神经元在接受外来刺激信号时比AC-PV神经元更难被兴奋。现有的研究认为PV神经元强烈涉及SPN活动的前馈抑制[27,28],而PV神经元的低活性和高活性都会减少SPN的输出,尤其是过度激活PV神经元足以破坏动物的神经动力学和行为能力[29]。结合本研究结果,表明TS-PV神经元的高阈值和低放电率特性能够使其避免过度兴奋。一个有待解决的问题是这些结果的生物学意义,以往的研究表明抑制PV神经元的活性能模拟稀疏PV神经元群的急性效应,这与Tourette综合征[30]和亨廷顿病[31]等疾病有关。然而,过度激活PV神经元目前没有反映任何已知的生理状态[31],这还需要进一步的研究。
本研究发现TS-PV神经元和AC-PV神经元在阈值附近表现出显著不同的AP波形。对于峰电位的研究结果显示,虽然它们拥有相同的静息膜电位,但TS-PV神经元的半峰宽更小,幅度更大。另外,TS-PV神经元有更大的AP最大上升斜率和最大下降斜率,这显示出TS-PV神经元在被去极化电流激活后,其膜电位的去极化和复极化速度都更快。对于后电位的研究结果显示,TS-PV神经元超极化程度更深,恢复到静息电位的时间更短。我们的研究结果显示,和AC-PV神经元相比,TS-PV 神经元表现出更狭窄的AP 波形。另外,虽然TS-PV神经元的AP发放阈值较高,放电率较低,但它具有更大的F/I斜率,表明随着去极化步进电流的增加,TS-PV神经元AP发放频率的增长速度会更快。因此虽然TS-PV神经元的放电率较低,但在接受一定强度的刺激后其快速增长的AP频率足以延迟或阻止SPN动作电位的发放,从而发挥强大的抑制作用,这也与现有文献报道的PV神经元接受兴奋性输入后阻止SPN放电的结果相似[12]。值得注意的是,TS-PV神经元也有更大的SFA。SFA是神经元的适应机制,当神经元接受外界信号刺激时,自身的放电频率会随着刺激时间不断减弱。SFA与神经元的长期可塑性有直接联系,SFA更大的神经元有望表现出更佳的尖峰时间依赖可塑性(TDP)[32],这是大脑学习和信息存储的基础。现有的研究表明AC-PV神经元在听觉联想学习行为中发挥着重要作用[33],这提示了我们TS-PV神经元也很有可能参与了小鼠的听觉学习过程,这与现有的文献报道的损伤纹状体PV神经元会导致小鼠依赖性学习产生严重缺陷的结果相类似[34]。
综上,本研究通过离体膜片钳电生理记录的方法探究了TS-PV神经元和AC-PV神经元内在电生理性质的异同,探究这些异同点有助于我们进一步理解TS-PV神经元在听觉信息处理过程中发挥的作用。

