牦牛GSTK1 基因序列特征分析及其组织表达谱构建
潘帮婷,熊显荣,于海玲,杨满珍,胡宇磊,朱艳锦,费熙熙,李 键
(1.西南民族大学畜牧兽医学院,四川 成都 610041;2.青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041;3.动物科学国家民委重点实验室,四川 成都 610041)
谷胱甘肽S-转移酶(Glutathione S-Transferases,GST)是生物体内代谢转化最重要的ⅱ相代谢酶之一,其催化谷胱甘肽(GSH)的还原形式与异生物种的结合以解毒而闻名[1].可溶性GST 分为八个家族:Alpha、Mu、Pi、Theta、Kappa、Sigma、Zeta 和Omeg,这些家族在物种之间高度保守[2].可溶性的谷胱甘肽S-转移酶大多数位于细胞质中,也有少数的位于线粒体和细胞核中[3].GST 超基因家族成员在植物、动物、细菌和真菌中有广泛表达,并编码的蛋白家族执行多种生理功能[4],其中GSTA1、GSTA2、GSTO1 和GSTK1 组织分布广泛,在不同的组织中有不同的作用.例如GSTA1在胎盘中参与前列腺素A2(PGA2)和前列腺素J2(PGJ2)谷胱甘肽偶联物的形成[5].GSTA2 在子宫中参与了芳烃受体途径[6].GSTO1 在结肠、胰腺、骨骼肌、脾、肝、心和血白细胞中高度表达,其参与无机砷的生物转化,还原甲基丙烯酸甲酯(MMA)和二甲基砷酸[7].GSTK1 是一种高度保守的线粒体酶,参与能量产生,脂质代谢和脂联素的调节[8].
GSTK1 是GST 超家族的kappa 类成员之一,参与能量产生、脂质代谢、上皮细胞分化和细胞排毒功能的调节,其编码的蛋白质位于细胞过氧化物酶体中,催化谷胱甘肽与各种疏水性物质的偶联,从而发挥其相关生物学功能[9-10].1991 年,Harris 等人在大鼠肝脏线粒体基质中发现并成功获得GSTK1,并命名为GST13-13[11].Zeng 等人在研究GSTK1 与猪精子质量的关系中,表明GSTK1 与精子质量呈正相关,并指出了这种相关性是一种有前景的精子质量评价指标[12].近几年有研究报道,血浆中线粒体DNA 的拷贝数跟GSTK1 的表达和2 型糖尿病的炎症有关,血浆中的线粒体DNA 拷贝数可能通过抑制GSTK1 在糖尿病慢性炎症的进程中发挥重要作用[13].Jin 等人在人胎盘蛋白质组学分析中,表明在谷氨酰胺代谢过程相关分子GSTK1 参与了谷胱甘肽从氧化型谷胱甘肽到还原型谷胱甘肽的转换、巯基尿酸和精氨酸的代谢过程,并表明了胎盘组织谷胱甘肽代谢紊乱大概率是子痫前期病发的因素之一[14].
牦牛(Bos grunniens)主要分布在高海拔地区,对高辐射、气温低和缺氧的恶劣环境等具有很强的适应能力,也是当地牧民赖以生存的经济基础[15].但由于牦牛繁殖能力较低,对当地畜牧业的经济发展造成了严重的影响,因此开展牦牛有关繁殖方面的研究就尤为重要.目前,与GSTK1 相关研究主要涉及猪精子质量的影响因素、人糖尿病的慢性炎症和人胎盘的蛋白质组学等,但是,对于牦牛GSTK1 基因的研究尚未见报道.因此,本研究以牦牛作为试验对象,采用RTPCR 技术手段对GSTK1 基因的编码区进行特异性扩增,并对其测序结果进行生物信息学分析,采用RTqPCR 技术检测GSTK1 基因在牦牛卵巢、脾、肝、小肠、肾、肌肉、肺和心等8 个组织中的mRNA 相对表达水平.试验结果对牦牛GSTK1 基因的功能研究提供参考依据,为牦牛GSTK1 基因在其繁殖过程中功能的深入研究奠定基础.
1 材料和方法
1.1 试验动物与样本采集
牦牛各组织样本均从四川省成都市周边屠宰场采集.选取4 岁健康状况正常的母牦牛,待屠宰后立刻采取无菌操作对心、小肠、肌肉、脾、肝、肺、肾和卵巢8 个组织进行采样,用含有双抗(青霉素和链霉素,均采购于Beyotime)的生理盐水对各组织样进行反复冲洗,剪成约1 cm×0.5 cm×0.5 cm 的组织块,放入预先编号的2.0 mL 冻存管(采购于LABSELECT)中,并快速放入到液氮罐(采购于Chart/Golden Phoenix)中,置于-80 ℃冰箱保存备用.
1.2 各组织cDNA 的获取
采用常规的Trizol 法(采购于南京诺唯赞)对牦牛心、肝、肌肉、脾、小肠、肺、肾和卵巢等8 个组织的总RNA 进行提取,检测各组织总RNA 浓度,并选取OD 值为1.8~2.0 的RNA 样本,根据逆转录试剂盒(采购于Thermo Scientific)的指示对各组织的总RNA进行逆转录,从而获得牦牛各个组织的cDNA,并保存于-20 ℃冰箱中备用.
1.3 引物的设计及合成
根据NCBI 数据库GenBank 中登陆的野牛(Bisonbison bison)GSTK1 基因序列(GenBank No:XM_010 834 016.1)以及牦牛内参基因GAPDH的序列(Gen-Bank No:EU195 062.1),利用NCBI 在线工具设计普通PCR 扩增引物和RT-qPCR 引物,并交由生工(上海)合成,序列见表1.

表1 目的基因和内参基因引物信息Table 1 Primer information for target and house-keeping genes
1.4 牦牛GSTK1 基因PCR 扩增及测序
以牦牛肝组织cDNA 为模板,GSTK1 反应体系为50 μL:2 ×Rapid Taq Master Mix(采购于南京诺唯赞)25 μL,F1和R1各引物4 μL,cDHA 模板2 μL,ddH2O 15 μL.反应条件为95 ℃3 min(预变性);95 ℃15 s(变性),62 ℃15 s(退火),72 ℃60 s(延伸),循环数41 个;72 ℃5 min(彻底延伸),4 ℃停止.
制备浓度为2%的琼脂糖凝胶电泳(采购于Thermo Scientific)对GSTK1 PCR 扩增产物进行检测,获得目标条带,并装入新的0.2 mL 微量离心管中将合格的PCR 产物送至生工(上海)进行测序,获得牦牛GSTK1 基因序列.
1.5 生物信息学分析
通过DNAMAN8 软件将测序结果中GSTK1 两条碱基拼接完整;在NCBI 的ORF Finder 中对牦牛GSTK1 的开放阅读框进行预测和分析;通过NCBI 中的Nucleotide BLAST 工具对各物种GSTK1 高度相似性的核苷酸序列进行检索;用MEGA10.2.软件构建系统发育树;通过Expasy-ProtParam Tool 在线预测蛋白理化性质;通过Expasy 中的Protscale 在线预测GSTK1 亲疏水性;通过PSIPRED、SWISS-MODEL 等在线工具对GSTK1 蛋白的高级结构进行预测;STRING在线对GSTK1 蛋白互作网络预测;DTU Bioinformatics在线对GSTK1 蛋白跨膜区域及磷酸化位点进行预测.
1.6 牦牛GSTK1 基因组织表达检测
以GAPDH为内参基因,采用RT-qPCR 技术手段检测GSTK1 基因在牦牛肝、脾和肺等8 个组织中的表达情况.检测前将所有的组织cDNA 模板浓度调整一致(20 ng/μL),以确保数据的可信度.RT-qPCR 扩增体系为20 μL:2 × NovoStart®SYBR qPCR SuperMix Plus(采购于苏州近岸蛋白)10 μL,F2和R2、F3和R3各引物1 μL(10 mol/L),各组织cDNA 模板2 μL,RNase Free Water 6 μL.RT-qPCR 扩增条件为95 ℃60 s(预变性);95 ℃20 s(变性),57 ℃20 s(退火),72 ℃30 s(延伸),循环数38 个;65 ℃~95 ℃,每5 s增加0.5 ℃进行溶解曲线的测定.
1.7 统计学分析
每组试验重复3 次,使用2-△△Ct方法对RT-qPCR结果进行均一化处理,采用SPSS 19.0 软件对处理结果进行方差分析,ANOVA 显著性差异分析.其中P>0.05 表示无显著性差异;0.01 <P<0.05 表示显著性差异;P<0.01 表示极显著性差异.
2 结果与分析
2.1 牦牛GSTK1 基因的扩增及序列分析
以牦牛肝脏组织cDNA 为模板,F1、R1为上下游引物,PCR 扩增牦牛GSTK1 基因CDS 区.扩增结果显示,目的条带长度为683 bp(图1A).测序结果ORF显示,牦牛GSTK1 基因编码区为618 bp,共编码205个氨基酸(图1B).

图1 牦牛GSTK1 基因的PCR 扩增结果Fig.1 PCR amplification results of yak GSTK1 gene
2.2 生物信息学分析
2.2.1 牦牛GSTK1 基因的同源性比对
通过NCBI 在线工具的Nucleotide BLAST 对牦牛GSTK1 所测核苷酸序列与野牦牛(Bos mutus,XM_005 886 716.2)、黄牛(Bos taurus,XM_005 205 872.4)、野牛(Bison bison bison,XM_010 834 016.1)、水牛(Bubalus bubalis,XM_006 071 877.3)、弯角剑羚(Oryx dammah,XM_040 260 052.1)、山羊(Capra hircus,XM_005 679 551.3)、绵羊(Ovis aries,XM_012 177 297.4)、马鹿(Cervus canadensis,XM_043 463 927.1)、蓝鲸(Balaenoptera musculus,XM_036 864 181.1)、白鳍豚(Lipotesvexillifer,XM_007 466 640.1)、单峰驼(Camelus dromedarius,XM_031 454 512.1)、北极熊(Ursus maritimus,XM_008 697 303.2)、野猪(Sus scrofa,NM_001 315 574.1)、马(Equus caballus,XM_001 489 929.4)的GSTK1 对应核苷酸同源性进行比对.结果表明,测序得到的牦牛GSTK1 基因序列与黄牛、野牦牛和野牛的同源性最高,分别为99.68%、99.68%和99.40%;与北极熊、马和野猪的同源性最低,分别为87.63%、87.25%和87.01%.系统发育树显示(图2),其与同源性结果一致,牦牛在进化上跟黄牛、野牦牛和野牛的亲缘关系最为密切.
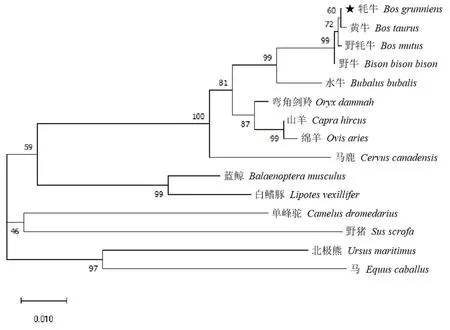
图2 GSTK1 基因系统发育树Fig.2 Phylogenetic tree analysis of GSTK1 gene sequence
2.2.2 牦牛GSTK1 基因编码蛋白理化性质分析
通过ExPASy 在线工具预测的GSTK1 蛋白相对分子质量为23 125.01,分子式为C1039H1662N284O290S11,共有原子数3 286 个;GSTK1 蛋白的脂肪指数、理论等电点、半衰期、不稳定系数和亲水指数分别为96.59、7.84、30 h、54.26、-0.176.从以上预测结果可知,GSTK1 属于不稳定亲水性蛋白(图3).GSTK1 蛋白氨基酸的比例结果显示(表2),亮氨酸(14.1%)含量最高,硒代半胱氨酸(0.0%)含量最低.GSTK1 基因编码带负电荷的氨基酸(Asp +Glu)有22 个,带正电荷氨基酸(Arg +Lys)有25 个,由此可知GSTK1 蛋白整体带正电荷.
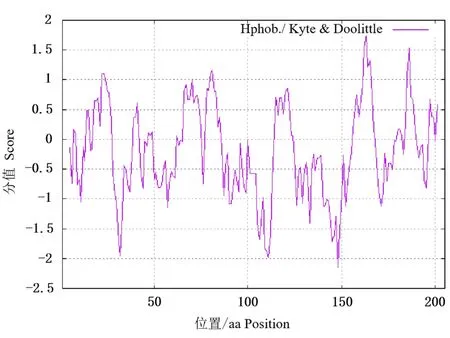
图3 牦牛GSTK1 蛋白的亲疏水性预测Fig.3 The prediction of hydrophobicity for GSTK1 protein in yak

表2 牦牛GSTK1 基因翻译蛋白的氨基酸比例Table 2 Amino acid composition of the protein encoded by the yak GSTK1 gene
2.2.3 牦牛GSTK1 高级结构与互作蛋白预测
通过PSIPRED 在线预测牦牛GSTK1 蛋白二级结构结果显示(图4A),该蛋白含有104 个α-螺旋(50.73%),82 个无规卷曲(40.00%),19 个延伸链(9.27%).通过SWISS-MODEL 在线对GSTK1 蛋白三级预测(图4B),其结果与二级结构一致.通过STRING 数据库分析牦牛GSTK1 潜在互相作用蛋白显示(图4C),GSTK1 可能与GPX1、GSTT4 和GSTO1等10 个蛋白存在相互作用.GO 分析显示,GSTK1 蛋白互作网络中蛋白质能够参与乙醇代谢、谷胱甘肽代谢、细胞排毒、类二十烷酸代谢和氧化还原等生物学过程.

图4 牦牛GSTK1 蛋白的高级结构及互作蛋白Fig.4 Conformation and interaction protein of GSTK1 protein in yak
2.2.4 牦牛GSTK1 蛋白跨膜结构域和磷酸化位点分析
通过蛋白跨膜结构域预测结果显示(图5A),牦牛GSTK1 蛋白无跨膜结构域,因此其不属于跨膜蛋白.通过GSTK1 蛋白磷酸化位点预测结果显示(图5B),在牦牛GSTK1 蛋白的氨基酸中高于其阈值0.5的有3 个苏氨酸(Thr)和9 个丝氨酸(Ser),由此可知GSTK1 蛋白具有12 个磷酸化位点.
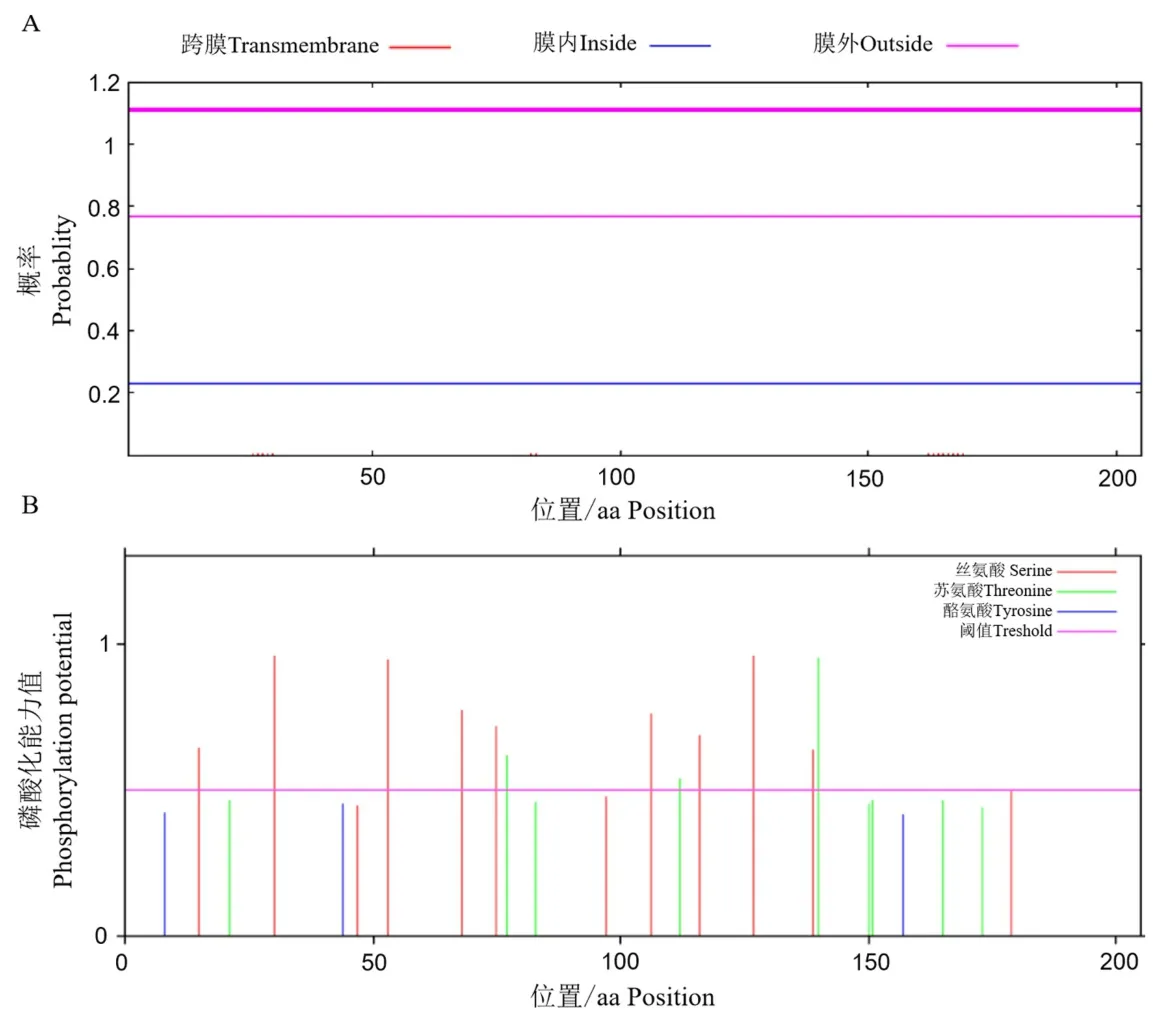
图5 牦牛GSTK1 蛋白跨膜区域和磷酸化位点分析Fig.5 The protein transmembrane regional and phosphorylation site analysis of GSTK1 protein in yak
2.3 牦牛GSTK1 基因的mRNA 组织表达谱分析
以GAPDH为内参基因,采用RT-qPCR 技术手段检测GSTK1 基因在牦牛肝、脾和肺等8 个组织中的表达情况,并绘制出表达谱.表达谱分析显示(图6),GSTK1 基因在这8 个组织中均有表达,且表达水平从高到低的顺序为肝、肌肉、肾、小肠、卵巢、肺、心、脾.

图6 牦牛GSTK1 基因的组织表达Fig.6 Tissue expression of GSTK1 gene in yak
3 讨论
GSTK1 在谷胱甘肽代谢过程中发挥线粒体和过氧化物酶体解毒功能,这是保护细胞免受自由基和氧化损伤的关键途径,可增加细胞内NADPH 氧化酶水平[2-14].随着NADPH 氧化酶的增加,活性氧水平趋于降低,而细胞内ATP 水平以及线粒体活性增强,从而促进卵巢卵母细胞成熟[16].因此猜想GSTK1 可能对牦牛的繁殖性能有重要作用,但目前对于牦牛GSTK1基因的研究尚未见报道,关于牦牛GSTK1 蛋白的结构、功能及其在组织中的表达规律缺少系统性研究.本研究克隆出了牦牛GSTK1 基因,其同源性比对结果显示,牦牛与野牦牛(99.68%)、黄牛(99.68%)和野牛(99.40%)的同源性最高,与系统发育树分析结果吻合,表明GSTK1 基因在物种进化过程中高度保守.本研究牦牛GSTK1 基因翻译蛋白的氨基酸比例结果显示,亮氨酸(Leu)和谷氨酸(Glu)含量最高,分别占总体的14.1%和7.8%,而在前人的研究中,亮氨酸(Leu)是具有能够促进能量代谢和促进肉仔鸡小肠上皮细胞的生长、增殖,并且能抑制细胞凋亡的作用[17-18],因此进一步证实GSTK1 参与了能量的产生和促进上皮细胞的分化等功能.本研究组织表达谱结果表明,GSTK1 在牦牛各组织中广泛表达,且在肝组织中表达量最高,Rachel 等人在小鼠的研究中发现心、胃、肝、脾、肺和肾组织中均表达GSTK1,在肝和胃中其表达量最高[19];在另外一项研究中证实了,不同年龄段大鼠的GSTK1 在肝表达中,GSTK1 的表达量随着寿命的增长而逐渐增加[20].因此猜测GSTK1 基因可能跟牦牛的能量产生,脂质代谢等主要功能有关,具体的作用机制有待进一步的研究.本研究GSTK1 在肌肉中的表达量居于第二,Breedon 等人研究淡水红耳龟在缺氧或者在有氧恢复期间,GSTK1 同工酶以心脏和肌肉组织特异性的方式升高[21].因此推测红耳龟跟牦牛在缺氧环境中为了生存并防止与活性氧相关的细胞损失,已经进化出对缺氧环境的高适应性.本研究结果可为GSTK1 基因对牦牛机体能量产生和抗低氧,从而提高牦牛高原适应性的研究提供了新思路.
本研究结果显示GSTK1 基因在牦牛卵巢中有所表达,有研究表明了GSTK1 在小鼠性腺中高度表达[22].除此之外,Chunyan 等人在松果体转录组分析小尾寒羊两种FecB 基因型与多产性相关的lncRNA和mRNA 差异调节的研究中,发现GSTK1 可能做为相关IncRNA 的靶基因,通过参与小尾寒羊的卵泡期谷胱甘肽代谢的生物学过程来影响其繁殖力[23].因此推测GSTK1 可能参与了牦牛卵巢相关生殖功能.通过以上的讨论,推测GSTK1 可能与牦牛高原适应性等有关联,但对于GSTK1 是否参与了牦牛繁殖等功能还有待进一步的研究.
4 结论
本试验成功克隆了牦牛GSTK1 基因,生物信息学分析其序列特征比较保守.组织表达谱揭示GSTK1在牦牛各组织中广泛表达,且在肝和卵巢中表达量较高.综上,推测GSTK1 基因与牦牛的高原适应性及繁殖密切相关,其具体作用机制有待进一步研究.

