非特指型多形性EBV阳性弥漫大B细胞淋巴瘤 1例
朱星瑶,农卫霞,陶 林,敖启林,邹 泓
患者男性,50岁,因扁桃体过度肥大行扁桃体切除术,术后发现右侧颈部有一鹅蛋大小包块,质硬,无红肿、疼痛,不易推动,抗生素治疗无效。颈部淋巴结彩超示:多发淋巴结肿大,部分髓质消失。PET/CT报告考虑淋巴源性病变。右侧颈部包块针吸涂片结果显示:见异型淋巴细胞,形态不除外霍奇金淋巴瘤。
病理检查眼观:右侧颈部取淋巴结5枚,大小3.0 cm×2.5 cm×2.0 cm,切面灰红、灰白色。镜检:正常淋巴结结构破坏,散在及小片状免疫母细胞样细胞及R-S样细胞分布(图1、2),细胞轻~中度异型,可见病理性核分裂象(图3),背景中可见大片淋巴细胞、浆细胞及散在组织细胞增生,局灶见高内皮小静脉。免疫表型:免疫母细胞样细胞及R-S样细胞CD20(图4)、CD30(图5)、EBER(图6)、PAX-5、CD79a、MUM1阳性,其余标志物均阴性,Ki-67增殖指数约50%。骨髓穿刺显示:造血细胞中散在异型增生的大淋巴细胞、单核样细胞浸润,免疫组化显示此类细胞CD20阳性,考虑淋巴瘤侵犯骨髓。
病理诊断:EBV阳性弥漫大B细胞淋巴瘤-非特指(Epstein Barr virus positive diffuse large B-cell lymphoma-non-specific, EBV+DLBCL-NOS),多形性亚型。患者确诊后行化疗,目前状况良好。
讨论EBV+DLBCL是一种EBV阳性的克隆性B细胞增生性病变,对传统治疗不敏感,预后差,中位生存期仅24个月[1]。在WHO(2016)造血和淋巴组织肿瘤分类中被命名为EBV+DLBCL-NOS[2-3],约占全部弥漫大B细胞淋巴瘤的10%[4]。发病部位以淋巴结病变为主,临床上多数患者表现为贫血,白细胞或血小板减低,血清乳酸脱氢酶水平明显增加。
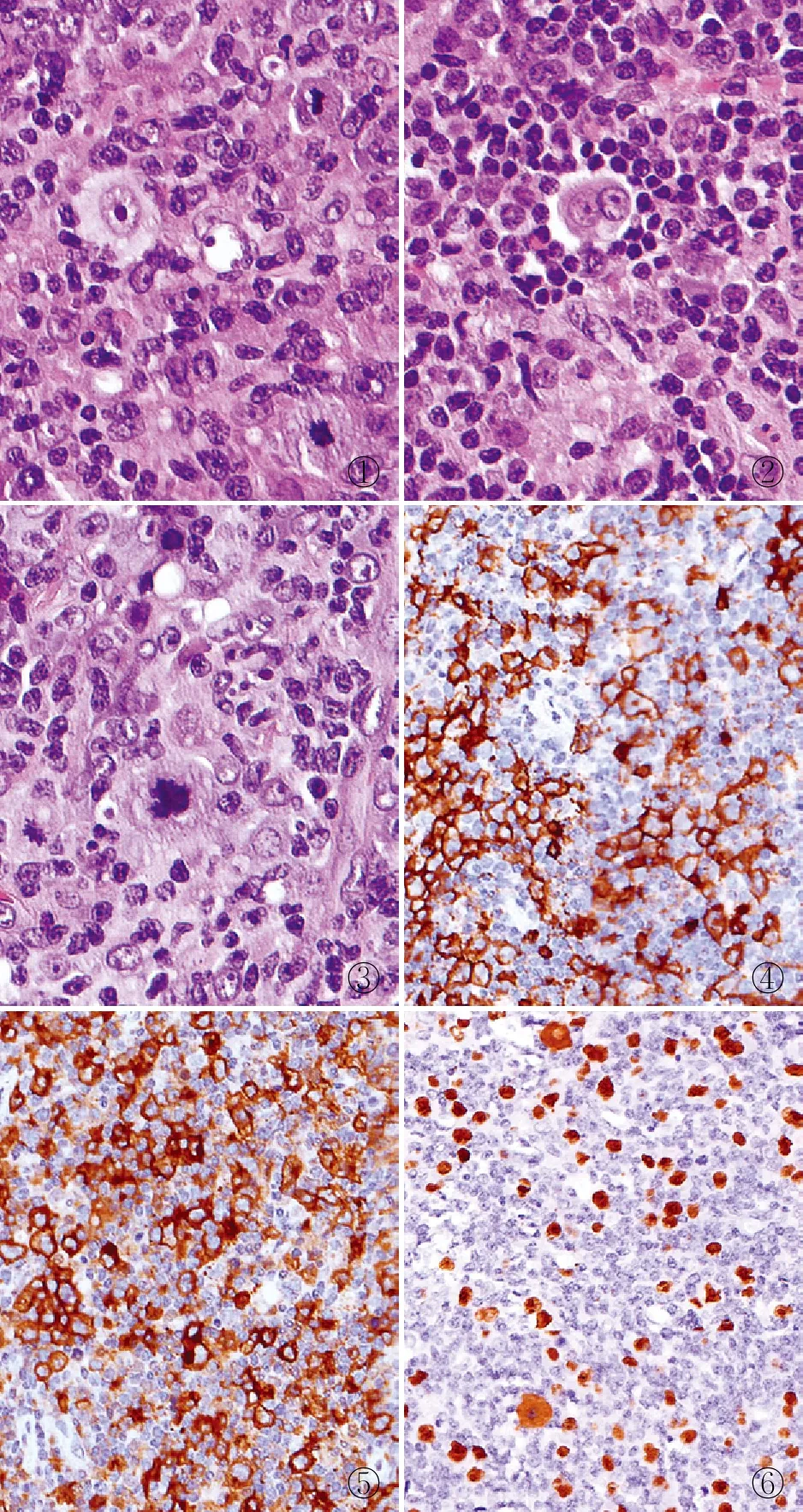
①②③④⑤⑥
按组织学形态特点,EBV+DLBCL-NOS可分为两类,一类以相对单一、大的异型淋巴细胞或免疫母细胞为主,称为大细胞亚型[5];另一类镜下见散在或小灶大淋巴瘤细胞,常具有霍奇金淋巴瘤样特征,背景多量炎细胞及免疫母细胞,称为多形性亚型。肿瘤细胞表达广泛的B细胞标志物,如CD20、CD30、CD79a及PAX-5,此外MUM1、CD15、CD10、BCL-6、BCL-2也是常用的诊断标志物,Ki-67增殖指数50%~90%。
多形性亚型更为常见,但极易与富含T细胞/组织细胞的大B细胞淋巴瘤(T-cell/histiocyte-rich large B-cell lymphoma, THRLBL)、血管免疫母细胞T细胞淋巴瘤(angioimmunoblastic T cell lymphoma, AITL)以及经典型霍奇金淋巴瘤(classical Hodgkin lymphoma, CHL)相混淆并误诊[6]。(1)AITL常不破坏皮质外周淋巴窦,可见残存的滤泡。增生细胞小~中等大,轻度异型,胞质淡染,核膜清楚,可形成高度特征性的花斑状结构。滤泡树突细胞增多,明显的高内皮细胞小静脉也是该肿瘤的一个特征。少数病例可见散在的R-S样细胞。T细胞系标志物(CD2、CD3、CD5)呈阳性,可见CD21+滤泡树突状细胞网。此外,AITL具有正常滤泡辅助T细胞表型,即CD3、CD10、CXCL13和PD-1阳性[7]。病变组织中存在的转化B细胞通常EBV阳性,但肿瘤细胞EBV阴性。(2)THRLBL也可见到类似于中心母细胞或R-S样细胞的肿瘤细胞,但肿瘤细胞EBV多为阴性,CD30阴性,且背景由数量不等的CD68+组织细胞及CD3+CD5+T细胞构成。若病例中缺乏一定数量的组织细胞,且中~大B细胞成簇分布时,不应诊断为THRLBL,而应考虑DLBCL-NOS。此外,若发现THRLBL中肿瘤细胞表现出霍奇金样细胞的形态且EBV阳性,则应考虑诊断EBV+DLBCL-NOS。(3)CHL很少出现骨髓受累,镜下见数量不等的R-S细胞并混杂反应性背景细胞,包括炎细胞及组织细胞,常伴不同程度的纤维化[8]。几乎所有病例中的R-S细胞CD30和MUM1强阳性,可见CD15核膜和核旁阳性,PAX-5较反应性B细胞弱阳性,而CD20、CD75a多呈阴性[9]。
EBV+DLBCL-NOS易侵犯骨髓,预后差,目前尚无特效治疗。传统R-CHOP或CHOP方案联合来那度胺治疗可能有利于提高患者生存率,但仍需要进一步的实验及临床验证。
总之,EBV+DLBCL-NOS多形性亚型常见,预后差,临床易误诊,各年龄段均可发病,以老年人更多见,免疫组化CD20、CD30、CD79a、PAX-5、BCL-6、MUM1、CD10、CD3、CD5、CD68、CD21抗体组合有助于该病的诊断及鉴别诊断。

