不典型主动脉夹层3例并文献复习
黄丽蓉 卢安卫
主动脉夹层(artic dissection,AD)是各种原因造成的主动脉壁内膜撕裂后循环中的血液通过破口进入主动脉壁内,使主动脉壁中层与外膜剥离延伸的一种严重心血管急重症,猝死率高。典型AD症状为胸部或腹部持续性撕裂样疼痛。当临床表现不典型时,易漏诊、误诊。未经治疗的AD患者48 h内病死率达50%,70%患者于1周内死亡[1]。笔者报道树兰(杭州)医院3例不典型AD并文献复习,以加强临床医师对不典型AD的认识,减少AD误诊、漏诊。
1 临床资料
例1 男,52岁,因“腹痛伴便血7 h”于2020年7月23日入住本院ICU。患者7 h前晨起后出现腹痛,剑突下为主,伴恶心、呕吐,呕吐物为少许胃内容物,后解暗血性便1次,休息后无缓解遂至本院就诊。既往有冠心病史,3年前于回旋支置入2枚支架,长期服用氯吡格雷片75mg。入院查体:血压150/89mmHg(1mmHg=0.133kPa),心率100次/min,体型肥胖,剑突下压痛,余查体无殊。辅助检查:D-二聚体3 290 μg/L,CRP 57.4 mg/L。全腹增强CT检查示:AD(DebakeyⅠ型),累及肠系膜上动脉,左髂总动脉,见图1。7月28日行主动脉瓣+升主动脉置换和冠脉移植术+主动脉支架置入术,治疗好转出院。

图1 全腹增强CT检查
例2 男,41岁,因“胸闷伴恶心、呕吐4 h”于2020年8月28日入住本院ICU。患者4 h前跑步后出现胸闷伴恶心、呕吐,症状较轻,但因血压低,由社区医院转诊至本院就诊。入院查体:61/30 mmHg,心率50次/min,神志清,心脏各瓣膜区听诊未闻及杂音,余查体无殊。既往无高血压等心血管病史、自身免疫系统等病史。辅助检查:D-二聚体2 499 μg/L,CRP正常。心电图检查示窦性心动过缓,主动脉弓CT血管造影(CT angiography,CTA)检查诊断AD(DebakeyⅠ型),见图2。住院期间行主动脉瓣+升主动脉置换和冠脉移植术+升主动脉部分切除伴人工血管置换术+全主动脉弓人工血管置换并支架象鼻手术,治疗好转出院。

图2 主动脉弓CT血管造影检查
例3 男,50岁,因“反复腹痛伴恶心、呕吐3 d”于2020年12月28日入住本院ICU。患者于3 d前少量饮酒后出现全腹痛,剧烈,伴恶心、呕吐,当地医院查血淀粉酶、脂肪酶正常,全腹CT平扫示胰腺肿大伴渗出,诊断急性胰腺炎,予禁食、抑酸、抑酶治疗3 d效果不佳,转至本院进一步治疗。入院查体:血压195/117 mmHg,心率60次/min,痛苦面容,强迫仰卧体位,腹肌紧张,上腹部压痛伴反跳痛。辅助检查:血淀粉酶720 U/L,血清钙1.69 mmol/L,TC 2.39 mmol/L,TG 1.3 mmol/L,肌酐233 μmol/L,ALT 3 105 U/L,AST 4 405 U/L,PT 25.9 s,D-二聚体7 074 μg/L,CRP 113.2 mg/L。胸腹主动脉CTA检查诊断为AD(DebakeyⅢ型),腹腔干闭塞,肠系膜上动脉次全闭塞,左肾动脉闭塞,见图3。予吗啡止痛、乌拉尔地尔静脉注射控制血压后,急诊行胸主动脉瘤腔内隔绝术,但患者病情加重,最终死亡。
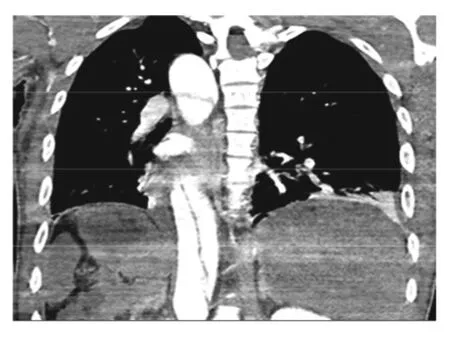
图3 胸腹主动脉CT血管造影检查
2 讨论
AD是各种原因造成的主动脉壁内膜撕裂后循环中的血液通过破口进入主动脉壁内,使主动脉壁中层与外膜剥离延伸的一种严重心血管急重症。我国AD发病率为4.3/100 000,好发年龄50~70岁,男女比例约为3∶1[2]。AD病因至今未明,可能与高血压、马方综合征、先天性主动脉病变、主动脉粥样硬化、炎性主动脉疾病、妊娠、创伤、脂代谢异常、饮酒等因素相关[3]。临床上常用Debakey分型,将AD分为Ⅰ、Ⅱ、Ⅲ型。Ⅰ型:原发破口位于升主动脉或主动脉弓,夹层累及大部或全部胸升主动脉、主动脉弓、胸降主动脉、腹主动脉;Ⅱ型:原发破口位于升主动脉,夹层累及升主动脉,少数可累及主动脉弓;Ⅲ型:原发破口位于左锁骨下动脉以远。根据主动脉及主动脉弓以下撕裂范围、缺血受损组织功能障碍不同,临床表现复杂多样。典型AD症状为胸部或腹部持续性撕裂样疼痛。不典型AD可能以心脏并发症、相关脏器灌注不良为主要临床表现。
有研究显示,AD各靶器官受累概率为四肢10%~20%,肾脏15%,心肌10%,脑5%~15%,肠道及脊髓3%[4]。AD累及心脏并发症时可有以下情况:(1)夹层导致主动脉根部扩张等可引起主动脉瓣关闭不全,可出现心力衰竭甚至心源性休克。(2)夹层累及冠状动脉开口可导致急性心肌梗死或恶性心律失常[5]。AD累及冠状动脉的发生率为6%~19%,而夹层造成的冠状动脉灌注不良被误诊为急性冠状动脉综合征的概率高达80%,常累及右冠状动脉[6-8]。故临床上常与急性心肌梗死进行鉴别。(3)夹层假腔渗漏或夹层破入心包可引起心包积液或心包压塞。当夹层撕裂至颈总动脉时可引起脑缺血,可表现为晕厥、意识障碍、癫痫发作等。当病变影响肋间动脉、腰动脉、根动脉、Adamkiewicz动脉时导致脊髓缺血,出现截瘫[9]。夹层累及腹主动脉并影响肠系膜动脉时可出现腹痛、呕吐、血便等急腹症表现,累及脾动脉可导致脾梗死[10],累及肾动脉时可出现血尿、无尿、肾功能异常。我国最大的AD注册登记研究数据显示,1 582例急性AD患者中有92.3%患者出现疼痛,其中非典型疼痛占5.0%(头颈部疼痛占2.4%,肢体疼痛占2.6%),无痛患者仅仅为7.7%。此外,在该回顾研究中,以晕厥为表现的患者占3.5%,发生充血性心力衰竭占0.3%[11],但在该文献中并未描述其他相关脏器灌注不良表现发生率。
AD可有下述各种表现,如心力衰竭、心律失常、心肌梗死、晕厥、癫痫发作、截瘫、消化道症状(恶心、呕吐、便血)、少尿、血尿等,当不伴胸部或腹部持续性疼痛,或疼痛不剧烈时,容易出现误诊、漏诊。临床上,大约15%~43%急性AD患者接诊时被考虑为其他疾病,例如急性冠状动脉综合征、心包炎、肺栓塞、胆囊炎等[12-13]。
当临床上疑似AD时,结合高水平D-二聚体对非典型症状的评估可用于决定对这些患者进行即时CT或CTA检查,从而提高诊断效率[14]。D-二聚体可用于早期诊断AD或排除AD。发病24 h内,当D-二聚体达到临界值500 μg/L时,诊断急性AD的灵敏度、特异度分别为1.00、0.67,因此,可作为急性AD诊断的排除指标,但D-二聚体阴性也不能除外主动脉溃疡或壁问血肿可能[2]。当AD患者D-二聚体阴性(定义为D-二聚体<500 μg/L),对其可进行主动脉夹层检测风险评分,主动脉夹层检测风险评分<1,心脏超声检查也无AD的间接征象(包括心包积液、扩张的主动脉根部和主动脉瓣关闭不全),那么基本可排除AD[15-16]。除上述实验室检测外,相关影像学检查(如胸部X线、超声心动图)等可帮助鉴别。AD患者的胸部X线检查异常,可表现为主动脉弥漫性扩大、气管向右移位、胸腔积液和心脏扩大、主动脉钙化征阳性(主动脉壁钙化向内移位超过10 mm)[17-18]。对于患者血流动力学指标不稳定,无法有条件行CT检查时,心脏超声可作为首选检查,且经食管超声心动图检查在诊断AD上优于经胸超声心动图检查。本院收治3例不典型AD患者,例1、例3以急腹症为主要表现。例1除了腹痛症状外还有便血症状,需与溃疡性结肠炎、消化道肿瘤等疾病进行鉴别,患者既往就诊史提示主动脉瘤样改变,不除外AD可能,完善腹部增强CT发现AD。例3患者于少量饮酒后出现全腹痛,有明显腹膜刺激征,血淀粉酶升高,全腹CT平扫示胰腺肿大伴渗出,外院首诊医师诊断为胰腺炎,但治疗过程中患者腹痛不缓解,且出现肝衰竭,肾功能不全,无法单纯用胰腺炎解释,结合D-二聚体明显升高,考虑可能AD撕裂至肝动脉、肠系膜上动脉进而引起供血范围相应脏器功能不全/衰竭(肝衰竭、急性肾功能不全、急性胰腺炎),本院进一步完善主动脉CTA检查证实为AD。例2主要以轻微胸闷不适,但伴严重低血压,四肢血压偏差大,D-二聚体明显升高,结合病史不除外AD,完善主动脉弓CTA检查明确诊断。经过3例患者的诊疗,笔者总结如下:(1)AD缺乏特异性表现,临床医师要提高对本病的警惕性和认识程度,对于出现急性腹痛、恶心、呕吐以及伴有其他系统症状患者应考虑AD的可能。(2)全面分析患者的临床表现、检验、影像学检查结果等资料,当无法完全解释患者病情时,需考虑是否合并其他疾病。(3)对于疑似AD患者而言,应及时行CTA,D-二聚体、胸部X线、心脏超声等检查可作为辅助手段来帮助鉴别。

