分子印迹聚合物吸头整体柱固相萃取结合GC-MS测定化妆水中的局麻药∗
赵丹妮,吴贝贝,吐尔洪·买买提†
(1.新疆大学 化学学院 省部共建碳基能源资源化学与利用国家重点实验室,新疆 乌鲁木齐 830017;2.中国石油化工股份有限公司 西北油田分公司工程技术研究院,新疆 乌鲁木齐 830000)
0 引言
化妆品已成为人们日常生活中的必需品之一,其质量安全问题备受关注.我国《化妆品安全技术规范(2015年版)》[1]中明确列出了化妆品限用组分(47项)和禁用组分(1 388项),其中局部麻醉药(Local Anesthetics,LAs)、抗生素类、非甾体类抗炎药、糖皮质激素和性激素等均为化妆品原料中的禁用组分,若掺杂这些成分的产品被人们长期使用,会导致皮肤产生不良反应,如皮肤萎缩、红斑和瘀点等[2].其中LAs是在保持意识清醒的情况下,引起可逆的局部组织痛觉消失,在临床医用和治疗各种急性、慢性疼痛症状中不可或缺.然而,LAs的过量或不当使用都会使人产生中毒反应[3−5],因此在我国LAs是化妆品中禁用的组分.为保护消费者的安全,建立可靠的化妆品中禁用组分检测分析方法是非常必要的.为对化妆品中LAs组分进行有效的萃取和富集,选择优良的吸附填料也极为重要.目前商品化填料众多,如硅胶基质、无机基质和离子交换基质材料等,但这些填料的吸附作用相比分子印迹聚合物(Molecularly Imprinted Polymers,MIPs)选择性不高.
分子印迹技术(Molecular Imprinting Technique,MIT)因具有对分析物提供强大的分子识别功能而受到广泛关注.MIPs是基于MIT制备的一种具有预定分子识别特性的高分子化合物,可实现对模板分子及其结构类似物选择性识别和结合[6].由于MIPs具有结构可预见性、识别特异性、应用广谱性、理化稳定性、重复性和低成本等优点,被广泛应用于生物、环境和食品样品中目标物的提取与纯化,并发展为分子印迹固相萃取(MISPE)[7].本文以布比卡因为模板分子制备MIPs,将其作为填料,采用共烧结法制备了吸头整体柱,结合GC-MS建立了化妆水中5种LAs的分离分析方法.
1 材料与方法
1.1 试剂与材料
试剂:盐酸布比卡因、二甲基丙烯酸乙二醇酯、甲基丙烯酸、盐酸普鲁卡因均购自上海梯希爱化成工业发展有限公司,丁卡因、苯佐卡因、盐酸普鲁卡因胺、偶氮二异丁腈均购自北京百灵威科技有限公司,利多卡因购自上海西格玛奥德里奇贸易有限公司,二氯甲烷购自国药集团化学试剂有限公司,甲苯购自成都科隆化学品有限公司;上述试剂均为分析纯.甲醇和乙腈购自美国SIGMA公司,均为HPLC级别;超高分子量聚乙烯购自东莞安特生物技术有限公司.
材料:化妆水由乌鲁木齐食品药品监督管理局提供.MCX小柱和C18小柱购自上海安谱实验科技股份有限公司,HLB小柱购自上海楚定分析仪器有限公司.
1.2 仪器与设备
气相色谱-质谱联用仪(5977A/7890B,安捷伦科技有限公司)、液相色谱(LC-20AD,日本岛津公司)、傅里叶变换红外光谱仪(EQUINOX 55,德国布鲁克公司)、扫描电子显微镜(SU 8010,日本日立公司)、超纯水仪(UPT-1-10T,成都优普仪器设备有限公司)、电子分析天平(BS210S,北京赛多利斯公司)、SPE装置(HX-SPE 12,武汉恒信世纪科技有限公司)、pH计(FE-28,上海梅特勒-托利多国际贸易有限公司)、离心机(HC-2062,安徽中科中佳科学仪器有限公司),吸头购自上海泰坦科技股份有限公司.
1.3 实验方法
1.3.1 储备液的制备
盐酸布比卡因储备液:称取0.025 0 g盐酸布比卡因于25 mL容量瓶中,甲醇溶解定容,制得1 000 mg·L−1盐酸布比卡因储备液,4℃保存.取出0.1 mL储备液于10 mL容量瓶中,用一定比例乙腈/水定容,制得工作溶液.
丁卡因储备液:称取0.025 0 g丁卡因于25 mL容量瓶中,甲醇溶解定容,配制成浓度为1 000 mg·L−1的丁卡因储备液.
混合LAs标准储备液:称取盐酸普鲁卡因胺、利多卡因各0.050 0 g或盐酸普鲁卡因、苯佐卡因、布比卡因各0.040 0 g于50 mL容量瓶中,甲醇溶解定容,摇匀备用,配制成浓度为1 000 mg·L−1和800 mg·L−1的混合LAs储备液.
1.3.2 布比卡因游离碱的制备
布比卡因游离碱的制备参照文献[8],取盐酸布比卡因(1.000 g)溶于80 mL水中,超声溶解,制成水溶液,将其过滤滤液用饱和Na2CO3将pH值调至11.00,使其沉淀完全,将其完全转移至分液漏斗中,加二氯甲烷进行萃取(3×30 mL),收集下层溶液,再加入适量无水硫酸钠进行干燥,过滤后收集溶液于圆底烧瓶中,通过旋转蒸发仪进行减压蒸发,得到布比卡因游离碱(即布比卡因),室温保存备用.
1.3.3 布比卡因MIPs的制备
将布比卡因(0.67 mmol,192.300 0 g)作为模板分子,溶解在11.50 mL无水甲苯中,加入功能单体甲基丙烯酸(8.20 mmol,0.705 9 g),超声5 min使其混匀.再加入交联剂二甲基丙烯酸乙二醇酯(44.10 mmol,9.915 0 g)和引发剂偶氮二异丁腈(0.48 mmol,0.079 0 g),超声10 min,通氮气5 min以去除聚合物瓶中的氧气,在氮气气氛下立即密封,紫外灯(6×8 W,365 nm)15℃下聚合24 h,最后得到白色的整体硬质聚合物,将其进行研磨,过筛(38∼75μm),用甲醇进行索氏提取洗去模板分子和未反应的单体,收集聚合物颗粒,用甲醇进行沉降以去除细小的颗粒.最后聚合物颗粒在60℃下干燥备用.非分子印迹聚合物(NIPs)的制备除了不加模板分子,其它条件与MIPs制备条件一致.
1.3.4 共烧结法制备吸头整体柱SPE装置
共烧结法制备吸头整体柱的方法与本课题组前期工作一致[9].将200μL吸头尖端热封得到吸头填充柱,调整吸头接口为注射器的适配接口,将MIPs填料和粘结剂(超高分子量聚乙烯)以40/60(w/w)混合装入吸头内部,吸头内混合粉末总质量为40 mg(16 mg MIPs填料,24 mg粘结剂),准确控制温度至150℃,于加热模块共烧结30 min,冷却后取出将封闭的尖端去除,即得吸头整体柱SPE装置,室温储藏备用.
1.3.5 样品处理及SPE净化过程
化妆水处理过程:称取1.000 0 g化妆水于试管中,添加5 mL乙腈,涡旋振荡5 min,超声提取10 min,4 000 r·min−1离心5 min后,取上清液于50 mL容量瓶中,以磷酸缓冲液(pH=9.00)定容,过0.22μm滤膜,室温储藏备用.
吸头整体柱用3 mL甲醇活化,1 mL化妆水样品上样,3 mL水淋洗,1 mL甲醇进行洗脱,收集洗脱液,过0.22 μm滤膜,进行GC-MS检测.
1.3.6 检测条件
HPLC:色谱柱为Waters XBridge C18柱(4.6 mm×250 mm,5μm).流动相A为乙腈,流动相B为pH=6.80的磷酸缓冲液,A和B的比例(65/35,v/v)固定.检测波长为230 nm,流速为1.0 mL·min−1,进样量为20μL[10].
GC:色谱柱为DB-5MS石英毛细管柱(30 m×0.25 mm,0.25μm).仪器参数设定为进样口温度280℃,载气为He,线速度为44.0 cm·sec−1,进样量为1μL,不分流进样,0.5 min后打开分流阀,分流比为5︰1;升温程序为初始温度120℃保持1 min,并以10℃·min−1升至280℃,保持12 min[11].
MS:电子轰击离子源,离子源温度为200℃,电子能量为70 eV,电子倍增器电压为0.70 kV,传输线温度为250℃,扫描模式为选择离子扫描(SIM)[11].
1.3.7 计算公式

式中:R为回收率,E为吸附率.Celu为洗脱液中目标分析物的浓度;Ce为上样溶液流经吸头后溶液中目标分析物的浓度;Caq为上样溶液中目标分析物的浓度;单位均为mg·L−1.Vaq为上样溶液的体积,Velu为洗脱溶液的体积;单位均为L.
2 结果与讨论
2.1 FTIR光谱表征
FTIR光谱广泛应用于物质的化学结构分析.对合成的MIPs、NIPs、模板分子以及含有模板分子的MIPs进行了表征,结果如图1所示.1 631 cm−1处为C=C的伸缩震动峰,聚合液中存在大量具有双键结构的功能单体、交联剂,但此处的吸收峰明显较小,表明功能单体(甲基丙烯酸)和交联剂(二甲基丙烯酸乙二醇酯)发生了聚合反应;1 230 cm−1处为苯环C-H骨架弯曲振动峰,对比图1(a∼d)发现,仅含有模板分子的MIPs和模板分子显示该峰,而MIPs曲线上并未出现,表明图1(c)中含有模板分子,而图1(b)中不含模板分子;洗去模板分子的MIPs和NIPs的FTIR谱图相似,说明模板分子被去除,可用于后续实验.
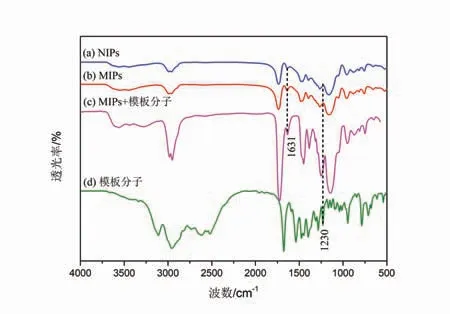
图1 FTIR谱图
2.2 分子印迹聚合物整体柱吸附性能的表征
2.2.1 吸附选择性
吸附选择性是考察MIPs的重要指标.选择利多卡因、盐酸普鲁卡因、苯佐卡因、盐酸普鲁卡因胺为布比卡因的结构类似物,分析了MIPs对布比卡因的吸附选择性.由图2(a)可知,MIPs对其具有良好的特异性吸附作用,同时利多卡因、盐酸普鲁卡因胺、苯佐卡因、盐酸普鲁卡因的结构与布比卡因具有相似性,易于嵌入MIPs孔穴与结合位点上的羧基形成氢键,从而具有相似的结合性能.因此,制备的MIPs可用于布比卡因及其结构类似物的吸附.
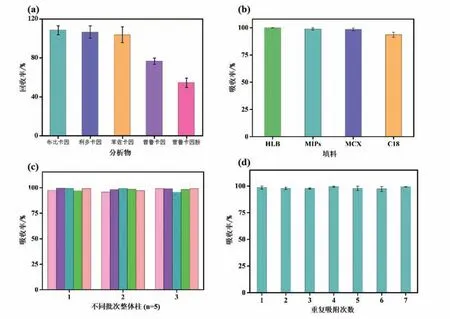
图2 布比卡因MIPs整体柱吸附性能分析
2.2.2 与商品化填料对比
为评价MIPs与商品化填料萃取性能的差异,将商品化填料HLB、MCX、C18与粘结剂通过共烧结制备的吸头整体柱与MIPs制备的整体柱进行对比.HLB填料表面键合了不同的官能团,吸附过程中对极性和非极性化合物均有保留作用;MCX填料具有分析物与吸附剂之间的离子交换作用及反向保留作用,且MCX填料在极端pH下仍具有较好的稳定性,对强极性化合物具有较好的萃取效果;C18填料具有疏水作用,对非极性化合物具有较好的萃取作用.由图2(b)可知,MIPs整体柱与商品化SPE填料(HLB)的萃取效果相近,萃取效果为HLB>MIPs>MCX>C18.
2.2.3 吸头整体柱批内批间重现性
3批次同样条件下,每次共烧结制备了5根吸头整体柱,以分析共烧结方法制备的同一批次和不同批次吸头整体柱的萃取性能差异.由图2(c)可知,批内的RSDs(n=5)为1.15%,批间的RSDs(n=3)为1.29%,表明批内与批间的整体柱均具有较好的制备重现性,可用于后续实验.
2.2.4 吸附重复性
对MIPs进行了重复吸附及再生,测试了MIPs的重复使用性能.由图2(d)可知,制备的MIPs在使用7次后,依然具有较好的吸附性能,表明MIPs具有良好的重复性,这对节约成本、提高使用效率具有较大的实际意义.
2.3 SPE条件优化
2.3.1 上样溶剂
为探究MIPs和NIPs对布比卡因的结合能力,以吸附量及印迹指数(IF)为指标,分析了不同比例的乙腈/水溶剂对其吸附作用的影响,印迹指数为MIPs对布比卡因的吸附量与NIPs对布比卡因的吸附量之比.由图3(a)可知,对比不同比例的乙腈/水对MIPs和NIPs吸附量的影响,发现MIPs的吸附容量远大于NIPs,即MIPs中存在大量与模板分子相匹配的印迹空穴,相比NIPs表现出更好的吸附行为.当乙腈/水为20/80(v/v)时,MIPs的IF最高(3.53).为进一步分析乙腈/水在20/80(v/v)比例附近对MIPs吸附率的影响,对10/90、20/80比例进行了对比,由图3(b)可知,两个比例对MIPs吸附率的影响并不显著,但随乙腈含量升高吸附率略有下降,因此选择乙腈/水(10/90,v/v)作为上样溶剂用于下一步实验.
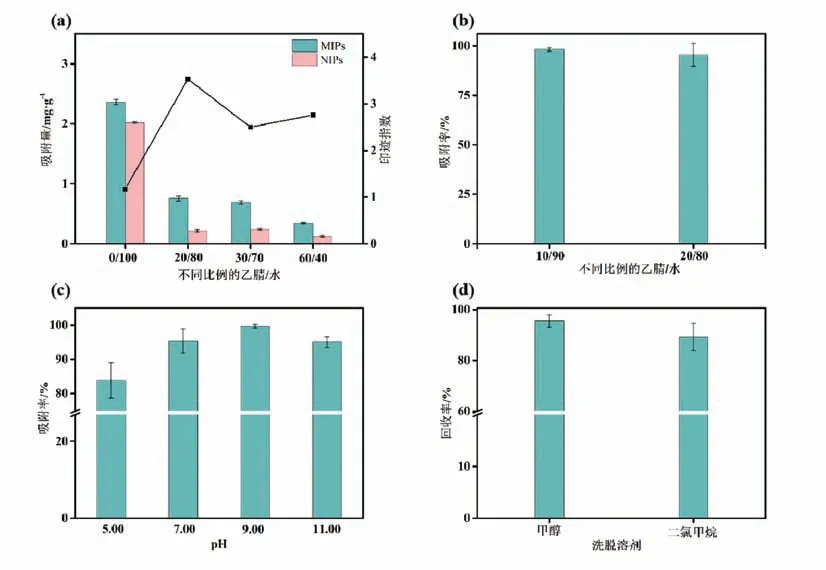
图3 MISPE条件的优化
2.3.2 上样溶液pH
SPE过程中溶液pH影响着分析物的状态,因此分析了不同pH(5.00∼11.00)对萃取效率的影响,结果如图3(c)所示.pH在5.00∼9.00范围内,吸附率逐渐升高;pH在9.00∼11.00范围内,萃取效率呈下降趋势,这可能是由于pH增加,布比卡因形成脱质子形式[12].故选择pH为9.00进行下一步实验.
2.3.3 洗脱溶剂
SPE过程中洗脱溶剂的选择至关重要,须确保分析物从填料中尽可能多地洗脱下来以获得较高的回收率.分别以二氯甲烷和甲醇作为洗脱溶剂对其洗脱能力进行分析,由图3(d)可知,当洗脱溶剂为甲醇时其回收率优于二氯甲烷,目标分析物能从填料中更好地洗脱下来,故选择甲醇为洗脱溶剂用于后续实验.
2.4 SPE与GC-MS联用对化妆水样品的测定
2.4.1 方法的建立及评价
在1.3.6节的GC-MS实验条件下,以丁卡因(5.0 mg·L−1)为内标物,对5种化合物进行了分析,总离子流图如图4所示,该条件下得到了较好的分离效果,GC-MS选择离子监测表(SIM)见表1.
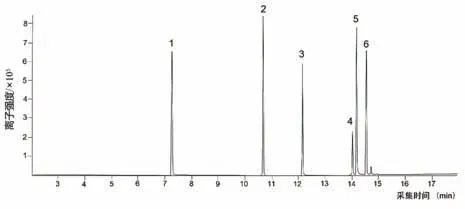
图4 混合标准溶液的总离子流图
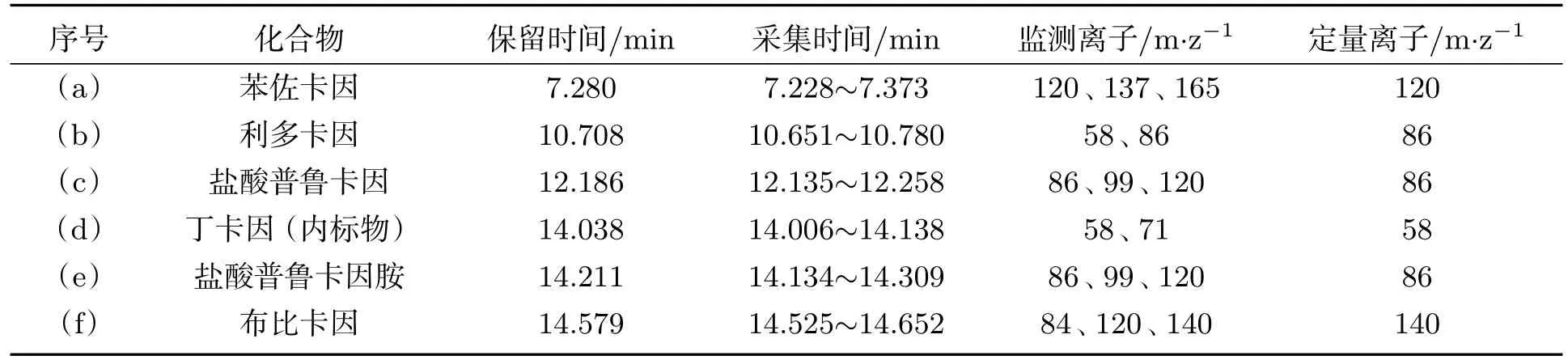
表1 GC-MS选择离子监测表(SIM)
从线性范围、相关系数、LODs、LOQs对本文建立的方法进行验证.制备0.5∼50.0 mg·L−1(利多卡因和盐酸普鲁卡因胺)和0.4∼40.0 mg·L−1(苯佐卡因、盐酸普鲁卡因和布比卡因)范围内的7个浓度的标准曲线.以5.0 mg·L−1的丁卡因为内标物,对分析物与内标物响应值之比y、分析物与内标物浓度之比x进行线性关系分析,结果见表2.5种LAs在一定范围内线性关系良好,可用于定量分析.
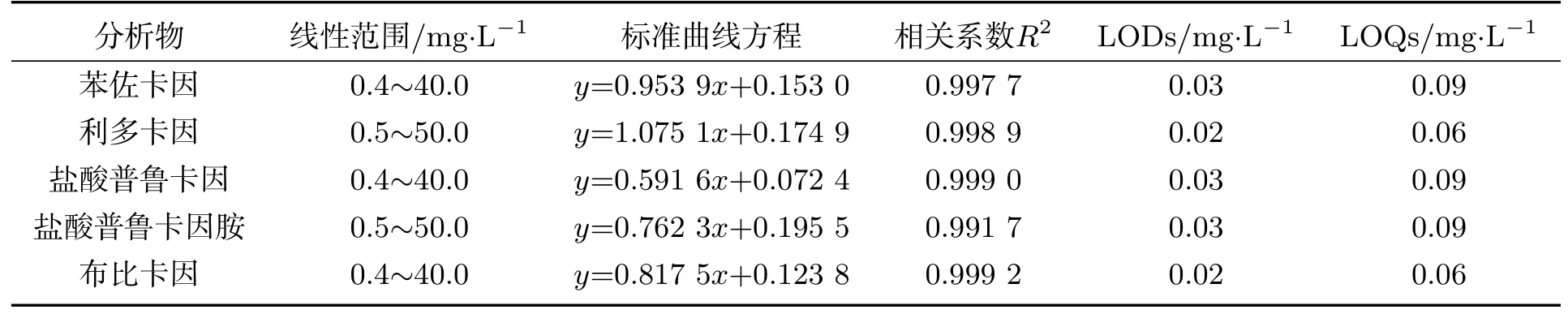
表2 GC-MS方法学参数
为检测化妆水中的5种LAs,将化妆水及加入标准物质的样品按照1.3.5节的方法进行预处理,GC-MS检测吸头整体柱SPE后的洗脱液,结果见表3,除盐酸普鲁卡因胺外,其它分析物的回收率为76.58%∼121%,RSDs<8.06%.
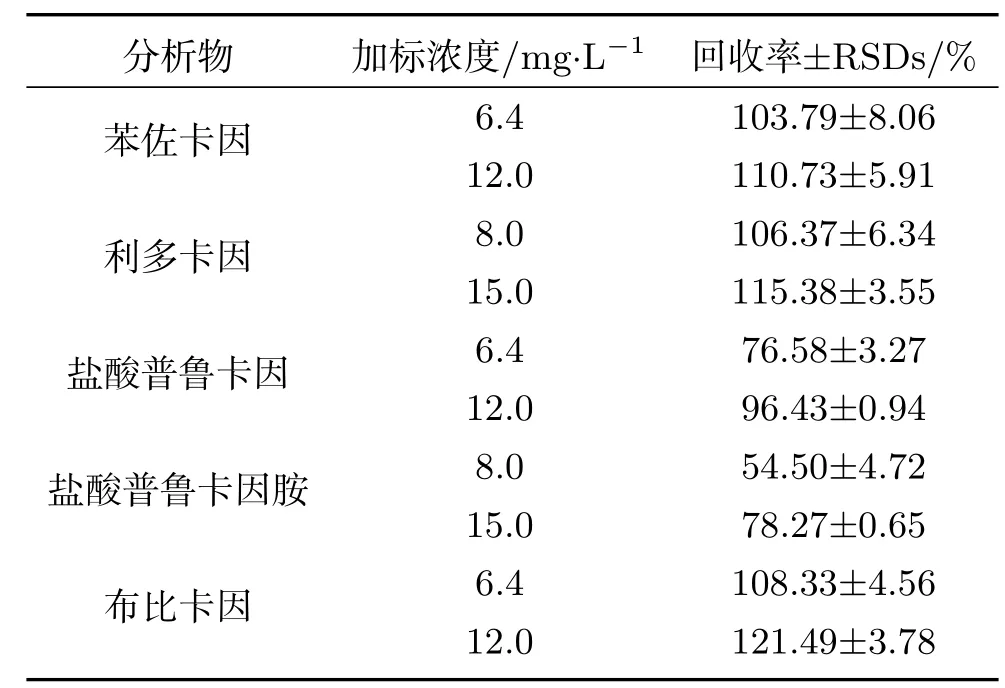
表3 化妆水中5种LAs的加标回收率与RSDs值(n=3)
2.4.2 实际样品的测定
化妆品成分复杂,样品中含有的基质较多.对比图5经SPE处理前后化妆水样品HPLC图发现,经SPE处理后化妆水样品中杂质含量相对减少.由图6(a)可知,经PT-SPE前处理后的样品中除了丁卡因(内标物)外,其它5种LAs均未检出.由图6(b∼c)可知,在不同的加标浓度下,目标分析物均可检出,杂质峰很少,得到了“干净”的谱图,表明该整体柱具有较好的净化作用.
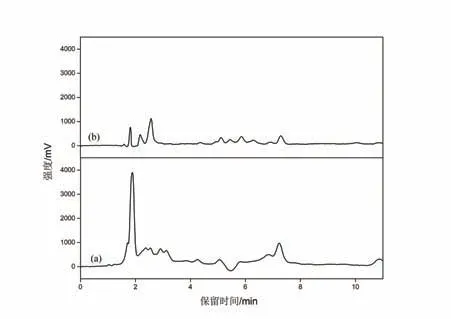
图5 化妆水样品经吸头整体柱处理前(a)和处理后(b)的HPLC图
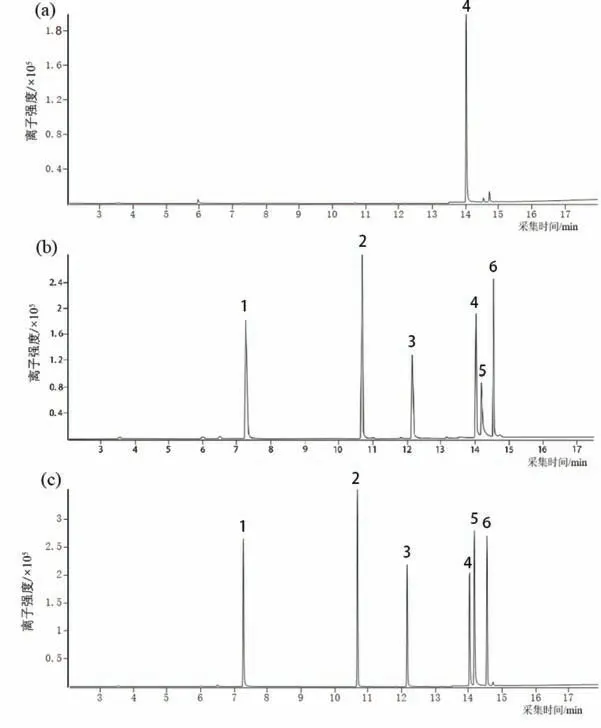
图6 经吸头整体柱处理后的洗脱液总离子流图
2.4.3 方法对比
将本文建立的方法与其它测定实际样品中LAs的分析方法从样品基质、检测仪器、线性范围、回收率和LOQs等方面进行对比,结果见表4.本文方法获得了较好的回收率并具有相对较低的LOQs,且对比行业标准《法庭科学生物检材中利多卡因、罗哌卡因和布比卡因检验气相色谱-质谱和液相色谱-质谱法(GA/T 1613―2019)》[13]中采用的固相萃取方法对洗脱液通过GC-MS进行测定,其检出限与本文方法的检出限相近,且本文制备的整体柱可替代较昂贵的进口HLB小柱并具有较低的传质阻力,使整个分析过程经济、绿色,为实际样品中含有此类分析物提供了一种可参考的样品前处理方法.

表4 本文建立的方法与其它方法萃取和检测LAs的对比
3 结论
以分子印迹聚合物吸头整体柱固相萃取结合GC-MS,建立了一种化妆水中5种LAs的检测方法.该方法前处理简便快捷、易于操作,净化效果好,目标分析物回收率高且具有较高的准确性.该PT-SPE整体柱具有较好的净化作用,提高了对目标物的识别能力.为化妆水中LAs的监控提供了一种灵敏度高、选择性好的分析方法,具有较高的应用价值和前景.

