基于柑橘叶斑驳病毒的表达载体构建及应用
张琦,段玉,苏越,蒋琪琪,王春庆,宾羽,宋震
基于柑橘叶斑驳病毒的表达载体构建及应用
张琦,段玉,苏越,蒋琪琪,王春庆,宾羽,宋震
西南大学柑桔研究所/国家柑桔工程技术研究中心,重庆 400712
【目的】构建基于柑橘叶斑驳病毒(citrus leaf blotch virus,CLBV)的表达载体,通过系统表达抗菌肽提高植物抗病性,为柑橘溃疡病、柑橘黄龙病等病害的防控提供新型技术手段。【方法】基于前期构建的侵染性克隆pCY-CLBV201,在外壳蛋白基因终止子后插入亚基因组启动子序列及多克隆位点,构建病毒表达载体pCLBV202。在多克隆位点插入绿色荧光蛋白(green fluorescent protein)基因(),通过农杆菌介导接种、荧光观察验证pCLBV202-GFP表达GFP的情况。克隆天蚕的抗菌肽(cecropin B,CB)基因并构建重组载体pCLBV202-CB,通过农杆菌介导分别注射接种本氏烟和真空浸润接种柑橘实生苗,筛选阳性植株并分别注射接种和根灌接种烟草青枯病菌及针刺离体叶片接种柑橘溃疡病菌,同时设空载体接种植株为对照,通过症状观察、发病率及病情指数评价接种植株的烟草青枯病抗性;通过柑橘叶片的病斑数量、发病率及菌落浓度评价其溃疡病抗性。【结果】pCLBV202-GFP接种烟草和尤力克柠檬后,均可以在系统新叶上观察到绿色荧光,在烟草上表现更为明亮,说明基于CLBV的表达载体构建成功。接种青枯病菌后,处理组(pCLBV202-CB)较对照组(pCLBV202)发病时间延迟4 d。在接种后第24天(24 dpi),处理组发病率为14.3%,对照组发病率为100%,差异显著。处理组相对于对照组的抗性指数为-2.66,抗性评价为高抗,表明利用pCLBV202-CB系统表达CB增强了对烟草青枯病的抗性。尤力克柠檬叶片针刺接种柑橘溃疡病菌,7 dpi时,处理组病斑数为47个,发病率为43.5%,对照组病斑个数为73个,发病率为67.6%。菌群数变化检测发现,处理组菌群数小于对照组菌群数,表明利用pCLBV202-CB系统表达CB增强了尤力克柠檬的溃疡病抗性。【结论】构建了基于CLBV的病毒表达载体pCLBV202。利用pCLBV202在本氏烟和柑橘中系统表达CB可以提高植株对细菌性病害的抗性,这为柑橘细菌性病害的防控提供了新技术。
柑橘叶斑驳病毒;病毒表达载体;抗菌肽;抗病性
0 引言
【研究意义】柑橘是一种重要的经济作物。近几十年来,受全球气候变暖等不利环境因素的影响,病虫害尤其是黄龙病、溃疡病对全球柑橘产业构成了严重威胁[1-2]。抗病育种是应对病虫害危害的重要途径。目前,通过转基因技术已获得许多抗病性显著增强的柑橘转基因材料[3],导入的抗病基因主要为来自昆虫的抗菌肽基因和植物的抗病基因。抗菌肽作为天然抗生素可以直接杀死微生物[4],而天蚕素B(cecropin B,CB)是一种灭菌活性很强的抗菌肽,在柑橘转基因抗病育种和病害防控中均得到了应用[5]。但柑橘转基因技术难度大、周期长,并受到品种种类的限制。植物病毒表达载体作为一类极具潜力的外源基因表达平台,可以快速在植物体内表达抗病基因,有望成为一种新型的病害防控手段。【前人研究进展】目前,抗菌肽基因在柑橘中的表达研究取得了一定进展,已将其成功导入多个品种的柑橘植株[6-7]。刘琦琦[8]研究表明,通过转基因表达CB的柑橘植株能显著提高其对柑橘溃疡病的抗病能力。果树病毒载体如柑橘衰退病毒(citrus tristeza virus,CTV)[9]、苹果潜隐球形病毒(apple latent spherical virus,ALSV)[10]等能侵染果树等多年生的植物,可用于在果树等多年生植物中系统表达抗病基因[11]。CTV载体在柑橘上表达外源基因具有表达量高、稳定性强等优点[12-13],但其会通过蚜虫传播,存在病毒病扩散的风险。柑橘碎叶病毒(citrus tatter leaf virus,CTLV)已被构建成侵染性克隆[14-15]。但CTLV侵染以枳及其杂种为砧木的柑橘植株后引起嫁接部位肿大及褐色坏死,导致树体生长衰弱和产量降低[16-17]。柑橘叶斑驳病毒(citrus leaf blotch virus,CLBV自然寄主广泛,不仅能侵染大多数柑橘品种,也可侵染猕猴桃、牡丹、桑葚等其他物种[18-20],并且在柑橘多数栽培品种中不引发明显症状,无昆虫传播媒介,适宜于植物病毒表达载体的开发[21]。目前,国外学者确定了CLBV外壳蛋白基因亚基因组RNA启动子位点[22-23]。Vives等将CLBV的全长cDNA插入改进后的载体中,获得了CLBV的全长侵染性克隆,并构建了病毒表达载体[10,24]。国内西南大学崔甜甜[25]构建了适用于农杆菌介导的CLBV侵染性克隆。【本研究切入点】在前期构建获得CLBV侵染性克隆的基础上,通过在其外壳蛋白(coat protein,CP)基因终止子后插入亚基因组启动子序列及多克隆位点构建表达载体并利用该载体在本氏烟()和柑橘中系统表达抗菌肽,进而进行抗病性评价。【拟解决的关键问题】构建基于CLBV的病毒表达载体pCLBV202,通过在烟草与柑橘中系统表达CB,提高植株抗病性,为柑橘细菌性病害的防控提供新方法。
1 材料与方法
试验于2019—2021年在西南大学柑桔研究所脱毒课题组完成。
1.1 试验材料
尤力克柠檬()、本氏烟、柑橘叶斑驳病毒的侵染性克隆(pCY-CLBV201)、烟草青枯病菌()、柑橘溃疡病菌(subsp.,)均由西南大学柑桔研究所国家柑桔苗木脱毒中心提供。
1.2 引物设计与基因合成
根据CLBV201侵染性克隆酶切位点的特性,利用Primer 5.0软件设计扩增亚基因组启动子序列的特异性引物92bpf1/92bpr1,以及用于插入载体目的片段检测、扩增与测序的引物(3+1)F/(3+1)R。CLBV的通用检测引物参考段玉等[26]的CLBV1F/CLBV5R。CB基因由上海英潍捷基贸易有限公司合成。利用引物5-F/5-R和3-F/3-R分别扩增I和I双酶切pCY-CLBV201所获小片段的5′端(1 904 bp)和3′端(658 bp)序列。gfpf1/gfpr1用于的扩增,引物序列如表1所示。

表1 试验所用引物序列
1.3 pCLBV202表达载体构建
1.3.1 pCLBV202表达载体构建原理 采用I和I双酶切pCY-CLBV201,将酶切下的小片段2 563 bp,自位点1 904处分成两段,分别命名为5′端(1 904 bp)和3′端(658 bp)。利用引物5-F、5-R和3-F、3-R分别扩增5′端和3′端。CLBV外壳蛋白亚基因组启动子序列大小92 bp,位于CLBV基因组的6 789—6 880,参照Agüero等[24]设计引物92bpf1/92bpr1。利用设计的带同源臂的引物gfpf1/gfpr1从本实验室的TuMV-GFP扩增回收基因片段。在设计引物时,除了同源臂外,在的两端添加I酶切位点,便于目的基因的更换,具体如图1所示。
1.3.2 CLBV201质粒酶切 将阳性的侵染性克隆菌株pCY-CLBV201,按照TIANprep Mini Plasmid Kit试剂盒的质粒提取步骤提取质粒,酶切体系:pCY- CLBV201质粒1.0 µg,10×Cutsmart Buffer 5 µl,I和I各1 µl,加入无菌水补足50 µl,25℃温育30 min。酶切产物用0.8%的琼脂糖凝胶电泳分离,进行切胶回收。
1.3.3 亚基因组启动子序列、载体酶切片段、、片段的扩增与重叠 PCR扩增体系:2 µl模板,2×PrimeStar Max反应液10 µl,上下游引物各0.2 µl,加入无菌水7.2 µl。将5个片段单独扩增出来,通过2次重叠PCR连接4个片段。92 bp+gfp重叠PCR:以92 bp亚启动子和gfp胶回收产物各1 µl为模板,2×PrimeStar Max反应液10 µl,加入无菌水6 µl,94℃预变性5 min,94℃变性5 s,60℃解链30 s,72℃延伸90 s,10个循环后立即将反应液置于冰上,向反应体系中加入引物92bpf1/gfpr1各1 µL,置于PCR仪,94℃预变性5 min,94℃变性30 s,62℃解链30 s,72℃延伸90 s,35个循环,72℃再延伸5 min,电泳验证后切胶回收。5′端+92 bp+gfp +3′端重叠PCR:以92 bp+gfp、5′端片段、3′端片段各1 µl,2×PrimeStar Max反应液10 µl,加入无菌水6 µl,94℃预变性5 min,94℃变性5 s,60℃解链30 s,72℃延伸90 s,10个循环后立即将反应液置于冰上,向反应体系中加入引物5-F/3-R各1 µL,置于PCR仪,94℃预变性5 min,94℃变性30 s,62℃解链30 s,72℃延伸90 s,35个循环,72℃再延伸5 min,电泳验证后切胶回收。
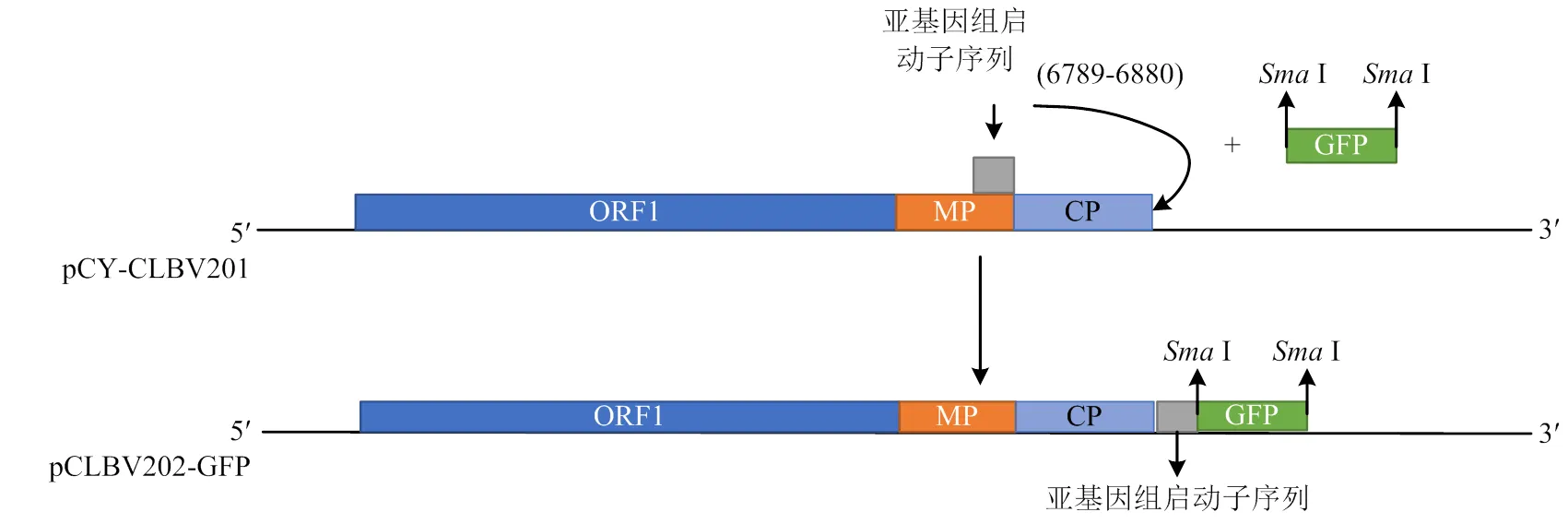
图1 pCLBV202-GFP表达载体结构图
1.3.4 pCLBV202-GFP、pCLBV202-CB重组表达载体的构建 目的片段100 ng,pCY-CLBV201酶切质粒200 ng,5×In-Fusion HD Enzyme Premix反应液2 µL,加入无菌水补足10 µl,在50℃中反应50 min,置于冰上,再将连接产物转化大肠杆菌(),将测序成功的大肠杆菌提取质粒,电转农杆菌。菌液PCR体系:菌液2 µl,2×Taq Master Mix反应液10 µl,上下游引物CLBV1F/CLBV5R各0.4 µl,无菌水7.2 µl。菌液PCR程序:94℃预变性5 min,94℃变性30s,55℃解链30 s,72℃延伸35 s,35个循环,72℃再延伸5 min。
1.3.5 农杆菌介导接种本氏烟和尤力克柠檬 农杆菌菌液在含Rif+和Kan+的平板上划线,28℃培养2 d。挑取单克隆于Rif+和Kan+的LB培养液中,28℃,220 r/min振荡培养2 d。按照1﹕50的比例将活化后的农杆菌菌液接种于农杆菌扩繁培养基中,相同条件下培养菌液至OD600=0.9—1.1。8 000 r/min离心8 min使菌液富集,用接种缓冲液悬浮(10 mmol·L-1MgCl2,10 mmol·L-1MES,200 µmol·L-1As),使其OD600为0.8—1.0,同时加入沉默抑制子P19表达克隆,使样品OD600≈1.0,沉默抑制子OD600≈0.5,黑暗静置2 h 备用。农杆菌注射接种:从叶背面注射本氏烟叶片,至直径约为1 cm。每菌株至少注射3株植物的3个叶片。农杆菌根灌接种:用7 mL离心管沿着本氏烟的根部浇灌5 mL农杆菌。农杆菌真空浸润:将清洗干净的柑橘幼苗放入接种菌液并置于真空干燥仪中,抽真空至压力-1.0—-0.8 kg·cm-2,保持5 min后快速释放压力并立即用无菌水冲洗,将植株移栽于土床中,28℃黑暗处理2 d,即可移栽于光照培养箱中。培养箱参数设置:光照时长16 h,23℃;黑暗8 h,20℃。待长出2—4片新叶后便可取样检测。
1.4 pCLBV202-CB对烟草青枯病的防治效果
1.4.1 pCLBV202-CB和pCLBV202接种本氏烟 本氏烟在长出第5片针叶后进行农杆菌注射接种,处理组pCLBV202-CB接种9株,对照组pCLBV202接种9株,具体接种步骤详见1.3.5。
1.4.2 烟草青枯菌活化与接种 将存于水中的青枯病菌涂布于TTC平板上,28℃培养48 h;挑取单克隆菌落接种于2 mL TTC培养基中,28℃250 r/min培养,监测菌液OD值,在OD值达到0.8之前停止培养细菌;转移1 mL菌液至1.5 mL离心管,8 000 r/min离心2 min,去上清,集沉淀;用10 mmol·L-1的MgCl2洗涤沉淀3次,离心,最后重悬青枯病菌于10 mmol·L-1MgCl2,OD=0.001备用。在处理组和处理组18 dpi时,接种烟草青枯病菌。每株进行注射叶片接种及根灌接种农杆菌菌液5 mL。
1.4.3 烟草青枯病病情统计 发病率(%)=(发病株数/调查总株数)×100;病情指数(DI)=[Σ(病情级数×此级菌株数)/(总级数×总株数)]×100;青枯病病情分级标准参照《烟草病虫害分级及调查方法》(GB/T 23222—2008)[27]。抗性指数RI=ln[DI/(100-DI)]-ln[DO/(100-DO)]。其中,DI指对照组病情指数;DO指处理组病情指数。RI≤0,表示高抗,用HR表示;0<RI≤1.00为抗病,用R表示;1.00<RI≤1.49为感病,用S表示,RI≥1.50为高感,用HS表示。
1.5 pCLBV202-CB对柑橘溃疡病的防治效果
1.5.1 pCLBV202-CB和pCLBV202接种尤力克柠檬 在播种柠檬长至8—10 d时,通过真空浸润处理组pCLBV202-CB 30株,对照组pCLBV202 30株,方法参照1.3.5。待柠檬植株长至30 d时,通过检测筛选pCLBV202-CB、pCLBV202阳性植株。
1.5.2 溃疡病菌离体针刺接种 取大小相近、生长状况相似的尤力克柠檬叶片,处理组3片,对照组3片。发病率(%)=(病斑个数/接种个数)×100;菌群数变化检测的具体操作参照Duan等[28]的方法。
2 结果
2.1 pCLBV202-GFP与pCLBV202-CB重组表达载体的构建
pCLBV202-GFP重组表达载体转入大肠杆菌DH10B后,进行菌液PCR检测,结果见图2-A,检测片段与目标片段大小一致。序列分析显示,在CP基因终止子后插入了92 bp的亚基因组启动子序列及其控制下的完整GFP开放读码框,GFP开放读码框两端分别包含一个I酶切位点,证明pCLBV202-GFP重组表达载体构建成功。使用I双酶切pCLBV202-GFP质粒构建pCLBV202-CB,转化大肠杆菌DH10B。菌液PCR检测结果如图2-B所示,获得大小约为732 bp的特异条带,符合目标基因片段大小,经序列分析后,确定pCLBV202-CB重组载体构建成功。
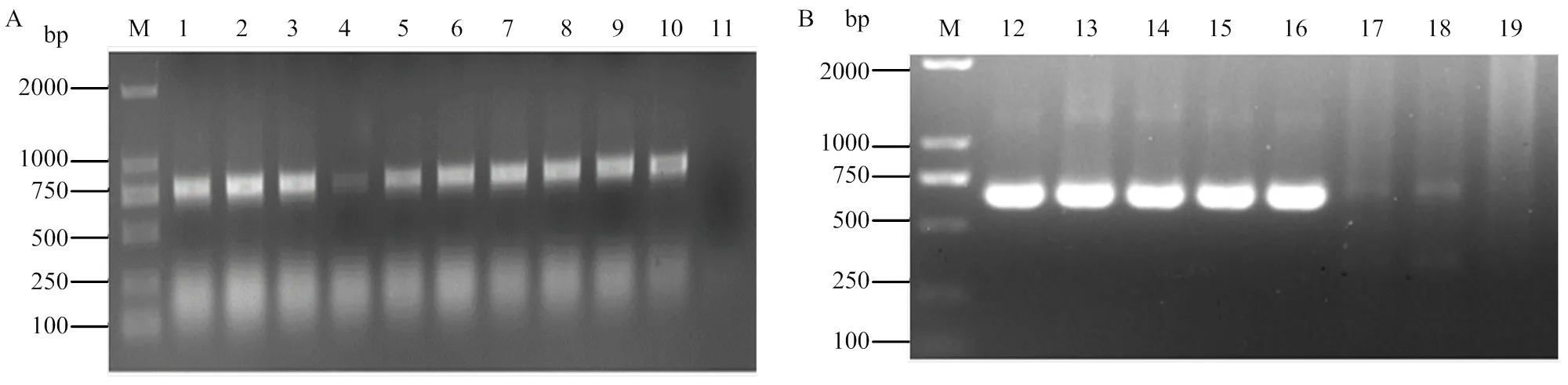
A:pCLBV202-GFP单克隆检测pCLBV202-GFP monoclonal detection;B:pCLBV202-CB单克隆检测pCLBV202-CB monoclonal detection。M:2000 bp标准分子量2000 bp molecular marker;1—10:pCLBV202-GFP转化大肠杆菌单克隆pCLBV202-GFP transformed E. coli clones;12—18:pCLBV202-CB转化大肠杆菌单克隆pCLBV202-CB transformed E. coli clones;11、19:水对照Water control
2.2 本氏烟和尤力克柠檬的荧光观察
本氏烟经注射接种含pCLBV202-GFP重组表达载体的农杆菌后,11 dpi时,茎和根部出现绿色荧光,在15 dpi时,系统新叶出现强烈的绿色荧光,表明pCLBV202-GFP在本氏烟植株中完成系统侵染。随后,在花中观察到绿色荧光,说明构建的pCLBV202-GFP能够在本氏烟植株中稳定表达外源的绿色荧光蛋白(图3-A—3-E)。
尤力克柠檬经真空浸润接种pCLBV202-GFP,30 dpi时通过共聚焦显微镜对系统叶进行绿色荧光观察。结果表明,与空载体对照相比,处理组柠檬叶片有微弱的绿色荧光颗粒。表明构建的pCLBV202-GFP在尤力克柠檬体内也具有表达功能,能够表达外源的绿色荧光蛋白(图3-F)。
2.3 pCLBV202-CB对烟草青枯病的防治效果
处理组pCLBV202-CB和对照组pCLBV202接种烟草青枯病菌后,处理组发病时间为7 dpi,对照组发病时间为3 dpi,处理组比对照组发病晚4 d。在接种青枯病菌24 dpi后,处理组发病率为14.3%,对照组发病率为100%,处理组发病率远低于对照组发病率。处理组相对于对照组的抗性指数为-2.66,抗性评价为高抗。处理组相较于对照组,症状出现明显减轻,具体结果如图4所示。这表明利用pCLBV202在烟草中系统表达CB增强了对烟草青枯病的抗性。
2.4 pCLBV202-CB对柑橘溃疡病的防治效果
通过RT-PCR检测CB蛋白基因是否在尤力克柠檬系统叶中存在转录,筛选阳性植株进行抗性评价。结果如图5所示,共获得了4株pCLBV202-CB阳性尤力克柠檬植株。
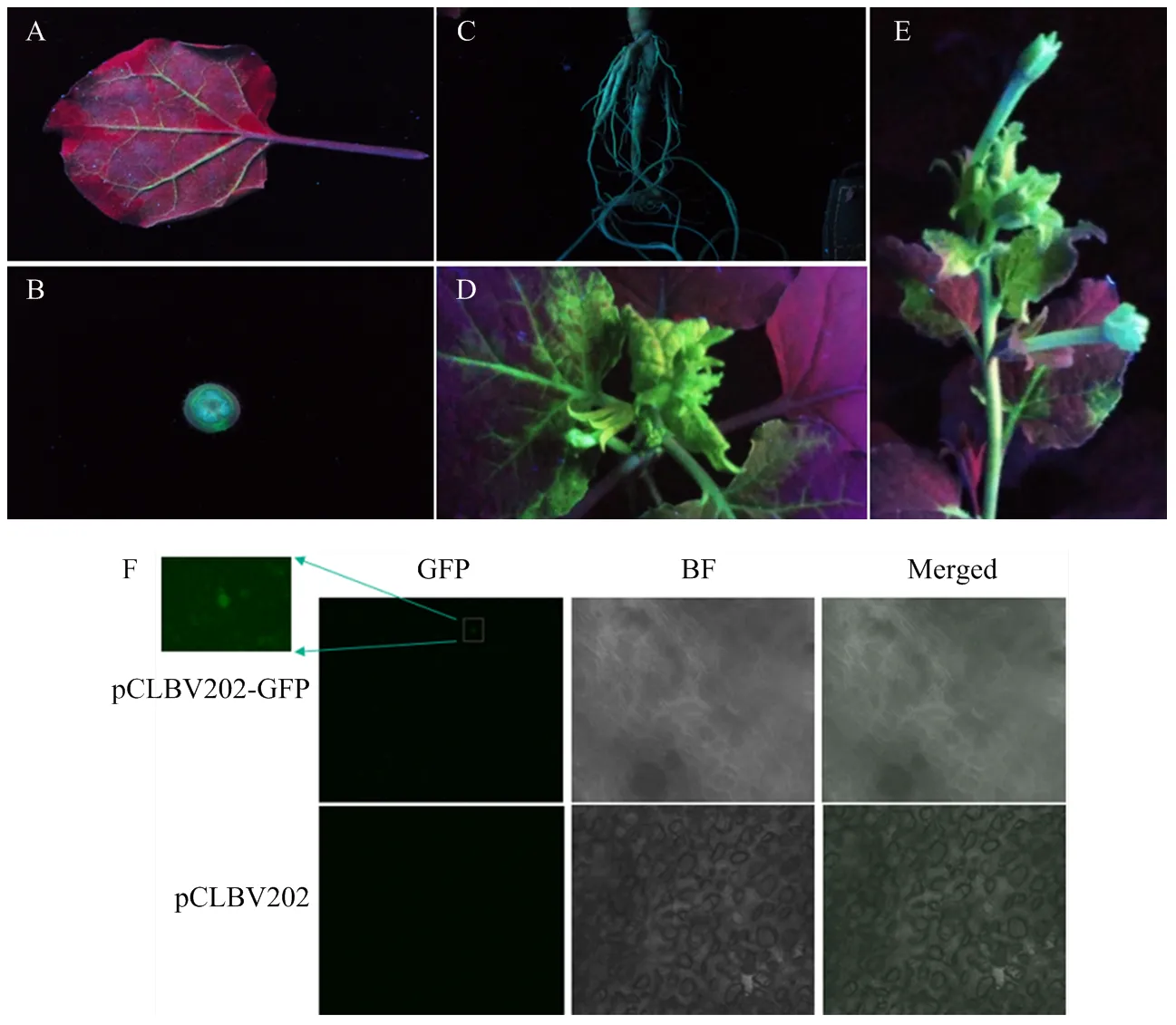
本氏烟N. benthamianaA:注射叶背面The reverse side of injection leaf (7 dpi);B:茎秆横切面Cross-section of stalk (11 dpi);C:根茎Rhizome (11dpi);D:系统叶systemic leaves (15 dpi);E:花蕾Buds (18 dpi)。尤力克柠檬C. limon F:系统叶Systemic leaves (30 dpi)

A:烟草青枯病症状的整体图overall picture of tobacco bacterial wilt symptoms;B:烟草青枯病分级classification of tobacco bacterial wilt;C:pCLBV202-CB组烟草青枯病症状tobacco bacterial wilt symptoms in pCLBV202-CB group;D:pCLBV202组烟草青枯病症状tobacco bacterial wilt symptoms in pCLBV202 group;E:pCLBV202-CB组注射叶injected leaf of pCLBV202-CB group;F:pCLBV202组注射叶injected leaf of pCLBV202 group
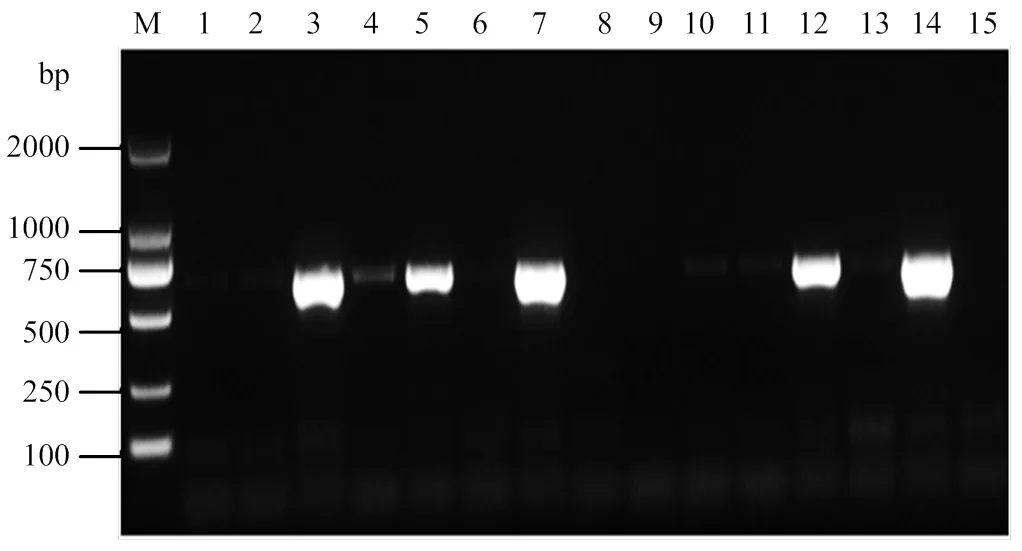
M:2000 bp标准分子量2000 bp molecular marker;1—12:pCLBV202-CB接种样品pCLBV202-CB inoculated samples;13:阴性对照Negative control;14:阳性对照Positive control;15:水对照Water control
观察记录接种柑橘溃疡病菌的尤力克柠檬叶片,在7 dpi时处理组和对照组均发病(图6)。处理组病斑数为47个,发病率为43.5%;对照组病斑个数为73个,发病率为67.6%。

图6 pCLBV202-CB对柑橘溃疡病的防治效果
溃疡菌斑研磨稀释后进行细菌的回补培养,结果如图7所示,处理组溃疡病菌在稀释51倍便停止生长;对照组的溃疡病菌稀释54倍停止生长。因此,处理组中溃疡病菌菌群数少于对照组溃疡病菌菌群数。
上述结果表明,利用pCLBV202-CB处理后的尤力克柠檬较对照的柑橘溃疡病抗性增强。

1、2、3、4、5、6:溃疡病菌的稀释倍数分别为51、52、53、54、55、56倍Dilution gradients of Xcc were 51, 52, 53, 54, 55, 56 times, respectively
3 讨论
3.1 pCLBV202-CB可提高植物对细菌性病害的抗性
柑橘产业是我国南方许多地区乡村振兴的支柱产业,但柑橘病害尤其是黄龙病、溃疡病严重影响了该产业的健康发展[28]。通过转基因技术将抗菌肽基因转入柑橘中可以增强柑橘对细菌病害的抗病性,但柑橘转基因周期长、操作繁琐并且存在较高的技术难度和一定的品种限制。本研究基于前期构建的侵染性克隆pCY-CLBV201,通过在其外壳蛋白基因终止子后插入92 bp亚基因组启动子序列及克隆位点,构建了病毒表达载体pCLBV202。抗菌肽cecropin B通过静电作用抑制细菌细胞呼吸,细菌最后死亡或者停止生长,从而有效降低细菌病害的危害与传播。李乃坚等[29]将天蚕抗菌肽B基因导入烟草品种‘Nc82’‘Col76’和‘K326’并获得了抗性后代,其抗青枯病能力与受体品种相比有较大幅度的提高。本研究利用该载体在本氏烟中表达抗菌肽CB,显著降低了烟草青枯病的发病率以及症状严重程度,提高了植物对烟草青枯病的抗性,这与李乃坚等[29]的结果一致;在尤力克柠檬植株体内表达CB也可显著降低柑橘溃疡病菌的病斑数和菌群数量,提高柠檬的柑橘溃疡病抗性,这与之前关于转基因抗菌肽的研究结果一致[30-32],这些结果均证明病毒表达载体在植物中系统的表达CB与转基因植物具有同样的抗细菌病害能力。
3.2 基于CLBV表达载体的优势
由于果树是多年生植物,因此构建能在果树植株内长期、稳定表达外源基因的病毒表达载体具有积极意义。目前已获得的果树病毒载体中,CTV载体的稳定性最好,这可能与长线型病毒属中所特有的HSP70同源蛋白和较低的重组率有关[33]。但CTV可以通过蚜虫传播[34],存在一定的病毒扩散风险。CLBV能够侵染大多数柑橘栽培品种,不引起明显的症状,且无昆虫传播媒介,从而适宜用于载体改造。已有研究表明基于CLBV的表达载体可以在柑橘中稳定表达GFP达7年之久,稳定性良好。插入的外源基因最终会丢失,不存在生物安全问题。因而,利用本研究构建的表达载体表达CB或其他更加高效的抗菌肽可使柑橘获得较持久的细菌性病害抗性,减轻病害防控压力。CLBV寄主广泛,可以侵染猕猴桃、桑树、牡丹等多种植物,因此,基于CLBV的表达载体也可能适用于更多的寄主,应用前景良好。另外,本研究所获载体也可用于反向遗传学研究,通过pCLBV202过表达外源基因,可快速对其功能进行研究,对于快速筛选抗性基因寻找更好的病害防控途径具有积极意义。目前,利用pCLBV202在柑橘中表达外源基因的表达量仍不够高,后续可通过筛选高滴度病毒、优选外源基因插入位点等研究继续优化,从而提高其外源抗性基因的表达量,这对提升柑橘抗性以及病害防控效果极其重要。
4 结论
构建了基于CLBV的病毒表达载体pCLBV202。利用pCLBV202在本氏烟、柑橘中系统表达抗菌肽可显著提高植株的细菌性病害抗性,为柑橘病害防控提供了新思路。
[1] 陈祝安, 曹光照, 许益伟, 黄基荣, 葛岚屏. 柑桔害虫病原真菌资源的考察和生测. 微生物学通报, 1985(5): 194-198.
CHEN Z A, CAO G Z, XU Y W, HUANG J R, GE L P. Investigation and bioassay of citrus pest pathogenic fungi resources. Microbiology China, 1985(5): 194-198. (in Chinese)
[2] BROWN K. Florida fights to stop citrus canker. Science, 2001, 292(5525): 2275-2276.
[3] 宋二玲. 三个病原物诱导启动子在转基因柑橘中受溃疡病菌和创伤诱导的表达分析[D]. 重庆: 西南大学, 2013.
SONG E L. Canker bacterium- and wound-response characteristics of three pathogen-induced promoters in transgenic citrus[D]. Chongqing: Southwest University, 2013. (in Chinese)
[4] NARDO A D, VITIELLO A, GALLO R L. Cutting edge: Mast cell antimicrobial activity is mediated by expression of cathelicidin antimicrobial peptide. Journal of Immunology, 2003, 170(5): 2274-2278.
[5] ZASLOFF M. Antimicrobial peptides of multicellular organisms. Nature, 2002, 415(6870): 389-395.
[6] 郑启发, 陈大成, 黄自然, 胡桂兵. 人工合成柞蚕抗菌肽D基因转化沙田柚. 华南农业大学学报, 1999, 20(1): 103-106. ZHENG Q F, CHEN D C, HUANG Z R, HU G B. Transformation of the Shatian pummelo () with the synthetic oak silkworm antibacterial peptide D gene. Journal of South China Agricultural University, 1999, 20(1): 103-106. (in Chinese)
[7] 陈善春, 张进仁, 黄自然, 高峰, 陈凤珍, 隆有庆. 根癌农杆菌介导柞蚕抗菌肽D基因转化柑桔的研究. 中国农业科学, 1997, 30(3): 7-13.
CHEN S C, ZHANG J R, HUANG Z R, GAO F, CHEN F Z, LONG Y Q. Studies on-mediated antibacterial peptide D gene transfer in citrus. Scientia Agricultura Sinica, 1997, 30(3): 7-13. (in Chinese)
[8] 刘琦琦. 转cecropin B基因柑橘对溃疡病抗性的研究[D]. 重庆: 西南大学, 2014.
LIU Q Q.resistance of transgenic plants with cecropin B gene to citrus canker caused bypv.[D]. Chongqing: Southwest University, 2014. (in Chinese)
[9] SATYANARAYANA T, GOWDA S, BOYKO V P, ALBIACH- MARTI M R, MAWASSI M, NAVAS-CASTILLO J, KARASEV A V, DOLJA V, HILF M E, LEWANDOWSKI D J, MORENO P, BAR-JOSEPH M, GARNSEY S M, DAWSON W O. An engineered closterovirus RNA replicon and analysis of heterologous terminal sequences for replication. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(13): 7433-7438.
[10] VIVES M C, MARTíN S, AMBRóS S, RENOVELL Á, NAVARRO L, PINA J, MORENO P, GUERRI J. Development of a full-genome cDNA clone of citrus leaf blotch virus and infection of citrus plants. Molecular Plant Pathology, 2008, 9(6): 787-797.
[11] OHIRA K, NAMBA S, ROZANOV M, KUSUMI T, TSUCHIZAKI T. Complete sequence of an infectious full-length cDNA clone of citrus tatter leaf capillovirus: comparative sequence analysis of capillovirus genomes. Journal of General Virology, 1995, 76(9): 2305-2309.
[12] GOWDA S, SATYANARAYANA T, ROBERTSON C J, GARNSEY S M, DAWSON W O. Infection of citrus plants with virions generated inplants agroinfiltrated with a binary vector based citrus tristeza virus//Proceedings of the Sixteenth Conference of the International Organization of Citrus Virologist. Riverside: IOCV, 2005: 23-33.
[13] SáNCHEZ F, MARTINEZ-HERRERA D, AGUILAR I, PONZ F. Infectivity of turnip mosaic potyvirus cDNA clones and transcripts on the systemic hostand local lesion hosts. Virus Research, 1998, 55(2): 207-219.
[14] 周彦. 果树病毒载体研究进展. 中国农业科学, 2014, 47(6): 1119-1127.
ZHOU Y. Progresses in study of virus-based vectors of fruit trees. Scientia Agricultura Sinica, 2014, 47(6): 1119-1127. (in Chinese)
[15] GALIAKPAROV N, TANNE E, SELA I, GAFNY R. Infectious RNA transcripts from grapevine virus A cDNA clone. Virus Genes, 1999, 19(3): 235-242.
[16] VELA L B, SKARIA M. Seven isolates of citrus tatter leaf virus induce varying levels of xylem tissue abnormalities in two citrange rootstocks//Proceedings of the Fifteenth Conference of the International Organization of Citrus Virologists. Riverside: IOCV, 2002: 371-372.
[17] MIYAKAWA T, MATSUI C. A bud-union abnormality of Satsuma mandarin onrootstock in Japan//Proceedings of the Seventh Conference of the International Organization of Citrus Virologists. Riverside: IOCV, 1976: 125-131.
[18] CAO M J, YU Y Q, TIAN X, YANG F Y, LI R H, ZHOU C Y. First report of citrus leaf blotch virus in lemon in China. Plant Disease, 2017, 101(8): 1561.
[19] CHAVAN R R, BLOUIN A G, COHEN D, PEARSON M N. Characterization of the complete genome of a novel citrivirus infecting. Archives of Virology, 2013, 158(8): 1679-1686.
[20] XUAN Z Y, XIE J X, YU H D, ZHANG S, LI R H, CAO M J. Mulberry () is a new natural host of citrus leaf blotch virus in China. Plant Disease, 2021, 105(3): 716.
[21] VIVES M C, GALIPIENSO L, NAVARRO L, MORENO P, GUERRIL J. The nucleotide sequence and genomic organization of citrus leaf blotch virus: candidate type species for a new virus genus. Virology, 2001, 287(1): 225-233.
[22] AGüERO J, VIVES M C, VELáZQUEZ K, RUIZ-RUIZ S, JUáREZ J, NAVARRO L, MORENO P, GUERRI J. Citrus leaf blotch virus invades meristematic regions inand citrus. Molecular plant pathology, 2013, 14(6): 610-616.
[23] RENOVELLá, GAGO S, RUIZ-RUIZ S, VELáZQUEZ K, NAVARRO L, MORENO P, VIVES M C, GUERRI J. Mapping the subgenomic RNA promoter of the citrus leaf blotch virus coat protein gene by-mediated inoculation. Virology, 2010, 406(2): 360-369.
[24] AGüERO J, RUIZ-RUIZ S, VIVES M C, VELáZQUEZ K, NAVARRO L, Peña L, MORENO P, GUERRI J. Development of viral vectors based on citrus leaf blotch virus to express foreign proteins or analyze gene function in citrus plants. Molecular plant-microbe interactions, 2012, 25(10): 1326-1337.
[25] 崔甜甜. 柑橘黄化脉明病毒和柑橘叶斑驳病毒的侵染性克隆构建[D]. 重庆: 西南大学, 2018.
CUI T T. Construction of infectious cDNA clones of citrus yellow vein clearing virus and citrus leaf blotch virus[D]. Chongqing: Southwest University, 2018. (in Chinese)
[26] 段玉, 许建建, 马志敏, 宾羽, 周常勇, 宋震. 柑橘叶斑驳病毒的逆转录重组酶聚合酶扩增检测. 中国农业科学, 2021, 54(9): 1904-1912.
DUAN Y, XU J J, MA Z M, BIN Y, ZHOU C Y, SONG Z. Detection of citrus leaf blotch virus by reverse transcription-recombinase polymerase amplification (RT-RPA). Scientia Agricultura Sinica, 2021, 54(9): 1904-1912. (in Chinese)
[27] 任广伟, 孔凡玉, 王凤龙. 烟草病虫害分级及调查方法: GB/T 23222—2008[S]. (2008-12-31) [2022-07-04].
REN G W, KONG F Y, WANG F L. Grade and investigation method of tobacco diseases and insect pests: GB/T 23222—2008[S]. (2008- 12-31) [2022-07-04]. (in Chinese)
[28] DUAN S, JIA H G, PANG Z Q, TEPER D, WHITE F, JONES J, ZHOU C Y, WANG N. Functional characterization of the citrus canker susceptibility gene. Molecular plant pathology, 2018, 19(8): 1908-1916.
[29] 李乃坚, 袁四清, 蒲汉丽, 周会光, 戴冕, 陈俊标, 罗战勇, 崔植琳, 黄自然, 李传瑛, 陈凤珍. 抗菌肽B基因转化烟草及转基因植株抗青枯病的鉴定. 农业生物技术学报, 1998, 6(2): 178-184.
LI N J, YUAN S Q, PU H L, ZHOU H G, DAI M, CHEN J B, LUO Z Y, CUI Z L, HUANG Z L, LI C Y, CHEN F Z. Transfer of cecropin B gene into tobacco plant and confer the bacterial wilt resistance. journal of agricultural biotechnology, 1998, 6(2): 178-184. (in Chinese)
[30] 黎观红, 洪智敏, 贾永杰, 瞿明仁. 抗菌肽的抗菌作用及其机制. 动物营养学报, 2011, 23(4): 546-555.
LI G H, HONG Z M, JIA Y J, QU M R. Activities and mechanisms of action of antimicrobial peptides. Chinese Journal of Animal Nutrition, 2011, 23(4): 546-555. (in Chinese)
[31] 王志兴, 贾士荣. 抗菌肽分泌型载体的构建及转基因马铃薯中蛋白的胞外分泌. 农业生物技术学报, 1996, 4(3): 277-286.
WANG Z X, JIA S R. Construction of vectors harboring a barley-amylase signal sequence and a cecropin B or shiva A gene that resulted in the extracellular protein secretion in potato transgenic plants. journal of agricultural biotechnology, 1996, 4(3): 277-286. (in Chinese)
[32] 贾士荣, 屈贤铭, 冯兰香, 唐惕, 唐益熊, 刘坤, 赵艳丽, 白永延, 蔡敏莺. 转抗菌肽基因提高马铃薯对青枯病的抗性. 中国农业科学, 1998, 31(3): 5-12.
JIA S R, QU X M, FENG L X, TANG T, TANG Y X, LIU K, ZHAO Y L, BAI Y Y, CAI M Y. Development of potato clones with enhanced resistance to bacterial wilt by introducing antibacterial peptide gene. Scientia Agricultura Sinica, 1998, 31(3): 5-12. (in Chinese)
[33] Kurth E G, Peremyslov V V, Prokhnevsky A I, Kasschau K D, Miller M, Carrington J C, Dolja V V. Virus-derived gene expression and RNA interference vector for grapevine. Journal of Virology, 2012, 86(11): 6002-6009.
[34] Zhou Y, Zhou C Y, Song Z, Liu K H, Yang F Y. Characterization of citrus tristeza virus isolates by indicators and molecular biology methods. Agricultural Sciences in China, 2007, 6(5): 573-579.
Construction and application of expression vector based on Citrus leaf blotch virus
ZHANG Qi, DUAN Yu, SU Yue, JIANG QiQi, WANG ChunQing, BIN Yu, SONG Zhen
Citrus Research Institute, Southwest University/National Citrus Engineering Research Center, Chongqing 400712
【Objective】The objective of this study is to construct an expression vector based on citrus leaf blotch virus (CLBV) and systematically express antimicrobial peptides to improve plant disease resistance, which will provide a new technical means for the prevention and control of citrus canker, citrus Huanglongbing (HLB) and other diseases.【Method】The subgenomic promoter sequence and multiple cloning sites were inserted after the terminator of the coat protein gene of CLBV to construct the viral expression vector pCLBV202 based on the previously constructed infectious clone pCY-CLBV201. Then green fluorescent proteingene () was inserted into the multiple cloning sites, and the expression of GFP was verified by-mediated inoculation and fluorescence observation. the cecropin B (CB) gene ofwas cloned and the recombinant vector pCLBV202-CB was constructed.and citrus seedlings were inoculated by pCLBV202-CB using-mediated injection and vacuum infiltration, respectively. Positive plants were screened and subjected to inoculation ofby injection and root irrigation orsubsp.() by pricking the detached leaves. At the same time, the plants inoculated with the empty vector were set as the control. The resistance to tobacco bacterial wilt of the inoculated plants was evaluated by symptom observation, incidence rate and disease index. The citrus resistance to canker was evaluated by the detriment, incidence rate and colony concentration on leaves. 【Result】After inoculated by pCLBV202-GFP, green fluorescence could be observed on the systemic leaves of theand, which was brighter in, indicating that the expression vector based on CLBV was successfully constructed. After inoculation of, the onset time of treatment group (pCLBV202-CB) was delayed by 4 days compared with the control group (pCLBV202). On the 24th day past inoculation (24 dpi), the incidence rate of the treatment group was 14.3%, and that of the control group was 100%. Compared with the control group, the resistance index of the treatment group was -2.66, and the resistance evaluation was high, indicating that the expression of CB by pCLBV202-CB enhanced the resistance to tobacco bacterial wilt. Whenleaves was inoculated by, the number of detriment in the treatment group at 7 dpi was 47, and the incidence rate was 43.5%, while that of the control group was 73, and 67.6%. The detection of colony concentration changes ofshowed that the number ofin the treatment group was less than that in the control group, indicating that the expression of CB by pCLBV202-CB enhanced the resistance to citrus canker.【Conclusion】The CLBV-based viral expression vector pCLBV202 was constructed. Using pCLBV202 to systematically express CB inand citrus can improve the resistance of plants to bacterial diseases, which provided a new technology for the prevention and control of citrus bacterial diseases.
citrus leaf blotch virus (CLBV);viral expression vector;antimicrobial peptide;disease resistance

10.3864/j.issn.0578-1752.2022.22.006
2022-07-04;
2022-07-16
国家重点研发计划(2021YFD1400800)、重庆市自然科学基金(CSTB2022NSCQ-MSX0752)
张琦,E-mail:18839773525@163.com。段玉,E-mail:982432080@qq.com。张琦和段玉为同等贡献作者。通信作者宋震,E-mail:songzhen@cric.cn
(责任编辑 岳梅)

